ZHOU Yuefei, E-mail:alphazhou@hfut.edu.cn
厌氧环境中广泛存在的SRB不仅通过影响元素循环 (C、S、Fe、重金属等) 制约地球演化 (Karnachuk et al., 2002; Liamleam et al., 2007; Muyzer et al., 2008), 同时也被广泛应用于环境工程领域, 如硫酸盐、重金属、难降解有机物的厌氧处理 (Muyzer et al., 2008; Baldi et al., 1996; Gramp et al., 2009; Aitken et al., 2013; Jaekel et al., 2013). SRB最基本的功能是还原SO42-为S2-, SO42-除了以溶解形式存在, 还会以硫酸盐矿物的形式存在, 研究证实SRB可以促进多种硫酸盐矿物 (石膏、重晶石、天青石、铅矾、施氏矿、黄钾铁矾等) 的还原分解 (Baldi et al., 1996; Gramp et al., 2009; Azabou et al., 2005; 2007;Schröder Wolthoorn et al., 2008; Wolicka et al., 2008), 且SRB具有通过直接接触作用还原分解难溶硫酸盐矿物 (如重晶石) 的功能 (Baldi et al., 1996).然而, 关于SRB还原分解硫酸盐矿物, 目前还存在较多待解决的问题, 如SRB是通过接触作用将电子直接传递给难溶硫酸盐矿物, 进而促进其分解 (直接作用), 还是通过还原溶解态SO42-, 使得难溶硫酸盐矿物的溶解得以持续进行, 进而间接促进其分解 (间接作用)? SRB的代谢产物 (S2-、重金属等) 对其自身往往有毒害效应, 在自然界厌氧环境中及环境工程系统中, SRB通过何种策略保持其生物活性? SRB表面经常会包裹次生沉淀 (如硫化物)(Labrenz et al., 2000), 这些物质对SRB的活性是否有影响?
铅污染是工业国家普遍面临的环境问题, 矿山开采、含Pb工业品 (蓄电池、涂料等) 的生产和处理等 (Weijma et al., 2002; Romero et al., 2003; Jensen et al., 2006), 均有可能导致Pb向环境中释放, 进而污染人类生存的大气、水及土壤环境.研究发现, 人为释放的Pb在环境中主要以铅矾 (PbSO4) 的形式存在, 以中国为例, 2010年全国排放的Pb中, 铅矾占最大比例, 达到23.4%(梁静等, 2014).由于铅矾具有一定的溶解度 (Pavlov et al., 1987), 并且当环境条件 (pH、温度、氧化还原电位等) 改变时, 铅矾的溶解可能会进一步加剧, 因此, 铅矾是具有严重环境风险的一种物质, 必须采取手段, 抑制铅矾的分解和Pb的释放, 主要方法包括提高铅矾的稳定性, 或强化铅矾向其它稳定含Pb物相的转化.由于Pb的磷酸盐 (氟磷铅矿、氯磷铅矿等) 和硫化物 (方铅矿, PbS) 溶解度很低, 因此, 目前防止Pb污染的一个重要手段是通过一定的工艺, 实现Pb由铅矾向Pb的磷酸盐或硫化物的转化 (Schröder Wolthoorn et al., 2008; Weijma et al., 2002; Traina et al., 1999; 王碧玲等, 2005; 陈建军等, 2010).在铅矾-方铅矿转化工艺中, 普遍以SRB作为还原分解铅矾的功能菌, 事实证明, SRB对铅矾的还原分解和方铅矿的生成有重要促进效应 (Schröder Wolthoorn et al., 2008).然而, 在机制方面, 前人的研究并未解决SRB是通过哪种作用促进铅矾的还原分解; 在工艺方面, 虽然铅矾和方铅矿中n(Pb):n(S) 均为1:1, 但在SRB作用体系中由于溶解及沉淀的动力学效应, 铅矾分解释放的Pb和S无法完全转化为PbS, 因而总会有Pb或S过剩, 进而对环境造成污染, 对这个问题目前还缺乏完善的解决方案.
铁氧化物广泛存在于土壤及沉积物中, 通常呈纳米粒级, 具有较大的比表面积, 因此有很好的吸附性能, 对环境中元素迁移转化具有重要的影响.针铁矿 (FeOOH) 加入有机物-硫酸盐-SRB体系能促进SRB的生长代谢 (Li et al., 2006; Chen et al., 2010), 加速硫酸盐矿物的分解; 同时, SRB代谢产生的S2-可以与针铁矿反应, 生成铁硫化物, 实现S2-的固定.然而纳米铁氧化物对SRB分解铅矾会有什么样的作用和影响尚无文献报道.本文以有机物的典型代表乳酸盐为SRB底物, 着重研究SRB分解铅矾的机制及针铁矿对SRB分解铅矾的影响.
2 材料与方法 (Materials and methods) 2.1 菌种及扩培实验用SRB购自中国普通微生物菌种保藏管理中心 (CGMCC), 属于脱硫弧菌亚种 (Desulfovibrio desulfuricans), 编号为CGMCC-1.3469(ATCC编号为29577).此株SRB的培养基组成 (g·L-1) 为:K2HPO4 0.5, NH4Cl 1.0, Na2SO4 1.0, CaCl2 0.076, MgSO4 0.976, 酵母膏1.0(经测试其中的SO42-含量为100 mg·kg-1), 质量分数为60%~70%的乳酸钠2 mL·L-1.培养基灭菌后通氮气冷却, 用1 mol·L-1NaOH调节pH至7.0±0.2. SRB按照10%的接种比例进行扩培, 接种时向反应瓶中持续通入N2, 加入0.1 g·L-1抗坏血酸, 使用无菌注射器取适量菌种保存液接种于250 mL盐水瓶中, 采用丁基胶塞与铝塑盖密封后于37 ℃恒温培养箱培养4 d.
2.2 实验材料与方法本实验使用的针铁矿为水热合成针铁矿, 购自镇江精细化工厂.铅矾为分析纯化学试剂, 购自国药集团.为考察针铁矿加入对SRB与铅矾作用的影响, 设计无针铁矿添加的SRB-PbSO4实验 (P1) 和SRB-FeOOH-PbSO4实验 (PF2), 每组实验设置3个重复样.实验选取250 mL盐水瓶作为反应容器, 每个实验瓶中包含200 mL培养基.培养基除不含SO42-外, 其它成分与扩培所用培养基相同.实验基本流程为:往各反应器中分别加入200 mL经灭菌的培养基和1.2 g经灭菌的铅矾; 往PF2组的各反应器中分别加入经灭菌的针铁矿0.1 g; 往各反应器中加入0.5 g NaHCO3以缓冲溶液pH值; 接种对数生长期的SRB, 接种方法为:抽取20 mL菌液, 用0.2 μm滤纸过滤 (在厌氧手套箱中进行), 采用去离子水冲洗截留于滤纸上的菌体, 将滤纸接种于含培养基的盐水瓶中, 接种后盐水瓶中菌密度约为1×107个·mL-1, 接种过程中持续通入N2和CO2(V(N2):V(CO2)=80:20) 的混合气体以驱赶氧气; 采用丁基胶塞与铝塑盖将反应器封口; 将反应器放入恒温培养箱, 37 ℃恒温培养; 定期抽取菌液7 mL, 测定pH、ORP (氧化还原电位)、蛋白质、可挥发性S (包括S2-、HS-、H2S、无定形铁硫化物等) 及SO42-; 实验结束后取固体残留物处理后进行X射线衍射 (XRD) 物相分析与扫描电镜 (SEM) 微形貌分析.需要注意的是, 在接种SRB时, 由于菌液中残存SO42-会影响实验效果, 因此需对其进行去除, 具体方法为:使用无菌注射器抽取20 mL对数期菌液, 过0.22 μm有机滤膜, 弃去滤液, 将含有SRB的滤膜放入反应器中.
2.3 分析方法溶液pH及ORP使用MYRON L UltrameterⅡTM多参数电导/pH表测定.可挥发性S采用气相分子吸收光谱法 (上海安杰, AJ-2100) 测定, 基本流程为:取1 mL待测溶液置入33 mL密闭反应瓶中, 加入2 mL 10% HCl反应20 min, 将S转化为气态H2S进行测定 (Chen et al., 2014).硫酸根使用离子色谱仪 (皖仪, IC6200) 测定, 将待测液稀释并过0.45 μm混合纤维素滤膜后进样测试.蛋白质采用福林酚法测定, 取0.9 mL待测液加入到含有0.1 mL浓度为0.5 mol·L-1的NaOH的离心管中, 100 ℃水浴加热30 min, 10000 r·min-1离心3 min后取上清液进行测定.使用皖仪ZCA-1000(AF) 型原子吸收分光光度计进行Pb2+的测定.用带能谱的场发射扫描电镜 (FEI, Sirion 200) 观察矿物及微生物形貌特征, 样品用乙醇梯度脱水、戊二醛固定, 再进行表面喷金处理.用丹东浩元DX-2700型X射线粉末衍射仪分析固体的物相组合.采用Horiba公司的HR Evolution型激光拉曼光谱仪对样品进行多点拉曼光谱测试,激光器波长532 nm, 波数为200~2000 cm-1, 将固体从盐水瓶中抽出后迅速测试, 以防止低结晶度硫化物的氧化.
3 结果与分析 (Results and analysis) 3.1 反应体系pH的变化图 1中P1组与PF2组的pH变化趋势基本相同, 均由初始阶段的6.92快速下降至6.5, 40 h后pH下降速率趋缓.初始阶段溶液pH的下降可能由于铅矾与碳酸根的反应生成碳酸铅 (白铅矿) 所致, 即在实验体系中发生了如下反应 (式 (1)~(2)).

|
(1) |

|
(2) |
由于铅矾的溶度积 (Ksp) 为10-7.8, 而白铅矿的Ksp为10-12.8(Traina et al., 1999), 因此, 反应 (1) 在本研究的实验体系中易于发生, 这一过程也进一步促进了反应 (2) 的进行, 从而使得体系pH值在初始40 h持续降低.前人得到了与本研究相似的pH变化结果 (Karnachuk et al., 2002), 但作者认为该现象与PbS的生成有关, 事实证明本研究的解释更为准确.
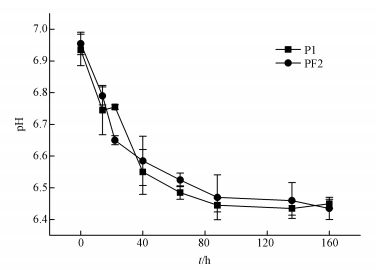 |
| 图 1 反应体系pH的变化 Fig. 1 Changes in pH in two reaction systems |
两组实验中ORP均在0~20 h快速下降 (图 2), 在20~40 h上升, 40 h后再次下降并在80 h后趋于稳定.实验结束时 (160 h), P1组中的ORP达到-275 mV, 而PF2组中的ORP约为-200 mV.在SRB-PbSO4及SRB-FeOOH-PbSO4实验体系中, 制约ORP的因素除了pH外, 还包括变价离子SO42-、S2-、Fe3+、Fe2+等的相对浓度, 通常SO42-/S2-及Fe3+/Fe2+的值越大, ORP越大.由两组实验中ORP具有相似的变化趋势及与pH变化趋势的不一致性, 推测ORP在40 h左右出现先上升再下降的现象主要受制于溶液中SO42-/S2-比值的变化. PF2中的ORP值始终略高于P1, 原因可能是在实验的pH条件下, 针铁矿表面带一定的正电荷, 添加针铁矿相当于添加了氧化剂, 致使体系ORP略有升高.
 |
| 图 2 反应体系ORP的变化 Fig. 2 Changes of ORP in two reaction systems |
在实验前40 h体系中蛋白质浓度保持在300 mg·L-1左右 (图 3), 表明添加的培养基中含有一定量的蛋白质 (主要来自酵母膏), 同时接种的SRB在初始0~40 h其生长处于停滞期, 没有产生和消耗蛋白质; 40~135 h蛋白质浓度迅速增加, 表明SRB处于对数生长期; 135~160 h蛋白质浓度保持稳定, 表明SRB处于稳定期.添加针铁矿显著提高了蛋白质的浓度, 假设蛋白质没有被SRB消耗 (或2个体系中消耗量一致), 则蛋白质浓度差异预示针铁矿对SRB的生长具有促进作用, 而这种促进作用在SRB生长的对数阶段体现得尤为明显.
 |
| 图 3 反应体系蛋白质浓度变化 Fig. 3 Changes of protein concentration in two reaction systems |
P1与PF2两组实验中SO42-浓度的变化规律基本相似 (图 4a), 均在初始40 h持续上升, 随后稳定于一个较高水平.总体上, PF2组中SO42-的浓度高于P1组.实验体系中SO42-浓度取决于PbSO4分解释放量和SRB生长的利用量, 由于0~40 h SRB增殖处于停滞期, SO42-的还原速率很低, 因此, 反应 (1) 释放的SO42-在溶液中累积, 致使其浓度持续升高. 40 h后SRB进入对数生长期, SO42-作为电子受体被还原为S2-, 因此其浓度不再上升.PF2中SO42-浓度始终高于P1, 在40 h时浓度差异最大, 实验结束时有所减小, 可能表明PF2中有更多的SO42-被SRB生长利用, 即针铁矿的添加促进了SRB的生长.
 |
| 图 4 反应体系中SO42-浓度 (a) 及AVS含量 (b) 变化 Fig. 4 Changes of SO42- concentration (a) and AVS (b) in two reaction systems |
P1与PF2组中AVS含量的变化有相似规律 (图 4b), 均为反应初期 (0~60 h) 缓慢增长, 反应中期 (60~130 h) 急剧增加, 130 h后趋于稳定. PF2组中AVS的产量明显高于P1(反应稳定时PF2最大值比P1提高93%), 表明针铁矿存在加速了SRB还原SO42-为S2-的速率. S2-浓度变化与蛋白质浓度变化 (图 3) 具有相似性, 表明S2-的产量严格受SRB活性的制约.但二者也略有区别, 表现为40~60 h蛋白质浓度增加较快, 而S2-浓度没有明显提高, 原因可能是PbS的生成消耗了SRB对数生长期早期产生的S2-.
3.5 矿化产物XRD结果反应后固相的XRD分析结果表明, 两组实验中的铅矾均完全消失 (图 5), 代之以新的含Pb物相, 主要为方铅矿和白铅矿. PF2组中针铁矿仍然存在, 未检测出铁硫化物的特征峰, 这可能有2个原因: ① 铁硫化物的结晶度差, 微弱的衍射峰被其它物相的强衍射峰掩盖; ② 在与铅矾共存的体系中铁硫化物 (FeS, 马基诺矿) 的Ksp远比方铅矿的Ksp大 (Di et al., 1992), 铁氧化物未参与硫的化合反应.第二种情形已在SRB诱导形成闪锌矿 (ZnS) 研究中得到证实 (Labrenz et al., 2000), 研究发现在含S2-体系中, 当Zn与Fe同时存在时, Ksp差异会使得闪锌矿优先生成, 只有在Zn不足时方可生成FeS.
 |
| 图 5 反应结束后固体的XRD物相分析结果 Fig. 5 XRD patterns of residual solids after reaction |
由于所测数据中600 cm-1后没有拉曼谱峰, 故取波数为200~600 cm-1的数据进行作图, 结果如图 6所示.两组实验在460 cm-1左右均出现了一个宽峰, 由前人的结果知道该峰指示了体系中方铅矿的存在 (Smith et al., 2002).值得注意的是, PF2中出现了260、320和385 cm-1的拉曼峰, 依据前人的结果 (Bourdoiseau et al., 2011), 前两个峰归属含Fe (Ⅲ) 马基诺矿 (Fe1-3ⅡxFe2ⅢxS), 后一个峰归属针铁矿.由此可知, 尽管XRD并未检测到铁硫化物的存在 (可能由于含量较低或结晶度较差), 但针铁矿仍然参与了反应, 生成了一些化学成分难以确定的铁硫化物.
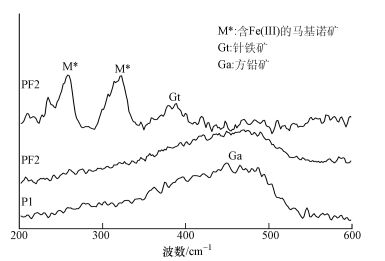 |
| 图 6 反应结束后固体的拉曼光谱分析结果 Fig. 6 Raman patterns of residual solids after reaction |
图 7为P1实验组SRB矿化产物的SEM图像, 其中存在大量微米-亚微米级球形颗粒, 根据能谱分析可以确定这些球形颗粒由纳米级方铅矿晶体聚集而成.这一现象表明SRB不仅可以还原铅矾中的SO42-为S2-, 进而生成方铅矿, 同时菌体或代谢产物对方铅矿的生长和聚集施加了重要影响 (Moreau et al., 2007).此外, 还有一些结晶较好、具假六方双锥形态的物相, 据SEM能谱结果知其为白铅矿, 该物相的发现进一步证实体系中发生了铅矾向白铅矿的转变.图 7b为PF2组SRB矿化产物的SEM图像, 其中大量存在针铁矿及团聚为葡萄状的球状方铅矿集合体.
 |
| 图 7 SRB矿化产物SEM图像 (a.P1, b.PF2) Fig. 7 SEM images of solid products after reaction (a.P1, b.PF2) |
根据上述结果, 分析在NaHCO3缓冲的P1与PF2两组反应体系中, 发生的反应依次为:铅矾中溶出的Pb与CO32-反应生成白铅矿; 铅矾中溶出的SO42-被SRB还原为S2-; 铅矾中溶出的Pb与S2-反应生成方铅矿; 白铅矿中溶出的Pb与S2-反应生成方铅矿.其中第一步为反应 (1), 其它各步骤分别发生如下反应:
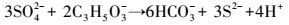
|
(3) |
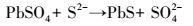
|
(4) |
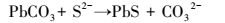
|
(5) |
因方铅矿的Ksp远小于白铅矿 (Traina et al., 1999; Di et al., 1992), 同时铅矾及方铅矿的Pb:S物质的量比均为1:1, 因此, 理论上当铅矾中的SO42-被SRB全部还原时, 体系中将生成单一物相方铅矿.但是, 许多因素导致这种理想状态不会出现, 如SO42-还原不彻底, 溶液中总会残留一定量的SO42-(图 4a), 因此体系中必定存在其它形式的Pb; 生成方铅矿的Pb由铅矾和白铅矿提供, 如果二者的溶解速率很慢 (如沉淀覆盖所致的钝化效应), 会导致Pb供给不足, 体系成为热力学非平衡系统, 即尽管溶液中S2-浓度很高, 但由于Pb从铅矾及白铅矿中释放的速率很慢, 因此也不会有更多的方铅矿生成.本研究中白铅矿存在于高AVS含量的条件下, 这一现象即可能与白铅矿溶解速率慢有关.
4.2 针铁矿在SRB分解铅矾中的作用图 3结果显示, 添加针铁矿促进了SRB的生长, 假设实验中铅矾完全分解 (残余固体中没有检测到该物相), SO42-为唯一电子受体, 并且SO42-还原产物均为S2-, 则实验结束时PF2中的SO42-浓度理应更低.事实上, PF2中SO42-浓度高于P1, 可见, SO42-为唯一电子受体的假设可能并不正确, 针铁矿在体系中部分承担了电子受体的角色, 即SRB在生长过程中将多余的电子传递给了针铁矿.
不同于SRB-PbSO4体系, SRB-FeOOH-PbSO4体系中, SRB代谢产生的S2-除与Pb反应生成沉淀外, 还可与针铁矿反应, 还原其中的Fe3+为Fe2+, 同时自身氧化为多种物相, 如S8o、Sn2-、S2O32-、SO32-等 (Chen et al., 2010; Neal et al., 2001), 其中的S2O32-、SO32-等可直接作为SRB生长的电子受体, 也可以通过歧化反应部分转化为SO42-后, 重新为SRB生长所用 (Habicht et al., 1998).通过该循环, 针铁矿作为电子受体间接促进了SRB的生长.此外, 已有研究表明SRB可以直接还原溶解态Fe3+, 或含Fe (Ⅲ) 的化合物 (如针铁矿)(Coleman et al., 1993; Lovley, 2006), 甚至有的SRB可以其为电子受体进行生长 (Li et al., 2006; Li et al., 2004).前人认为本研究采用的SRB可通过直接和间接2种方式还原分解赤铁矿 (Neal et al., 2001; Li et al., 2009), 但缺乏确凿证据.
根据前述分析, SRB分解铅矾时溶液中会产生S2-的累积, 相关环境问题 (如污染大气和水体、毒害SRB、腐蚀容器等) 也随之产生. SRB还原分解针铁矿产生的Fe2+, 可以与S2-反应生成多种铁硫化物, 由此缓解S2-累积带来的各种环境问题.典型实例是:实验结束时P1和PF2中剩余SO42-的浓度很相近 (图 4a), 但PF2中蛋白质的产量显著高于P1(图 3), 原因除了PF2中针铁矿作为额外电子受体提高了SRB的数量外, 还可能与针铁矿降低了S2-对SRB的毒性有关.此外, 随着Pb从铅矾和白铅矿中缓慢释放, 亚稳态铁硫化物分解释放S2-, 其随后与Pb反应生成稳定的方铅矿, 在此过程中铁硫化物强化了S向方铅矿结合态的转化.
5 结论 (Conclusions)1) 碳酸盐缓冲体系中, SRB分解铅矾的过程为在溶度积控制下, 铅矾首先转化为白铅矿, SRB还原此过程中释放的SO42-及剩余铅矾中的SO42-, 产生的S2-与Pb反应生成方铅矿, 其中Pb由铅矾和白铅矿溶解共同提供.
2) 针铁矿添加可以固定溶液中的S2-, 降低铅矾SRB分解的环境污染风险.针铁矿可以提高SRB的生物活性, 主要机制是: ① 作为SRB生长的电子受体; ② 还原产生的Fe2+与S2-反应产生硫化物沉淀, 降低S2-对SRB的毒害效应.
| [${referVo.labelOrder}] | Aitken C M, Jones D M, Maguire M J, et al. 2013. Evidence that crude oil alkane activation proceeds by different mechanisms undersulfate-reducing and methanogenic conditions[J]. Geochimicaet Cosmochimica Acta, 109 : 162–174. DOI:10.1016/j.gca.2013.01.031 |
| [${referVo.labelOrder}] | Azabou S, Mechichi T, Patel B K C, et al. 2007. Isolation and characterization of a mesophilic heavy-met als-tolerant sulfate-reducing bacterium Desulfomicrobium sp[J]. from an enrichment culture using phosphogypsum as a sulfate source[J].Journal of Hazardous Materials, 140(1/2) : 264–270. |
| [${referVo.labelOrder}] | Azabou S, Mechichi T, Sayadi S. 2005. Sulfate reduction from phosphogypsum using a mixed culture of sulfate-reducing bacteria[J]. International Biodeterioration & Biodegradation, 56(4) : 236–242. |
| [${referVo.labelOrder}] | Baldi F, Pepi M, Burrini D, et al. 1996. Dissolution of barium from barite in sewage sludges and cultures of desulfovibrio desulfuricans[J]. Applied & Environmental Microbiology, 62(7) : 2398–2404. |
| [${referVo.labelOrder}] | Bourdoiseau J A, Jeannin M, Rémazeilles C, et al. 2011. The transformation of mackinawite intogreigite studied by Raman spectroscopy[J]. Journal of Raman Spectroscopy, 42(3) : 496–504. DOI:10.1002/jrs.v42.3 |
| [${referVo.labelOrder}] | 陈建军, 俞天明, 王碧玲, 等. 2010. 用TCLP和形态法评估含磷物质修复铅锌矿污染土壤的效果及其影响因素[J]. 环境科学, 2010, 31(1) : 185–191. |
| [${referVo.labelOrder}] | Chen D, Li S, Liu H, et al. 2014. Rapid determination of sulfide sulfur in anaerobic reaction system by gas-phase molecular absorption spectrometry[J]. Analytical Methods (Royal Society of Chemistry), 6(22) : 9085–9092. |
| [${referVo.labelOrder}] | Chen T, Wang J, Jin X, et al. 2010. Goethite-enhanced anaerobic bio-decomposition of sulfate minerals[J]. Frontiers of Earth Science in China, 4(2) : 160–166. DOI:10.1007/s11707-010-0020-x |
| [${referVo.labelOrder}] | Coleman M L, Hedrick D B, Lovley D R, et al. 1993. Reduction of Fe (Ⅲ) in sediments by sulphate-reducingbacteria[J]. Nature, 361 : 436–438. DOI:10.1038/361436a0 |
| [${referVo.labelOrder}] | Di Toro D M, Mahony J D, Hansen D J, et al. 1992. Acid volatile sulfide predicts the acute toxicity of cadmium and nickel in sediments[J]. Environmental Science & Technology, 26(1) : 96–101. |
| [${referVo.labelOrder}] | Gramp J P, Wang H, Bigham J M, et al. 2009. Biogenic synthesis and reduction of Fe (Ⅲ)-hydroxysulfates[J]. Geomicrobiology Journal, 26(4) : 275–280. DOI:10.1080/01490450902892597 |
| [${referVo.labelOrder}] | Habicht K S, Canfield D E, Rethmeier J. 1998. Sulfur isotope fractionation during bacterial reduction and disproportionation of thiosulfate and sulfite[J]. Geochimicaet Cosmochimica Acta, 62(15) : 2585–2595. DOI:10.1016/S0016-7037(98)00167-7 |
| [${referVo.labelOrder}] | Jaekel U, Musat N, Adam B, et al. 2013. Anaerobic degradation of propane and butane by sulfate-reducing bacteria enriched from marine hydrocarbon cold seeps[J]. The ISME Journal, 7(5) : 885–895. DOI:10.1038/ismej.2012.159 |
| [${referVo.labelOrder}] | Jensen P E, Ottosen L M, Pedersen A J. 2006. Speciation of Pb in industrially polluted Soils[J]. Water, Air and Soil Pollution, 170(1/4) : 359–382. |
| [${referVo.labelOrder}] | Karnachuk O, Kurochkina S, Tuovinen O. 2002. Growth of sulfate-reducing bacteria with solid-phase electron acceptors[J]. Applied Microbiology & Biotechnology, 58(4) : 482–486. |
| [${referVo.labelOrder}] | 梁静, 毛建素. 2014. 铅元素人为循环环境释放物形态分析[J]. 环境科学, 2014, 35(3) : 1191–1197. |
| [${referVo.labelOrder}] | Labrenz M, Druschel G K, Thomsen Ebert T, et al. 2000. Formation of sphalerite (ZnS) deposits in natural biofilms of sulfate-reducing bacteria[J]. Science, 290(5497) : 1744–1747. DOI:10.1126/science.290.5497.1744 |
| [${referVo.labelOrder}] | Li Y L, Pfiffner S M, Dyar M D, et al. 2009. Degeneration of biogenic superparamagnetic magnetite[J]. Geobiology, 7(1) : 25–34. DOI:10.1111/gbi.2009.7.issue-1 |
| [${referVo.labelOrder}] | Li Y L, Vali H, Sears S K, et al. 2004. Iron reduction and alteration of nontronite NAu-2 by a sulfate-reducingbacterium[J]. Geochimicaet Cosmochimica Acta, 68(15) : 3251–3260. DOI:10.1016/j.gca.2004.03.004 |
| [${referVo.labelOrder}] | Li Y, Vali H, Yang J, et al. 2006. Reduction of iron oxides enhanced by a sulfate-reducing bacterium and biogenic H2S[J]. Geomicrobiology Journal, 23(2) : 103–117. DOI:10.1080/01490450500533965 |
| [${referVo.labelOrder}] | Liamleam W, Annachhatre A P. 2007. Electron donors for biological sulfate reduction[J]. Biotechnology Advances, 25(5) : 452–463. DOI:10.1016/j.biotechadv.2007.05.002 |
| [${referVo.labelOrder}] | Lovley D R. 2006. Dissimilatory Fe (Ⅲ)-and Mn (Ⅳ)-reducing prokaryotes[J]. The Prokaryotes, 1 : 635–658. |
| [${referVo.labelOrder}] | Moreau J W, Weber P K, Martin M C, et al. 2007. Extracellular proteins limit the dispersal of biogenic nanoparticles[J]. Science, 316(5831) : 1600–1603. DOI:10.1126/science.1141064 |
| [${referVo.labelOrder}] | Muyzer G, Stams A J M. 2008. The ecology and biotechnology of sulphate-reducing bacteria[J]. Nature Reviews Microbiology, 6(6) : 441–454. |
| [${referVo.labelOrder}] | Neal A L, Techkarnjanaruk S, Dohnalkova A, et al. 2001. Iron sulfides and sulfur species produced at hematite surfaces in the presence of sulfate-reducing bacteria1[J]. Geochimicaet Cosmochimica Acta, 65(2) : 223–235. DOI:10.1016/S0016-7037(00)00537-8 |
| [${referVo.labelOrder}] | Pavlov D, Pashmakova I. 1987. Influence of the size of PbSO4 crystals on their solubility and the significance of this process in the lead-acid battery[J]. Journal of Applied Electrochemistry, 17(5) : 1075–1082. DOI:10.1007/BF01024373 |
| [${referVo.labelOrder}] | Romero R, Mazuelos A, Carranza F. 2003. Copper recovery from chalcopyrite concentrates by the BRISA process[J]. Hydromet allurgy, 70(1/3) : 205–215. |
| [${referVo.labelOrder}] | Schröder Wolthoorn A, Kuitert S, Dijkman H, et al. 2008. Application of sulfate reduction for the biological conversion of anglesite (PbSO4) to galena (PbS)[J]. Hydromet allurgy, 94(1/4) : 105–109. |
| [${referVo.labelOrder}] | Smith G D, Firth S, Clark R J H. 2002. First-and second-order Raman spectra of galena (PbS)[J]. Journal of Applied Physics, 9(8) : 4375–4380. |
| [${referVo.labelOrder}] | Traina S J, Laperche V. 1999. Contaminant bioavailability in soils, sediments, and aquatic environments[J]. Proceedings of the National Academy of Sciences, 96(7) : 3365–3371. DOI:10.1073/pnas.96.7.3365 |
| [${referVo.labelOrder}] | 王碧玲, 谢正苗, 孙叶芳, 等. 2005. 磷肥对铅锌矿污染土壤中铅毒的修复作用[J]. 环境科学学报, 2005, 25(9) : 1189–1194. |
| [${referVo.labelOrder}] | Weijma J, De Hoop K, Bosma W, et al. 2002. Biological conversion of anglesite (PbSO4) and lead waste from spent car batteries to galena (PbS)[J]. Biotechnology Progress, 18(4) : 770–775. DOI:10.1021/bp025523k |
| [${referVo.labelOrder}] | Wolicka D. 2008. Biotransformation of phosphogypsum in wastewaters from the dairy industry[J]. Bioresource Technology, 99(13) : 5666–5672. DOI:10.1016/j.biortech.2007.10.029 |
 2017, Vol. 37
2017, Vol. 37


