超滤膜能在低压力运行条件下截留细菌和大多数病毒,并有效去除浊度,使出水水质稳定,因而在饮用水、脱盐预处理等领域得到广泛应用.聚砜 (PSf) 因具有机械强度高、热稳定性好、耐酸碱腐蚀等优点而成为常用的膜材料之一 (Qin et al., 2003),然而其较强的疏水性使聚砜膜易产生膜污染,导致通量下降,膜的使用寿命缩短.膜污染主要分为无机污染、有机污染和生物污染 (Osada et al., 1992; Gao et al., 2011; Dong et al., 2015).生物污染是指微生物在膜表面粘附、繁殖并生成代谢产物形成生物膜的过程 (Mansouri et al., 2010),因其难以控制、清洗并导致膜性能不可逆的降低而备受关注.提高膜亲水性可有效减少有机物粘附,从而减轻膜污染 (Xiao et al., 2011),因此,成为膜改性的主要方向;此外,还可制备具有抗菌性的膜等 (Koseoglu Imer et al., 2013;王智等, 2013).
通常可通过添加、涂覆、接枝等方法对膜进行改性 (Khulbe et al., 2010;Ulbricht, 2006),根据改性目的选择性地植入功能性材料.随着纳米技术的发展,纳米材料因其特殊的理化性质 (如亲水性、抗菌性) 等成为膜改性的主要材料之一.例如,氧化铝 (Wang et al., 2011; Dong et al., 2015; Daraei et al., 2013)、分子筛 (Leo et al., 2013 Junaidi et al., 2013)、二氧化硅 (Liang et al., 2014; Wu et al., 2013) 等可有效改善膜亲水性;纳米银 (Koseoglu Imer et al., 2013; Zodrow et al., 2009)、纳米铜 (Ben Sasson et al., 2013; Isloor et al., 2013) 等还兼有抑菌效果.共混法 (Yan et al., 2006) 是常用的制备纳米颗粒混合基质膜的方法,通过共混法可成功植入二氧化钛 (Yang et al., 2007)、氧化锌 (Liang et al., 2012) 等纳米颗粒,改性后膜的亲水性提高,有机物的不可逆吸附减少.然而,Maximous等 (2009)使用共混法制备氧化铝混合基质膜时发现,所有的纳米颗粒基本都被包覆在膜内,无法直接发挥纳米颗粒的作用,造成较大浪费.而原位植入法则是将沉淀浴中的纳米颗粒在相转化过程植入膜表面,Wang等 (2011)通过该方法将氧化铝颗粒稳固地嵌入到PVDF膜表面,而聚砜膜表面原位植入纳米颗粒后 (Dong et al., 2015),膜的亲水性有一定提高同时抗生物污染性能显著增强,初步证明是膜的抗微生物粘附性提高的结果.因此,原位植入法是一种很好的表面改性方法,可使纳米颗粒暴露在表面并直接与微生物作用,发挥颗粒性能.
TiO2作为一种稳定性强的无机纳米材料,具有无毒、粒径小、亲水性强等优点,是制备纳米改性超滤膜的主要材料之一 (Pinget al., 1995).研究表明,植入TiO2后的膜的亲水性大幅提高,在光催化下显出良好的抗菌性能 (Huang et al., 2008; Rahimpour et al., 2011; Liu et al., 2008).因此,本文尝试通过原位植入亲水性强的TiO2对聚砜超滤膜进行改性,观察原位植入法的适用性,并探究黑暗条件下TiO2的抗生物污染性能,识别其机理是否依旧与“抗生物粘附性”有关;其次针对改性膜的抗生物污染性能与抗粘附性能之间的关系,改变膜表面纳米颗粒覆盖率,观察改性膜的抗生物污染性能与颗粒覆盖率之间的关系.
2 材料及方法 (Materials and methods) 2.1 试验材料与试剂试剂:聚砜 (PSf, Sigma-Aldrich)、1-甲基-2-吡咯烷酮 (NMP, Sigma-Aldrich)、聚乙烯吡咯烷酮 (PVP, Sigma-Aldrich)、二氧化钛 (TiO2, P25, Evonik-Degussa)、盐酸 (HCl, 分析纯)、氢氧化钠 (NaOH, 分析纯)、无水乙醇 (分析纯)、戊二醛 (分析纯)、铜绿假单胞菌 (P. aeruginosa, ATCC 27853,中国工业微生物菌种保藏管理中心)、干粉性LB培养基 (生化纯)、磷酸盐缓冲溶液 (PBS, 磷酸二氢钾0.24 g·L-1、磷酸氢二钠1.44 g·L-1、氯化钾0.2 g·L-1、氯化钠8.0 g·L-1)、假单胞菌显色培养基 (CHROMagar Pseudomonas, 郑州博赛生物技术股份有限公司)、SYTO®9绿色荧光核酸染料 (LIVE/DEAD® Biofilm Viability Kit, Invitrogen, Ltd., UK).
仪器:刮膜刀 (AP-G06/10, Paul N. Gardner Company)、玻璃板 (DP-GB-2B, Paul N. Gardner Company)、纳米粒度及Zeta电位仪 (DelsaNano C, Beckman)、扫描电子显微镜 (UHR FE-SEM SU8000, HITACHI, Janpan)、倒置激光共聚焦显微镜 (LSM780, Zeiss, Germany)、接触角测定仪 (OCA20, DataPhysics)、超滤杯 (Amicon 8050, Millipore Corporation)、双光束紫外可见分光光度计 (TU-1901,北京普析通用仪器有限公司)、pH计 (ORION STAR A211, Thermo)、数控超声波清洗器、数显恒温水浴锅、高压蒸汽灭菌锅、生化培养箱、磁力搅拌器、电子天平.
2.2 聚砜超滤膜的制备铸膜液制备:将PSf、PVP和NMP按质量比为15:8:77的比例混合并连续搅拌24 h,形成均一透亮的淡黄色液体,然后于避光处静置12 h脱泡.
将铸膜液 (60 ℃,水浴) 倒出少许在经乙醇洗净并干燥的玻璃板上,用已调节厚度为200 μm的刮刀快速均匀地刮膜,而后迅速置于60 ℃的去离子水中固化20 min,将膜取出并浸泡在去离子水中,24 h后自然干燥并保存,所制膜即为未改性膜,记为UF-B.
2.3 改性聚砜超滤膜的制备配制浓度为10 g·L-1的TiO2储备液,超声2 h后,取一定量储备液稀释成不同浓度 (分别是50、100、250和500 mg·L-1) 的使用液,于60 ℃恒温超声30 min使其充分分散后作为沉淀浴使用.其余步骤与2.2节所述操作相同.改性膜分别记为“UF-浓度”(即使用500 mg·L-1的使用液改性的膜记为UF-500).
2.4 纳米颗粒的分散性分别测定不同条件下TiO2纳米颗粒的粒径,观察分散性对颗粒植入的影响.取已超声的TiO2使用液,分别测定其pH和粒径.取一定量已超声的TiO2使用液用HCl或NaOH分别调节至不同的pH,然后测其粒径.
2.5 膜性能表征和测试 2.5.1 膜表面形貌特征将自然干燥的膜经镀铂预处理后用扫描电子显微镜 (SEM) 观察表面形貌.
2.5.2 膜阻测试将在去离子水中浸泡24 h的膜样剪成大小合适的圆形膜片,通过死端过滤超纯水方式测定通量.经0.15 MPa预压30 min后,将通量测试装置在0.1 MPa下运行30 min并通过与计算机相连的电子天平自动记录滤出液质量.使用达西方程计算膜阻,具体如公式 (1) 所示.
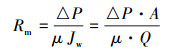
|
(1) |
式中,Rm为过滤阻力 (m-1); △P为过滤压差 (Pa); A为过滤面积 (m2);Q为体积流速 (m3·s-1);μ为液体粘度 (Pa·s), 本实验即为纯水粘度.
2.5.3 接触角测试通过接触角测试观察聚砜膜改性前后亲水性的变化.膜经自然风干后,以纯水作为测试液体,选取膜表面较为平整的区域进行接触角测试.随机测量膜上的10个位置,去掉最大、最小值后取平均值作为该膜的接触角,用以表征所制超滤膜表面的亲水性.
2.5.4 抑菌实验铜绿假单胞菌 (P. aeruginosa,ATCC 27853,中国工业微生物菌种保藏管理中心) 极易形成生物膜, 因此, 被选为模型微生物.
取活化至第3代的菌种按1%的比例与新鲜LB培养基 (已灭菌) 混合,置于37 ℃、120 r·min-1的振荡培养箱中培养12 h,菌液OD600值为1.3左右,浓度约为2×109 CFU·mL-1(梯度稀释平板计数法测定).取一定体积的菌液,在4 ℃、5000 r·min-1条件下离心5 min,倒去上清液后用等体积的PBS缓冲溶液分散并摇匀,重复离心分散操作3次,以去除多余的LB培养基,再用等体积的PBS缓冲溶液分散,所得即为同等浓度的铜绿假单胞菌悬浮液.
抑菌环实验:抑菌环实验 (Inhibition zone test) 常用于膜的抑菌性能评价 (Kim et al., 2012; Liu et al., 2010), 具体操作过程如下:利用PBS将所制备的铜绿假单胞菌悬浮液稀释1000倍,取200 μL稀释后的铜绿假单胞菌悬浮液滴加到已准备好的LB固体培养基 (琼脂质量分数为1.5%) 上,并用三角涂布棒将其涂布均匀; 将膜样剪成直径约为2 cm的圆片,经PBS浸泡湿润后,正面向下,轻轻贴在涂好菌液的LB固体培养基上,用锡纸完全包覆使其处于黑暗条件; 将培养基置于37 ℃条件下,黑暗培养18~24 h后观察膜片周围铜绿假单胞菌菌落的生长情况.
显色培养实验:在过滤过程中,如果纳米颗粒破坏或穿透细菌细胞,则细菌不能进一步形成菌落,因此,可根据模型细菌在膜表面的生长情况判断膜是否有抑菌性能.利用PBS将所制备的铜绿假单胞菌悬浮液稀释107倍 (菌液浓度约为200 CFU·mL-1),然后取1 mL菌悬液和9 mL的PBS缓冲液加入到超滤杯中,在0.15 MPa的操作压力下 (铜绿假单胞菌可承受压力范围内),将铜绿假单胞菌过滤到膜表面,直至滤干.然后用镊子将膜样取出,正面放置于提前准备好的盛有15 mL的假单胞菌固体显色培养基上,使膜样和培养基完全贴合以保证培养基可从底部向表面迁移,供铜绿假单胞菌生长,然后置于30 ℃黑暗培养24 h.
2.5.5 膜的微生物粘附性通过观察铜绿假单胞菌在垂直放置的膜表面上粘附的个数对膜的微生物粘附性进行测试.生物污染的第一阶段即是微生物在膜表面的粘附,因此,膜表面粘附细菌越少,其抗生物污染性能就越强.具体操作如下.
按照2.5.4节配制一定体积的铜绿假单胞菌悬浮液.将膜样剪成1.5 cm×4 cm大小,提前在紫外灯下照射30 min以去除杂菌干扰.将膜垂直置于10 mL的菌悬液中,在37 ℃的培养箱中黑暗培养12 h,然后将膜样转移至10 mL体积分数为2.5%的戊二醛溶液中固定,于4 ℃冰箱中放置5 h.
经固定后,将膜样在30 mL的PBS中浸泡5 min,然后依次在30 mL的25%、50%、75%和100%的乙醇溶液中浸泡10 min进行梯度脱水,取出后自然晾干待SEM观察.
为模拟实际过滤中产生的生物污染,将4 ℃冰箱中保存的铜绿假单胞菌培养液 (已活化至第3代,OD600约1.4) 按照2.5.4节中的方法配制成铜绿假单胞菌悬浮液,并梯度稀释108倍.取3 mL已稀释菌悬液和27 mL的PBS缓冲液加到超滤杯中,在0.10 MPa的操作压力下过滤20 mL.将膜片在PBS缓冲溶液中漂洗3次,正面置于提前准备好的盛有15 mL的假单胞菌固体显色培养基上,使膜样和培养基完全贴合,然后置于30 ℃黑暗培养24 h.
2.5.6 生物膜生长测试超滤膜表面的生物膜是导致膜水通量降低乃至寿命缩短的主要因素,因此,通过对比相同时间内膜表面的生物膜厚度,即可判断膜改性前后抗生物污染性能的变化.
按照2.5.4节中方法配制一定体积的菌悬液,将膜样剪成1 cm×1 cm大小,用双面胶固定在载玻片上,然后置于盛有30 mL菌悬液 (约2×109 CFU·mL-1) 的培养皿中,在37 ℃的培养箱中黑暗培养24 h.取出载玻片,用PBS洗去表面游离的菌悬液,用SYTO®9绿色荧光染料在黑暗条件下染色15 min,用PBS洗去表面多余的染料,将其置于激光共聚焦显微镜 (CLSM) 下观察.
3 结果 (Results) 3.1 原位植入TiO2前后膜表面形貌特征 3.1.1 TiO2的原位植入图 1是原位植入TiO2前后的聚砜超滤膜表面形貌的SEM图,分别放大了50000、5000和10000倍.60 ℃去离子水沉淀浴中所制得空白聚砜膜的孔径大都在30 nm左右,且孔隙率较高 (图 1a).观察图 1b可知,将沉淀浴换成500 mg·L-1的TiO2使用液后,膜表面基本没有颗粒粘附,因此,通过原位植入法并不能直接植入TiO2颗粒,然而之前的研究中可直接植入氧化铝和LTL型沸石颗粒 (Dong et al., 2015),因此,TiO2的植入条件有所不同.
 |
| 图 1 聚砜超滤膜表面SEM图 (a.未改性超滤膜UF-B, b.自然分散的TiO2原位植入改性超滤膜, c.pH=4的原位植入法改性膜UF-500) Fig. 1 The SEM images of the polysulfone ultrafiltration membranes (a.unmodified membrane UF-B, b.membrane modified by TiO2 unsuccessfully, c.membrane UF-500 modified by TiO2(pH=4)) |
尝试调节已超声的TiO2使用液的pH为4,作为沉淀浴使用.根据图 1c可知,调节pH为4后,膜表面的TiO2覆盖率有了极大提高,通过调节pH的原位植入法可以成功植入TiO2.因此,后续实验则用调节pH的原位植入法.观察图 1c可知,植入到膜表面的TiO2颗粒粒径大都在100 nm左右,分散较为均匀,因为TiO2的一次颗粒为21 nm,极强的表面能使一次颗粒团聚在一起方可形成稳定体系,因此,膜表面的颗粒均是TiO2的一次颗粒团聚在一起形成的颗粒,还出现了部分微米级的团聚体.
3.1.2 不同覆盖率的TiO2改性膜的形貌特征分别使用已超声的50、100、250和500 mg·L-1的TiO2分散液,各自调节pH为4后作为沉淀浴使用,即可制得具有不同TiO2覆盖率的改性膜,SEM下放大50000倍后其表面形态如图 2所示.
 |
| 图 2 不同覆盖率的TiO2改性聚砜超滤膜表面 (a.UF-50, b.UF-100, c.UF-250, d.UF-500) Fig. 2 The SEM images of the modified ultrafiltration membranes with different TiO2 coverages (a.UF-50, b.UF-100, c.UF-250, d.UF-500) |
从图 2可以看出,随着沉淀浴中TiO2浓度的增加,膜表面TiO2颗粒覆盖率在不断提高,而且由于浓度的提高,一次颗粒碰撞并结合在一起的概率提高,因此,颗粒团聚体体积也有所增大.经图像软件测算,不同浓度对应的覆盖率分别是12.3%、17.0%、22.4%和27.7%.
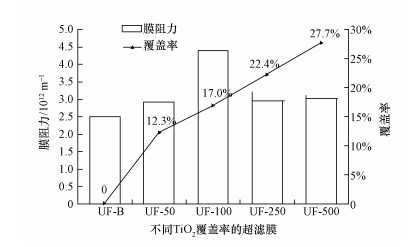
3.2 TiO2改性超滤膜的基本性能表征经测试,0.1 MPa恒定压力下,未改性膜UF-B的纯水通量为142.38 L·m-2·h-1,用50、100、250和500 mg·L-1的TiO2分散液制备的改性膜的纯水通量分别为121.84、81.35、121.12和117.68 L·m-2·h-1.如图 3所示,未改性膜UF-B的膜阻力约为2.51×1012 m-1,相对于未改性膜,改性膜的膜阻力稍有增加,分别为2.93×1012、4.39×1012、2.95×1012和3.03×1012 m-1.
 |
| 图 3 改性膜与未改性膜的膜阻力与TiO2覆盖率 Fig. 3 The membrane resistances and TiO2 coverages of unmodified and modified membranes |
除UF-100外,随着膜表面颗粒覆盖率的提高,改性膜的膜阻力也随之增加,但增加幅度并不明显,膜阻力均为3×1012 m-1左右,因此,TiO2的植入在一定程度上会稍降低膜纯水通量,但影响并不大.
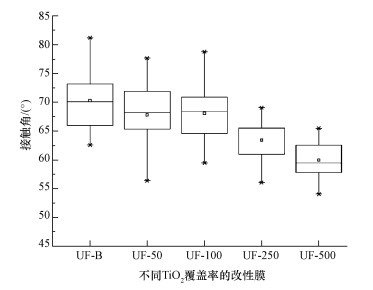
用纯水测定膜接触角可发现 (图 4),同一膜表面接触角测试的结果均出现较大波动,最大最小值可相差十几度,可能是测试环境影响, 例如, 灰尘粘附在膜上或者是膜表面颗粒分布不够均匀造成.空白膜的接触角为70.14°,不同TiO2覆盖率的改性膜的接触角均值分别为67.88°、67.81°、63.65°及59.98°.因此,随着膜表面TiO2覆盖率的提高,膜的接触角降低,亲水性不断增加.
 |
| 图 4 不同TiO2覆盖率的超滤膜的接触角对比 Fig. 4 Contact angles of membranes with different TiO2 coverage |
图 5是黑暗条件下进行的抑菌试验,可以看出,未改性膜UF-B和改性超滤膜UF-500周围的铜绿假单胞菌均能正常生长,没有出现明显的抑菌环.因此,在黑暗条件下,TiO2纳米颗粒的植入并没有提高膜的抑菌性能.
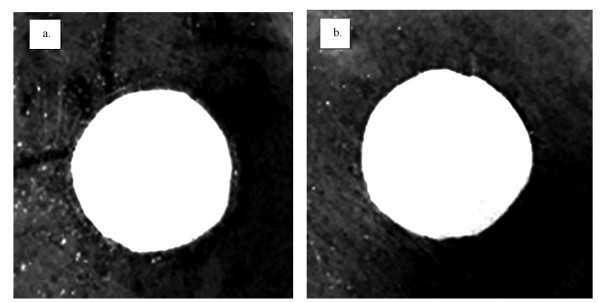 |
| 图 5 膜改性前后的抑菌环实验 (a.UF-B, b.UF-500) Fig. 5 The inhibition zone test of unmodified and modified membranes (a.UF-B, b.UF-500) |
显色培养是细菌在生长过程中产生的特异性酶与显色酶底物反应释放色原物质从而使培养基着色的过程.图 6是黑暗条件下未改性膜UF-B和改性超滤膜UF-500的显色培养实验结果.可以看出,经过24 h培养后,2种膜表面的铜绿假单胞菌都已形成菌苔,尽管无法清楚计算2种膜表面的菌落数,但通过铜绿假单胞菌代谢产生的蓝色反应所占膜表面的面积进行定性判断可发现,UF-500膜表面的铜绿假单胞菌的生物量相对于未改型膜UF-B上的生物量并没有明显的减少,因此,TiO2纳米颗粒在黑暗条件下并没有抑菌性,经TiO2改性的超滤膜也没有明显的抑菌性.
 |
| 图 6 膜改性前后的显色培养实验 (a.UF-B, b.UF-500) Fig. 6 The P. aeruginosa clonies growed on unmodified and modified membranes on chromogenic media a.UF-B, b.UF-500) |
图 7是静态浸泡过程中铜绿假单胞菌在聚砜膜表面的粘附情况 (分别放大了5000倍).12 h培养后,未改性膜表面粘附了大量细菌,部分细菌对生或短链排列形成细胞群 (图 7a).经计算,膜表面的细菌密度约为3.48×1011个·m-2.图 7b~7e分别是经TiO2改性后的超滤膜表面的铜绿假单胞菌的粘附情况.相对于未改性膜,植入TiO2后,铜绿假单胞菌在膜表面的粘附大大减少,而且随着覆盖率的提高,单位面积上的细菌粘附个数也在不断减少.UF-50、UF-100、UF-250和UF-500膜表面铜绿假单胞菌的粘附密度分别约为1.19×1011、7.61×1010、2.43×1010和2.68×1010个·m-2,相对于未改性膜,膜表面细菌粘附分别减少了65.7%、78.1%、93.0%和92.3%.可以看出,TiO2的植入可有效减少细菌的粘附,而且随着膜表面覆盖率的提高,粘附的细菌的数量也随之明显下降.然而,随着膜表面覆盖率的进一步提高,对比UF-250和UF-500可知,膜表面细菌粘附的数量却有一定的增加.
 |
| 图 7 聚砜超滤膜表面铜绿假单胞菌的粘附情况电镜图 (a.UF-B, b.UF-50, c.UF-100, d.UF-250, e.UF-500) Fig. 7 The SEM images of P. aeruginosaadhesion on polysulfone membranes with different TiO2 coverages (a.UF-B, b.UF-50, c.UF-100, d.UF-250, e.UF-500) |
图 8是过滤等量的20 mL菌悬液并用PBS缓冲溶液漂洗后粘附到膜表面的铜绿假单胞菌经显色培养后的结果.根据3.3节的结果可知,黑暗条件下TiO2没有直接的抑菌性能,因此,通过过滤等量菌悬液可以表征过滤过程中细菌在膜上粘附的倾向性,然后通过漂洗可去除膜表面未粘附或粘附不紧密的铜绿假单胞菌.由图 8可知,在植入TiO2纳米颗粒后,改性膜表面细菌的不可逆粘附相对于未改性膜有了明显减少,随着膜表面颗粒覆盖率的不断提高,膜表面的不可逆粘附也呈现出先减少后部分增加的趋势.
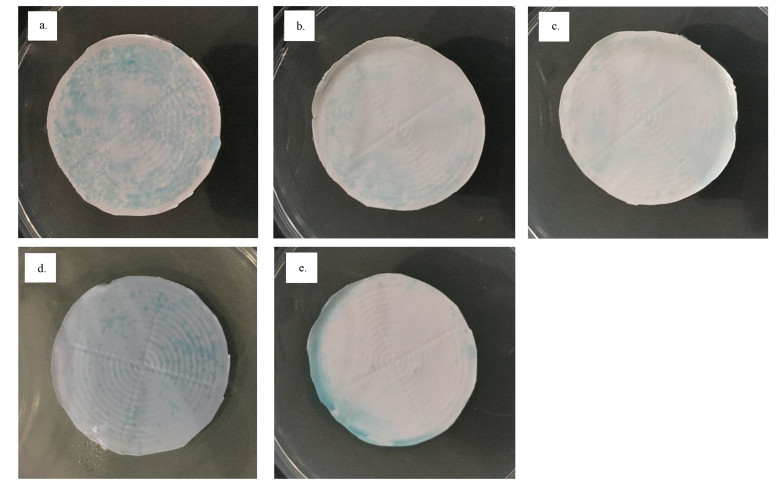 |
| 图 8 过滤过程中粘附到膜表面的铜绿假单胞菌的显色培养 (a.UF-B, b.UF-50, c.UF-100, d.UF-250, e.UF-500) Fig. 8 The P. aeruginosa clonies growed on unmodified and modified membranes on chromogenic media after filtration (a.UF-B, b.UF-50, c.UF-100, d.UF-250, e.UF-500) |
用铜绿假单胞菌悬浮液培养24 h后,膜表面出现了生物膜,CLSM观察结果显示,未改性超滤膜表面的生物膜厚度可达到64.5 μm (图 9a);植入不同浓度的TiO2之后,UF-50、UF-100、UF-250和UF-500表面生物膜厚度分别是42.5、32.8、19.3和32.3 μm,生物膜厚度分别减少了34.1%、49.1%、70.1%和49.9%(部分CLSM图在文中略去).TiO2的植入能有效减少膜表面生物膜的生长,因此,改性后的超滤膜抗生物污染性能有明显增强.
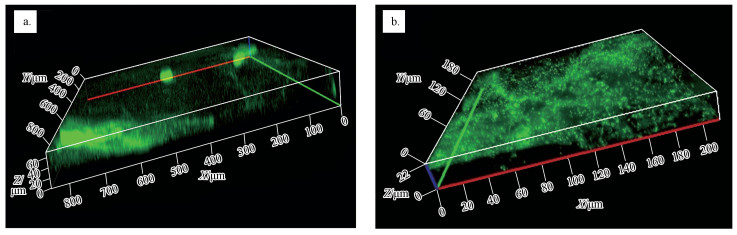 |
| 图 9 膜改性前后的生物膜生长的共聚焦显微镜图像 (a.UF-B, b.UF-250) Fig. 9 The CLSM images of thickness of P. aeruginosa biofilm on unmodified and modified membranes (a.UF-B, b.UF-250) |
经调节pH至4后,可通过原位植入法将TiO2纳米颗粒负载到聚砜膜表面,从而改变膜的性能.对pH调节前后的TiO2使用液的粒径测试可知 (图 10),TiO2作为亲水性很强的纳米颗粒,在常温超声后具有较好的分散性,颗粒大都在200 nm以下,而经过60 ℃恒温超声后,使用液中TiO2颗粒粒径有了明显的增加达到微米级,此时测得pH为5.79;当调节pH为4后,颗粒粒径重新回归至100 nm左右.根据Komkrit等 (2011)的研究结果,纳米TiO2等电点pH为6.02,因此,60 ℃超声状态下TiO2使用液的Zeta电位较低,颗粒基本不带电荷,而且温度较高布朗运动剧烈使得碰撞概率提高,因此,颗粒团聚现象严重;而当调节pH为4后,颗粒表面Zeta电位升高带电量增加,颗粒间的静电斥力增大从而TiO2颗粒的分散性增强.因此,良好的分散性是影响TiO2原位植入的主要因素之一.而根据前期 (Dong et al., 2015;董蕾茜等,2014) 研究成果,Al2O3因分散性良好可直接植入到膜表面;未成功分散的LTL无法植入,但延长超声时间后分散性增强使LTL植入成功,因此,良好的分散性也是影响纳米颗粒原位植入的主要因素之一.
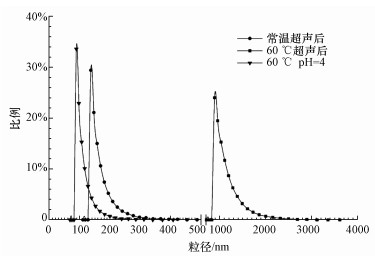 |
| 图 10 不同条件下500 mg·L-1的TiO2分散液的粒径分布 Fig. 10 The diameter distributions of TiO2 (500 mg·L-1) under different conditions |
TiO2的植入能够在不明显牺牲膜通量的前提下,有效增强聚砜膜的亲水性.无孔的TiO2一次颗粒约在21 nm左右,稍大于膜孔径,因此,表面植入的颗粒嵌入膜孔中后对部分膜孔有一定的堵塞作用,然而由于TiO2有较强的亲水性,且在膜表面的覆盖率最高为27.7%(图 11),因此,在膜润湿性增强和膜孔堵塞的双重作用下,使改性膜阻力有了一定的升高,但幅度不大.Yang等 (2007)利用共混方法植入了较高浓度TiO2颗粒后也出现膜通量下降而膜亲水性明显增强的情况.然而原位植入Al2O3和LTL的改性超滤膜的膜阻力相对于未改性膜却有明显下降,主要是因为膜亲水性增强的缘故 (Dong et al., 2015).使用相同浓度的纳米颗粒沉淀浴时,TiO2改性膜的亲水性弱于Al2O3改性膜和LTL改性膜的亲水性,主要是因为TiO2改性膜的颗粒覆盖率低于后两者,而且颗粒本身亲水性有所差别.改性膜通过调节沉淀浴中TiO2的浓度,制备了具有不同TiO2覆盖率的纳米颗粒改性膜,从而制备了一系列具有不同亲水性的改性膜.而且膜表面TiO2的覆盖率和沉淀浴中颗粒的浓度在一定范围内呈现出良好的线性关系,通过原位植入法可对膜改性过程进行一定的控制.纳米颗粒通常具有较高的表面能,其亲水性一般会强于疏水的聚砜,例如, Li等 (2004)测定了TiO2薄膜的接触角为59°±2°,依旧比添加了亲水物质PVP的聚砜膜的接触角 (70.14°) 小,因此,表面植入TiO2可以有效改善膜的亲水性.
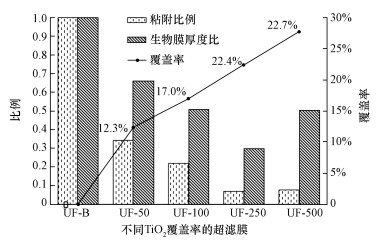 |
| 图 11 改性膜与未改性膜表面的细菌粘附比例、生物膜生长比例与TiO2覆盖率 Fig. 11 P. aeruginosa adhesion and biofilm thickness on membranes with different TiO2 coverages |
不同TiO2覆盖率的改性膜的抗生物污染性能均优于未改性聚砜膜.随着膜表面TiO2覆盖率的提高,改性膜的抗粘附性和抗生物膜生长性能都存在先增强后略微下降的趋势.经对比,改性膜表面TiO2覆盖率为22.4%时 (UF-250),能够减少93%的细菌粘附和70%的生物膜生长,且在过滤过程中也可以明显减少细菌的不可逆粘附,在4种膜中其抗生物污染性能表现最优,所以当TiO2覆盖率在22.4%~27.7%之间时,改性膜具有最优的抗生物污染性能,因此,在制备纳米颗粒改性膜时需要控制颗粒在膜表面的覆盖率以达到最佳效果.膜表面植入TiO2也可有效减少过滤过程中细菌在膜表面的不可逆粘附,因此,植入TiO2改性超滤膜在实际生产中有应用前景.实际生产中,原水中的细菌个数及活性远远达不到本研究的实验设计,而且超滤膜装置常采用错流过滤的方式,水流对膜表面有一定的冲刷作用,因此,改性膜在浸泡条件下的抗生物污染性能的提高和过滤过程中的不可逆粘附的减少对膜的实际应用均有指导意义.本研究仅初步采用了死端过滤的方式定性判断,可进一步通过添加搅拌器对实际水流流动形态进行模拟,研究搅拌速度、过滤时间和体积等对细菌粘附的影响.
通过抑菌环实验和黑暗条件下的显色培养实验可看出,TiO2没有直接的抑菌性.抑菌环的形成和抑菌性物质 (银离子) 的扩散有关,因此,可通过抑菌环大小来表征释放性抑菌物质的抑菌性能 (Kim et al., 2012; Liu et al., 2010).通过抑菌环实验可知,TiO2不能产生并释放对细菌有直接抑制的物质.还有研究指出,对于部分无机氧化物纳米颗粒,其抑菌原理主要表现在“接触-抑制”上.纳米颗粒较大的表面能会对接触的细菌细胞膜产生“刺穿”效果,从而使细胞质泄漏进而细胞死亡 (Li et al., 2008; Huh et al., 2011; Ansari et al., 2013).然而根据3.3节结果可知,黑暗条件下过滤到未改性膜和改性膜表面的铜绿假单胞菌均正常生长,因此,TiO2和铜绿假单胞菌之间也不存在“接触-抑制”.而且大量研究证明,TiO2的抑菌性是因其在紫外激发下释放的羟基自由基对细菌细胞产生破坏作用 (Ping et al., 1995;Li et al., 2008),本实验均在黑暗中进行,因此,改性膜具有的抗生物污染性能与TiO2的光催化性无关.TiO2的植入提高了膜的亲水性,可以有效减少铜绿假单胞菌的粘附,从而影响膜表面生物膜生长.生物膜生长不仅受细菌和膜之间粘附的影响,还与细菌之间的粘附能力有关,因此,改性膜的抗生物膜生长能力与其抗粘附能力有一定差别,但二者随膜表面TiO2覆盖率的变化趋势一致.然而,当膜表面覆盖率从22.4%提高到27.7%后,膜表面粘附的细菌有一定增加,或许是因为膜表面粗糙度增大的影响,根据图 3可发现,UF-500相比UF-250,植入到膜表面的TiO2的颗粒团聚体更大.而且,董蕾茜等 (2015)曾用相同方法将Al2O3植入到聚砜膜表面,经对比发现, 对于不同的纳米颗粒改性后的超滤膜的抗生物性能也有不同,在相同浓度的纳米颗粒沉淀浴条件下,通过氧化铝或LTL制备的改性膜因具有更高的覆盖率,其抗生物污染性能均稍强于TiO2改性膜,在相同覆盖率条件下,氧化铝改性膜的抗生物污染性能也强于TiO2改性膜.
对比氧化铝、LTL及TiO2改性膜的抗生物污染性能可发现,纳米颗粒或许普遍都具有抗微生物粘附性能,但不同的纳米颗粒的抗粘附性能力强弱有所不同,说明颗粒本身性质对膜抗生物污染性能会产生影响.初步实验发现,通过离心取上清液的方式可以提高膜表面植入颗粒的均一性,但相对地降低了膜表面的覆盖率,因此,对于粗糙度及颗粒本身理化性质对于膜抗生物污染性能的影响需进一步研究,希望通过植入颗粒更小、分散性更强的颗粒观察颗粒的粒径对于抗生物污染性能的影响.
5 结论 (Conclusions)1) 通过调节TiO2沉淀浴的pH为4,可以增强TiO2的分散性,从而将TiO2原位植入到聚砜膜的表面.纳米颗粒的分散性是影响植入的主要因素之一.控制沉淀浴中TiO2的浓度可有效地控制改性聚砜膜表面TiO2的覆盖率,从而制备具有不同性能的TiO2改性超滤膜.
2) 制备了具有12.3%、17.0%、22.4%和27.7%覆盖率的TiO2改性超滤膜,其膜的接触角从70.14°分别下降为67.88°、67.81°、63.65°及59.98°,改性后聚砜膜的亲水性增加,纯水通量没有明显下降,相对于未改性超滤膜,改性膜表面细菌粘附分别减少了65.7%、78.1%、93.0%和92.3%,生物膜厚度减少了30%以上,改性膜的抗生物污染性能均优于未改性膜,其中, 当膜表面TiO2覆盖率介于22.4%~27.7%之间时具有最优的抗生物污染性能.
3) 改性膜亲水性的增强是其抗生物污染性能提高的原因之一,此外,纳米颗粒的性质如粒径、形态等和改性膜表面粗糙度或是影响膜的抗生物污染性能的其它因素,需进一步的实验研究.
致谢: 感谢清华大学分析中心及清华大学生物医学测试中心等对本实验提供的大力支持.| [${referVo.labelOrder}] | Ansari M A, Khan H M, Khan A A, et al. 2013. Antibacterial potential of Al2O3 nanoparticles against multidrug resistance strains of Staphylococcus aureus isolated from skin exudates[J]. Journal of Nanoparticle Research, 15(10) : 1–12. |
| [${referVo.labelOrder}] | Ben Sasson M, Zodrow K R, Genggeng Q, et al. 2013. Surface functionalization of thin-film composite membranes with copper nanoparticles for antimicrobial surface properties[J]. Environmental Science & Technology, 48(1) : 384–393. |
| [${referVo.labelOrder}] | Daraei P, Madaeni S S, Ghaemi N, et al. 2013. PAA grafting onto new acrylate-alumoxane/PES mixed matrix nano-enhanced membrane:Preparation, characterization and performance in dye removal[J]. Chemical Engineering Journal, 221 : 111–123. DOI:10.1016/j.cej.2013.01.079 |
| [${referVo.labelOrder}] | Dong L X, Yang H W, Liu S T, et al. 2015. Fabrication and anti-biofouling properties of alumina and zeolite nanoparticle embedded ultrafiltration membranes[J]. Desalination, 365 : 70–78. DOI:10.1016/j.desal.2015.02.023 |
| [${referVo.labelOrder}] | 董蕾茜, 王小, 丁文明, 等. 2014. 纳米颗粒原位植入法制备改性超滤膜及其抗生物污染性能研究[J]. 环境科学学报, 2014, 34(11) : 2731–2738. |
| [${referVo.labelOrder}] | Gao W, Liang H, Ma J, et al. 2011. Membrane fouling control in ultrafiltration technology for drinking water production:a review[J]. Desalination, 272(1) : 1–8. |
| [${referVo.labelOrder}] | Huang X, Leal M, Li Q. 2008. Degradation of natural organic matter by TiO2 photocatalytic oxidation and its effect on fouling of low-pressure membranes[J]. Water Research, 42(4) : 1142–1150. |
| [${referVo.labelOrder}] | Huh A J, Kwon Y J. 2011. "Nanoantibiotics":A new paradigm for treating infectious diseases using nanomaterials in the antibiotics resistant era[J]. Journal of Controlled Release, 156 : 128–145. DOI:10.1016/j.jconrel.2011.07.002 |
| [${referVo.labelOrder}] | Isloor A M, Ganesh B M, Isloor S M, et al. 2013. Studies on copper coated polysulfone/modified poly isobutylene alt-maleic anhydride blend membrane and its antibiofouling property[J]. Desalination, 308 : 82–88. DOI:10.1016/j.desal.2012.07.021 |
| [${referVo.labelOrder}] | Junaidi M U M, Leo C P, Kamal S N M, et al. 2013. Fouling mitigation in humic acid ultrafiltration using polysulfone/SAPO-34 mixed matrix membrane[J]. Water Science & Technology, 67(9) : 2102–2109. |
| [${referVo.labelOrder}] | Khulbe K C, Feng C, Matsuura T. 2010. The art of surface modification of synthetic polymeric membranes[J]. Journal of Applied Polymer Science, 115(2) : 855–895. DOI:10.1002/app.v115:2 |
| [${referVo.labelOrder}] | Kim E S, Hwang G, Gamal El Din M, et al. 2012. Development of nanosilver and multi-walled carbon nanotubes thin-film nanocomposite membrane for enhanced water treatment[J]. Journal of Membrane Science, 394-395 : 37–48. DOI:10.1016/j.memsci.2011.11.041 |
| [${referVo.labelOrder}] | Kim S H, Kwak S Y, Sohn B H, et al. 2003. Design of TiO2 nanoparticle self-assembled aromatic polyamide thin-film-composite (TFC) membrane as an approach to solve biofouling problem[J]. Journal of Membrane Science, 211(1) : 157–165. DOI:10.1016/S0376-7388(02)00418-0 |
| [${referVo.labelOrder}] | Koseoglu Imer D Y, Kose B, Altinbas M, et al. 2013. The production of polysulfone (PS) membrane with silver nanoparticles (AgNP):Physical properties, filtration performances, and biofouling resistances of membranes[J]. Journal of Membrane Science, 428 : 620–628. DOI:10.1016/j.memsci.2012.10.046 |
| [${referVo.labelOrder}] | Leo C P, Kamil N A, Junaidi M U M, et al. 2013. The potential of SAPO-44 zeolite filler in fouling mitigation of polysulfone ultrafiltration membrane[J]. Separation and Purification Technology, 103 : 84–91. DOI:10.1016/j.seppur.2012.10.019 |
| [${referVo.labelOrder}] | Li B, Logan B E. 2004. Bacterial adhesion to glass and metal-oxide surfaces[J]. Colloids and Surfaces B:Biointerfaces, 36(2) : 81–90. DOI:10.1016/j.colsurfb.2004.05.006 |
| [${referVo.labelOrder}] | Li Q, Mahendra S, Lyon D Y, et al. 2008. Antimicrobial nanomaterials for water disinfection and microbial control:potential applications and implications[J]. Water Research, 42(18) : 4591–4602. DOI:10.1016/j.watres.2008.08.015 |
| [${referVo.labelOrder}] | Liang S, Qi G, Xiao K, et al. 2014. Organic fouling behavior of superhydrophilic polyvinylidene fluoride (PVDF) ultrafiltration membranes functionalized with surface-tailored nanoparticles:Implications for organic fouling in membrane bioreactors[J]. Journal of Membrane Science, 463 : 94–101. DOI:10.1016/j.memsci.2014.03.037 |
| [${referVo.labelOrder}] | Liu S, Lim M, Fabris R, et al. 2008. TiO2 photocatalysis of natural organic matter in surface water:impact on trihalomethane and haloacetic acid formation potential[J]. Environmental Science & Technology, 42(16) : 6218–6223. |
| [${referVo.labelOrder}] | Liu C X, Zhang D R, He Y, et al. 2010. Modification of membrane surface for anti-biofouling performance:Effect of anti-adhesion and anti-bacteria approaches[J]. Journal of Membrane Science, 346 : 121–130. DOI:10.1016/j.memsci.2009.09.028 |
| [${referVo.labelOrder}] | Mansouri J, Harrisson S, Chen V. 2010. Strategies for controlling biofouling in membrane filtration systems:challenges and opportunities[J]. Journal of Materials Chemistry, 20(22) : 4567–4586. DOI:10.1039/b926440j |
| [${referVo.labelOrder}] | Maximous N, Nakhla G, Wan W, et al. 2009. Preparation, characterization and performance of Al2O3/PES membrane for wastewater filtration[J]. Journal of Membrane Science, 341(1) : 67–75. |
| [${referVo.labelOrder}] | Osada Y, Nakagawa T. 1992. Membrane Science and Technology[M]. Boca Raton: CRC Press: 321–326. |
| [${referVo.labelOrder}] | Ping L, Huaxiang L, Xianzhi F, et al. 1995. Preparation of the doped TiO2 film photocatalyst and its bactericidal mechanism[J]. Chinese Journal of Catalysis, 20(3) : 327–328. |
| [${referVo.labelOrder}] | Qin J J, Wong F S, Ying L, et al. 2003. A high flux ultrafiltration membrane spun from PSU/PVP (k90)/DMF/1, 2-propanediol[J]. Journal of Membrane Science, 211 : 139–147. DOI:10.1016/S0376-7388(02)00415-5 |
| [${referVo.labelOrder}] | Rahimpour A, Jahanshahi M, Rajaeian B, et al. 2011. TiO2 entrapped nano-composite PVDF/SPES membranes:Preparation, characterization, antifouling and antibacterial properties[J]. Desalination, 278(1) : 343–353. |
| [${referVo.labelOrder}] | Suttiponparnit K, Jiang J, Sahu M, et al. 2010. Role of surface area, primary particle size, and crystal phase on titanium dioxide nanoparticle dispersion properties[J]. Nanoscale Research Letters, 6(1) : 1–8. |
| [${referVo.labelOrder}] | Ulbricht M. 2006. Advanced functional polymer membranes[J]. Polymer, 47(7) : 2217–2262. DOI:10.1016/j.polymer.2006.01.084 |
| [${referVo.labelOrder}] | Wang X M, Li X Y, Shih K. 2011. In situ embedment and growth of anhydrous and hydrated aluminum oxide particles on polyvinylidene fluoride (PVDF) membranes[J]. Journal of Membrane Science, 368(1) : 134–143. |
| [${referVo.labelOrder}] | 王智, 高学理, 李赛赛. 2013. 表面化学改性法制备抑菌性聚醚砜超滤膜[J]. 水处理技术, 2013, 39(7) : 42–45. |
| [${referVo.labelOrder}] | Wu H, Mansouri J, Chen V. 2013. Silica nanoparticles as carriers of antifouling ligands for PVDF ultrafiltration membranes[J]. Journal of Membrane Science, 433 : 135–151. DOI:10.1016/j.memsci.2013.01.029 |
| [${referVo.labelOrder}] | Xiao K, Wang X M, Huang X, et al. 2011. Combined effect of membrane and foulant hydrophobicity and surface charge on adsorptive fouling during microfiltration[J]. Journal of Membrane Science, 373(1) : 140–151. |
| [${referVo.labelOrder}] | Yan L, Li Y S, Xiang C B, et al. 2006. Effect of nano-sized Al2O3-particle addition on PVDF ultrafiltration membrane performance[J]. Journal of Membrane Science, 276(1) : 162–167. |
| [${referVo.labelOrder}] | Yang Y, Zhang H, Wang P, et al. 2007. The influence of nano-sized TiO2 fillers on the morphologies and properties of PSF UF membrane[J]. Journal of Membrane Science, 288(1) : 231–238. |
| [${referVo.labelOrder}] | Zodrow K, Brunet L, Mahendra S, et al. 2009. Polysulfone ultrafiltration membranes impregnated with silver nanoparticles show improved biofouling resistance and virus removal[J]. Water Research, 43(3) : 715–723. DOI:10.1016/j.watres.2008.11.014 |
 2017, Vol. 37
2017, Vol. 37


