2. 合肥工业大学宣城校区机械工程系, 宣城 242000
2. Department of Mechanical Engineering, Hefei University of Technology Xuancheng Campus, Xuancheng 242000
细颗粒物 (PM2.5)和二氧化硫 (SO2) 是常见的大气污染物,主要来源于煤炭燃烧和机动车尾气排放.研究发现,PM2.5和SO2单独暴露可导致心脏功能下降、心肌缺血和坏死、心衰等,增加了心肌梗死、心律失常、缺血性心脏病等心脏疾病的发病风险和死亡率 (Wang et al., 2009;Brook et al., 2010).数据表明,PM2.5和SO2浓度每增加10 μg·m-3,缺血性心脏病死亡率分别增加5%和1% (Talbott et al., 2014;Liu et al., 2015). PM2.5致心血管系统损伤的机制与氧化应激、炎症反应、血管舒缩功能、血液成分改变、血管内皮细胞功能失调、心脏自主神经功能改变等有关 (陈惠卿等,2014). SO2致心脏损伤的机制与氧化应激、线粒体DNA损伤、心肌细胞膜ATP酶降低及NO-cGMP信号转导通路等有关 (张全喜和孟紫强,2012;秦国华等,2014).目前,PM2.5和SO2联合作用致心脏毒性的机制研究很少.
对空气污染物 (如SO2和PM2.5) 的大多数研究常以单一污染物毒性和健康效应为主 (Deger et al., 2012;Reno et al., 2015;He et al., 2016).然而,空气污染物由多种污染物质混合形成,污染来源不同,成分复杂,故对污染物毒性评估而言,复合污染效应更符合实际. PM2.5和SO2是典型大气污染物,常共同存在于环境中,且接触人群广泛,因此, 对PM2.5和SO2共同暴露的心脏毒性研究对探讨污染复合因子引发心脏疾病的毒理学机制及正确评估污染的健康风险有重要意义.
炎症是机体对于刺激的一种防御反应,同时,炎症反应又是疾病的发病基础.研究表明,炎症及炎症标志物与心脏病发病风险密切相关 (Willerson et al., 2004).促炎细胞因子白介素-1β (IL-1β)、IL-6、肿瘤坏死因子 (TNF-α) 是重要的炎症标志物.一氧化氮 (NO) 是一种心血管调节因子,又是一种毒性强、化学特性极为活泼的自由基.外来刺激可使诱导型一氧化氮合酶 (iNOS) 表达,释放过多NO,引起炎症反应 (自伯海等,2001;姚琪和朱铁兵,2015).鉴于此,本文通过模拟大气PM2.5和SO2污染,研究2种污染物复合暴露对大鼠心脏病理学损伤及炎症因子 (IL-1β、IL-6、TNF-α及iNOS/NO) 表达的影响,探讨PM2.5和SO2复合暴露引起心血管疾病的机制,以期为PM2.5和SO2污染诱导炎症发生提供可靠实验依据.
2 材料与方法 (Materials and methods) 2.1 PM2.5样品采集采用大气颗粒物采样器及石英纤维滤膜收集山西大学环境与资源学院楼顶PM2.5.PM2.5膜剪碎、超纯水超声振荡,纱布过滤洗脱液,收集PM2.5悬液,真空冷冻干燥,以灭菌生理盐水配制成不同浓度的PM2.5悬液.
2.2 实验动物分组和染毒健康成年SD大鼠购自北京中国人民解放军医学科学院实验动物中心,体重180~200 g,购入后在本研究室动物房饲养. 30只大鼠随机分为对照组、5.6 mg·m-3 SO2组、1.5 mg·kg-1 PM2.5组、1.5、6、24 mg·kg-1 PM2.5分别和5.6 mg·m-3 SO2联合作用组,共6组 (编号依次为1~6),每组5只. PM2.5对大鼠染毒采用气管滴注法,大鼠在密闭玻璃容器中乙醚麻醉2 min后,取出大鼠置于泡沫平板上,采用套管和注射器将生理盐水或不同浓度PM2.5混悬液滴注入大鼠气管.隔天1次,共5次. SO2采用动式吸入法,与PM2.5滴注同天进行动式吸入法,每天6 h.联合作用时,先滴注后进行动式吸入法.对照组大鼠于新鲜清洁空气环境中.
2.3 测定指标及分析方法最后1次处理24 h后,处死大鼠,打开胸腔,取心脏左心室中间部位,并在预冷的生理盐水中漂洗浮血,滤纸吸去水分.一部分组织甲醛固定,采用HE (伊红-苏木精) 进行病理学实验;一部分迅速冻于液氮,之后移入-80 ℃冰箱保存,用于测定炎症因子mRNA表达.采用荧光定量RT-PCR方法,所测基因的引物序列、产物大小、退火温度参考本室前期研究 (Li et al., 2015);另取剩余的部分组织以10%(质量体积比, g/mL) 生理盐水匀浆,匀浆液于4 ℃ 3000 r·min-1离心10 min.取上清液,采用ELISA方法 (上海西塘生物科技) 测定IL-1β、IL-6、TNF-α水平. NO和iNOS水平测定采用比色法 (南京建成).蛋白含量测定采用考马斯亮蓝法.
2.4 统计学处理实验所得数据用平均值±标准偏差表示,采用SPSS19.0统计软件进行最小方差 (LSD) 检验,n=5,p < 0.05表示有显著性差异,p < 0.01表示有极显著性差异.
3 结果 (Results) 3.1 PM2.5和SO2对大鼠心脏病理学影响心脏组织病理学观察结果如图 1所示.对照组 (1组) 大鼠心脏组织结构正常,心肌排列规则,横纹清晰,无炎性细胞浸润及出血现象. 1.5 mg·kg-1 PM2.5组 (2组)和SO2组 (3组) 大鼠心肌细胞损伤不明显,略有间隔增大及少量充血.复合暴露组炎症较PM2.5组或SO2组严重,表现为心肌纤维呈不规则断裂,炎性细胞浸润、血管出血及心肌间隔变宽,呈急性炎症反应表现.复合暴露组引起的心脏损伤随PM2.5浓度增加而加重.
 |
| 图 1 PM2.5和SO2作用对大鼠心脏组织病理学影响 (1~6组分别为对照、1.5 mg·kg-1 PM2.5组, 5.6 mg·m-3 SO2组、1.5 mg·kg-1 PM2.5+SO2组、6.0 mg·kg-1 PM2.5+SO2组、24.0 mg·kg-1 PM2.5+SO2组, 下同)(400×) Fig. 1 Morphological characteristics in rat hearts from different groups (400×magnification) |
从图 2中看出,与对照组相比,PM2.5(1.5 mg·kg-1) 组和SO2(5.6 mg·m-3) 组单独作用没有引起大鼠心脏IL-1β、IL-6和TNF-α mRNA和蛋白发生显著变化,除了IL-1β mRNA水平显著升高外.与对照组相比,3个PM2.5+SO2组显著增加了促炎细胞因子IL-6和IL-1β表达水平 (p < 0.05或p < 0.01),较高剂量PM2.5(6和24 mg·kg-1)+SO2组极显著增加了TNF-α表达水平 (p < 0.01).与SO2组相比,PM2.5和SO2复合暴露引起的大鼠心脏IL-6 mRNA和蛋白水平显著升高;较高剂量PM2.5组 (6和24 mg·kg-1)+SO2组极显著增加了IL-1β和TNF-α表达水平 (p < 0.01).与PM2.5组相比,较高剂量PM2.5(6和24 mg·kg-1)和SO2复合暴露引起的大鼠心脏IL-6和TNF-α mRNA和蛋白水平显著升高;最高剂量PM2.5组 (24 mg·kg-1)+SO2组极显著增加了IL-1β mRNA和蛋白表达水平 (p < 0.01).
 |
| 图 2 PM2.5和SO2对大鼠心脏炎症细胞因子mRNA (a)和蛋白 (b) 表达影响 (与对照组相比,*p < 0.05, **p < 0.01;与SO2(5.6 mg·m-3) 组相比,#p < 0.05,##p < 0.01;与PM2.5(1.5 mg·kg-1) 组相比,□p < 0.05, □□p < 0.01, 下同). Fig. 2 Effect of PM2.5 and SO2 on mRNA (a) and protein (b) levels of inflammatory cytokines in rat hearts |
从图 3中看出,与对照组相比,PM2.5(1.5 mg·kg-1) 组和SO2(5.6 mg·m-3) 组单独作用没有引起大鼠心脏NO含量、iNOS mRNA和蛋白发生显著变化.与对照组相比,3个PM2.5+SO2组显著或极显著增加了iNOS mRNA表达水平 (p < 0.05或p < 0.01),较高剂量PM2.5(6和24 mg·kg-1)+SO2组极显著增加了NO含量和iNOS蛋白表达水平 (p < 0.01).与SO2组相比,较高剂量PM2.5(6和24 mg·kg-1)+SO2组极显著增加了NO含量和iNOS蛋白表达水平 (p < 0.01),3个剂量PM2.5+SO2组显著增加了iNOS mRNA表达水平 (p < 0.01).与PM2.5组相比,较高剂量PM2.5(6和24 mg·kg-1)和SO2复合暴露引起了大鼠心脏NO含量和iNOS蛋白表达水平显著增加 (p < 0.05或p < 0.01).
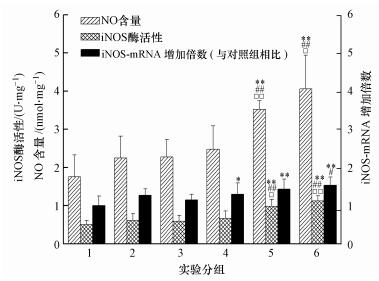 |
| 图 3 PM2.5和SO2对大鼠心脏炎症因子NO、iNOS mRNA和蛋白表达影响 Fig. 3 Effect of PM2.5 and SO2 on NO levels and iNOS mRNA and protein expression in rat hearts |
《2014中国环境状况公报》显示,全国监测的161个城市中,仅有16个城市空气质量年均值达标,145个城市空气质量超标. 74个城市中,2014年SO2年平均浓度达标 (60 μg·m-3) 城市占89.2%;PM2.5是首选污染物,其年平均浓度达标 (35 μg·m-3) 城市占12.2%.由于人群暴露的真实条件是多种污染物复合的空气条件,故空气污染物复合污染引起的毒理学效应及潜在的健康风险是一个非常值得和应该关注的重要课题.
近年来,我国北京、石家庄等大城市不定时出现雾霾天气,其发生与空气中PM2.5浓度高密切相关.研究表明,PM2.5不是单纯对呼吸系统有影响,对心血管系统、免疫系统和神经系统等均有危害 (Wang et al., 2009;Zhao et al., 2013;潘小川,2015).对于心脏,PM2.5能够刺激肺内迷走神经,造成神经紊乱从而波及心脏,并可直接到达心脏,发生心肌梗塞 (陈惠卿等,2014).
SO2是一些工业较发达、人口较稠密或燃用高硫煤较多的城市或地区的典型污染物,是一种普遍存在的大气污染物和刺激性气体.它以低浓度存在于普通大气中,高浓度存在于某些工作场所.其污染主要是由含硫燃料的燃烧和处理过程中而产生,在造纸、钢铁、化工等行业中,许多职业性SO2接触很普遍.最早的SO2功能毒理学研究是SO2对呼吸系统功能影响的研究,它确定了呼吸器官是SO2毒理作用的靶器官.后续的研究发现SO2及其衍生物不仅是呼吸系统毒物,还是全身性毒物 (Meng, 2003).研究发现,高浓度SO2可以引起大鼠血压下降、血管环舒张、心脏收缩力下降、脂质过氧化水平升高,且这些心血管功能的改变与线粒体DNA损伤及多种信号通道改变等有关 (张全喜和孟紫强,2012;秦国华等,2014).
PM2.5和SO2气体进入呼吸道后,最先造成肺部炎症反应,随后SO2及其衍生物、极细小的颗粒和PM2.5可溶性成分会随血液到达心脏.可推测,PM2.5和SO2对心脏的致炎效应可能被炎症因子 (如促炎细胞因子和NO) 所介导,其所致心脏损伤是过度炎症反应作用的结果.
炎症发生时,因外来损伤因子的作用,机体组织受到损伤,炎症细胞因子和炎性介质释放,炎性细胞如淋巴细胞、嗜酸性粒细胞和嗜中性粒细胞等增多,血管扩张、局部血量增多. IL-6、IL-1β和TNF-α是重要的促炎细胞因子,当炎症发生时,这些因子的表达水平会升高 (赵璨等,2014).本研究结果显示,PM2.5和SO2复合暴露下,不仅大鼠心脏组织IL-6、IL-1β和TNF-α的mRNA和蛋白表达比对照组显著上升,而且这种增加效应与PM2.5组或SO2组相比仍具有显著统计学意义 (尤其在较高浓度PM2.5与SO2共同暴露的条件下).提示PM2.5和SO2复合暴露通过介导炎性细胞因子的表达使心脏出现炎症反应.文献显示,不同实验条件PM2.5、SO2和NO2复合暴露引起小鼠心脏内皮IL-6和TNF-α水平升高 (Zhang et al., 2015).本研究与文献结论一致.
作为一种信使,NO可参与炎症反应、免疫调节、血管舒张和信号调控等过程. NOS是合成NO的关键酶,体内NO水平上升通常是iNOS被激活的结果.心肌细胞、单核细胞、血管内皮细胞均可合成iNOS.当iNOS一经化学性刺激诱导或细胞因子调节生成,会产生大量NO,参与多种心血管疾病的发生发展过程 (姚琪和朱铁兵,2015).例如,NO是一种自由基,与超氧离子反应生成有毒的强氧化物ONOO—,导致心脏氧化损伤和心肌炎 (Hua et al., 2013).本研究发现,PM2.5和SO2复合暴露增加了心脏iNOS的mRNA和蛋白表达及NO含量,与对照组或SO2组或PM2.5组相比均具有显著统计学意义,说明iNOS被诱导和NO水平升高是PM2.5和SO2复合暴露导致心脏炎症反应的机制之一.有报道指出,促炎细胞因子如TNF-α可使心肌细胞iNOS活性明显提高 (敖杰男等, 2005),说明细胞因子会调节iNOS或NO的表达.本研究中,PM2.5和SO2复合暴露导致心脏炎性细胞因子水平增加与NO水平的增加有相同的趋势,提示二者之间存在某种调控关系或协同作用,对此需进一步探讨.
5 结论 (Conclusions)1) SO2或PM2.5单独暴露引起大鼠心脏病理损伤不明显、炎症因子水平的变化也不显著.
2) 相比于SO2或PM2.5单独暴露,SO2和PM2.5共同作用引起大鼠心脏严重的炎症损伤,提示PM2.5和SO2联合作用引起的心脏毒性大于PM2.5或SO2单独作用,其机制可能与SO2和PM2.5共同作用促进了炎性细胞因子高表达和NO含量增高有关.
| [${referVo.labelOrder}] | 敖杰男, 冯慧娟, 吴迪, 等. 2005. 炎症细胞因子在心力衰竭发病过程中的作用[J]. 中国病理生理杂志, 2005, 21(10) : 2062–2064. DOI:10.3321/j.issn:1000-4718.2005.10.047 |
| [${referVo.labelOrder}] | Brook R D, Rajagopalan S, Pope C A, et al. 2010. Particulate matter air pollution and cardiovascular disease:an update to the scientific statement from the American Heart Association Circulation[J]. Circulation, 121(21) : 2331–2378. DOI:10.1161/CIR.0b013e3181dbece1 |
| [${referVo.labelOrder}] | 陈惠卿, 洪新如, 孙庆华. 2014. 大气细颗粒物对心血管毒性作用机制的研究进展[J]. 中国医师杂志, 2014, 16(4) : 556–558. |
| [${referVo.labelOrder}] | Deger L, Plante C, Jacques L, et al. 2012. Active and uncontrolled asthma among children exposed to air stack emissions of sulphur dioxide from petroleum refineries in Montreal, Quebec:a cross-sectional study[J]. Canadian Respiratory Journal, 19(2) : 97–102. DOI:10.1155/2012/218957 |
| [${referVo.labelOrder}] | He M, Ichinose T, Kobayashi M, et al. 2016. Differences in allergic inflammatory responses between urban PM2.5 and fine particle derived from desert-dust in murine lungs[J]. Toxicology and Applied Pharmacology, 297 : 41–55. DOI:10.1016/j.taap.2016.02.017 |
| [${referVo.labelOrder}] | Hua W, Chen Q, Gong F Q, et al. 2013. Cardioprotection of H2S by down regulating iNOS and upregulating HO-1 expression in mice with CVB3-induced myocarditis[J]. Life Science, 93(24) : 949–954. DOI:10.1016/j.lfs.2013.10.007 |
| [${referVo.labelOrder}] | Li R, Kou X, Xie L, et al. 2015. Effects of ambient PM2.5 on pathological injury, inflammation, oxidative stress, metabolic enzyme activity, and expression of c-fos and c-jun in lungs of rats[J]. Environmental Science and Pollution Research, 22(24) : 20167–20176. DOI:10.1007/s11356-015-5222-z |
| [${referVo.labelOrder}] | Liu Y, Chen X, Huang S, et al. 2015. Association between air pollutants and cardiovascular disease mortality in Wuhan, China[J]. International Journal of Environmental Research and Public Health, 12(4) : 3506–3516. DOI:10.3390/ijerph120403506 |
| [${referVo.labelOrder}] | Meng Z Q. 2003. Oxidative damage of sulfur dioxide on various organs ofmice:sulfur dioxide is a systemic oxidative damage agent[J]. Inhalationtoxicology, 15(2) : 181–195. |
| [${referVo.labelOrder}] | 潘小川. 2015. 关注中国大气灰霾 (PM2.5) 对人群健康影响的新常态[J]. 北京大学学报 (医学版), 2015, 47(3) : 377–379. |
| [${referVo.labelOrder}] | 秦国华, 霍雅俊, 桑楠. 2014. 二氧化硫对心肌细胞线粒体损伤的分子机制探讨[J]. 环境科学学报, 2014, 34(4) : 1074–1078. |
| [${referVo.labelOrder}] | Reno A L, Brooks E G, Ameredes B T. 2015. Mechanisms of heightened airway sensitivity and responses to inhaled SO2 in asthmatics[J]. Environmental Health Insights, 9 : 13–25. |
| [${referVo.labelOrder}] | Talbott E O, Rager J R, Benson S, et al. 2014. A case-crossover analysis of the impact of PM2.5 on cardiovascular disease hospitalizations for selected CDC tracking states[J]. Environmental Research, 134 : 455–465. DOI:10.1016/j.envres.2014.06.018 |
| [${referVo.labelOrder}] | Wang X, Hu W, Tong S. 2009. Long-term exposure to gaseousair pollutants and cardio-respiratory mortality in Brisbane, Australia[J]. Geospatial Health, 3(2) : 257–263. DOI:10.4081/gh.2009.225 |
| [${referVo.labelOrder}] | Willerson J T, Ridker P M. 2004. Inflammation as a cardiovascular risk factor[J]. Circulation, 109 : Ⅱ2–Ⅱ10. DOI:10.1161/01.CIR.0000122867.89751.59 |
| [${referVo.labelOrder}] | 姚琪, 朱铁兵. 2015. 诱导型一氧化氮合酶对心血管疾病的调节作用[J]. 江苏医药, 2015, 41(2) : 192–194. |
| [${referVo.labelOrder}] | Zhang Y, Ji X, Ku T, et al. 2015. Inflammatory response and endothelial dysfunction in the hearts of mice co-exposed to SO2, NO2, and PM2.5[J]. Environmental Toxicology . DOI:10.1002/tox.22200 |
| [${referVo.labelOrder}] | Zhao J, Gao Z, Tian Z, et al. 2013. The biological effects of individual-level PM2.5 exposure on systemic immunity and inflammatory response in traffic policemen[J]. Occupational and Environmental Medicine, 70(6) : 426–431. DOI:10.1136/oemed-2012-100864 |
| [${referVo.labelOrder}] | 张全喜, 孟紫强. 2012. 二氧化硫对大鼠离体心脏功能影响的机制研究[J]. 环境科学学报, 2012, 32(4) : 968–973. |
| [${referVo.labelOrder}] | 赵璨, 廖纪萍, 王广发. 2014. 免疫调节在颗粒物质诱导气道炎性反应中的作用[J]. 中国医学前沿杂志, 2014, 6(2) : 29–33. |
| [${referVo.labelOrder}] | 自伯海, 付凤先, 陈守平, 等. 2001. 一氧化氮在炎症反应中的作用[J]. 齐鲁医学杂志, 2001, 16(2) : 170–172. |
 2017, Vol. 37
2017, Vol. 37


