2. 广州市环境暴露与健康重点实验室, 暨南大学环境学院, 广州 510632
2. Guangzhou Key Laboratory of Environmental Exposure and Health, School of Environment, Jinan University, Guangzhou 510632
作为一种主要大气污染物, SO2会对人们的身体健康和社会发展造成不可忽视的负面影响.国内外流行病学调查结果发现, SO2不仅可引起呼吸系统疾病, 还与心血管系统健康密切相关, SO2吸入人体之后增加了心律失常、心力衰竭、肺心病、缺血性心脏病等心血管疾病的风险和死亡率 (Chen et al., 2008; Pereira et al., 2008; Martins et al., 2006; Maitre et al., 2006; 杨敏娟等, 2008). SO2吸入人体后会转变为其衍生物——亚硫酸盐和亚硫酸氢盐, 随血液在体内循环 (秦国华等, 2014), SO2对体内组织细胞的毒作用主要是通过这些体内衍生物来实现的.已检测到小鼠吸入SO2后心脏中亚硫酸盐含量增加 (Meng et al., 2005a). SO2及其衍生物作为全身性毒物能够导致心脏氧化损伤 (Meng et al., 2003)、DNA损伤 (Meng et al., 2004; Meng et al., 2005b)、调亡及炎症相关因子的改变 (Yun et al., 2011) 等.
心脏组织中胶原浓度的升高或者成分的改变, 可导致心脏组织硬化或纤维化, 影响心脏的收缩功能, 这种病理变化存在于多种心血管疾病中, 现认为与心律失常、心功能障碍及心脏性猝死等密切相关 (张召才等, 2004).我们最近的研究发现SO2吸入可导致心脏收缩功能紊乱, 抗氧化剂NALC (N-乙酰半胱氨酸) 可有效缓解SO2所引起的心脏收缩功能紊乱 (Qin et al., 2016).在血管周区域的胞外基质蛋白中, 胶原蛋白高达85%, 心肌胶原含量升高2~3倍可导致心室舒张期硬度增加和充盈异常, 升高4倍以上可导致心室收缩功能的下降 (Weber et al., 1995).然而在大部分组织中,Ⅰ型胶原和Ⅲ型胶原组成了总胶原蛋白量的2/3(Heeneman et al., 2003), 因此研究Ⅰ型胶原和Ⅲ型胶原的表达水平对于研究SO2对心脏功能产生的影响具有重要意义.
基于此, 在本研究中我们用SO2衍生物之一—亚硫酸氢钠对大鼠心肌细胞H9C2进行不同时间 (3、6、12、24 h) 染毒处理, 再进一步用7 mg·m-3 SO2单独或与NALC复合暴露于大鼠, 测定了H9C2细胞和大鼠心脏组织中ROS含量, 并对Ⅰ型胶原 (Col1a1) 和Ⅲ型胶原 (Col3a1) 进行了mRNA和蛋白水平的分析.
2 材料与方法 (Materials and methods) 2.1 材料 2.1.1 主要试剂H9C2细胞来自国家实验细胞资源共享平台 (中国, 北京); 低糖DMEM培养基购自Gibco公司; 胎牛血清购自Invitrogen公司; NaHSO3、NALC购自Sigma公司; 提取总RNA时所用Trizol、反转试剂盒以及荧光定量PCR试剂均购自于Takara公司; 引物合成由上海英潍捷基生物有限公司完成; anti-GAPDH抗体购自Cell Signaling Technology; anti-Col1a1、anti-Col3a1抗体均购自于Bioss公司; ROS检测试剂盒购自Beyotime公司; 其余试剂均为国产分析纯.
2.1.2 主要仪器CO2培养箱 (Thermo,美国)、SO2自动监测仪 (万安迪FIX 550, 中国)、超低温冰箱 (Thermo,美国)、凝胶成像系统 (美国BIO-RAD公司)、蛋白核酸仪 (NanoDrop,美国)、IQ5 Real-Time PCR系统 (Bio-Rad,USA)、多功能酶标仪 (Thermo Scientific 3001,美国)、垂直电泳槽 (Bio-Rad 300,美国)、流式细胞仪 (BD Accuri)
2.2 体外染毒实验H9C2细胞贴壁生长于含10%胎牛血清和1%青链霉素的低糖DMEM培养液中, 置于含5% CO2, 37 ℃恒温培养箱中培养, 细胞生长至80%左右时, 将生长良好的细胞随机分为5组, 低糖DMEM培养液配制亚硫酸氢钠溶液至终浓度为100 μmol·L-1, 加入H9C2细胞培养皿中, 染毒时间分别为3、6、12、24 h, 另设置对照组.
2.3 整体动物染毒实验体重200 g左右的SPF级Wistar成年雄性大鼠21只, 购自河北实验动物中心, 随机分为3组, 每组7只, 分别为对照组、SO2组、SO2+NALC组.将受试大鼠置于体积为1 m3的箱体内, 12 h昼夜周期,外界温度为 (24±2) ℃, 湿度为50%±5%, 其中SO2组和SO2+NALC组暴露于7 mg·m-3的SO2中进行动式吸入染毒, 对照组接受过滤后的洁净空气.每天染毒4 h, 持续染毒28 d. SO2自动监测仪实时监测箱体内SO2浓度, 染毒期间禁水禁食, 其余时间自由进水进食. SO2+NALC组自染毒之日起以腹腔注射的方式隔天注射50 mg·kg-1 (b.w.) NALC, 对照组和SO2组注射生理盐水.染毒结束后处死大鼠, 测定大鼠体重及心脏重量, 取部分心脏组织进行ROS测定, 其余组织放入液氮中速冻随后转入-80 ℃储存.
2.4 H9C2细胞ROS检测细胞染毒不同时间 (0, 3、6、12、24 h) 后, 预冷的D-hanks洗细胞, 阳性对照组加阳性试剂于37 ℃孵育30 min, 其他组加等体积无血清培养基.孵育结束后加入胰酶消化, 600 g, 离心4 min, 弃上清, 加DCFH-DA探针于37 ℃避光孵育25 min, 弃上清, D-hanks洗细胞3次并重悬, 过滤, 流式细胞仪检测.
2.5 大鼠心肌细胞ROS检测取50 mg大鼠心脏组织, 加入0.1 mol·L-1 PBS缓冲液1 mL, 匀浆至无组织块. 4 ℃, 1000 g离心10 min, 取上清液用于蛋白浓度和ROS的测定.以BSA作为标准蛋白, 考马斯亮蓝法测定蛋白质浓度. 96孔板每孔加入190 μL上清液和10 μL 1 mmol·L-1 DCFH-DA探针至终体积为200 μL. 37 ℃暗处孵育30 min.多功能酶标仪检测荧光值.
2.6 总RNA的提取与荧光定量PCR取50 ~ 100 mg大鼠心脏组织或1×106 H9C2细胞, 用Trizol提取组织或细胞总RNA, 甲醛变性琼脂糖凝胶电泳检测RNA完整性, 确保OD260/280值处于1.8~2.0范围内, 取1 μg总RNA, 使用反转试剂盒合成cDNA, 将产物放置于-80 ℃备用. IQ5 Real-Time PCR系统进行扩增, 荧光定量PCR所用的引物序列见表 1. PCR反应体积为20 μL, 其中含有1 μL cDNA, 10 μL SYBR Premix Ex Taq, 上下游引物各1 μL, H2O 7 μL.反应条件为:95 ℃ 3 min, 95 ℃ 20 s, 55 ℃ 20 s, 72 ℃ 20 s, 所有PCR扩增片段的大小均已经溴化乙啶染色的琼脂糖胶电泳证实.
| 表 1 荧光定量PCR所用引物序列 Table 1 Primers used in real-time PCR |
取大鼠心脏组织50~80 mg或1×106 H9C2细胞, 加入1 mL裂解缓冲液, 成分为:1% Nonidet P40, 1 mmol·L-1 EDTA, 125 mmol·L-1 sodium fluoride, 0.5 mmol·L-1 sodium vanadate, 2.5 μg·mL-1 aprotinin, 5 μg·mL-1 pepstatin, 50 μg·mL-1 leupeptin, 25 μmol·L-1 PMSF, 25 μg·mL-1 trypsin inhibitor.匀浆至无组织块后, 4 ℃, 13000 r·min-1离心15 min, 取上清.以BSA作为标准蛋白, 考马斯亮蓝法测定蛋白质浓度, -80 ℃备用.Western blot检测目的蛋白表达水平: 50 μg蛋白上样量, 加蛋白上样缓冲液, 聚丙烯酰胺凝胶电泳分离蛋白, 将蛋白电转至硝酸纤维素膜上, 封闭, 加对应的一抗与特定蛋白发生免疫反应, 4 ℃孵育过夜, 清洗一抗, 加荧光二抗与一抗结合, 清洗二抗, LI-COR Odyssey红外荧光系统扫描检测, 结果表示为目的蛋白与GAPDH蛋白的灰度比值.
2.8 数据统计学处理用SPSS 17.0对数据进行统计分析.图中结果以均值±标准误 (mean ± SE) 的形式表示, 用one-way ANOVA检验亚硫酸氢钠不同时间处理组与对照组、SO2组与对照组、SO2组与SO2+NALC组之间的差异显著性.
3 结果 (Results) 3.1 亚硫酸氢钠对H9C2细胞ROS含量的影响由图 1可知, 亚硫酸氢钠对H9C2细胞进行不同时间染毒处理以后, 细胞内ROS水平随着处理时间的延长而升高, 染毒3 h后H9C2细胞内ROS水平已发生显著升高, 染毒12 h时ROS水平达到峰值, 为对照组的4.27倍, 24 h组则为4.14倍, 该实验结果表明亚硫酸氢钠可显著诱导ROS的产生, 且呈现明显的时间效应关系.
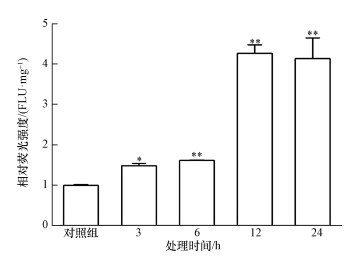 |
| 图 1 亚硫酸氢钠对H9C2细胞ROS含量的影响 Fig. 1 Effect of sodium bisulfite on ROS contents in H9C2 cells *p < 0.01; **p < 0.001; n=6 |
由图 2可知, 使用亚硫酸氢钠对H9C2细胞进行不同时间染毒后, 细胞内Col1a1和Col3a1基因mRNA的转录水平基本一致, 且与对照组相比均没有统计学上的显著性.
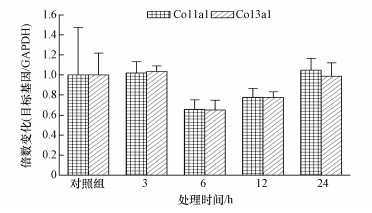 |
| 图 2 亚硫酸氢钠对H9C2细胞Col1a1和Col3a1 mRNA转录水平的影响 Fig. 2 Effect of sodium bisulfite on mRNA levels of Col1a1 and Col3a1 in H9C2 cells (n=6) |
由图 3可知, 亚硫酸氢钠处理H9C2细胞不同时间以后, 与对照组相比, Col1a1的蛋白表达水平只有12 h组和24 h组显著升高, 分别为对照组的2.14倍和4.73倍; Col3a1的蛋白表达水平在不同时间染毒组均有显著升高, 分别为对照组的3.26、3.98、4.58和5.64倍.总体而言细胞内Col1a1和Col3a1蛋白表达水平均随着处理时间的延长而升高, 且呈现明显的时间效应关系.
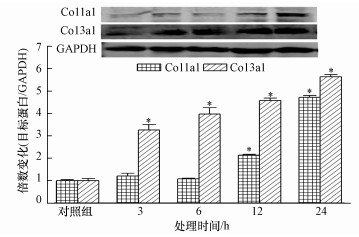 |
| 图 3 亚硫酸氢钠对H9C2细胞Col1a1和Col3a1蛋白表达水平的影响 Fig. 3 Effect of sodium bisulfite on protein levels of Col1a1 and Col3a1 in H9C2 cells *p < 0.01; n=6 |
由表 2可知, SO2暴露导致大鼠的体重减轻, 心脏重量增加, 同时心体比显著升高, 表明SO2暴露后大鼠相对心脏重量发生显著增加, 提示具有发生心肌肥大的潜在可能性.与SO2组相比, SO2+NALC处理组的心体比显著下降, 恢复至对照组水平.
| 表 2 SO2暴露后大鼠体重及心体比变化 Table 2 Effects of SO2 inhalation on body weight and heart/body weight ratio |
由图 4可知, SO2暴露后大鼠心脏组织中ROS含量显著升高, 表明吸入SO2后在动物心脏内产生了一定量的自由基.而NALC作为一种自由基清除剂显著减少了SO2诱导机体氧化应激产生的ROS.
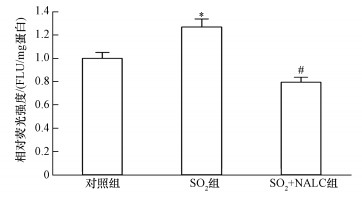 |
| 图 4 SO2暴露对大鼠心脏组织中ROS含量的影响 (与对照组相比:*p < 0.01;与SO2组相比:#p < 0.01; n=7) Fig. 4 Effect of SO2 exposure on ROS contents in rat hearts |
由图 5可知, SO2吸入后, 大鼠心脏组织中Col1a1和Col3a1的mRNA转录水平与对照组相比均没有显著变化, 这一结果与亚硫酸氢钠细胞染毒实验结果相似.
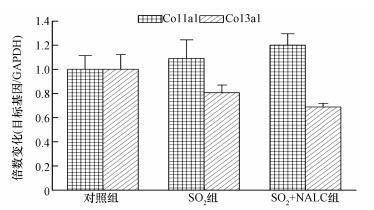 |
| 图 5 SO2暴露对大鼠心脏组织中Col1a1和Col3a1 mRNA转录水平的影响 Fig. 5 Effect of SO2 exposure on mRNA levels of Col1a1 and Col3a1 in rat hearts (n=7) |
由图 6可知, SO2暴露后大鼠心脏组织中Col1a1和Col3a1的蛋白表达水平与对照组相比均显著升高, Col1a1蛋白表达量是对照组的4.42倍, Col3a1蛋白表达量是对照组的2.13倍. NALC处理后, 与SO2组相比, Col1a1和Col3a1的蛋白表达水平下降十分显著, Col1a1蛋白表达量下降了72.6%, Col3a1蛋白表达量下降了22%, 这一结果表明NALC可有效抑制SO2吸入后Col1a1和Col3a1蛋白表达的上升.
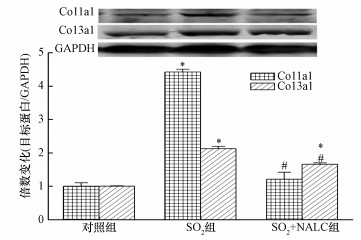 |
| 图 6 SO2暴露对大鼠心脏组织中Col1a1和Col3a1蛋白表达水平的影响 (与对照组相比:*p < 0.01;与SO2组相比:#p < 0.01; n=7) Fig. 6 Effect of SO2 exposure on protein levels of Col1a1 and Col3a1 in rat hearts |
心血管疾病是全世界范围内导致死亡发生的主要因素之一, 其发病率与死亡率连年增加, 流行病学研究显示空气污染物, 如SO2、NOx、PM2.5等与心血管疾病发病率和死亡率的升高密切相关 (Newby et al., 2015).与此同时, 由于SO2及其衍生物被广泛地应用于食品工业 (Taylor et al., 1986) 以及制药原料 (Gunnison, 1981), 相关的调查研究也在逐渐增加.
据报道, 一个健康成年人血清中亚硫酸盐的平均浓度约为5 μmol·L-1, 但在口服含有偏亚硫酸盐的蔬菜汁30 min以后血浆中亚硫酸盐的平均浓度可升高至112 μmol·L-1 (Ji et al., 1995).同时, 实验室前期研究表明亚硫酸氢钠染毒浓度为100 μmol·L-1时对细胞活力无明显影响, 染毒浓度高于100 μmol·L-1(300 μmol·L-1) 时细胞活力出现显著下降 (Qin et al., 2016), 故在本研究中选取100 μmol·L-1作为亚硫酸氢钠染毒浓度.此外, 本研究选取7 mg·m-3作为SO2整体动物染毒浓度, 出于以下两点考虑:首先, 美国国家职业安全卫生研究所推荐的职业工作环境中SO2浓度为0.5~20.0 mg·m-3(Dutch Expert Committee on Occupational Standards, 2003).其次, 在本研究中动物每天暴露于SO2的时间为4 h, 但实际情况下人或动物则是每天24 h暴露于污染的大气中.因此, 本研究使用的7 mg·m-3高于人类嗅觉阈值, 与职业工作环境的浓度相一致 (Sang et al., 2010).
在本研究中, 亚硫酸氢钠体外染毒实验的荧光定量PCR结果表明亚硫酸氢钠并不会引起Col1a1和Col3a1在mRNA转录水平发生显著变化, 然而Western blot实验结果表明两种蛋白表达水平均有显著升高, 并且有显著的时间效应关系. SO2整体动物染毒实验的结果与此相似, SO2吸入后没有导致大鼠心脏组织中Col1a1和Col3a1在mRNA转录水平发生显著变化, 但二者的蛋白表达水平升高十分显著.研究表明SO2可以引起机体的氧化应激, 在亚硫酸盐氧化过程中形成的以硫和氧为中心的自由基会参与细胞、组织和器官的氧化损伤过程 (Meng et al., 2003).我们的体内外实验结果也表明SO2及亚硫酸氢钠引起的氧化应激显著诱导了心脏组织及体外培养H9C2细胞中ROS的产生.在SO2暴露实验中, 我们加入了抗氧化剂NALC, 同时也是一种自由基清除剂.有报道指出腹腔注射50 mg·kg-1 (b.w.) NALC时能有效抑制四氯化碳 (CCl4) 及硫代乙酰胺 (TAA) 诱导的大鼠肝脏纤维化及肝损伤 (Nissar et al., 2013), 所以在本研究中采用了相同的NALC剂量, 结果表明NALC处理可显著降低SO2在大鼠心脏内诱导的ROS.有研究指出在心衰、心肌肥大及纤维化模型中氧化应激显著增强 (Cucoranu et al., 2005), 产生大量ROS,而ROS能够刺激转化生长因子 (TGF-β1) 的释放和激活 (Li et al., 1999), TGF-β1是纤维化发生过程中的重要介导因子 (Biernacka et al., 2011), 它能够通过上调NADPH氧化酶的表达进一步诱导ROS的产生 (Cucoranu et al., 2005), Hu等 (2008)的研究表明TGF-β1与NADPH氧化酶介导产生的ROS之间存在正反馈调节, 其诱导产生的ROS能够激活下游的MAPK通路, 使得氧化还原敏感性转录因子发生转录, 诱导胶原蛋白的表达.提示SO2吸入后可能通过产生ROS最终导致胶原蛋白表达的增加.同时, 我们的实验还观察到SO2+NALC组Col1a1和Col3a1的蛋白表达水平与SO2组相比显著降低.这一结果表明Col1a1和Col3a1蛋白表达水平的上升确实与SO2及其衍生物所产生的ROS有关, 而NALC能够通过抑制ROS的产生而有效抑制SO2吸入后Col1a1和Col3a1蛋白表达的上升.综合本研究中的体内外实验结果可以看出, SO2及其衍生物会导致Col1a1和Col3a1蛋白表达水平的显著上调, 进而引起Ⅰ型胶原和Ⅲ型胶原蛋白含量的增多, 具体的发生机制仍需进一步实验研究证实.
此外, 本研究的体内与体外实验均发现SO2及其衍生物处理后Col1a1和Col3a1在mRNA转录水平没有显著变化而蛋白水平则显著升高, 该实验结果提示SO2及其衍生物诱导心肌细胞内Col1a1和Col3a1表达极有可能属于转录后水平调控.一般认为, 对mRNA成熟、降解、胞浆内定位等翻译起始前过程的调控称为转录后调控, 研究证实miRNA是基因转录后调控中起重要作用的一类分子. miRNA是19~26个核苷酸长度的非编码RNA, 能够介导转录后基因调节的发生 (Bartel et al., 2009).有研究表明miR-29家族可以调节Col1a1和Col3a1的表达 (Van Rooij et al., 2008).其他几种miRNA也被证实与胶原形成相关, 如Let-7i以及miR-26a能够分别作用于Col1a2和Col1a1以行使功能, 缓解胶原沉积 (He et al., 2016; Wei et al., 2013; Wang et al., 2015).我们推测SO2及其衍生物可能会以转录后调控的方式调控Col1a1和Col3a1这两个蛋白的表达, 该过程可能与miRNA有关, 但尚需进一步实验研究证实.
5 结论 (Conclusions)1) SO2及其衍生物不会引起大鼠心脏组织及体外培养H9C2细胞中Col1a1和Col3a1 mRNA转录水平的显著变化.
2) SO2及其衍生物暴露后大鼠心脏组织及体外培养H9C2细胞中Col1a1和Col3a1蛋白表达水平显著升高.
3) 抗氧化剂NALC能够显著抑制SO2及其衍生物暴露后Col1a1和Col3a1蛋白表达的上升.
| [${referVo.labelOrder}] | Bartel D P. 2009. MicroRNAs: target recognition and regulatory functions[J]. Cell, 136(2) : 215–233. DOI:10.1016/j.cell.2009.01.002 |
| [${referVo.labelOrder}] | Biernacka A, Dobaczewski M, Frangogiannis N G. 2011. TGF-β signaling in fibrosis[J]. Growth Factors, 29(5) : 196–202. DOI:10.3109/08977194.2011.595714 |
| [${referVo.labelOrder}] | Chen H, Goldberg M S, Villeneuve P J. 2008. A systematic review of the relation between long-term exposure to ambient air pollution and chronic diseases[J]. Reviews on Environmental Health, 23(4) : 243–297. |
| [${referVo.labelOrder}] | Cucoranu I, Clempus R, Dikalova A, et al. 2005. NAD (P) H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts[J]. Circulation Research, 97(9) : 900–907. DOI:10.1161/01.RES.0000187457.24338.3D |
| [${referVo.labelOrder}] | Dutch Expert Committee on Occupational Standards. 2003. Sulphur Dioxide; Health-Based Recommended Occupational Exposure Limit, 5th ed[S]. (ISBN 90-5549-507-7). Hague, The Netherlands: Health Council of the Netherlands Press |
| [${referVo.labelOrder}] | Gunnison A F. 1981. Sulfite toxicity: a critical review of in vitro and in vivo data[J]. Food and CosmeticsToxicology, 19(5) : 667–682. |
| [${referVo.labelOrder}] | He W, Huang H, Xie Q, et al. 2016. MiR-155 knockout in fibroblasts improves cardiac remodeling by targeting tumor protein p53-inducible nuclear protein 1[J]. Journal of Cardiovascular Pharmacology and Therapeutics, 21(4) : 423–435. DOI:10.1177/1074248415616188 |
| [${referVo.labelOrder}] | Heeneman S, Cleutjens J P, Faber B C, et al. 2003. The dynamic extracellular matrix: intervention strategies during heart failure and atherosclerosis[J]. The Journal of Pathology, 200(4) : 516–525. DOI:10.1002/path.1395 |
| [${referVo.labelOrder}] | Hu C, Abhijit Dandapat, Sun L, et al. 2008. Regulation of TGFβ1-mediated Collagen Formation by LOX-1:Studies Based on Forced Over-expression of TGFβ1 in Wild-Type and Lox-1[J]. The Journal of Biological Chemistry, 283(16) : 10226–10231. DOI:10.1074/jbc.M708820200 |
| [${referVo.labelOrder}] | Ji A J, Savon S R, Jacobsen D W. 1995. Determination of total serum sulfite by HPLC with fluorescence detection[J]. Clinical Chemistry, 41 : 897–903. |
| [${referVo.labelOrder}] | Li P F, Dietz R, von Harsdorf R. 1999. Superoxide induces apoptosis in cardiomyocytes, but proliferation and expression of transforming growth factor-beta1 in cardiac fibroblasts[J]. FEBS Letters, 448(2/3) : 206–210. |
| [${referVo.labelOrder}] | Maitre A, Bonneterre V, Huillard L, et al. 2006. Impact of urban atmospheric pollution on coronary disease[J]. European Heart Journal, 27(19) : 2275–2284. DOI:10.1093/eurheartj/ehl162 |
| [${referVo.labelOrder}] | Martins L C, Pereira L A, Lin C A, et al. 2006. The effects of air pollution on cardiovascular diseases: lag structures[J]. Revista de Saude Publica, 40(4) : 677–683. DOI:10.1590/S0034-89102006000500018 |
| [${referVo.labelOrder}] | Meng Z, Li R, Zhang X. 2005a. Levels of sulfite in three organs from mice exposed to sulfur dioxide[J]. Inhalation Toxicology, 17(6) : 309–313. DOI:10.1080/08958370590922634 |
| [${referVo.labelOrder}] | Meng Z, Qin G, Zhang B, et al. 2003. Oxidative damage of sulfur dioxide inhalation on lungs and hearts of mice[J]. Environmental Research, 93(3) : 285–292. DOI:10.1016/S0013-9351(03)00045-8 |
| [${referVo.labelOrder}] | Meng Z, Qin G, Zhang B, et al. 2004. DNA damaging effects of sulfur dioxide derivatives in cells from various organs of mice[J]. Mutagenesis, 19(6) : 465–468. DOI:10.1093/mutage/geh058 |
| [${referVo.labelOrder}] | Meng Z, Qin G, Zhang B. 2005b. DNA damage in mice treated with sulfur dioxide by inhalation[J]. Environmental and Molecular Mutagenesis, 46(3) : 150–155. DOI:10.1002/(ISSN)1098-2280 |
| [${referVo.labelOrder}] | Newby D E, Mannucci P M, Tell G S, et al. 2015. Expert position paper on air pollution and cardiovascular disease[J]. European Heart Journal, 36(2) : 83–93. DOI:10.1093/eurheartj/ehu458 |
| [${referVo.labelOrder}] | Nissar A U, Farrukh M R, Kaiser P J, et al. 2013. Effect of N-acetyl cysteine (NAC), an organosulfur compound from Allium plants, on experimentally induced hepatic prefibrogenic events in Wistar rat[J]. Phytomedicine, 20(10) : 828–833. DOI:10.1016/j.phymed.2013.03.009 |
| [${referVo.labelOrder}] | Pereira Filho M A, Pereira L A, Arbex F F, et al. 2008. Effect of air pollution on diabetes and cardiovascular diseases in São Paulo, Brazil[J]. Brazilian Journal of Medical and Biological Research, 41(6) : 526–532. DOI:10.1590/S0100-879X2008005000020 |
| [${referVo.labelOrder}] | 秦国华, 霍雅俊, 桑楠. 2014. 二氧化硫对心肌细胞线粒体损伤的分子机制探讨[J]. 环境科学学报, 2014, 34(4) : 1074–1078. |
| [${referVo.labelOrder}] | Qin G, Wu M, Wang J, et al. 2016. Sulfur dioxide contributes to the cardiac and mitochondrial dysfunction in rats[J]. Toxicological Sciences, 151(2) : 334–346. DOI:10.1093/toxsci/kfw048 |
| [${referVo.labelOrder}] | Sang N, Yun Y, Li H, et al. 2010. SO2 inhalation contributes to the development and progression of ischemic stroke in the brain[J]. Toxicological Sciences, 114(2) : 226–236. DOI:10.1093/toxsci/kfq010 |
| [${referVo.labelOrder}] | Taylor S L, Higley N A, Bush R K. 1986. Sulfites in foods: uses, analytical methods, residues, fate, exposure assessment, metabolism, toxicity, and hypersensitivity[J]. Advances in Food and Nutrition Research, 30 : 1–76. DOI:10.1016/S0065-2628(08)60347-X |
| [${referVo.labelOrder}] | Van Rooij E, Sutherland L B, Thatcher J E, et al. 2008. Dysregulation of microRNAs after myocardial infarction reveals a role of miR-29 in cardiac fibrosis[J]. Proceedings of the National Academy of Sciences of the United States of America, 105(35) : 13027–13032. DOI:10.1073/pnas.0805038105 |
| [${referVo.labelOrder}] | Wang X, Wang H, Li Y, et al. 2015. MicroRNA Let-7i negatively regulates cardiac inflammation and fibrosis[J]. Hypertension, 66(4) : 776–785. DOI:10.1161/HYPERTENSIONAHA.115.05548 |
| [${referVo.labelOrder}] | Weber K T, Sun Y, Campbell S E. 1995. Structural remodeling of the heart by fibrous tissue: role of circulating hormones and locally produced peptides[J]. European Heart Journal, 16(Suppl N) : 12–18. DOI:10.1093/eurheartj/16.suppl_N.12 |
| [${referVo.labelOrder}] | Wei C, Kim I K, Kumar S, et al. 2013. NF-κB mediated miR-26a regulation in cardiac fibrosis[J]. Journal of Cellular Physiology, 228(7) : 1433–1442. DOI:10.1002/jcp.24296 |
| [${referVo.labelOrder}] | 杨敏娟, 潘小川. 2008. 北京市大气污染与居民心脑血管疾病死亡的时间序列分析[J]. 环境与健康杂志, 2008, 25(4) : 294–297. |
| [${referVo.labelOrder}] | Yun Y, Hou L, Sang N. 2011. SO2 inhalation modulates the expression of pro-inflammatory and pro-apoptotic genes in rat heart and lung[J]. Journal of Hazardous Materials, 185(1) : 482–488. DOI:10.1016/j.jhazmat.2010.09.057 |
| [${referVo.labelOrder}] | 张召才, 陈英珍, 杨灏珠. 2004. 心肌纤维化的研究进展[J]. 临床心血管病杂志, 2004, 20(1) : 58–60. |
 2017, Vol. 37
2017, Vol. 37


