2. 中国石油勘探开发研究院, 北京 100083
2. Research Institute of Petroleum Exploration & Development, Beijing 100083
近年来, 随着气候变暖速度加快和降水量的日趋减少, 水体富营养化现象普遍发生, 已经严重影响了人们的日常饮水安全, 引起了全球范围内的高度重视(Mo et al., 2016;Carey et al., 2012;Reynaldo et al., 2014).蓝藻是水体富营养化的主要藻类之一, 其中的铜绿微囊藻在淡水水体中常常大量繁殖, 并且持续时间较长, 控制难度大, 危害更为严重(Qi et al., 2016;张君枝等, 2016).β-环柠檬醛是铜绿微囊藻所产生的主要嗅味物质, 在较低浓度范围内便可导致水体散发出难闻的木头味(Suffet et al., 1999), 这是民众抱怨水质不佳的重要原因.2007年5月太湖蓝藻大规模暴发事件中, 藻类代谢产生的浓重异味造成近百万无锡市民生活用水困难, 其中β-环柠檬醛也占了重要比例(Zhang et al., 2010;Yang et al., 2008).同时, 铜绿微囊藻是一种产毒藻, 在其生长过程中能够产生大量的藻毒素.因而, 研究如何去除铜绿微囊藻致嗅物质β-环柠檬醛及灭活藻细胞迫在眉睫.
目前, 传统的高藻原水处理技术主要依靠投加O3、ClO2、Cl2、CuSO4等化学除藻剂.但O3和ClO2虽能较好地除嗅和除藻, 成本却相对较高;Cl2和CuSO4容易破坏藻细胞结构, 导致藻毒素的大量释放, 并且易产生消毒副产物, 使水体二次污染(蒋道松等, 2000;汪小雄, 2011;Rodríguez et al., 2008;Daly et al., 2007).国内外大量研究表明(Drábková et al., 2007b;Kay et al., 1982;He et al., 2013;Barrington et al., 2008), H2O2是一种绿色氧化剂, 在去除嗅味物质过程中只产生H2O和O2, 没有其他有毒有害副产物;此外, H2O2也是潜在的除藻剂, 它能够产生氧化能力很强的羟基自由基(·OH), 抑制藻细胞的光合作用活性, 从而达到灭活藻细胞的目的.因此, 本文以铜绿微囊藻为研究对象, 探究不同H2O2投加量下嗅味物质β-环柠檬醛的去除效果及藻细胞的灭活程度, 以期为实际水处理技术提供理论依据.
2 材料与方法(Materials and methods) 2.1 实验材料与药剂藻种培养:铜绿微囊藻(Microcystis aeruginosa)藻种购自中国科学院淡水藻种库, 在无菌操作下以1∶2(藻液∶培养基)的转接比例接种于新鲜的BG11培养基(霍书豪等, 2012)中, 在温度为25 ℃、光照强度为2000 lx(光暗比=12 h∶12 h)的条件下连续培养, 每日定时摇藻2次.培养20 d后, 若藻种生长状态良好, 生物量明显增多, 可再次以1∶5的转接比例进行扩大培养, 以备使用.
所需药剂:实验过程中使用H2O2溶液(优级纯, ρ(H2O2)=30%, 国药集团化学试剂有限公司);Na2S2O3溶液(分析纯, 北京化工厂);NaCl溶液(分析纯, 国药集团化学试剂有限公司).
2.2 实验设计将不同浓度梯度的H2O2溶液(2、3、4和5 mg·L-1)投加至藻细胞密度为1.01×106 cells·mL-1的铜绿微囊藻藻液中进行氧化, 分别于不同时刻(1、2、3、4、5、10和20 min)滴加Na2S2O3溶液终止反应.取氧化后的藻液置于50 mL离心管中离心(8000 r·min-1)15 min, 部分上清液用于测定胞外嗅味物质β-环柠檬醛含量, 剩余上清液经0.45 μm的PES滤膜过滤, 得到胞外有机物溶液.将藻细胞用NaCl(0.8%)溶液清洗2遍, 得到不含培养基的纯净藻细胞.经3次反复冻融(-20 ℃: 37 ℃, 30 min: 5 min)和超声处理, 把已充分破碎的藻细胞重新溶于超纯水中, 静置2 h后再次离心10 min, 上清液用于测定胞内β-环柠檬醛含量和其余胞内有机物各项指标.
2.3 测定项目及分析方法终止氧化反应之后, 在显微镜(ZEISS-Axio Imager.A2) 下观察藻细胞损坏程度, 并测定藻密度变化.据研究表明(汪小雄等, 2010;许晨等, 2015), 铜绿微囊藻在波长680 nm处具有最大吸收峰, 并且此处测定的吸光度值与藻细胞密度呈良好的线性比例关系, 因而可利用紫外可见分光光度计(Lambda 650S)测定的OD680值来间接反映藻细胞密度.β-环柠檬醛含量采用气相色谱质谱联用仪(GCMS-QP2010 Plus)进行测量, 其萃取过程选用Gerstel的MPS自动固相微萃取模块进行.胞内外有机物所测指标包括DOC和三维荧光光谱图, 所用仪器分别为TOC分析仪(Multi N/C-3100) 和三维荧光光谱仪(Hitachi F-7000) .
3 结果与讨论(Results and discussion) 3.1 H2O2去除β-环柠檬醛的效能研究将不同浓度的H2O2分别投加到铜绿微囊藻藻液中, 对比研究了其对胞外和胞内β-环柠檬醛的去除效果, 结果如图 1所示.同其他典型嗅味物质土臭素和2-甲基异茨醇一样, 大部分β-环柠檬醛产自于细胞内部组织.因而在氧化高藻水时, 应重点研究胞内嗅味物质的降解程度.
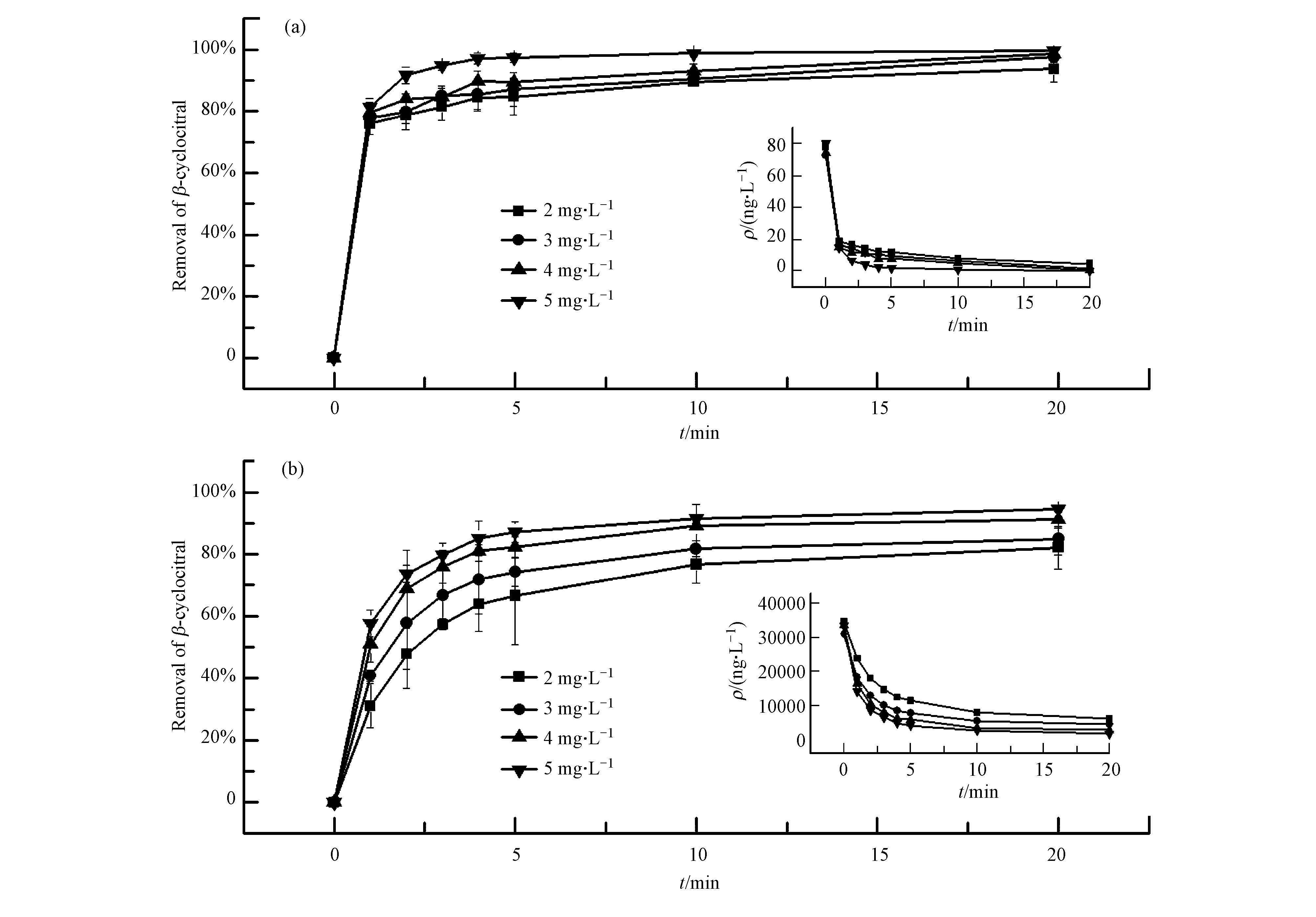 |
| 图 1 不同H2O2投加量对胞外(a)和胞内(b)β-环柠檬醛的去除效果比较 Fig. 1 Comparison of the removal efficiencies of extracellular β-cyclocitral (a) and intracellular β-cyclocitral (b) under different concentrations of hydrogen peroxide |
由图 1可以看出, H2O2对胞外β-环柠檬醛的氧化较为迅速, 即使投加量低至2 mg·L-1, 反应1 min后也可达到76%的去除率;甚至当加入5 mg·L-1的H2O2时, 在短短2 min内即可去除92%的胞外β-环柠檬醛.由于细胞壁和细胞膜的保护机制, 需要消耗一定的时间, 大量的H2O2才能顺利进入到细胞内部发挥作用.因而, 胞内β-环柠檬醛的降解速率不及胞外.随着H2O2投加量的逐步增加, 胞内氧化效果提升幅度较大, 5 mg·L-1的H2O2在0~5 min内的去除率远大于其他投加量.当氧化时间长达20 min时, 投加4 mg·L-1以上才可勉强去除90%的嗅味物质.由此可知, 胞内β-环柠檬醛的降解比较缓慢, 只有投加高浓度的H2O2(4或5 mg·L-1)才能取得较为显著的氧化效果.
已有研究表明, 氧化剂与铜绿微囊藻之间的反应符合二级动力学模型(Fan et al., 2013).因此, 假定H2O2氧化β-环柠檬醛也遵循此反应表达式:

|
(1) |
式中, k为二级反应速率常数;[odorant]为β-环柠檬醛浓度;而[oxidant]为H2O2质量浓度.
由于在反应过程中, H2O2的剩余量远远大于消耗量, 因而其质量浓度可视为定值, 则此反应将转化为准一级动力学模型, 其表达式为:
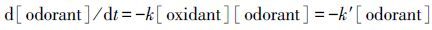
|
(2) |
式中, k′为准一级速率常数.
根据β-环柠檬醛氧化前后的含量变化, 由公式(2) 计算可得反应速率k′和半衰期t1/2, 结果如表 1所示.可以看出, 随着投加量的增加, β-环柠檬醛的降解速率逐步提升, 呈现出良好的比例关系(R2=0.9820) :
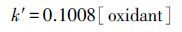
|
(3) |
结合公式(2) 和(3) 计算可知, H2O2氧化β-环柠檬醛的二级反应速率常数k为57.12 L·mol-1·s-1.
据研究可知, β-环柠檬醛在KMnO4氧化下的二级速率常数为107.2 L·mol-1·s-1(张可佳等, 2011), 在6 W紫外灯照射下的光解速率常数为0.056 min-1(马晓雁等, 2013).由于β-环柠檬醛属醛类化合物, 自身带有很强的还原性, 能够被氧化剂降解.但若投加KMnO4, 会导致水的色度和锰离子含量增加(王桂荣等, 2005), 并且在长时间接触下, 易将铜绿微囊藻组织内部的β-胡萝卜素转化生成新的β-环柠檬醛, 造成嗅味物质不降反增的现象.相比而言, H2O2属于绿色氧化剂范畴, 不会过多地产生副产物.同时, H2O2不仅本身具有氧化性, 其在溶液中还会部分离解产生HO-2, 此为重要的诱发剂, 可诱发产生氧化能力更强的·OH, 它的氧化电极电位(2.8 V)远超于KMnO4、Cl2等氧化剂, 与有机物的反应速率更是高达107~109 L·mol-1·s-1(Yuan et al., 2013), 能够快速降解β-环柠檬醛.此外, 若向水库、湖泊等露天的高藻原水投加H2O2将会取得更为显著的氧化效果, 因为在太阳照射的自然光中包含了范围广泛的光谱, 其中的紫外光能够与H2O2起到协同作用, 激发产生更多的·OH, 增强嗅味物质的去除效果(Brookes et al., 2004;Hipsey et al., 2004;Rueda-Márquez et al., 2016).
| 表 1 不同H2O2投加量下β-环柠檬醛的反应动力学参数 Table 1 Reaction kinetic parameters of β-cyclocitral under different concentrations of hydrogen peroxide |
在氧化过程中, 由于H2O2能产生具有强氧化能力的·OH, 可导致藻细胞破碎, 胞内有机物释放到水中.因碳元素是有机物的主要构成成分, 故常用溶解性有机碳(DOC)的浓度变化来表征反应中藻细胞的破碎程度(裴海燕等, 2003).
投加不同浓度的H2O2后, 胞内和胞外DOC含量变化由图 2所示.可以看出, 相对于空白对照组而言, 在2 mg·L-1的H2O2氧化作用下, 胞内DOC不减反增, 说明低浓度的氧化剂并未使藻细胞剧烈破碎, 并且H2O2与细胞内部物质之间快速反应, 反而生成了更多的DOC.但随着氧化时间的延长, 胞内DOC的质量浓度由1 min时的11.99 mg·L-1逐渐降至20 min的10.01 mg·L-1.当逐步提高H2O2的投加量时, 胞内DOC呈现出越来越少的梯度变化趋势, 且DOC含量达到最低点的氧化时间由原来的20 min缩短至5 min.由此可知, 氧化剂投加量越大, 藻细胞破碎程度越剧烈, 达到预期氧化效果的时间越短.
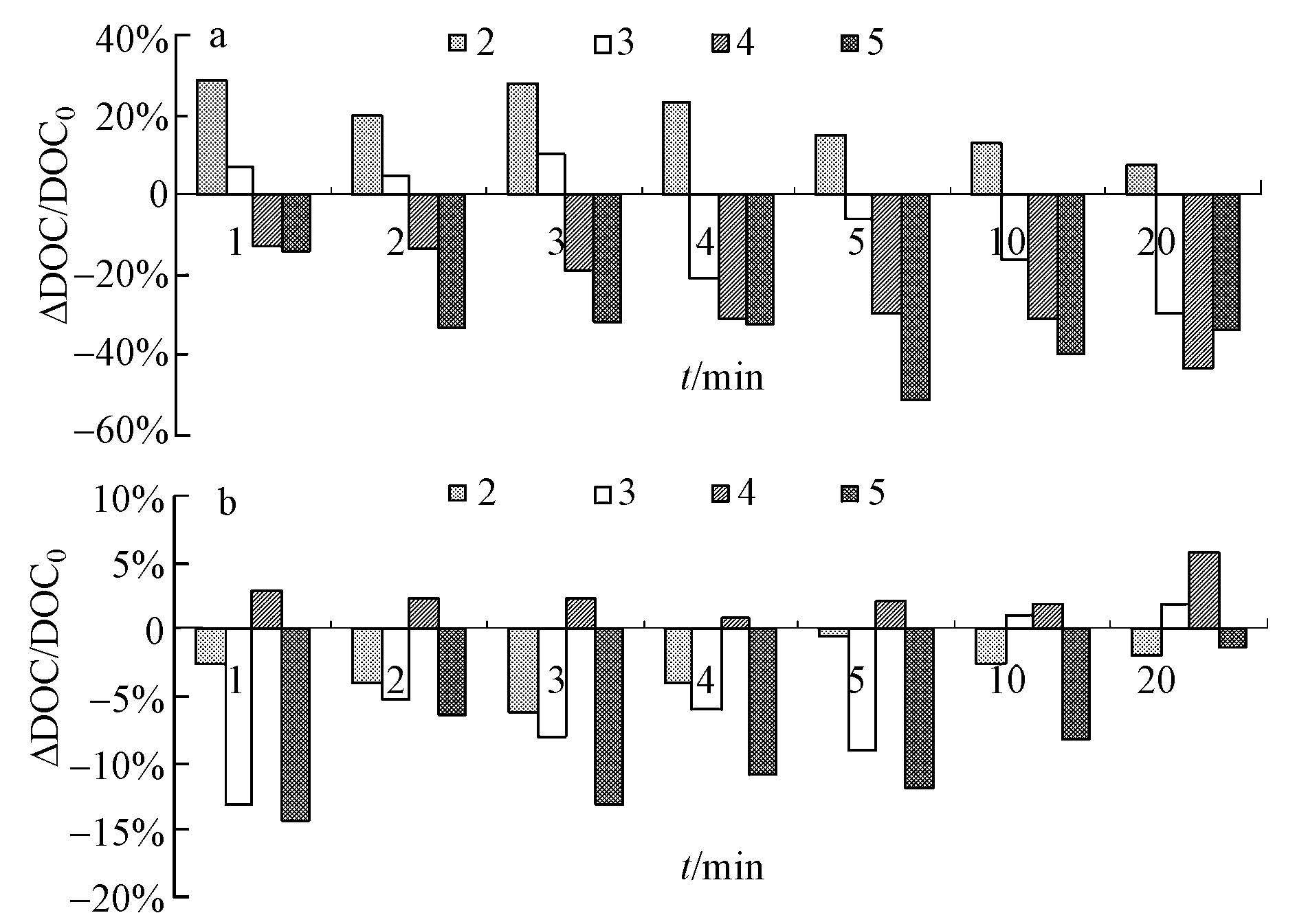 |
| 图 2 不同H2O2投加量对胞内(a)和胞外(b)DOC含量变化的影响(△DOC为氧化前后DOC的变化量) Fig. 2 Effects on the content changes of intracellular DOC (a) and extracellular DOC (b) under different concentrations of hydrogen peroxide (△DOC is the change quantity of DOC before and after oxidation) |
尽管胞内有机物释放出来, 胞外DOC并未因此而增多, 是因为·OH能将一些不稳定的藻类有机物矿化为无机物, 导致胞外DOC下降.Her等(2004) 研究发现, 细胞组织中的类腐殖酸就能够在氧化剂作用下发生降解.因而, 胞外DOC含量变化是胞内DOC释放和细胞组织中有机物氧化降解综合作用的结果.在H2O2为4 mg·L-1时, 胞外△DOC>0, 可知此时胞内有机物流失起主导作用, 而当H2O2提高至5 mg·L-1时, 氧化能力增强, 更多的有机物进行矿化, 促使△DOC<0.但有研究表明(Coral et al., 2013;Liu et al., 2015), 在O3、Cl2等其他氧化剂作用下, 铜绿微囊藻的DOC均呈现上升趋势.对比本实验中胞外△DOC可以判断出, H2O2的氧化强度相对较弱, 不足以导致细胞超严重破碎, 胞内有机物也并未大量释放出来.
众所周知, 铜绿微囊藻可产生对人体健康危害最大的微囊藻毒素, 并且胞内释放的部分有机物是消毒副产物的重要前体物(Ross et al., 2006;Mash et al., 2016), 因而防止水体二次污染的关键在于减少氧化过程中藻细胞的破碎程度, 尽量避免胞内有毒有害物质释放到水中.相比于其他强氧化剂, H2O2既可以有效去除嗅味物质, 又不因藻细胞过度破碎而导致水质恶化, 是一种较为理想的氧化剂.
3.3 H2O2改变藻液DOM组分的研究藻液中所含的可溶性有机物(DOM)往往是水处理过程中产生有害副产物的重要来源, 因而详细了解DOM的分类及分布是高藻水治理中不可或缺的步骤.采用三维荧光光谱(3DEEM)技术监测铜绿微囊藻藻液在H2O2氧化前后各类有机物的含量变化情况, 结果如图 3所示.
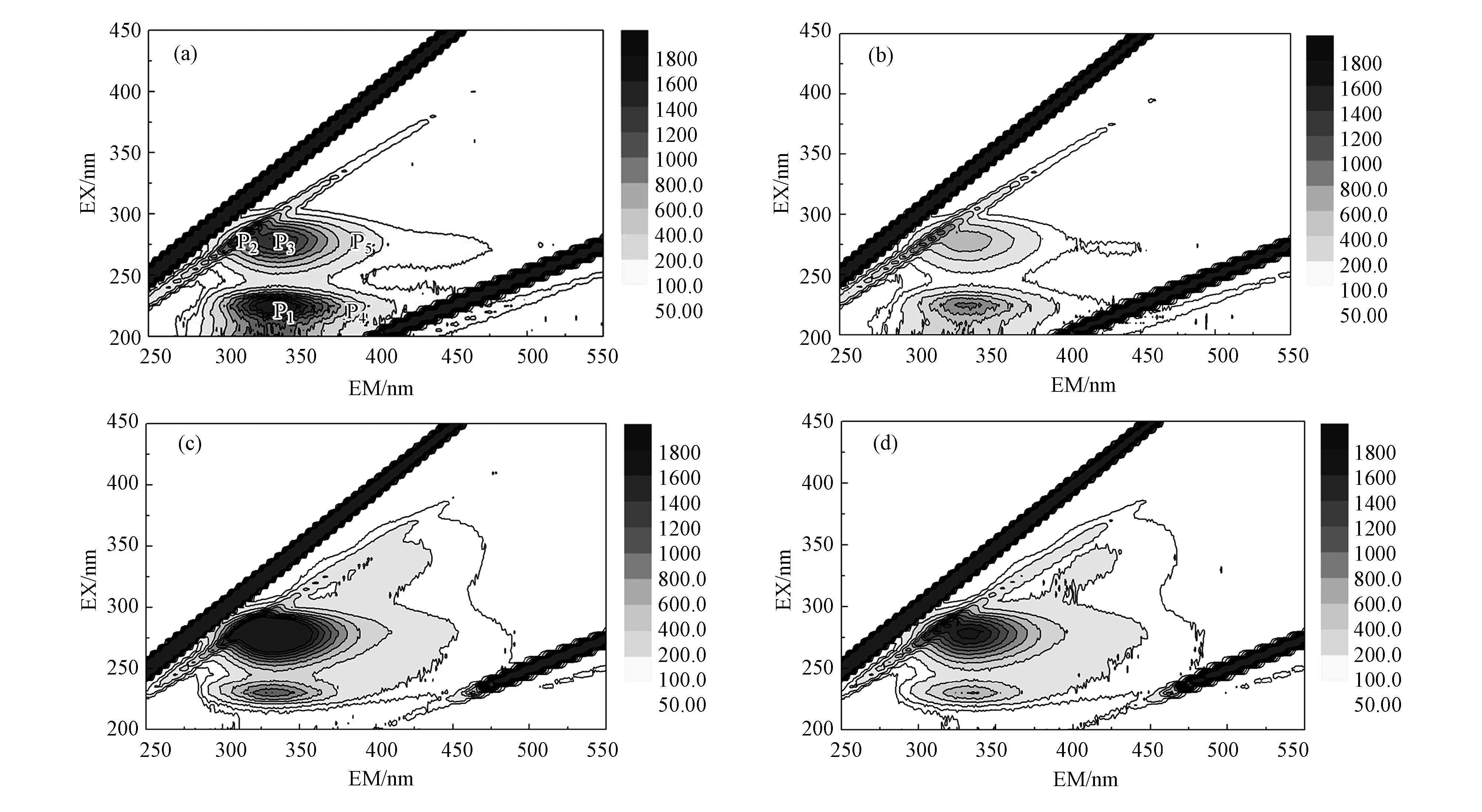 |
| 图 3 5 mg·L-1H2O2氧化前后的三维荧光光谱等高线图(有机物浓度:DOC=2 mg·L-1(胞内)或3 mg·L-1(胞外);氧化前(胞内)(a), 5 mg·L-1 H2O2氧化20 min(胞内)(b);氧化前(胞外)(c), 5 mg·L-1H2O2氧化20 min(胞外)(d)) Fig. 3 Contour maps of three-dimensional fluorescence spectra before and after oxidation under 5 mg·L-1 of hydrogen peroxide(The concentration of organic matter: DOC=2 mg·L-1 (intracellular) or 3 mg·L-1 (extracellular);Before oxidation (intracellular) (a), Oxidation for 20 min under 5 mg·L-1 of hydrogen peroxide (intracellular);(b) Before oxidation (extracellular) (c), Oxidation for 20 min under 5 mg·L-1 of hydrogen peroxide (extracellular) (d)) |
可以看出, 铜绿微囊藻藻液主要有5种荧光溶解有机物, 分别体现在P1~P5这5个荧光峰上.据相关研究(任保卫等, 2008), 同一种物质的荧光光谱等高线图为圆形, 由此判断出峰P1为混合物.因酪氨酸中的酚醛官能团和色氨酸中的吲哚官能团均能在此区域发出荧光(Korak et al., 2015), 故峰P1为酪氨酸类和色氨酸类芳香族蛋白质的混合.峰P2代表可溶性微生物代谢产物, P3表示酚类化合物或芳香族蛋白质, 而P4 、P5分别对应富里酸和腐殖酸类物质.如图 3a和3c所示, 胞内藻液所含荧光有机物主要为芳香族蛋白质, 其次为微生物代谢产物, 而胞外藻液与之相反, 微生物代谢产物和酚类化合物较多, 酪氨酸和色氨酸含量相对较少.富里酸和腐殖酸等腐殖质不是铜绿微囊藻藻液的主要组成部分, 在此DOM中所占比例非常小, 甚至在胞外溶液中, 富里酸含量少到无法形成单个的荧光峰.
向藻液中投加不同浓度的H2O2, 氧化后各个荧光峰的位置和强度变化值列于表 2.可以发现, 氧化后胞内外DOM的荧光强度均有明显降低, 且随着H2O2的增加, 下降幅度逐渐增大.投加5 mg·L-1时, 胞内外芳香族蛋白质在反应20 min后, 分别由原来的2335和1225降至1107和847, 各减少了53%和31%.荧光峰P3在反应后也明显减弱, 胞内外荧光强度分别下降53%和37%.因为酚类化合物或芳香族蛋白质分子结构中存在不饱和键, H2O2易使其断裂(杨岸明等, 2010), 从而发生显著降解.Mcknight等(2001) 研究发现, 荧光指数FI((370 nm, 470 nm)和(370 nm, 520 nm)的荧光强度之比)>1.8表示低芳香性有机物来源于微生物, FI<1.4表示高芳香性物质更多来自于陆源.经计算得, FI值均在2.5以上, 由此判断出藻液的部分有机物主要为微生物源, 且含量较多, 降解缓慢.这或许是造成可溶性微生物代谢产物荧光峰强度减少相对较少的原因(胞内外降解率分别为28%和25%).腐殖质是水体消毒副产物三氯甲烷的重要前体物, H2O2所产生的·OH能与富里酸和腐殖酸中的还原性官能团发生反应, 导致CC键和含氮基团明显减少, 并产生一系列醛、酮和酸类化合物, 甚至部分微量有机物直接被氧化成水和二氧化碳, 从而有效减少了水体中的有害物质.FI值的变化表明反应中DOM组成成分的改变(Wert et al., 2014).由FI增量较少可知受H2O2的氧化刺激之后, 藻细胞破碎程度并不严重, 这与DOC所得结论一致.
H2O2氧化藻液过程中, 各个荧光峰中心位置也进行了一定程度的偏移.实验结果显示, 大多数胞内外荧光峰均蓝移了1~4 nm, 原因在于H2O2的强氧化性导致π电子系统改变, 引起DOM中稠环芳烃的裂解, 以及芳香环总量减少, 组成成分发生变化(王丽莎等, 2007).但胞外酪氨酸类芳香族蛋白质的分子内部羰基和羧基官能团在H2O2的刺激反应下数量不减反增(廖日红等, 2011), 从而造成胞外峰P1进行了1~7 nm的红移.
| 表 2 胞内外藻液氧化20 min后的荧光强度F和荧光指数FI值 Table 2 Fluorescence intensity F and fluorescence index FI of intracellular and extracellular algae solution after oxidation for 20 min |
为研究H2O2对藻细胞的灭活效应, 配制密度为4.45×106 cells·mL-1的铜绿微囊藻藻液, 分别向其投加0、2、3、4和5 mg·L-1的H2O2进行氧化, 连续6 d检测表征藻细胞密度的OD680值, 从而判断出不同投加量下的H2O2对藻类生长变化的影响.
由图 4可知, 相对于空白对照组, H2O2对铜绿微囊藻的生长产生了一定程度的抑制作用.由于H2O2在光照条件下极易分解(李今等, 2011), 同时也会被藻类释放的有机物消耗利用, 因而低浓度下的氧化剂不能充分灭活藻细胞.在反应的24 h之内, 2 mg·L-1的H2O2所产生的抑制作用即可消失殆尽, OD680值基本恢复至初始水平.投加3 mg·L-1时抑制程度稍微增强, 直至氧化后的第4 d藻细胞才复苏进入快速生长阶段.4和5 mg·L-1的H2O2能够产生较为明显的灭活效果, 在检测的6 d内, OD680值基本保持稳定, 不再出现上升趋势, 说明此时铜绿微囊藻处于停滞生长或衰亡阶段.
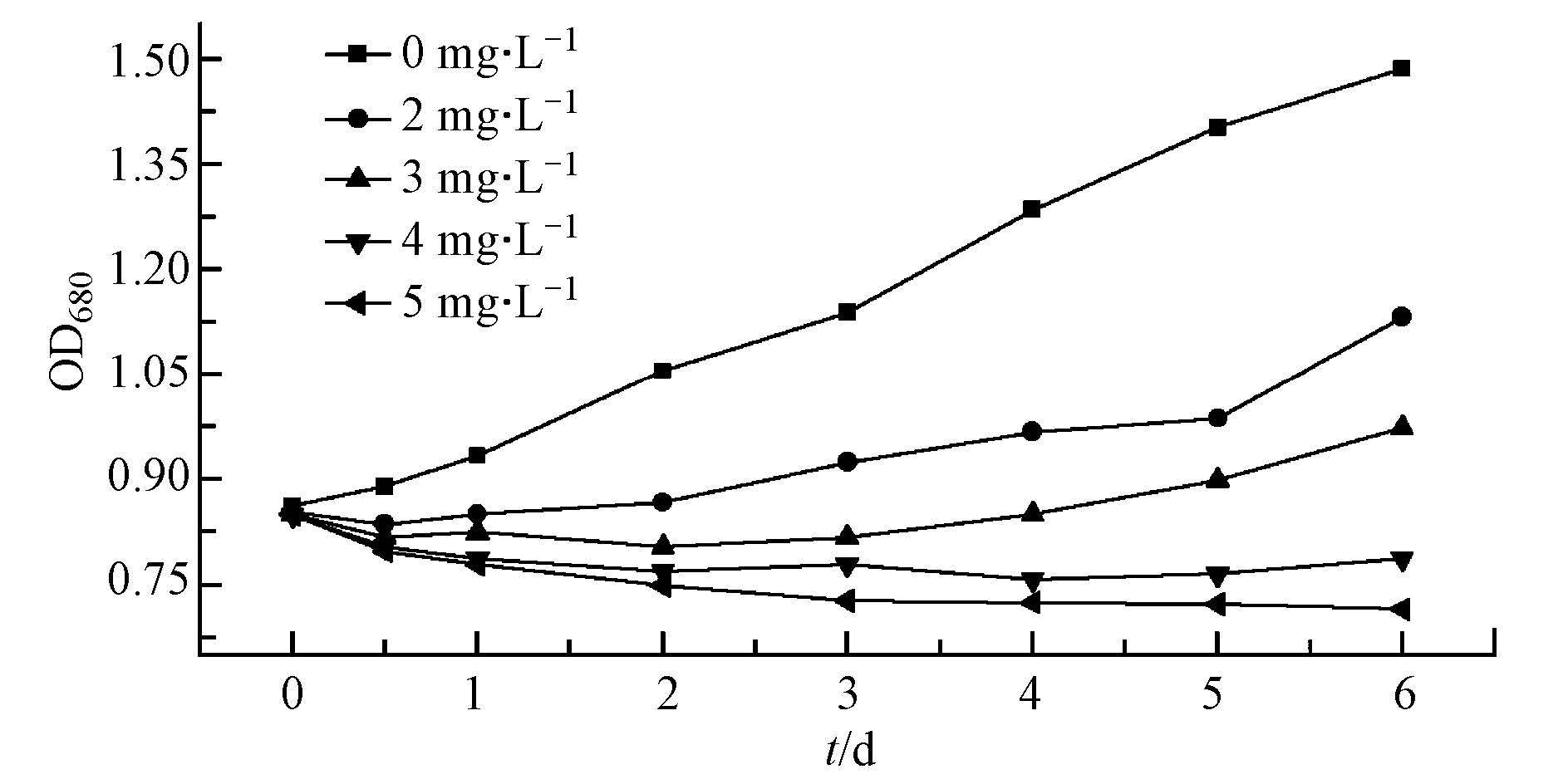 |
| 图 4 不同H2O2投加量对藻细胞生长的影响 Fig. 4 Concentration Effects of hydrogen peroxide on algal cells growth under |
以上结果表明, 较高浓度的H2O2(4或5 mg·L-1)能够充分灭活藻细胞.在显微镜下观察氧化后的细胞形态可以发现, 在高投加量下, 大多数细胞不再保持完整, 细胞壁和细胞膜均受到不同程度的破坏, 且随着氧化时间的延长, 甚至会出现一个个不规则的藻细胞碎片.其可能的原因是H2O2能够过氧化膜系统, 使其脂质性质和功能受到损害(李娟等, 2015), 细胞膜稳定性下降, 细胞壁扭曲或破裂, 大量H2O2扩散进入细胞内部, 进而通过氧化光和器官中的蛋白质和阻碍电子传输过程来破坏光合作用系统(Wang et al., 2015), 最终致使藻细胞灭活.此外, 有研究者认为H2O2属于活性氧(ROS)化合物, 能改变蓝藻部分基因的表达, 使其混乱, 不利于细胞的生存和繁殖(Mehterov et al., 2012;Fotiou et al., 2016).
总体而言, 作为潜在的除藻剂, H2O2能对铜绿微囊藻产生一定的毒害作用.并且, 在整个水生态系统中, 相比于其他水生生物, 蓝藻对H2O2更敏感(Drábková et al., 2007a).因此, 在不影响其他生物正常生长的情况下, 向高藻水中投加H2O2氧化剂, 从而有选择性地控制了蓝藻生长, 这是应用H2O2除藻的独特优势所在.
4 结论(Conclusions)1) 铜绿微囊藻致嗅物质β-环柠檬醛大部分产自于细胞内部.H2O2对胞外β-环柠檬醛的氧化较为迅速, 反应1 min内即可去除75%以上;而对胞内β-环柠檬醛的降解相对缓慢, 只有在投加4或5 mg·L-1时才能取得显著效果.计算可得H2O2氧化β-环柠檬醛的二级动力学速率常数为57.12 L·mol-1·s-1.
2) 由DOC所表征的藻细胞破碎程度可看出, H2O2的氧化能力相对较弱, 不足以导致藻细胞剧烈破碎, 但也因此减少了藻毒素的释放.H2O2既能有效去除嗅味物质的同时, 又不因细胞过度破碎而使水质恶化, 属于理想的氧化剂.
3) 胞内藻液所含荧光有机物主要为芳香族蛋白质, 而胞外含量最多的则是微生物代谢产物和酚类化合物.H2O2可使DOM各个组分的荧光强度明显降低, 并且荧光峰中心位置也发生了一定的偏移.
4) 因细胞壁和细胞膜受到损害, 浓度为4 mg·L-1以上的H2O2能够充分灭活藻细胞.并且蓝藻比其他水生生物对H2O2更敏感, 因而以此为除藻剂可以有选择性地控制高藻水中蓝藻的生长.
| [${referVo.labelOrder}] | Barrington D J, Ghadouani A. 2008. Application of hydrogen peroxide for the removal of toxic cyanobacteria and other phytoplankton from wastewater[J]. Environmental Science & Technology, 42(23) : 8916–8921. |
| [${referVo.labelOrder}] | Brookes J D, Antenucci J, Hipsey M, et al. 2004. Fate and transport of pathogens in lakes and reservoirs[J]. Environment International, 30(5) : 741–759. DOI:10.1016/j.envint.2003.11.006 |
| [${referVo.labelOrder}] | Carey C C, Ibelings B W, Hoffmann E P, et al. 2012. Eco-physiological adaptations that favour freshwater cyanobacteria in a changing climate[J]. Water Research, 46(5) : 1394–1407. DOI:10.1016/j.watres.2011.12.016 |
| [${referVo.labelOrder}] | Coral L A, Zamyadi A, Barbeau B, et al. 2013. Oxidation of Microcystis aeruginosa and Anabaena flos-aquae by ozone:Impacts on cell integrity and chlorination by-product formation[J]. Water Research, 47(9) : 2983–2994. DOI:10.1016/j.watres.2013.03.012 |
| [${referVo.labelOrder}] | Daly R I, Ho L, Brookes J D, et al. 2007. Effect of chlorination on Microcystis aeruginosa cell integrity and subsequent microcystin release and degradation[J]. Environmental Science & Technology, 41(12) : 4447–4453. |
| [${referVo.labelOrder}] | Drábková M, Admiraal W, Maršálek B. 2007a. Combined exposure to hydrogen peroxide and light-selective effects on cyanobacteria, green algae, and diatoms[J]. Environmental Science & Technology, 41(1) : 309–314. |
| [${referVo.labelOrder}] | Drábková M, Matthijs H C P, Admiraal W, et al. 2007b. Selective effects of H2O2 on cyanobacterial photosynthesis[J]. Photosynthetica(Prague), 45(3) : 363–369. DOI:10.1007/s11099-007-0062-9 |
| [${referVo.labelOrder}] | Fan J J, Ho L, Hobson P, et al. 2013. Evaluating the effectiveness of copper sulphate, chlorine, potassium permanganate, hydrogen peroxide and ozone on cyanobacterial cell integrity[J]. Water Research, 47(14) : 5153–5164. DOI:10.1016/j.watres.2013.05.057 |
| [${referVo.labelOrder}] | Fotiou T, Triantis T M, Kaloudis T, et al. 2016. Assessment of the roles of reactive oxygen species in the UV and visible light photocatalytic degradation of cyanotoxins and water taste and odor compounds using C-TiO2[J]. Water Research, 90 : 52–61. DOI:10.1016/j.watres.2015.12.006 |
| [${referVo.labelOrder}] | He X X, Cruz A A, Dionysiou D D. 2013. Destruction of cyanobacterial toxin cylindrospermopsin by hydroxyl radicals and sulfate radicals using UV-254 nm activation of hydrogen peroxide, persulfate and peroxymonosulfate[J]. Journal of Photochemistry and Photobiology A:Chemistry, 251 : 160–166. DOI:10.1016/j.jphotochem.2012.09.017 |
| [${referVo.labelOrder}] | Her N, Amy G, Park H R, et al. 2004. Characterizing algogenic organic matter (AOM) and evaluating associated NF membrane fouling[J]. Water Research, 38(6) : 1427–1438. DOI:10.1016/j.watres.2003.12.008 |
| [${referVo.labelOrder}] | Hipsey M, Antenucci J, Brookes J D, et al. 2004. A three-dimensional model for Cryptosporidium dynamics in lakes and reservoirs:A new tool for risk management[J]. International Journal of River Basin Management, 2 : 181–197. DOI:10.1080/15715124.2004.9635231 |
| [${referVo.labelOrder}] | 霍书豪, 陈玉碧, 刘宇鹏, 等. 2012. 添加沼液的BG11营养液微藻培养试验[J]. 农业工程学报, 2012, 28(8) : 241–246. |
| [${referVo.labelOrder}] | 蒋道松, 刘其城, 章俭, 等. 2000. 除藻技术新进展[J]. 常德师范学院学报(自然科学版), 2000, 12(1) : 25–31. |
| [${referVo.labelOrder}] | Kay S H, Quimby P C, Quzts J D. 1982. Hydrogen peroxide:A potential algicide for aquaculture[A]. Proceedings of the 35th Annual Meeting of the Southern Weeding Science Society. Atlanta, GA:275-289 |
| [${referVo.labelOrder}] | Korak J A, Wert E C, Rosario-Ortiz F L. 2015. Evaluating fluorescence spectroscopy as a tool to characterize cyanobacteria intracellular organic matter upon simulated release and oxidation in natural water[J]. Water Research, 68 : 432–443. DOI:10.1016/j.watres.2014.09.046 |
| [${referVo.labelOrder}] | 李今, 华江环. 2011. 几种除藻剂对铜绿微囊藻生长的毒性效应[J]. 沈阳师范大学学报(自然科学版), 2011, 29(3) : 444–448. |
| [${referVo.labelOrder}] | 李娟, 王应军, 高鹏. 2015. 过氧化氢对铜绿微囊藻的损伤效应研究[J]. 环境科学学报, 2015, 35(4) : 1183–1189. |
| [${referVo.labelOrder}] | 廖日红, 申颖洁, 战楠, 等. 2011. 臭氧氧化对地表水溶解性有机物去除效果的影响研究[J]. 给水排水, 2011, 37(3) : 127–132. |
| [${referVo.labelOrder}] | Liu B, Liang H, Qu F S, et al. 2015. Comparison of evaluation methods for Microcystis cell breakage based on dissolved organic carbon release, potassium release and flow cytometry[J]. Chemical Engineering Journal, 281 : 174–182. DOI:10.1016/j.cej.2015.06.072 |
| [${referVo.labelOrder}] | 马晓雁, 倪梦婷, 李军, 等. 2013. UV-C辐照降解水中藻源性污染物β-环柠檬醛[J]. 华中科技大学学报(自然科学版), 2013, 41(11) : 26–31. |
| [${referVo.labelOrder}] | Mash H, Wittkorn A. 2016. Effect of chlorination on the protein phosphatase inhibition activity for several microcystins[J]. Water Research, 95 : 230–239. DOI:10.1016/j.watres.2016.03.024 |
| [${referVo.labelOrder}] | Mcknight D M, Boyer E W, Westerhoff P K, et al. 2001. Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic materials and aromaticity[J]. Limnology & Oceanography, 46(1) : 38–48. |
| [${referVo.labelOrder}] | Mehterov N, Balazadeh S, Hille J, et al. 2012. Oxidative stress provokes distinct transcriptional responses in the stress-tolerant atr7 and stress-sensitive loh2 Arabidopsis thaliana mutants as revealed by multi-parallel quantitative real-time PCR analysis of ROS marker and antioxidant genes[J]. Plant Physiology and Biochemistry, 59 : 20–29. DOI:10.1016/j.plaphy.2012.05.024 |
| [${referVo.labelOrder}] | Mo W W, Wang H Y, Jacobs J M. 2016. Understanding the influence of climate change on the embodied energy of water supply[J]. Water Research, 95 : 220–229. DOI:10.1016/j.watres.2016.03.022 |
| [${referVo.labelOrder}] | 裴海燕, 李富生, 汤浅晶, 等. 2003. 藻细胞破碎释放有机物的特性[J]. 中国环境科学, 2003, 23(3) : 272–275. |
| [${referVo.labelOrder}] | Qi J, Lan H C, Miao S Y, et al. 2016. KMnO4-Fe(II) pretreatment to enhance Microcystis aeruginosa removal by aluminum coagulation:Does it work after long distance transportation?[J]. Water Research, 88 : 127–134. DOI:10.1016/j.watres.2015.10.004 |
| [${referVo.labelOrder}] | 任保卫, 赵卫红, 王江涛, 等. 2008. 海洋微藻生长过程藻液三维荧光特征[J]. 光谱学与光谱分析, 2008, 28(5) : 1130–1134. |
| [${referVo.labelOrder}] | Reynaldo P, Dan D, Matthew M V. 2014. Retrospective analysis of associations between water quality and toxic blooms of golden alga (Prymnesium parvum) in Texas reservoirs:Implications for understanding dispersal mechanisms and impacts of climate change[J]. Harmful Alage, 33 : 1–11. DOI:10.1016/j.hal.2013.12.006 |
| [${referVo.labelOrder}] | Rodríguez E M, Acero J L, Spoof L, et al. 2008. Oxidation of MC-LR and-RR with chlorine and potassium permanganate:Toxicity of the reaction products[J]. Water Research, 42(6/7) : 1744–1752. |
| [${referVo.labelOrder}] | Ross C, Santiago-Vázquez L, Paul V. 2006. Toxin release in response to oxidative stress and programmed cell death in the cyanobacterium Microcystis aeruginosa[J]. Aquatic Toxicology, 78(1) : 66–73. DOI:10.1016/j.aquatox.2006.02.007 |
| [${referVo.labelOrder}] | Rueda-Márquez J J, Levchuk I, Salcedo I, et al. 2016. Post-treatment of refinery wastewater effluent using a combination of AOPs (H2O2 photolysis and catalytic wet peroxide oxidation) for possible water reuse[J]. Comparison of low and medium pressure lamp performance[J]. Water Research, 91 : 86–96. |
| [${referVo.labelOrder}] | Suffet I H, Khiari D, Bruchet A. 1999. The drinking water taste and odor wheel for the millennium:Beyond geosmin and 2-methylisoborneol[J]. Water Science and Technology, 40(6) : 1–13. DOI:10.1016/S0273-1223(99)00531-4 |
| [${referVo.labelOrder}] | Wang B L, Wang X, Hu Y W, et al. 2015. The combined effects of UV-C radiation and H2O2 on Microcystis aeruginosa, a bloom-forming cyanobacterium[J]. Chemosphere, 141 : 34–43. DOI:10.1016/j.chemosphere.2015.06.020 |
| [${referVo.labelOrder}] | 王桂荣, 张杰, 黄丽, 等. 2005. 三种预氧化剂在水处理中的应用评估[J]. 中国给水排水, 2005, 21(4) : 37–39. |
| [${referVo.labelOrder}] | 王丽莎, 胡洪营, 藤江幸一. 2007. 污水氯和二氧化氯消毒过程中溶解性有机物变化的三维荧光光谱解析[J]. 环境科学, 2007, 28(7) : 1524–1528. |
| [${referVo.labelOrder}] | 汪小雄. 2011. 化学方法在除藻方面的应用[J]. 广东化工, 2011, 38(4) : 24–26. |
| [${referVo.labelOrder}] | 汪小雄, 林细池, 姜成春, 等. 2010. 臭氧氧化铜绿微囊藻及其对水质的影响[J]. 环境保护科学, 2010, 36(6) : 10–14. |
| [${referVo.labelOrder}] | Wert E C, Korak J A, Trenholm R A, et al. 2014. Effect of oxidant exposure on the release of intracellular microcystin, MIB, and geosmin from three cyanobacteria species[J]. Water Research, 52 : 251–259. DOI:10.1016/j.watres.2013.11.001 |
| [${referVo.labelOrder}] | 许晨, 李伟英, 王峰, 等. 2015. 氧化剂投加量与作用时间(CT值)对藻类抑制效果及机理分析[J]. 净水技术, 2015, 34(4) : 60–64. |
| [${referVo.labelOrder}] | 杨岸明, 常江, 甘一萍, 等. 2010. 臭氧氧化二级出水有机物可生化性研究[J]. 环境科学, 2010, 31(2) : 363–367. |
| [${referVo.labelOrder}] | Yang M, Yu J W, Li Z L, et al. 2008. Taihu Lake not to blame for Wuxi's woes[J]. Science, 319(5860) : 158. |
| [${referVo.labelOrder}] | Yuan B L, Xu D M, Li F, et al. 2013. Removal efficiency and possible pathway of odor compounds (2-methylisoborneol and geosmin) by ozonation[J]. Separation & Purification Technology, 117(39) : 53–58. |
| [${referVo.labelOrder}] | 张君枝, 邱丽佳, 张艳娜, 等. 2016. 高温热浪下北京城市水体典型蓝绿藻生长规律研究[J]. 河南师范大学学报(自然科学版), 2016, 44(2) : 89–94. |
| [${referVo.labelOrder}] | 张可佳, 高乃云, 黎雷. 2011. 高锰酸钾氧化嗅味物质β-环柠檬醛的动力学[J]. 中南大学学报(自然科学版), 2011, 42(4) : 1161–1166. |
| [${referVo.labelOrder}] | Zhang X J, Chen C, Ding J Q, et al. 2010. The 2007 water crisis in Wuxi, China:Analysis of the origin[J]. Journal of Hazardous Materials, 182(1/3) : 130–135. |
 2017, Vol. 37
2017, Vol. 37


