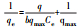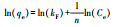2. 南华大学铀矿冶生物技术国防重点学科实验室, 衡阳 421001
2. Key Discipline Laboratory for National Defence for Biotechnology in Uranium Mining and Hydrometallurgy, University of South China, Hengyang 421001
铀矿冶生产中产生了大量的低浓度含铀废水, 如不妥善处理直接排放, 对生态环境和人体健康将构成潜在的严重威胁, 有效处理含铀废水显得尤为重要 (李小燕等, 2012).含铀废水的主要处理方法有化学沉淀法、生物修复法、膜分离法和吸附法等, 其中吸附法因其高效廉价、操作简单、无二次污染且便于铀回收利用的优点而备受关注, 成为铀矿冶环境治理的研究热点 (Afsari et al., 2012; Zhang et al., 2012).
氧化石墨烯 (GO) 是石墨氧化的产物, 表面富含羧基、羟基等含氧基团, 且比表面积较大, 对重金属离子有很好的吸附效果 (Wang et al., 2013).Zhao等 (2012)研究发现氧化石墨烯对U (Ⅵ) 的最大吸附量达111.7 mg·g-1, 明显高于其它铀酰离子吸附剂.但由于氧化石墨烯具有亲水性, 吸附后难以从水中分离, 在实际应用中可将GO与其它吸附材料复合, 既可以提高GO的吸附能力, 又使其便于分离回收.壳聚糖 (CS) 是甲壳素脱乙酰化的产物, 其分子结构中存在大量的氨基和羟基, 具有吸附性能好、易再生和价廉等优点.但CS能溶于酸性溶液, 这极大地限制了它的应用, 因此有必要对CS进行交联改性, 使直链的CS分子形成网状结构, 从而提高其在酸性溶液中的稳定性 (桂珊等, 2015).有研究 (Zhang et al., 2011; Yang et al., 2010; Liu et al., 2012) 表明, 将壳聚糖接枝到氧化石墨烯上得到的CS/GO复合材料热稳定性高、机械性能好, 对Au3+, Pd2+等有毒重金属具有良好的吸附效果.但有关CS/GO吸附热力学、动力学及机理等方面的研究还不够深入, 且将其应用于低浓度含铀废水处理的报道相对较少.本研究利用Hummers法合成氧化石墨烯并与壳聚糖进行混合, 经戊二醛交联改性后制备出吸附位点多, 不溶于酸, 且可过滤分离的CS/GO复合材料.探讨了CS/GO对U (Ⅵ) 的吸附特性, 通过SEM-EDS、FTIR、XRD等表征手段研究其吸附机理, 以期为CS/GO处理含铀废水提供理论依据.
2 材料与方法 (Materials and methods) 2.1 主要试剂与仪器主要试剂:天然鳞片石墨 (325目), 青岛金日来石墨有限公司;壳聚糖 (脱乙酰度大于90%), 国药集团化学试剂有限公司;硝酸钠、高锰酸钾、氢氧化钠、盐酸 (37%)、戊二醛等其他试剂均为市售分析纯, 模拟含铀废水采用U3O8(分析纯) 根据GBW04201配制而成.
主要仪器:台式恒温振荡器 (IS-RDD3, 美国精骐有限公司);pHS-3C型精密酸度计 (上海雷磁仪器厂);扫描电子显微镜 (JSM-7500F, 日本电子);X射线能谱仪 (Energy 350, 英国牛津仪器有限公司);傅里叶变换红外光谱仪 (NICOLET6700, 美国Themo Fisher公司);X射线衍射仪 (D8 Advance, 德国布鲁克AXS公司);紫外可见分光光度计 (T6, 北京普析通用公司).
2.2 壳聚糖/氧化石墨烯的制备采用改进的Hummers法 (Mi et al., 2012) 制备氧化石墨.称取一定量研磨好的氧化石墨加到25 mL体积分数为1%的乙酸水溶液中, 室温下超声45 min, 形成均匀悬浊液.不断搅拌的同时逐步加入0.5 g壳聚糖粉末, 超声1 h, 使壳聚糖与氧化石墨烯混合均匀, 再加入1.5 mL 50%的戊二醛作为交联剂, 继续搅拌1 h.静置12 h, 将分散良好的悬浊液用0.1 mol·L-1的NaOH溶液浸泡, 使复合物变成凝胶状, 将产物过滤并依次用50%的乙醇溶液和超纯水洗涤、烘干、研磨、过筛 (0.15 mm), 密封干燥备用.
2.3 吸附试验取50 mL一定浓度 (2~100 mg·L-1) 的铀溶液置于150 mL锥形瓶中, 用0.1 mol·L-1的HCl和NaOH溶液调节pH值 (2~8), 加入适量 (0.05~0.40 g·L-1) 吸附剂, 恒温振荡 (20~40 ℃, 150 r·min-1) 一定时间 (5~420 min) 后过滤, 用紫外分光光度计在578 nm处测定滤液U (Ⅵ) 浓度, 试验重复3次, 取平均值.分别按式 (1) 和式 (2) 计算CS/GO的吸附量q(mg·g-1) 和U (Ⅵ) 的吸附率η:
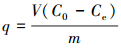
|
(1) |
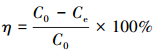
|
(2) |
式中:C0、Ce分别为吸附前后溶液中U (Ⅵ) 的浓度 (mg·L-1);V为溶液体积 (L);m为吸附剂的投加量 (g).
2.4 解吸试验将0.4 g·L-1的CS/GO投加到pH=5, U (Ⅵ) 初始浓度为150 mg·L-1的溶液中, 30 ℃恒温振荡5 h后过滤, 测定滤液中U (Ⅵ) 的剩余浓度.再将吸附后的CS/GO放入100 mL 0.1 mol·L-1的HCl溶液中, 振荡解吸120 min, 过滤并测定滤液U (Ⅵ) 浓度.将解吸后的CS/GO用去离子水反复洗涤若干次, 烘干后再在相同条件下进行吸附-解吸试验, 循环利用4次.U (Ⅵ) 的解吸率按照式 (3) 计算:
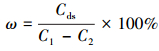
|
(3) |
式中:C1为U (Ⅵ) 的初始浓度 (mg·L-1);C2为吸附后溶液中的U (Ⅵ) 浓度 (mg·L-1);Cds为解吸液中U (Ⅵ) 的浓度 (mg·L-1).吸附和解吸过程中溶液的体积相同.
3 结果与讨论 (Results and discussion) 3.1 GO含量对CS/GO吸附U (Ⅵ) 的影响在pH值为5, CS/GO投加量为0.2 g·L-1, U (Ⅵ) 初始浓度为10 mg·L-1, 温度为30 ℃, 吸附时间为5 h的条件下, CS/GO中GO的质量分数 (5%~70%) 对吸附效果的影响如图 1所示.
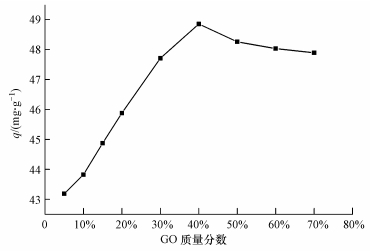 |
| 图 1 GO含量对CS/GO吸附U (Ⅵ) 的影响 Fig. 1 Effect of GO contents on U (Ⅵ) adsorption by CS/GO |
由图 1可见, CS/GO对U (Ⅵ) 的吸附量随GO含量的提高先快速增加后逐渐减小.这是因为GO的加入增大了CS/GO的比表面积, 提供更多的含氧基团 (羟基、羧基等), 使得CS/GO的吸附能力增强.当GO质量分数为40%时, 吸附量达到最大值.但继续提高GO含量, 吸附量反而略有降低, 可能是GO上的羧基和CS的氨基发生酰胺化反应, 形成—NHCO—键, 从而降低了羧基和氨基对铀酰离子的螯合能力 (He et al., 2011).在后续试验中, 均采用GO质量分数为40%的CS/GO复合材料进行吸附试验.
3.2 pH值对CS/GO吸附U (Ⅵ) 的影响在U (Ⅵ) 初始浓度为10 mg·L-1, 吸附剂投加量为0.2 g·L-1, 温度为30 ℃, 吸附时间为5 h的条件下, pH值对GO、CS、CS/GO吸附效果的影响如图 2所示.
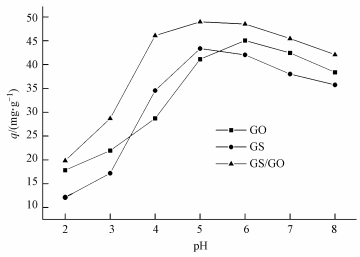 |
| 图 2 pH值对U (Ⅵ) 吸附的影响 Fig. 2 Effect of pH on U (Ⅵ) adsorption |
从图 2可以看出, CS/GO对U (Ⅵ) 的吸附量明显高于CS和GO, pH值对3种材料吸附效果的影响均较大.当pH<5时, 随着pH值的升高, 吸附量逐渐增大.因为pH值较低时, 溶液中大量的H+与UO22+竞争吸附剂上的结合位点, 同时CS和GO表面的活性基团易被质子化而带正电, 增强了CS/GO对UO22+的静电斥力, 故吸附量较低 (郑伟娜等, 2011).随着pH值的升高, CS和GO上游离活性基团 (如—NH2、—COOH等) 的含量逐渐增加, 其络合能力也随之提高.当pH为5~6时, 3种材料的吸附量达到最大值.pH>6时, 吸附量反而减小, 这是由于溶液中UO22+易发生水解, 形成UO2(OH)3-、UO2(OH)42-等络合负离子, 与CS/GO表面活性基团产生静电斥力作用, 阻碍吸附反应的进行;同时溶液中CO32-、HCO3-离子增多, 易与UO22+形成难以被吸附的碳酸铀酰络合物 (Zou et al., 2012).因此CS/GO去除U (Ⅵ) 的最佳pH值选为5.
3.3 投加量对CS/GO吸附U (Ⅵ) 的影响在pH值为5, U (Ⅵ) 初始浓度为10 mg·L-1, 温度为30 ℃, 吸附时间为5 h的条件下, CS/GO投加量 (0.05~0.40 g·L-1) 对吸附效果的影响如图 3所示.
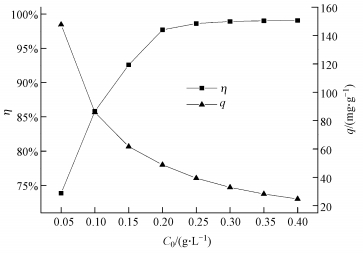 |
| 图 3 CS/GO投加量对U (Ⅵ) 吸附的影响 Fig. 3 Effect of CS/GO dosage on U (Ⅵ) adsorption |
由图 3可知, 随着CS/GO投加量的增加, U (Ⅵ) 的吸附率η逐渐提高, 而吸附量q却逐渐降低.这可能是用量的增加使得CS/GO上活性位点的数目增多, 铀酰离子与活性位点结合概率增大, 故U (Ⅵ) 的吸附率随之上升.当CS/GO投加量较低时, 其表面的氨基、羟基等结合位点能被充分利用, 随着投加量增加, 吸附剂相互碰撞团聚导致活性基团利用率下降, 从而导致吸附量减小 (陈月芳等, 2013).当CS/GO投加量为0.2 g·L-1时, U (Ⅵ) 的吸附率达97.70%, 继续增加投加量, 吸附率增加很小.考虑吸附效果且使吸附剂能被充分利用, 试验中CS/GO的最佳投加量定为0.2 g·L-1.
3.4 反应时间对CS/GO吸附U (Ⅵ) 的影响及动力学分析在pH值为5, CS/GO投加量为0.2 g·L-1, 温度为30 ℃的条件下, 反应时间 (5~420 min) 对初始浓度分别为5、10、15 mg·L-1含铀废水吸附效果的影响如图 4所示.
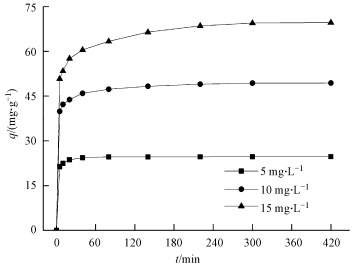 |
| 图 4 反应时间对U (Ⅵ) 吸附的影响 Fig. 4 Effect of time on U (Ⅵ) adsorption |
从图 4可以看出, 在吸附的前5 min, CS/GO对U (Ⅵ) 的吸附量急剧增加, 此后5~300 min吸附量上升减缓, 300 min后吸附趋于平衡.这是由于吸附初期CS/GO上有大量的结合位点, 溶液中UO22+的浓度较高, 使得吸附驱动力较大;而随着吸附的进行, 有效活性位点被不断占据, 吸附驱动力减弱, 导致吸附速率变慢.当吸附时间达到300 min后, CS/GO上的活性位点被基本占据, 吸附达到平衡.因此, 确定最佳吸附时间为5 h.
为了探讨扩散速率与速率控制步骤对CS/GO吸附过程的影响, 分别采用准一级、准二级动力学模型和颗粒内扩散模型对试验数据进行拟合, 结果如表 1所示.由表 1可知, 准二级动力学模型中3个浓度的可决系数R2均大于0.999, 且理论平衡吸附量qe, cal接近实际值qe, exp, 说明准二级动力学模型更适合描述CS/GO对U (Ⅵ) 的吸附过程, 由此表明该吸附为化学吸附, U (Ⅵ) 主要通过化学键合作用结合在CS/GO表面 (季雪琴等, 2016).另外, 颗粒内扩散模型的拟合直线不经过原点, 表明颗粒内扩散不是CS/GO吸附U (Ⅵ) 的速率控制步骤.
| 表 1 吸附动力学参数 Table 1 Kinetic parameters of uranium (Ⅵ) adsorption on CS/GO |
在pH值为5, CS/GO投加量为0.15 g·L-1, 温度分别为20、30、40 ℃, 吸附时间为5 h, U (Ⅵ) 的初始浓度为2、5、10、15、20、30、40、50、70、100 mg·L-1的条件下, CS/GO对U (Ⅵ) 的吸附等温线如图 5所示.
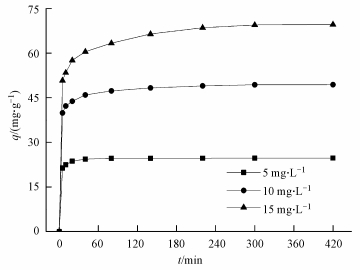 |
| 图 5 CS/GO对U (Ⅵ) 的吸附等温线 Fig. 5 Sorption isotherms of U (Ⅵ) on the CS/GO nanocomposite at different temperatures |
从图 5可以看出, 随着平衡浓度的升高, CS/GO对U (Ⅵ) 的吸附量也逐渐增加, 且吸附效果与温度正相关.采用Langmuir和Freundlich等温吸附方程对吸附过程进行拟合, 结果如表 2所示.由表 2可知, Langmuir等温吸附方程的可决系数R2均大于0.999, 而Freundlich等温吸附方程拟合度较低, 说明CS/GO对U (Ⅵ) 的吸附是单分子层吸附;Freundlich方程中的参数n均大于2, 表明吸附较易 (李凯斌等, 2014);在Langmuir等温吸附方程中, 初始浓度为10 mg·L-1的铀溶液在3个温度下的分离因子RL(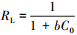
| 表 2 U (Ⅵ) 的等温吸附方程和拟合参数 Table 2 Equations and fitted parameters of adsorption isotherm for U (Ⅵ) |
利用焓变ΔH0、熵变ΔS0和吉布斯自由能变ΔG0来分析温度对CS/GO吸附过程的影响, 计算公式如下:
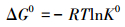
|
(4) |
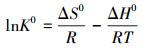
|
(5) |
式中:ΔH0(kJ·mol-1) 和ΔS0(J·mol-1·K-1) 可视为不随温度改变的常数, 不同温度的吸附平衡常数K0可按以下方法 (Al-othman et al., 2011) 计算:在不同温度下分别作lnKd(Kd=qe/Ce) 对Ce的线性图 (如图 6), 当Ce趋近于0时即得到该温度的lnK0.
 |
| 图 6 lnKd与Ce的关系线 Fig. 6 Linear plots of lnKd versus Ce |
再根据方程 (5), 通过lnK0对1/T做图 (图 7), 由拟合直线的斜率和截距分别计算出ΔH0和ΔS0, 计算结果见表 3.
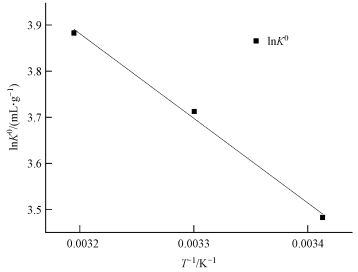 |
| 图 7 lnK0与1/T的关系线 Fig. 7 Linear plot of lnK0 versus 1/T |
| 表 3 CS/GO吸附铀的热力学参数 Table 3 Thermodynamic parameters of U (Ⅵ) adsorption on CS/GO |
由表 3可知, CS/GO对铀的吸附过程中吉布斯自由能变ΔG0均为负值, 表明吸附反应是自发进行的 (Subbaiah et al., 2011);温度越高, ΔG0越小, 说明升温将促进吸附, 这与试验结论相符;焓变ΔH0>0, 说明吸附是吸热反应;熵变ΔS0>0, 表明吸附过程中固液交界面的混乱程度增大, CS/GO对铀酰离子具有一定的亲和作用 (王哲等, 2015).
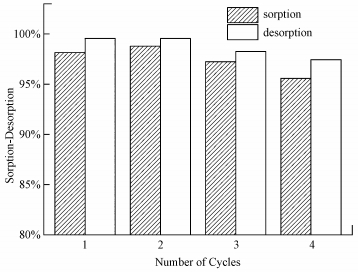
3.6 CS/GO的吸附解吸试验通过解吸试验可以了解吸附剂的循环次数, 以判定其能否重复利用.由前述试验可知, 在强酸条件下, CS/GO对U (Ⅵ) 的吸附率较低, 因此可通过H+与UO22+之间的离子交换作用来对CS/GO进行洗脱.选用0.1 mol·L-1的HCl溶液作解吸剂, 4次吸附/解吸循环下CS/GO对U (Ⅵ) 的吸附率/解吸率如图 8所示.
 |
| 图 8 U (Ⅵ) 的吸附与解吸 Fig. 8 Sorption and desorption of U (Ⅵ) from CS/GO |
由图 8可知, 初次解吸率高达99.55%, 解吸一次后吸附率反而略有增加, 这可能是经HCl处理后, CS/GO表面增加了更多的吸附位点.经4次吸附解吸试验后, CS/GO的吸附率仍高达95%以上, 表明CS/GO具有良好的再生与循环利用性.
3.7 扫描电镜及EDS能谱分析图 9为GO、CS以及CS/GO吸附U (Ⅵ) 前后的扫描电镜图.从图中可以看出, GO呈单层片状结构, 表面光滑, 局部地方出现弯曲和褶皱;CS表面致密均匀, 没有明显的凸起和孔隙;而CS/GO表面粗糙, 凹凸不平, CS与GO结合较为紧密, 材料具有更多的吸附位点和更大的比表面积, 有利于其对铀酰离子的吸附.对比图 9c、d可知, 吸附U (Ⅵ) 后CS/GO的形态结构发生明显变化, 表面变得较平整, 孔隙减少, 这可能是铀酰离子与CS/GO中的有机官能团相互键合的结果 (聂小琴等, 2013).
 |
| 图 9 GO (a)、CS (b) 和CS/GO吸附U (Ⅵ) 前 (c)、后 (d) 的扫描电子显微镜图 Fig. 9 SEM images of GO (a), CS (b), CS/GO before (c) and after (d) adsorption of U (Ⅵ) |
CS/GO吸附U (Ⅵ) 前后的EDS分析结果如图 10所示.从图中可以看出, 吸附前后都有C、N、O、Au存在, 其中Au是照射前的喷金处理导致的, 而壳聚糖和氧化石墨烯中含有大量的C、N、O是图中C、N、O元素含量较高的原因.吸附后材料中出现很强的铀峰, 表明CS/GO对U (Ⅵ) 具有一定的吸附能力.
 |
| 图 10 CS/GO吸附U (Ⅵ) 前 (a)、后 (b) 的X射线能谱分析图 Fig. 10 EDS analysis of CS/GO before (a) and after (b) adsorption of U (Ⅵ) |
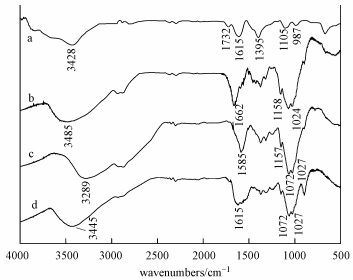
图 11为GO、CS以及CS/GO吸附U (Ⅵ) 前后的红外光谱图, 由谱线a可知, GO在3428 cm-1处有一个宽强峰, 为—OH的的伸缩振动峰;在1732、1615、1395和1105 cm-1处分别是C=O和C=C的伸缩振动峰、叔羟基的特征峰以及环氧基C—O—C的伸缩振动峰 (Yang et al., 2010).CS红外光谱图中3485 cm-1处是—NH2和O—H的伸缩振动重叠峰, 1662 cm-1处则属于“酰胺Ⅰ带”上C=O的伸缩振动峰 (Wang et al., 2009).
 |
| 图 11 GO (a)、CS (b)、CS/GO (c)、CS/GO-U (Ⅵ)(d) 的红外光谱图 Fig. 11 FTIR spectra of GO (a), CS (b), CS/GO (c) and CS/GO after adsorption of U (Ⅵ)(d) |
CS/GO的IR吸收曲线中, 在3289 cm-1处的峰为仲酰胺—NH和—OH相互重叠形成的伸缩振动峰, 该峰相对于CS在3485m-1处的峰出现偏移, 可能是CS上的—NH2与GO的—COOH反应生成酰胺引起的.1585 cm-1处的峰是壳聚糖“酰胺Ⅱ带”烷基伯酰胺—NH2的弯曲振动峰, 1072 cm-1处是GO上环氧基C—O—C和CS上脂肪伯胺C—NH2的重叠峰, 1157 cm-1和1027 cm-1处的峰则分别来自壳聚糖C6位叔醇基团C6—OH和C3位C3—OH的吸收峰, 上述结果表明CS/GO成功合成.
比较CS/GO吸附前后的FTIR结果可知, CS/GO吸附U (Ⅵ) 后有部分峰位置偏移或者强度发生变化.其中, 3289 cm-1处的峰消失, 在3445 cm-1处出现强度减弱的谱峰, 这可能是由于—OH与U (Ⅵ) 通过氢键发生了配位络合, 而酰胺基N—H未参与反应.1585 cm-1处的峰偏移到了1615 cm-1处, 表明烷基伯酰胺—NH2参与了铀的螯合.此外, 1072 cm-1和1027 cm-1处的峰强明显减弱, 说明脂肪伯胺C—NH2和C3—OH基团也参与了U (Ⅵ) 的吸附.以上结果表明, 在CS/GO对U (Ⅵ) 的吸附过程中, 羟基和氨基为主要吸附位点.
3.9 X射线衍射分析在对CS/GO表面形貌和官能团分析的基础上, 利用X-射线衍射对其晶体结构进行表征, 如图 12所示.从图中可以看出, GO在2θ=10.6°处出现了一个反应GO (100) 晶面的特征峰, 说明石墨已经被充分氧化成GO (吴敏杰, 2011).CS在2θ=20.7°的峰对应于壳聚糖的无定形结构.而复合材料CS/GO在2θ为10.6°和20.7°附近的特征衍射峰强度均明显减弱, 这可能是GO和CS之间的相互作用影响了CS分子链在晶格中的排列, 并导致GO不能相互堆积形成有序结构.
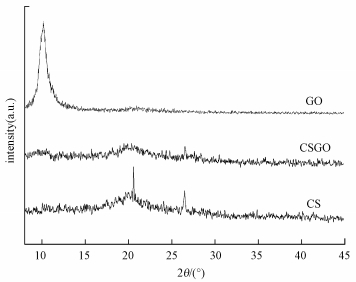 |
| 图 12 GO、CS和CS/GO的XRD图 Fig. 12 XRD patterns of GO, CS and CS/GO |
1) 利用Hummers法合成氧化石墨烯 (GO) 并与壳聚糖 (CS) 进行混合, 经戊二醛交联改性后, 制备得到CS/GO复合材料.
2) CS/GO对U (Ⅵ) 具有良好的吸附性能.当GO质量分数为40%, pH值为5时吸附效果最好, 吸附平衡时间为5 h, 30 ℃时理论饱和吸附量为227.3 mg·g-1.Langmuir等温吸附方程和准二级动力学模型 (R2>0.999) 能较好地拟合CS/GO对U (Ⅵ) 的吸附过程.CS/GO吸附U (Ⅵ) 是自发的吸热反应.吸附解吸试验表明CS/GO具有良好的再生与循环利用性.
3) SEM-EDS、FTIR和XRD分析表明, CS/GO吸附U (Ⅵ) 的过程中, 参与反应的基团主要有羟基和氨基;吸附U (Ⅵ) 后CS/GO表面变得平整光滑, 孔隙明显减少.
| [${referVo.labelOrder}] | Al-othman Z A, Naushad M. 2011. Adsorption thermodynamics of trichloroacetic acid herbicide on polypyrrole Th (Ⅳ) phosphate composite cation-exchanger[J]. Chemical Engineering Journal, 169(1) : 38–42. |
| [${referVo.labelOrder}] | Afsari M, Safdari J, Towfighi J, et al. 2012. The adsorption characteristics of uranium hexafluoride onto activated carbon in vacuum conditions[J]. Annals of Nuclear Energy, 46 : 144–151. DOI:10.1016/j.anucene.2012.03.031 |
| [${referVo.labelOrder}] | 陈月芳, 曹丽霞, 林海, 等. 2013. 中药渣和麦麸对模拟矿山酸性废水中Cu2+的吸附[J]. 中国有色金属学报, 2013, 23(6) : 1775–1782. |
| [${referVo.labelOrder}] | He Y Q, Zhang N N, Wang X D. 2011. Adsorption of grapheme oxide/chitosan porous materials for metal ions[J]. Chinese Chemical Letters, 22(7) : 859–862. DOI:10.1016/j.cclet.2010.12.049 |
| [${referVo.labelOrder}] | 桂珊, 刘贡钢, 姜珩, 等. 2015. 新型多胺羧甲基壳聚糖的合成及对Ni (Ⅱ) 的吸附特性[J]. 化工学报, 2015, 66(5) : 1785–1791. |
| [${referVo.labelOrder}] | 季雪琴, 吕黎, 陈芬, 等. 2016. 秸秆生物炭对有机染料的吸附作用及机制[J]. 环境科学学报, 2016, 36(5) : 1618–1654. |
| [${referVo.labelOrder}] | 李凯斌, 沈一丁, 费贵强, 等. 2014. 阴离子β-环糊精/Fe3O4磁性微球对Cu2+的吸附[J]. 化工学报, 2014, 65(6) : 2148–2155. |
| [${referVo.labelOrder}] | 李小燕, 花明, 刘义保, 等. 2012. 改性玉米芯吸附溶液中U (Ⅵ) 的动力学和热力学[J]. 化工学报, 2012, 63(12) : 4068–4074. |
| [${referVo.labelOrder}] | Liu L, Li C, Bao C L, et al. 2012. Preparation and characterization of chitosan/graphene oxide composites for the adsorption of Au (Ⅲ) and Pd (Ⅱ)[J]. Talanta, 93 : 350–357. DOI:10.1016/j.talanta.2012.02.051 |
| [${referVo.labelOrder}] | Mi X, Huang G B, Xie W S, et al. 2012. Preparation of graphene oxide aerogel and its adsorption for Cu2+ ions[J]. Carbon, 50(13) : 4856–4864. DOI:10.1016/j.carbon.2012.06.013 |
| [${referVo.labelOrder}] | 聂小琴, 董发勤, 刘明学, 等. 2013. 生物吸附剂梧桐树叶对铀的吸附行为研究[J]. 光谱学与光谱分析, 2013, 33(5) : 1290–1294. |
| [${referVo.labelOrder}] | Subbaiah M V, Vijaya Y, Reddy A S, et al. 2011. Equilibrium, kinetic and thermodynamic studies on the biosorption of Cu (Ⅱ) onto Trametes versicolor biomass[J]. Desalination, 276(1) : 310–316. |
| [${referVo.labelOrder}] | Wang G H, Liu J S, Wang X G, et al. 2009. Adsorption of uranium (Ⅵ) from aqueous solution onto cross-linked chitosan[J]. Journal of Hazardous Materials, 168(2) : 1053–1058. |
| [${referVo.labelOrder}] | Wang H, Yuan X Z, Wu Y, et al. 2013. Adsorption characteristics and behaviors of graphene oxide for Zn (Ⅱ) removal from aqueous solution[J]. Applied Surface Science, 279 : 432–440. DOI:10.1016/j.apsusc.2013.04.133 |
| [${referVo.labelOrder}] | 王哲, 易发成, 冯源. 2015. 铀在木纤维上的吸附行为及机理分析[J]. 原子能科学技术, 2015, 49(2) : 263–272. |
| [${referVo.labelOrder}] | 吴敏杰. 2011. 石墨烯制备、表征及其在聚合物复合材料中应用[D]. 杭州: 浙江工业大学. 28-29 |
| [${referVo.labelOrder}] | 谢水波, 冯敏, 杨金辉, 等. 2014. 腐殖酸改性针铁矿对铀U (Ⅵ) 的吸附性能及机理研究[J]. 环境科学学报, 2014, 34(9) : 2271–2278. |
| [${referVo.labelOrder}] | Yang S T, Chang Y L, Wang H F, et al. 2010. Folding/aggregation of graphene oxide and its application in Cu2+ removal[J]. J Colloid Interface Sci, 351(1) : 122–127. DOI:10.1016/j.jcis.2010.07.042 |
| [${referVo.labelOrder}] | Yang X M, Tu Y F, Li L, et al. 2010. Well-dispersed chitosan/graphene oxide nanocomposites[J]. ACS applied materials & interfaces, 2(6) : 1707–1713. |
| [${referVo.labelOrder}] | 曾淦宁, 吴勇, 柳慧敏, 等. 2016. 铜藻基载铁活性炭的制备及其对亚甲基蓝的吸附特性研究[J]. 环境科学学报, 2016, 36(5) : 1655–1662. |
| [${referVo.labelOrder}] | Zhang N N, Qiu H X, Si Y M, et al. 2011. Fabrication of highly porous biodegradable monoliths strengthened by graphene oxide and their adsorption of metal ions[J]. Carbon, 49(3) : 827–837. DOI:10.1016/j.carbon.2010.10.024 |
| [${referVo.labelOrder}] | Zhang X F, Jiao C S, Wang J, et al. 2012. Removal of uranium (Ⅵ) from aqueous solutions by magnetic Schiff base: kinetic and thermodynamic investigation[J]. Chemical Engineering Journal, 198 : 412–419. |
| [${referVo.labelOrder}] | Zhao G X, Wen T, Yang X, et al. 2012. Preconcentration of U (Ⅵ) ions on few-layered graphene oxide nanosheets from aqueous solutions[J]. Dalton Transactions, 41 : 6182–6188. DOI:10.1039/c2dt00054g |
| [${referVo.labelOrder}] | 郑伟娜, 夏良树, 王晓, 等. 2011. 谷壳对铀 (Ⅵ) 的吸附性能及机理研究[J]. 原子能科学技术, 2011, 45(5) : 534–540. |
| [${referVo.labelOrder}] | Zou W H, Zhao L, Zhu L. 2012. Efficient uranium (Ⅵ) biosorption on grapefruit peel: kinetic study and thermodynamic parameters[J]. Journal of Radioanalytical and Nuclear Chemistry, 292(3) : 1303–1315. DOI:10.1007/s10967-011-1602-0 |
 2017, Vol. 37
2017, Vol. 37