2. 大唐南京环保科技有限责任公司, 南京 211111;
3. 山东天璨环保科技有限公司, 淄博 255086;
4. 神华国华太仓发电有限公司, 太仓 215040
2. Datang Nanjing Environmental Protection Technology Co. Ltd., Nanjing 211111;
3. Shandong Gem-sky Environmental Technology Co. Ltd., Zibo 255086;
4. Shenhua Guohua Taicang Power Generation Co. Ltd., Taicang 215040
燃煤电站是人为汞排放污染的主要来源,已对生态环境和人类健康造成了极大危害.汞是一种通过食物链积累的挥发性和持久性的污染物,会对人的神经系统造成破坏(Kim et al., 2010).近年来,SCR脱硝催化剂对单质汞的催化氧化效率研究得到了广泛关注,He等(2014) 发现,CeMnOx/TiO2-柱状-黏土催化剂在100~350 ℃温度范围内对Hg0有着90%的捕获率.Chang等(2015) 合成了一系列的CeMoOx催化剂,在pH=9条件下制备的CeMo(pH9) 催化剂在有HCl(20 mg·L-1)时对Hg0的催化氧化效率接近100%.此外,如MnOx/α-Al2O3、SiO2-TiO2-V2O5和V2O5-WO3/TiO2等(乔少华等, 2009; Li et al., 2011; Busca et al., 1999)体系也得到了研究.但Mn基催化剂活性温度窗口不高,钒钛基催化剂中的活性组分V2O5毒性较大,会造成二次污染.基于此,本研究以自主研发的ATS(Al2TiO5-TiO2-SiO2)蜂窝陶瓷为载体,采用等体积浸渍法制备Ce-Zr-Ox/ATS复合催化剂,在含有HCl气体的模拟烟气中考察负载量、反应温度、空速、SO2、NH3对催化剂的催化氧化性能的影响.
2 材料与方法(Materials and methods) 2.1 催化剂制备Ce/Zr的不同物质的量比均是按照Ce(NO3)3·6H2O(AR级)和Zr(NO3)4·3H2O(AR级)作为Ce源和Zr源来进行计算的.分别将不同物质的量比的Ce源和Zr源溶解于适量去离子水中,磁力搅拌2 h,使得前驱体溶液中的活性物质均匀溶解.ATS瓷片载体经过预处理,浸渍于活性组分前驱体溶液中,室温静置2 h之后在干燥箱中以120 ℃干燥2 h,最后在马弗炉中550 ℃焙烧保温6 h,即得到Ce-Zr-Ox/ATS复合氧化物催化剂样品.
2.2 催化剂表征使用Belsorp mini型比表面积及微孔分析仪,以液氮低温吸附法测定催化剂的表面积及孔径分布,测试样品均在300 ℃温度下抽真空预处理3 h.催化剂样品的XRD晶型分析测试采用Rigaku D max/RB型X射线衍射(XRD)仪,扫描范围为5°~90°,靶材为Cu Kα靶(入射光波长为0.154 nm),扫描速度10°·min-1,扫描步长为0.02°.催化剂样品的表面形貌是在TM3000型扫描电子显微镜上观察的,电子显微镜的加速电压为5~15 kV,扫描倍率为15~30000倍.样品XPS分析是在Thermo ESCALAB 250型X射线光电子能谱仪上进行的, 激发源是单色Al Kα射线,并以C 1s=284.8 eV为基准进行结合能校正.
2.3 实验装置实验装置主要由气路系统、汞渗透发生装置、固定床反应器和测汞仪等部分组成.固定床反应器由温控管式炉和2根石英管(内径为8 mm)组成,其中一根管内填充适量的待测催化剂,另一根作为空白参比管.反应气体由钢瓶内的各单独气体在计算好的流量下通入到混气瓶中进行混合,接着通入到放在管式温控炉中的石英管中,在设定温度下参与催化剂的反应,其中,测试NH3浓度影响时,为防止其与HCl提前反应,NH3由气路直接通到催化剂表面.汞在线检测采用QM201H燃煤烟气测汞仪(苏州市青安仪器有限公司),废气经由KMnO4溶液吸收后排出.
2.4 实验方法据报道(Granite et al., 2000),部分金属氧化物对Hg0有一定的吸附能力,因此,本研究将催化剂样品事先暴露在汞蒸气中一段时间,来排除Hg0的吸附对催化氧化效率的影响.填充10 mL的催化剂样品于反应器中,将其暴露在1.2 L·min-1、汞浓度为35.2 μg·m-3的模拟烟气中15 h,在出口单质汞浓度达到稳定后再进行催化活性测试.催化实验通过改变催化剂负载量、温度、空速、SO2和NH3浓度等参数考察其对催化活性的影响.文中Hg0氧化率Eoxi计算公式如式(1) 所示.
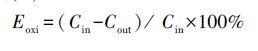
|
(1) |
式中, Cin为参比管出口汞浓度(μg·m-3),Cout为反应器出口汞浓度(μg·m-3).
3 结果与讨论(Results and discussion) 3.1 Ce/Zr比对催化剂催化氧化Hg0的影响经550 ℃保温6 h焙烧制得的Ce-Zr-Ox/ATS复合氧化物催化剂在空速5000 h-1、20 mg·m-3 HCl条件下,对Hg0的氧化率随反应温度的变化曲线见图 1.由图中变化曲线可知,在200~350 ℃区间,催化剂对Hg0的氧化率都在80%以上,350 ℃时催化剂对Hg0的氧化率最高为94.9%.温度较高活性下降可能是因为高温下催化剂会将一部分的NH3氧化,其氧化Hg0的性能会受到影响.由图 1还可知,Ce/Zr比为1∶1的复合氧化物催化剂催化活性明显高于其他比例的催化剂,这可能是由于Ce/Zr比为1∶1的催化剂能很好地形成CexZryO2(x+y)固溶体,因此,选择Ce/Zr比为1∶1作为催化剂的最佳配比.
 |
| 图 1 Ce/Zr不同配比对Hg0催化氧化率的影响 Fig. 1 Effects of Ce/Zr on Hg0 oxidation efficiency |
图 2为550 ℃保温2 h焙烧制得的不同负载量的Ce0.5Zr0.5O2复合氧化物催化剂的活性变化曲线.由图 2可知,Ce0.5Zr0.5O2复合氧化物催化剂的活性随着反应温度的增加呈抛物线变化.在150~250 ℃,Hg0氧化率随温度的升高而上升;在300~350 ℃,催化氧化活性稳定在最高效率;350 ℃以后,Hg0氧化率逐渐下降.由此可见,该复合催化剂活性温度窗口为200~350 ℃.
 |
| 图 2 不同负载量对Ce0.5Zr0.5O2催化剂活性的影响 Fig. 2 Effects of loading rates on Hg0 oxidation efficiency over Ce0.5Zr0.5O2 catalyst |
另外,随着催化剂活性组分负载量的不同,催化剂的催化活性也表现各异.当活性组分负载量达到10%时,催化剂的催化氧化活性最为稳定.当活性组分负载量低于10%时,随着负载量的增加,催化剂在载体表面的单层覆盖率也相应增大,催化活性组分不断增多使得催化活性相应上升.而当负载量达到10%时,活性组分在载体表面的覆盖率接近最高,因而催化活性稳定在最高.然而,随着负载量的进一步增加,催化剂活性出现降低,主要原因可能是负载量增加,铈锆氧化物富集结晶程度增加,比表面积减小,导致催化活性下降.
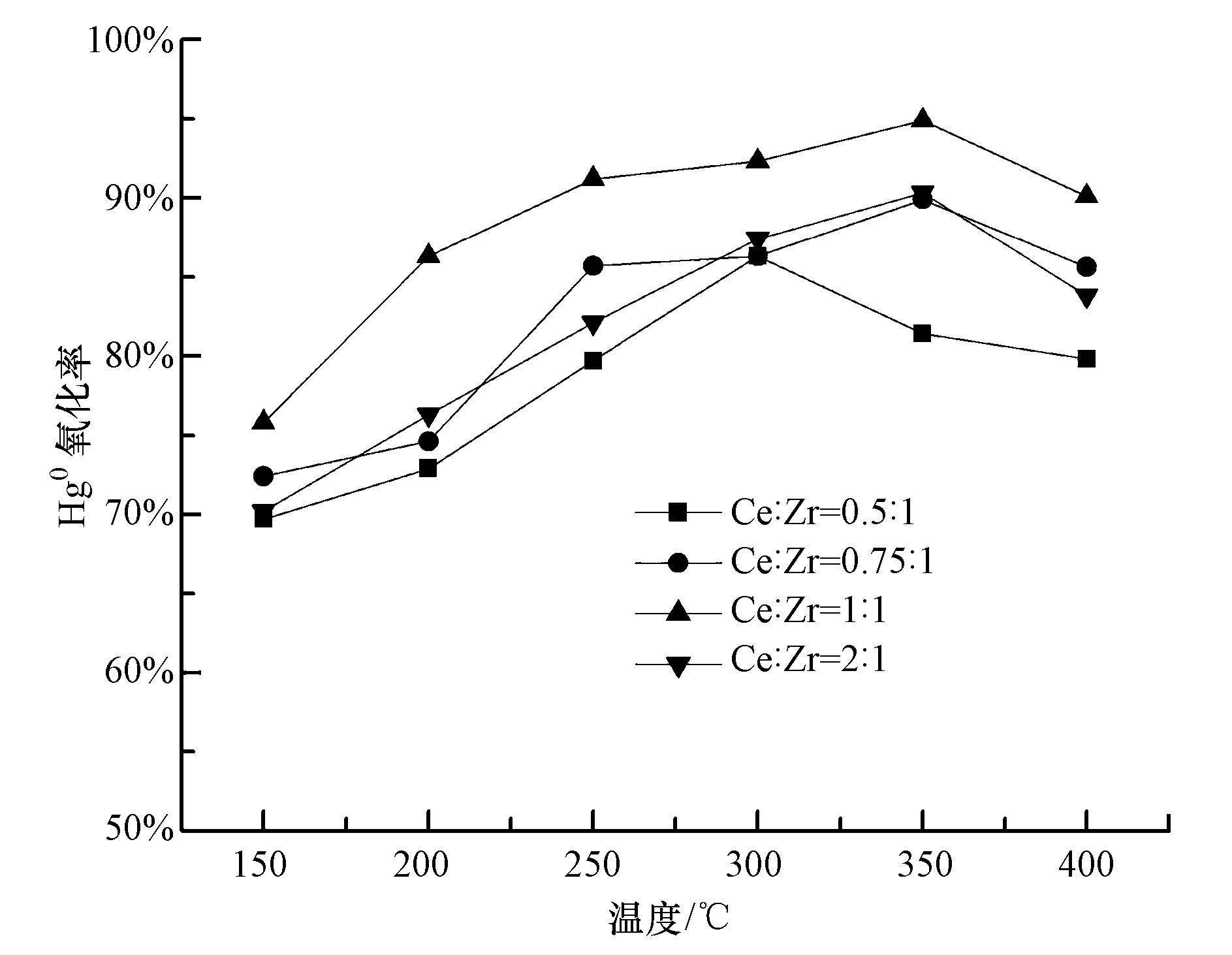
3.3 空速对Hg0氧化的影响图 3为在20 mg·m-3 HCl条件下,10%负载量的Ce0.5Zr0.5O2/ATS复合催化剂对Hg0氧化率随空速的变化曲线.由图 3可知,随空速的增加,Hg0氧化率呈下降趋势.350 ℃时,空速从3000 h-1升至7000 h-1,Hg0氧化率从97.1%下降至87.4%.原因主要是空速较小时,参与反应的气体分子与催化剂表面可以充分接触,气体分子可以很好地扩散到催化剂内孔表面活性位上,催化反应进行完全,Hg0氧化率高;而当空速较大时,气体分子与催化剂的接触时间缩短,部分反应分子扩散不到催化剂内微孔表面活性位上,导致了Hg0氧化率的下降.
 |
| 图 3 空速对Hg0催化氧化率的影响 Fig. 3 Effect of space velocity on Hg0 oxidation efficiency |
在350 ℃下,SO2浓度对10%负载量的Ce0.5Zr0.5O2/ATS复合催化剂催化氧化Hg0效率的影响如图 4所示.由图 4可知,随着SO2浓度的增加,催化剂的催化氧化活性不断下降,当SO2浓度为800 mg·m-3时,催化剂的催化氧化活性下降至64.3%.SO2与HCl在催化剂表面的竞争吸附导致催化剂表面吸附的HCl减少,这可能是SO2抑制催化剂催化氧化活性的主要原因.
 |
| 图 4 SO2对催化剂催化氧化Hg0效率的影响 Fig. 4 Effect of SO2 on Hg0 oxidation efficiency |
在350 ℃下,NH3浓度对10%负载量的Ce0.5Zr0.5O2/ATS复合催化剂催化氧化Hg0效率的影响如图 5所示.由图 5可知,随着NH3浓度的增加,催化剂的催化氧化活性不断下降,当NH3浓度为400 mg·m-3时,催化剂活性降幅达到了30%.研究表明,NH3在催化剂表面的吸附为化学吸附(何明峰等, 2011),比催化剂对Hg0和HCl的吸附性能更强,氨气吸附在催化剂表面的活性位上,占据了单质汞的吸附位,因而减小了单质汞的吸附量,降低了单质汞的催化氧化效率.
 |
| 图 5 NH3对催化剂催化氧化Hg0效率的影响 Fig. 5 Effect of NH3 on Hg0 oxidation efficiency |
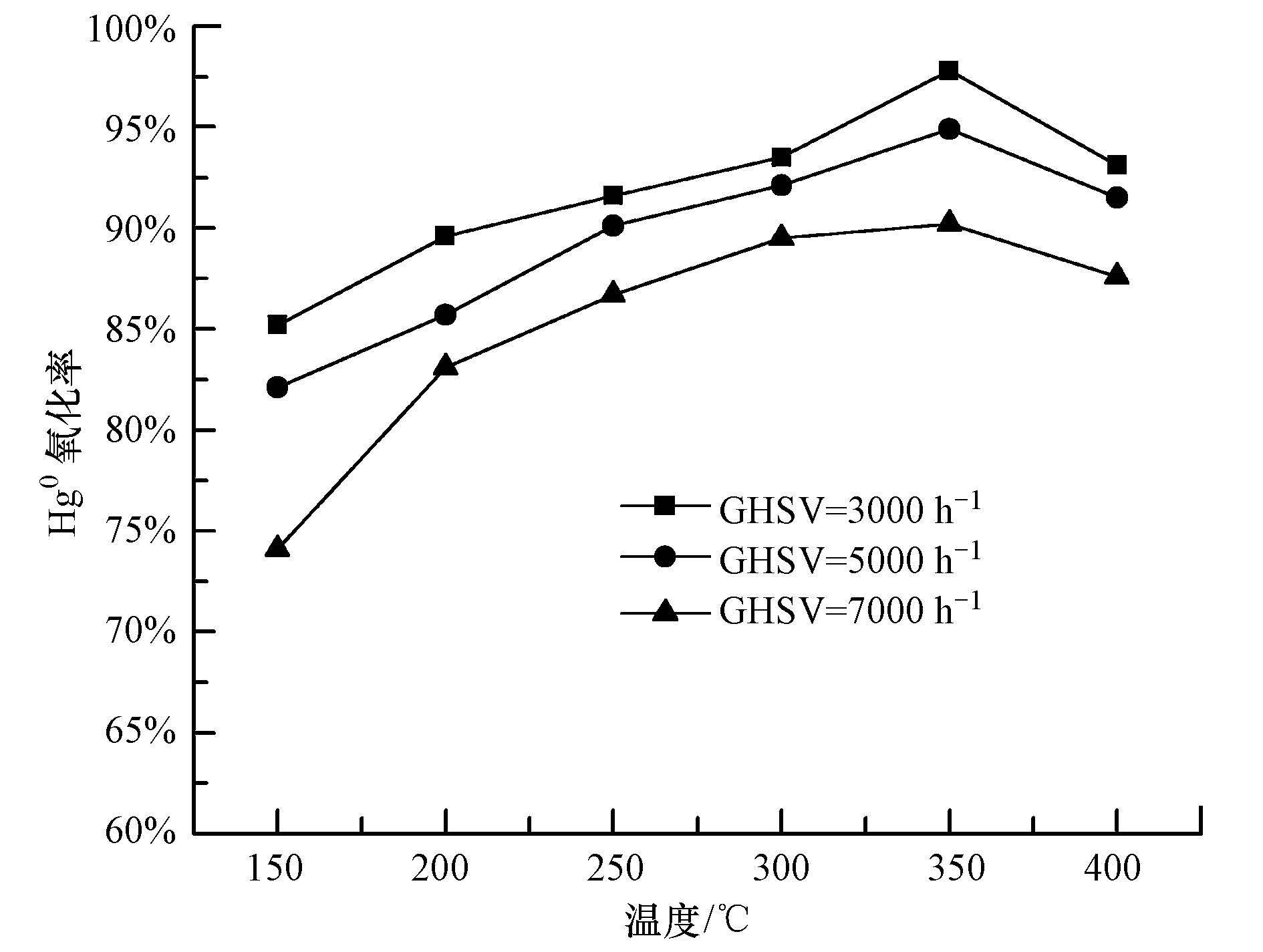
同时通入600 mg·m-3的NH3和SO2条件下,10%负载量的Ce0.5Zr0.5O2/ATS复合催化剂催化氧化Hg0效率的变化如图 6所示.由图 6可知,同时通入NH3和SO2对催化剂的活性影响巨大.200 ℃时,催化活性只有28.4%,随着温度升高,活性呈上升趋势, 350 ℃时达到最高的37.8%, 温度大于350 ℃时,活性开始下降.造成催化剂活性比较低的原因除了上述分析的竞争吸附之外,NH3和SO2反应生成的硫铵盐会覆盖在催化剂表面,大大减小了Hg0的吸附,致使催化活性很低.
 |
| 图 6 NH3和SO2对催化剂催化氧化Hg0效率的影响 Fig. 6 Effect of NH3 and SO2 on Hg0 oxidation efficiency |
经550 ℃焙烧保温2 h制得的Ce/Zr系列复合氧化物催化剂(Ce0.25Zr0.5O1.5、Ce0.75ZrO3.5、Ce0.5Zr0.5O2、Ce0.5Zr0.25O1.5、Ce0.75Zr0.25O2)的比表面积(SBET)和孔容(Vtotal)数据如表 1所示.结果表明,随着Ce含量的逐渐增加,催化剂的比表面积逐渐增大,但孔容和孔径并没有一致的变化.可能原因是铈在此煅烧温度下可以形成稳定结构,而锆比较松散,随着掺杂量的增加,催化剂颗粒不再松散,结构稳定,比表面积不断增大,而孔容孔径的影响因素较复杂,不随比表面积一起变化.该系列催化剂的表面特征与Hg0的氧化率之间没有明显的相关性,这说明比表面积等物理特征对Hg0的脱除不能起决定作用.活性组分覆盖的表面只占催化剂总面积的一部分,同时,催化剂的活性还与活性组分在催化剂表面的分散程度等因素有关.
| 表 1 Ce/Zr系列催化剂的表面性质 Table 1 Surface characterization of Ce/Zr series catalysts |
测试结果表明,Ce0.5Zr0.5O2的催化氧化效率最好,其平均孔径(Dpore)为5.51 nm,在所有样品中处于最小,而Hg0的直径为320 pm,这说明孔径与催化剂吸附Hg0的能力有关.孔径越小,催化剂吸附Hg0的能力越强.
从图 7可以看出,样品的吸附等温线为Langmuir IV型物理吸附等温线,是中孔固体的自由表面上多分子层的物理吸附.样品在低相对压力拐点前为单分子层吸附,中间区域的斜率较小代表多层分散.根据IUPAC关于滞后环的分类来看,样品的滞后环的形状大致与B类回线相近,对应的材料具有片状颗粒松散堆积形成的楔形孔.由于在介孔或大孔中存在毛细凝聚,导致吸附线与脱附线不重合,进而导致滞后环的出现.
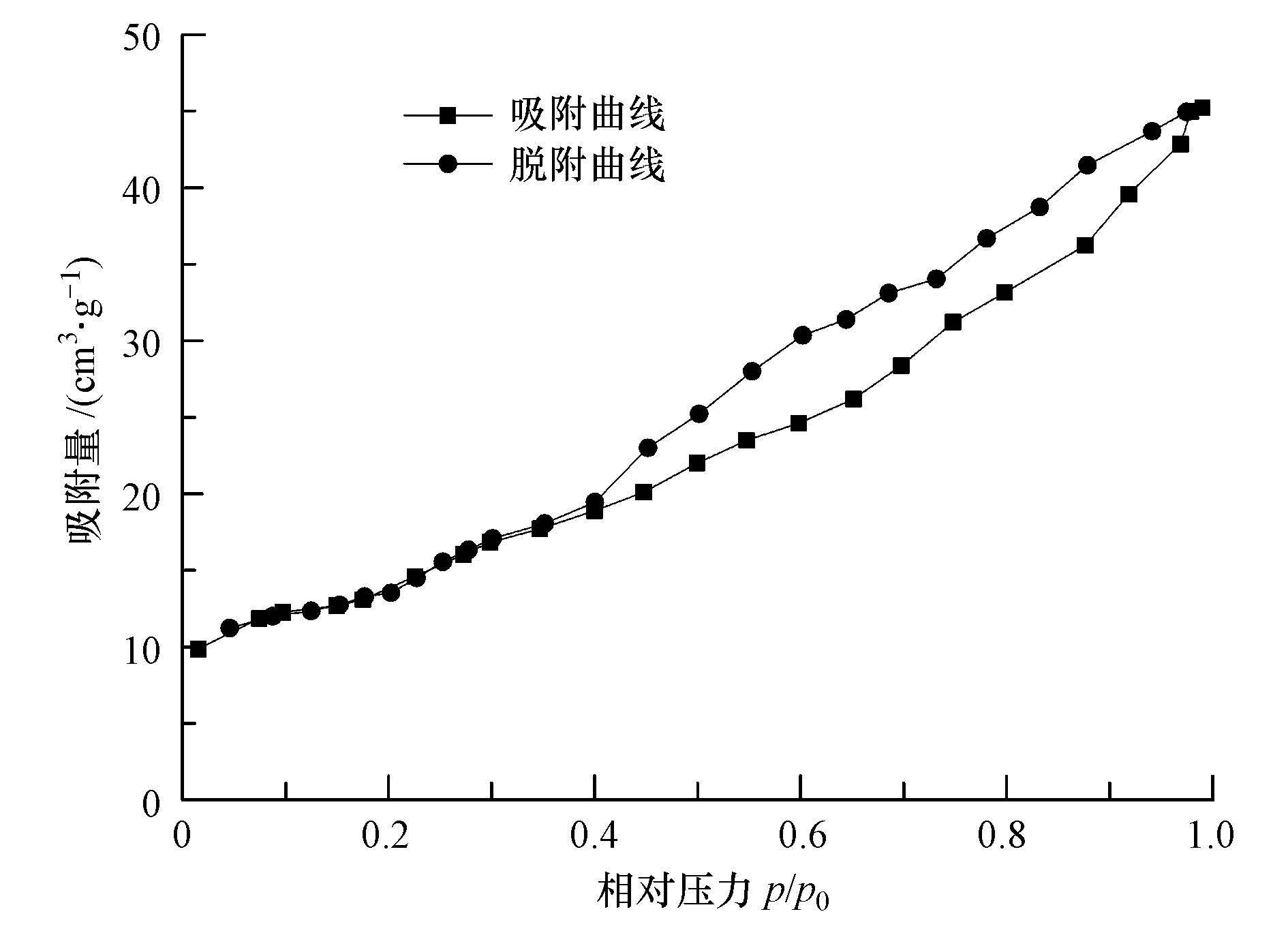 |
| 图 7 催化剂样品的N2吸附/脱附等温线 Fig. 7 N2 adsorption/desorption isotherms of catalyst samples |
图 8是经550 ℃保温2 h焙烧制得的Ce0.5Zr0.5O2混合氧化物催化剂样品的XRD粉末衍射谱图.可以看出,随着锆的加入,CeO2的晶化程度逐渐减弱,主要原因是锆掺杂具有抑制晶核生长和细化晶粒的作用,从而导致无定型相和晶粒细化程度随着锆的掺入而加强.另由图谱分析可知,锆掺杂后,铈锆复合形成了Ce2Zr2O7新相.Ce3+半径(0.118 nm)与Zr4+半径(0.084 nm) 也满足15% <(r1-r2)/r1<30%,因此,在离子尺寸上ZrO2与Ce2O3也具备生成不连续固溶体的条件.由此可推测出催化剂表面形成了Ce2Zr2O7新相的可能反应如式(2) 、(3) 所示(Shen et al., 2012).反应生成的Ce2Zr2O7具有良好的储释氧性能(OSC),对催化剂的催化氧化活性有很好的促进作用.
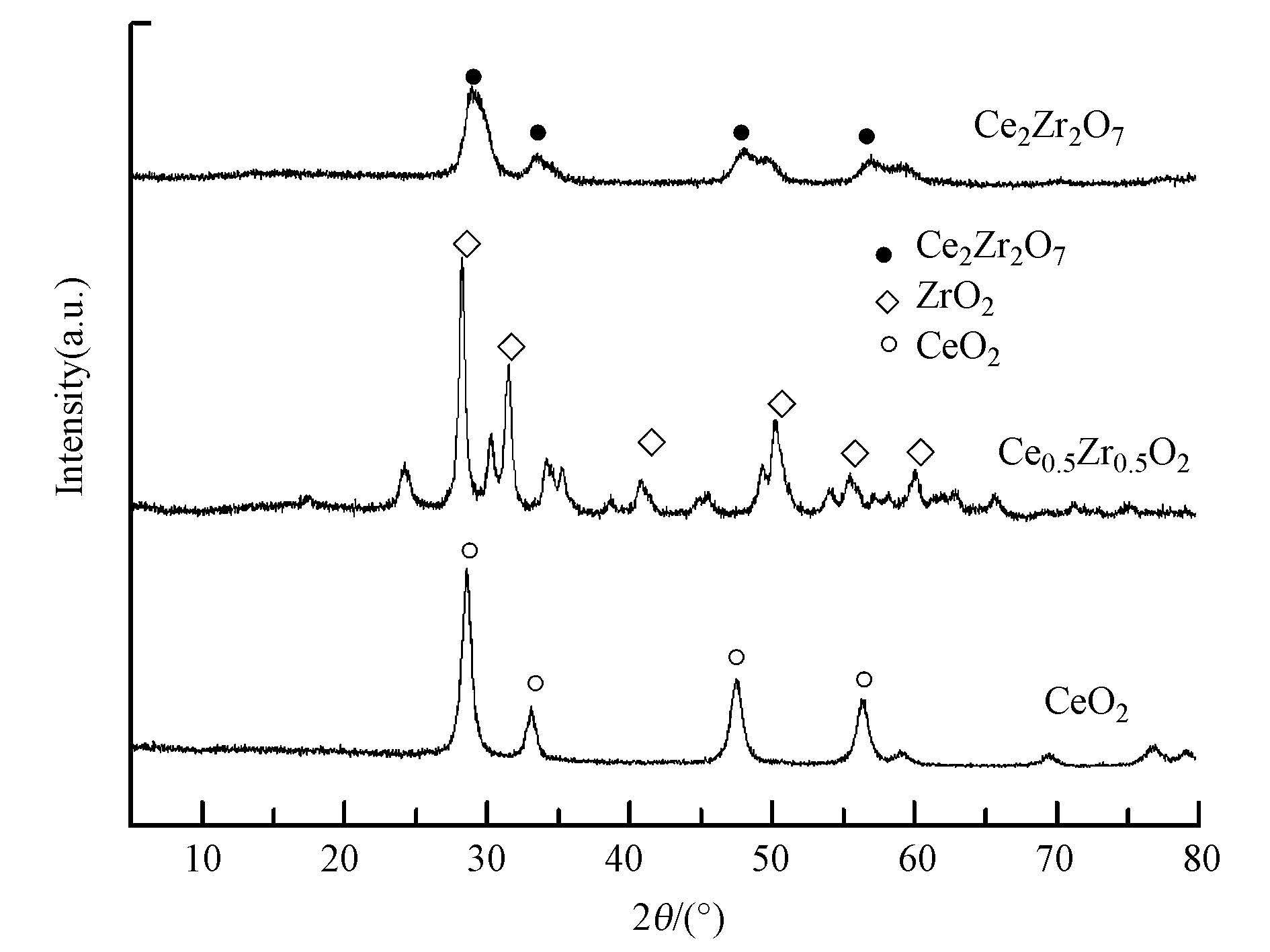 |
| 图 8 催化剂的粉末XRD谱 Fig. 8 Powder X-ray diffraction (XRD) patterns of catalyst |
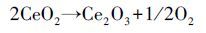
|
(2) |
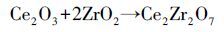
|
(3) |
图 9a显示,ATS载体表面孔洞分布较为均匀,这对活性组分的均匀负载有利,便于提高催化剂的催化氧化性能.从图 9b可以看出,10%负载量的Ce0.5Zr0.5O2/ATS复合催化剂表面没有大颗粒的结晶态氧化物,有研究认为, 锆的掺入能比较好地抑制晶粒生长和细化(沈岳松等, 2009).同时,图中催化剂表面比较粗糙,分层性也比较明显,符合催化活性中心的边缘理论模型(陈进生等, 2008),对Hg0的吸附催化氧化有利.
 |
| 图 9 催化剂载体(a)和催化剂(b)的SEM形貌 Fig. 9 SEM micrographs of catalyst carrier (a) and catalyst (b) |
对照Ce元素的XPS手册可知,Ce 3d的XPS谱(图 10a)的主要峰值表明催化剂表面同时存在Ce4+和Ce3+.谱图的结果还表明,Ce4+是催化剂的主要形态(约占65%~75%),这也同时说明了样品表面没有被完全氧化.尽管Ce4+具有很强的氧化性能,但催化剂表面的Ce3+能形成很强的不饱和键,这可以增加氧的吸附分布,对催化氧化反应的进行是有利的(Benjaram et al., 2003).由图 10b和10c可知,O 1s峰的结合能在530.1 eV,为晶格氧,从电负性的差异来判断,这可以归因于O结合到Ce0.5Zr0.5O2固溶体中(Wagner et al., 1978; Briggs et al., 1990) .
 |
| 图 10 10%负载量的Ce0.5Zr0.5O2/ATS复合催化剂XPS结果 (a. Ce 3d, b. Zr 3d, c. O 1s) Fig. 10 XPS profiles of 10% loading Ce0.5Zr0.5O2/ATS catalyst (a. Ce 3d, b. Zr 3d, c. O 1s) |
对于Ce0.5Zr0.5O2催化剂而言,其催化氧化Hg0可以看作一个氧化还原反应,分2步进行:①Hg0和HCl与CeO2反应,Hg0和HCl被阶段氧化,氧化物被还原;②还原的氧化物在氧的作用下恢复到最初形态.在反应过程中,CeO2可以进行快速的氧化还原循环反应:2CeO2→Ce2O3+1/2O2(Adamowska et al., 2008).
研究证实,在氧化还原条件下,在Ce3+/Ce4+的氧化还原变换过程中,很容易形成活泼的氧空位和迁移能力较强的体相物种(Reddy et al., 2003; Trobarelli et al., 1995).假定直接与氧化有关的氧物种是CeO2催化剂表面上的O2-, 此过程可表述为:
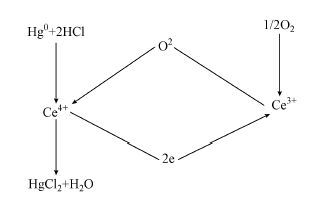
|
(4) |
根据上述归纳,催化剂催化氧化Hg0反应机理符合Langumuir-Hinshelwood机理.具体反应历程为:Hg0和HCl分别吸附在不同Ce4+中心上,HCl吸附形成Cl-,后被与Ce4+相关联的晶格氧氧化成Cl*;Hg0与Cl*形成HgCl*,HgCl*与HCl形成HgCl2.由Ce3+中心转移一个晶格氧到相邻的Ce4+活性位上,同时,Ce4+活性位被还原成了Ce3+活性位,吸附的氧将Ce3+活性位氧化成Ce4+活性位,相应地,吸附氧被还原成O2-,这样通过2CeO2→Ce2O3+1/2O2还原-氧化无限循环重复,使催化氧化反应进行下去.
6 结论(Conclusions)1) 单质汞的催化氧化反应受温度的影响较大,氧化效率在350 ℃时达到最高,最高氧化率为94.7%.
2) Ce-Zr-Ox/ATS催化剂催化活性较强,在200~350 ℃温度区间范围内催化效率保持在80%以上.
3) NH3会抑制Hg0的脱除反应,主要原因是NH3会与Hg0和HCl在催化剂表面产生竞争吸附;SO2对催化氧化反应也具有一定抑制作用,抑制催化剂活性的原因可能是SO2与HCl在催化剂表面活性位上的竞争吸附,因此, 提高催化剂的抗硫和抗氨性能是有待解决的问题.
4) 表征结果说明,催化剂的比表面积及孔容孔径大小不是影响其对Hg0催化氧化性能的主要因素.XRD和XPS表征结果说明,Ce-Zr-Ox可能形成了储释氧能力很强的固溶体,有利于催化剂的化学吸附和催化氧化反应的进行.
| [${referVo.labelOrder}] | Adamowska W, Krzton A, Najbar M, et al. 2008. DRIFT study of the interaction of NO and O2 with the surface of Ce0.62Zr0.38O2 as deNOx catalyst[J]. Catalysis Today, 137(2) : 288–291. |
| [${referVo.labelOrder}] | Busca G,Baldi C M.1999.Pistarino,et al.Evaluation of V2O5-WO3-TiO2 and alternative SCR catalysts in the abatement of VOCs[J].Catalysis Today,53:525-533 |
| [${referVo.labelOrder}] | Briggs D, Seah M P. 1990. Practical Surface Analysis,Auger and X-Ray Photoelectron Spectroscopy (2nd ed.)[M]. New York: Wiley. |
| [${referVo.labelOrder}] | Benjaram M, Ataullah K, Yusuke Y, et al. 2003. Structural characterization of CeO2-TiO2 and V2O5/CeO2-TiO2 catalysts by Raman and XPS techniques[J]. Journal of Physical Chemistry B, 107(22) : 5162–5167. DOI:10.1021/jp0344601 |
| [${referVo.labelOrder}] | Chang H, Wu Q, Zhang T, et al. 2015. Design strategies for CeO2-MoO3 catalysts for DeNO(x) and Hg0 oxidation in the presence of HCl:The significance of the surface acid-base properties[J]. Environmental Science & Technology, 49(20) : 12388–12394. |
| [${referVo.labelOrder}] | 陈进生. 2008. 火电厂烟气脱硝技术-选择性催化还原法[M]. 北京: 中国电力出版社. |
| [${referVo.labelOrder}] | Granite E J, Pennline H W, Hargis R A. 2000. Novel sorbents for mercury removal from flue gas[J]. Industrial and Engineering Chemistry Research, 39(4) : 1020–1029. DOI:10.1021/ie990758v |
| [${referVo.labelOrder}] | He C, Shen B, Chen J, et al. 2014. Adsorption and oxidation of elemental mercury over Ce-MnOx/Ti-PILCs[J]. Environmental Science & Technology, 48(14) : 7891–7898. |
| [${referVo.labelOrder}] | 何明峰.2011.SCR催化剂对燃煤烟气汞的吸附反应机理研究[D].武汉:华中科技大学 |
| [${referVo.labelOrder}] | Kim M H, Ham S W, Lee J B, et al. 2010. Oxidation of gaseous elemental mercury by hydrochloric acid over CuCl2/TiO2-based catalysts in SCR process[J]. Applied Catalysis B:Environmental, 99(1) : 272–278. |
| [${referVo.labelOrder}] | Li H L, Li Y, Wu C Y, et al. 2011. Oxidation and capture of elemental mercury over SiO2-TiO2-V2O5 catalysts in simulated low-rank coal combustion flue gas[J]. Chemical Engineering Journal, 169(1) : 186–193. |
| [${referVo.labelOrder}] | 乔少华, 晏乃强, 陈杰. 2009. MnOx/α-Al2O3催化氧化燃煤烟气中Hg0的试验研究[J]. 中国环境科学, 2009, 29(3) : 237–241. |
| [${referVo.labelOrder}] | Reddy B M, Khan A, Yamada Y, et al. 2003. Structural characterization of CeO2-TiO2 and V2O5/CeO2-TiO2 catalysts by Raman and XPS techniques[J]. Journal of Physical Chemistry B, 107(22) : 5162–5167. DOI:10.1021/jp0344601 |
| [${referVo.labelOrder}] | 沈岳松, 祝社民, 丘泰. 2009. Ti-Zr-V-O复合催化材料的制备及其选择性催化还原NO[J]. 无机材料学报, 2009, 24(3) : 457–462. |
| [${referVo.labelOrder}] | Shen Y, Zhu S. 2012. Deactivation mechanism of potassium additives on Ti0.8Zr0.2Ce0.2O2.4 for NH3-SCR of NO[J]. Catalysis Science & Technology, 2(9) : 1806–1810. |
| [${referVo.labelOrder}] | Trovarelli A, Deleitenburg C, Dolcetti G, et al. 1995. CO2 Methanation under transient and steady-state conditions over Rh/CeO2 and CeO2-promoted Rh/SiO2:The role of surface and bulk ceria[J]. Journal of Catalysis, 151(1) : 111–124. DOI:10.1006/jcat.1995.1014 |
| [${referVo.labelOrder}] | Wagner C D,Riggs W M,Davis L E,et al.1978.//Muilenberg G E.Handbook of X-ray Photoelectron Spectroscopy[M].MN:Perkin-Elmer Corporation.156-162 |
 2017, Vol. 37
2017, Vol. 37


