四氯化碳(CCl4)是一种具有微甜气味的无色液体,不易溶于水,20 ℃时在水中溶解度约为800 mg·L-1,但易溶于有机溶剂(王小呈等,2003;刘永娟等,2005).CCl4曾被广泛用于熏蒸剂、干洗剂、溶剂及灭火器(Alvarado et al., 2010),也是生产氟氯烃的主要原料,在化工、制药、清洗及皮革行业中应用广泛.CCl4可通过挥发、泄露及废水排放等途径进入环境,其化学性质稳定,不容易被分解,会对生态环境产生不可逆的影响;并且易通过皮肤、黏膜吸收进入人体,进而对肝脏等器官产生严重危害(Nada et al., 2010).美国于20世纪70年代开始禁止使用CCl4(Hua et al., 1996),并将其列入129种“水中优先控制污染物黑名单”(刘永娟等,2005).近年来,随着我国工业化程度的不断提高,CCl4造成的环境污染日益引起人们的重视.方生等(2001)检测到山东小清河沿岸500 m地下水中的CCl4浓度高达16~380 μg·L-1;张达政等(2002)于2000年5月-2001年7月对我国某地区浅层地下水在进行了监测,结果表明,CCl4检出率在26.00%~58.06%之间.这些污染状况势必会影响周围居民的生活质量,因此,必须加强对CCl4污染防治的重视.
去除CCl4的传统方法有活性炭吸附、高级氧化技术、空气吹脱及膜分离技术等,但这些方法都存在一定的局限性(高乃云等,2003).1994年Gillham等提出用零价铁(ZVI)还原脱氯(Gillham et al., 1994),随后应用ZVI还原降解包括氯代有机物在内的一系列污染物的研究(Song et al., 2005;Choi et al., 2009)相继展开,其中,包括用ZVI还原三氯乙烯(Chen et al., 2001; Szecsody et al., 2004; Liu et al., 2006)、五氯苯酚(Kim et al., 2000)、杀虫剂(Sayles et al., 1997; Eykholt et al., 1998)及偶氮染料(Nam et al., 2000)等, Amonette (2006)还用ZVI进行CCl4的原位修复,均获得显著效果.对于氯代化合物,主要脱氯反应可以表示为:
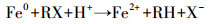
|
(1) |
ZVI方便易得、无毒,可以快速还原卤代烃化合物(Lien et al., 2006).Zhang等曾研究发现,相比普通铁,纳米铁粉对四氯乙烯、二氯乙烯、氯乙烯和三氯乙烯的脱氯效果更显著(Zhang et al., 1998; Lien et al., 2001).但ZVI容易钝化,反应过程中颗粒大小和活性都会对其处理效果产生限制,nZVI相比具有更大的比表面积和更高的表面活性(Lowry et al., 2004),进而在降解卤代烃化合物时可以取得更好的效果.
基于此,本研究采用nZVI降解CCl4,探究不同温度、初始pH、nZVI投加量、CCl4初始浓度对CCl4去除效果的影响,并对nZVI降解CCl4反应动力学、热力学、反应路径和主要产物进行分析.
2 材料与方法(Materials and methods) 2.1 试剂和仪器试剂:FeSO4·7H2O、NaBH4、Na2SO4、Al2(SO4)3、NaCl、AlCl3、乙醇、CCl4等均为分析纯.
仪器:TDL-5离心机,GC-2014气相色谱仪(日本岛津公司),SHA-B恒温水浴振荡器,FA1004分析天平,Aquelix5去离子水制水机,pH仪(赛默飞世尔科技公司),D40-2F型电动搅拌机,HH-S数显恒温油浴锅,LGJ-10D冷冻干燥机,BT100-1J蠕动泵驱动器,ZEISSJSM-6480 LV扫描电镜(德国ZEISS公司).
2.2 纳米零价铁的制备在室温环境下,采用液相还原法制备nZVI颗粒.首先在四口圆底烧瓶反应器中加入浓度为0.04 mol·L-1的FeSO4·7H2O溶液100 mL,通入氮气使之保持无氧状态;将100 mL浓度为0.2 mol·L-1的NaBH4溶液通过蠕动泵以20 r·min-1的速度滴入四口圆底烧瓶中,同时用电动搅拌器以400 r·min-1的转速连续搅拌溶液,反应原理如式(2)所示(Glavee et al., 1995).反应完成后,静置使合成的纳米铁粒子沉淀,然后用去离子水反复洗涤,再用无水乙醇洗涤,最后用冷冻干燥机干燥后密封并在无氧环境中保存备用.
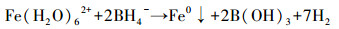
|
(2) |
本实验的反应条件参考已有的文献(张军等,2015;何小娟等,2003)进行.首先配制400 mg·L-1的CCl4储备液,在100 mL反应瓶中加入一定量的CCl4溶液和nZVI,以Teflon丁基塞与铝盖双重密封.设置不同的反应条件,包括初始pH、温度、nZVI投加量和初始CCl4浓度,放置在转速为150 r·min-1的摇床中.在设定的时刻取样,并用0.22 μm的聚四氟乙烯滤膜过滤.
样品中CCl4和中间产物氯仿、二氯甲烷的浓度用气相色谱进行检测.测试条件为:电子捕获检测器(ECD),Rtx-1毛细管色谱柱(美国Restek,30 m×0.25 mm×0.25 μm),以高纯氮为载气,柱箱升温程序为:初始40 ℃保持5 min,以8 ℃·min-1升温到100 ℃后,再以6 ℃·min-1升温至200 ℃,保持10 min,进样口温度220 ℃,检测器温度320 ℃.
3 结果分析(Results and discussion) 3.1 纳米零价铁的表征图 1为自制纳米零价铁的扫描电镜(SEM)结果,可以看出,本次实验所用的自制nZVI为形状规则的颗粒状物质,粒径主要分布在50~200 nm之间,与Shih等(2011)制备的nZVI结果类似(50~100 nm).而且,nZVI由于主要颗粒之间的磁性作用以链状聚集在一起(Zhang et al., 1997).团聚颗粒有明显的表面凹凸性,比表面积较大,一般而言,比表面积越大暴露出来的表面活性位点越多,降解效果也会越好.
 |
| 图 1 nZVI的扫描电镜谱图 Fig. 1 SEM image of nZVI |
在CCl4初始浓度为2.0 mg·L-1,nZVI投加量为1.0 g·L-1,反应温度为30 ℃,初始pH值分别为3、5、7、9的条件下,溶液中CCl4的去除率变化如图 2a所示.由图 2a可以看出,反应进行至10 h,CCl4的降解率分别达到96.7%、95.0%、92.8%、89.5%,可见nZVI降解CCl4对pH的适应范围比较广.Zhang等(2011)及Leah等(1994)的研究也表明,pH值对ZVI降解CCl4的脱氯效果影响并不明显.
 |
| 图 2 不同pH对nZVI降解CCl4的影响(a)和不同pH下CCl4降解的动力学模拟(b) Fig. 2 Performance (a) and dynamics simulation (b) of CT degradation by nZVI under different pH |
nZVI降解CCl4的反应可以用一级动力学描述,pH值分别为3、5、7、9时的一级动力学模拟结果如图 2b所示,得出的一级动力学速率常数k分别为0.3433、0.2885、0.2663、0.2390 h-1,可见随着pH值增大,反应速率减小.pH=3时反应达到平衡所用时间最短,最终去除率也最高,为96.7%,明显高于普通零价铁还原CCl4时的去除率76.81%(揣小明等,2008).造成这种现象的原因可能是:①在pH较高时,溶液中会形成氢氧化铁附着在nZVI表面,阻碍反应的进行,而酸性环境加速了nZVI表面形成的氧化铁表层的溶解(Yang et al., 2005),产生更多降解CCl4的活性位点,促进了还原脱氯反应的进行;②颗粒越小零价铁的比表面积越大,与CCl4反应界面越多(Cheng et al., 2007),脱氯效果也越好.
3.2.2 溶液温度对CCl4降解的影响在CCl4浓度为2.0 mg·L-1,nZVI投加量为1.0 g·L-1,初始pH=7,反应分别为20、25、30、35和40 ℃的条件下,溶液中CCl4的降解率变化如图 3a所示,5种温度对应的降解率分别为78.4%、82.5%、87.5%、90%和92.2%.可以看出,随着温度升高,CCl4的降解率增大.周红艺等(2004)在研究m-二氯苯的催化脱氯时发现,温度升高脱氯率增加;Wei等(2006)在用双金属Pd/Fe降解2, 4-二氯酚时也发现了这种规律,这些研究均表明温度升高会促进零价铁降解脱氯反应的进行.
 |
| 图 3 不同温度对nZVI降解CCl4的影响(a)及不同温度下CCl4降解的动力学模拟(b) Fig. 3 Performance (a) and dynamics simulation (b) of CT degradation by nZVI under different temperature |
nZVI降解CCl4在5种温度下的动力学模拟结果如图 3b所示,对应的CCl4降解速率常数k分别为0.1555、0.1705、0.209、0.2219和0.2559 h-1,表明温度升高,nZVI降解CCl4的速率加快.
根据阿伦尼乌斯方公式,温度对nZVI降解CCl4的影响可以用下式表示:

|
(3) |
式中,k为降解速率常数(h-1),A为频率因子,Ea为活化能(kJ·mol-1),R为理想气体常数(J·mol-1·K-1),T为温度(K).再结合艾琳公式(4)和吉布斯自由能的定义公式(5),分别计算出该反应的活化能Ea、焓变△ H、熵变△ S和吉布斯自由能△ G(Tang et al., 2010).
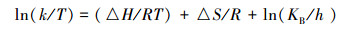
|
(4) |
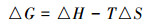
|
(5) |
式中,△ H是焓变(kJ·mol-1),△ S是熵变(kJ·mol-1),KB是玻尔兹曼常数.
对ln k和1/ T作图,结果如图 4a所示;对ln (k/ T)和1/ T作图,结果如图 4b所示.通过斜率和截距可以得出活化能Ea、焓变△ H和熵变△ S的值,最终得出每种温度下反应的吉布斯自由能△ G,结果如表 1所示.其中,活化能Ea仅为19.22 kJ·mol-1,活化能较低,表明发生反应需要的能量低,反应易于进行.
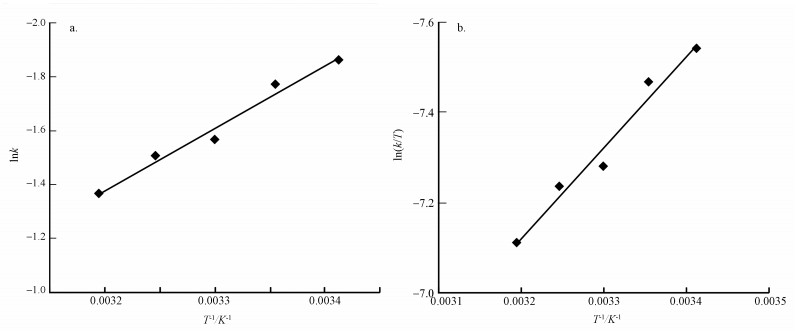 |
| 图 4 CCl4降解的热力学分析(a. ln k-T拟合曲线, b. ln (k/ T)-T拟合曲线) Fig. 4 Thermodynamic analysis of the degradation of CT |
| 表 1 CCl4降解的热力学计算参数值 Table 1 Results of activation thermodynamics for CT degradation |
CCl4初始浓度为2.0 mg·L-1,初始pH=7,温度为30 ℃,设置nZVI的投加量分别为0.5、0.7、1.0和1.2 g·L-1,溶液中CCl4的降解率变化如图 5a所示.可见,在nZVI投加量低于1.0 g·L-1时, 随着nZVI投加量增大,CCl4的降解率也随之增加,但当nZVI投加量高于1.0 g·L-1时最终CCl4的降解率相似.不同nZVI投加量下的动力学模拟曲线如图 5b所示,对应的CCl4降解速率常数k分别为0.5、0.7、1.0和1.2 h-1.可见,反应速率是随着nZVI投加量的增加而增大的,这可能是由于nZVI投加量增加,总表面积增大,提高了CCl4与nZVI的接触几率,提供了更多自由电子用于CCl4的还原脱氯(胡劲召等,2005).但在nZVI投加量大于1.0 g·L-1时,CCl4降解率近似,说明1.0 g·L-1的nZVI已经与溶液中的大部分CCl4反应,投加量超过1.0 g·L-1时过量的铁粉会吸附凝聚(那娟娟,2006),故增大投加量并没有显著提高其降解率.因此,在该条件下为避免nZVI浪费和损失,投加量宜设为1.0 g·L-1.由此可知,在用nZVI去除CCl4的应用中最佳nZVI投配比即nZVI与CCl4质量比约为500:1.
 |
| 图 5 nZVI投加量对CCl4降解的影响(a)和不同nZVI投加量下CCl4降解的动力学模拟(b) Fig. 5 Performance (a) and dynamics simulation (b) of CT degradation by nZVI under different nZVI dosage |
在nZVI投加量为1.0 g·L-1,初始pH=7,温度30 ℃,改变CCl4初始浓度分别为1.0、2.0、3.0和4.0 mg·L-1的条件下,溶液中CCl4的降解率如图 6a所示.不同CCl4初始浓度下的一级动力学模拟曲线如图 6b所示,对应的降解CCl4速率常数k分别为0.3120、0.2973、0.2539、0.1902 h-1.可见,反应速率是随CCl4初始浓度的升高而降低的,随nZVI投配比的降低而降低.而且随着CCl4初始浓度的增大,CCl4的降解率减小,当CCl4浓度在3.0 mg·L-1以下时,至反应10 h时CCl4降解率都在90%以上,而浓度为4.0 mg·L-1时,相同时间内的降解率为80%左右,这与曾爱斌等(2006)的研究结果一致.表明CCl4浓度大于3.0 mg·L-1时,nZVI的活性位点相对不足(William et al., 2000),致使还原脱氯效率不能持续增长.
 |
| 图 6 CCl4初始浓度对反应的影响(a)和不同CCl4初始浓度下CCl4降解的动力学模拟(b) Fig. 6 Effect of initial concentration of CT on the reaction (a) and dynamics simulation of CT degradation in different initial concentration of CT (b) |
在温度30 ℃、pH=7、nZVI投加量为1.0 g·L-1、CCl4初始浓度为2.0 mg·L-1的条件下,分析降解中间产物及可能的反应路径.反应至10 h,溶液中CCl4、氯仿(CF)及总碳平衡如图 7所示.其中,CCl4浓度明显降低,氯仿浓度升高,6 h后观察到有少量的二氯甲烷产生,但浓度很低.前4 h氯仿增长速度较快,可能是由于氯仿与nZVI之间亦存在相互作用,但现有的nZVI投加量不足以继续降解氯仿,因此,溶液中仅检测到极少量的二氯甲烷.此外,溶液中还检测到许多游离的二价铁离子,浓度约为0.6 g·L-1.综上,根据CCl4、氯仿及总碳平衡可以推断发生的主要反应如式(6),这与其他学者(Lowry et al., 2004; Matheson et al., 1994; Lien et al., 2001)研究的零价铁降解氯代化合物的结果类似.

|
(6) |
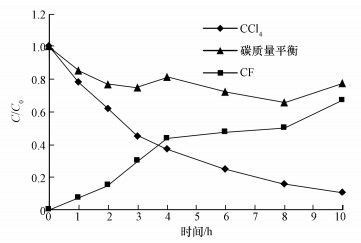 |
| 图 7 溶液中CCl4和氯仿浓度变化及碳质量平衡 Fig. 7 CCl4 and CF change and carbon mass balanced in solution |
1)采用自制nZVI降解CCl4,发现降解效果明显.其中,温度在20~30 ℃之间时,每升高5 ℃,CCl4降解率提高4.1%~5.0%;温度在30~40 ℃之间时,每升高5 ℃,CCl4降解率提高2.2%~2.5%,所以最佳反应温度为30 ℃.nZVI投加量在0.5~1.0 g·L-1之间时,浓度每增加0.2 g·L-1,CCl4降解率提高6.0%~9.1%;nZVI投加量在1.0~1.2 g·L-1之间时,浓度增加0.2 g·L-1,CCl4降解率提高2.6%,故应用自制nZVI去除CCl4的最佳投配比约为500:1.CCl4初始浓度为1.0和2.0 mg·L-1时,CCl4降解率相似,初始浓度增加到3.0和4.0 mg·L-1时,CCl4降解率分别下降4.2%和13.8%,因而在同等nZVI投加量下CCl4初始浓度不宜高于3.0 mg·L-1.pH值对CCl4降解效果影响不大.实验获得的最佳反应条件为:30 ℃,初始pH=3,CCl4初始浓度2.0 mg·L-1,nZVI投加量1.0 g·L-1,CCl4的降解率高达96.7%.
2) nZVI具有较大的比表面积,在降解CCl4的过程中可以发挥较好的活性.而且,nZVI降解CCl4的反应符合一级动力学,反应活化能较低,说明该反应容易发生.
3)通过分析中间产物发现,本研究的主要中间产物为氯仿,仍具有一定的毒性,对环境依然存在威胁,因此,有必要进一步研究将CCl4降解为无毒产物的方法.
| [${referVo.labelOrder}] | Amonette J E. 2006. Reductive degradation of carbon tetrachloride by iron:Progress and prognosis[J]. American Chemical Society, 85(2) : 170–186. |
| [${referVo.labelOrder}] | Alvarado J S, Rose C, et al. 2010. Degradation of carbon tetrachloride in the presence of zero-valent iron[J]. Journal of Environmental Monitoring, 12(8) : 1524–1530. DOI:10.1039/c0em00039f |
| [${referVo.labelOrder}] | 揣小明, 单爱琴, 刘敬武, 等. 2008. 利用零价铁去除四氯化碳的批实验研究[J]. 农业环境科学学报, 2008, 27(2) : 762–766. |
| [${referVo.labelOrder}] | Chen J L, Al-Abed S R, Ryan J A, et al. 2001. Effect of pH on dechlorination of trichloroethylene by zero-valent iron[J]. Journal of Hazardous Materials, 83(3) : 243–254. DOI:10.1016/S0304-3894(01)00193-5 |
| [${referVo.labelOrder}] | Choi J, Choi K, Lee W. 2009. Effects of transition metal and sulfide on the reductive dechlorination of carbon tetrachloride and 1, 1, 1-trichloroethane by FeS[J]. Journal of Hazardous Materials, 162(2) : 1151–1158. |
| [${referVo.labelOrder}] | Cheng R, Wang J L, Zhang W X. 2007. Comparison of reductive dechlorination of p-chlorophenol using Fe0 and nanosized Fe0[J]. Journal of Hazardous Materials, 144(1) : 334–339. |
| [${referVo.labelOrder}] | Eykholt G R, Davenport D T. 1998. Dechlorination of the chloroacetanilide herbicides alachlor and metolachlor by iron metal[J]. Environmental Science and Technology, 32(10) : 1482–1487. DOI:10.1021/es970678n |
| [${referVo.labelOrder}] | 方生, 陈秀玲. 2001. 地下水开发引起的环境问题与治理[J]. 地下水, 2001, 23(1) : 8–11. |
| [${referVo.labelOrder}] | 高乃云, 李富生, 汤浅晶, 等. 2003. 水中三氯乙烯的去除研究进展[J]. 工业水处理, 2003, 23(9) : 14–17. |
| [${referVo.labelOrder}] | Gillham R W, Blowes D W, OHannesin S F, et al. 1994. Use of Zero-Valent Metals in in-situ Remediation of Contaminated Ground Water[M]. Columbus, OH: Battelle Press: 1–5. |
| [${referVo.labelOrder}] | Glavee G N, Klabunde K J, Sorensen C M, et al. 1995. Chemistry of borohydride reduction of iron (Ⅲ) ions in aqueous and nonaqueous media-formation of nanoscale Fe, FeB and Fe2B powders[J]. Inorganic Chemistry, 34(1) : 28–35. DOI:10.1021/ic00105a009 |
| [${referVo.labelOrder}] | Hong S H, Kwon B H, Lee J K. 2008. Degradation of 2-chlorophenol by Fenton and photo-Fenton processes[J]. Korean Journal of Chemical Engineering, 25(1) : 46–52. DOI:10.1007/s11814-008-0008-3 |
| [${referVo.labelOrder}] | Hua I, Hoffmann M R. 1996. Kinetics and mechanism of the sonolytic degradation of CCl4 intermediates and byproducts[J]. Environmental Science & Technology, 30(3) : 864–871. |
| [${referVo.labelOrder}] | 胡劲召, 陈少瑾, 吴双桃, 等. 2005. 零价铁对土壤中4-氯苯酚还原脱氯研究[J]. 生态环境, 2005, 14(3) : 349–352. |
| [${referVo.labelOrder}] | 何小娟, 刘菲, 黄园英, 等. 2003. 利用零价铁去除挥发性氯代脂肪烃的试验[J]. 环境科学, 2003, 24(1) : 139–142. |
| [${referVo.labelOrder}] | Kim Y H, Carraway E R. 2000. Dechlorination of penta-chlorophenol by zerovalent iron and modified zero valent irons[J]. Environmental Science and Technology, 34(10) : 2014–2017. DOI:10.1021/es991129f |
| [${referVo.labelOrder}] | Lowry G V, Johnson K M. 2004. Congener-specific dechlorination of dissolved PCBs by microscale and nanoscale zerovalent iron in a water/methanol solution[J]. Environmental Science and Technology, 38(19) : 5208–5216. DOI:10.1021/es049835q |
| [${referVo.labelOrder}] | Lien H L, Elliott D W, Sun Y P, et al. 2006. Recent progress in zero-valent iron nanoparticles for groundwater remediation[J]. Journal of Environmental Engineering and Management, 16(6) : 371–380. |
| [${referVo.labelOrder}] | Lien H L, Zhang W X. 2001. Nanoscale iron particles for complete reduction of chlorinated ethenes[J]. Colloid and Surfaces A:Physicochemical and Engineering Aspects, 191(1) : 97–105. |
| [${referVo.labelOrder}] | Lien H L, Zhang W X. 2001. Nanoscale iron particles for complete reduction of chlorinated ethenes[J]. Colloids and Surafaces A:Physicochemical and Engineering Aspects, 191(1) : 97–105. |
| [${referVo.labelOrder}] | Leah J M, Panl G T. 1994. Reductive dehalogenation of chlorinated methanes by iron metal[J]. Environmenial Science & Technology, 28(12) : 2045–2053. |
| [${referVo.labelOrder}] | Liu C C, Tseng D H, Wang C Y. 2006. Effects of ferrous ions on the reductive dechlorination of trichloroethylene by zero-valent iron[J]. Journal ofHazardous Materials, 136(3) : 706–713. DOI:10.1016/j.jhazmat.2005.12.045 |
| [${referVo.labelOrder}] | 刘永娟, 韩宝平, 王小英. 2005. 地下水四氯化碳污染现状与治理技术研究进展[J]. 水资源保护, 2005, 21(2) : 5–8. |
| [${referVo.labelOrder}] | Nada S A, Omara E A, Zahran H G, et al. 2010. Mushroom insoluble polysaccharides prevent carbon tetrachloride-induced hepatotoxicity in rat[J]. Food and Chemical Toxicology, 48(11) : 3184–3188. DOI:10.1016/j.fct.2010.08.019 |
| [${referVo.labelOrder}] | 那娟娟.2006.纳米铁粉脱氯降解四氯化碳和四氯乙烯的研究[D].成都:四川大学.34-35 |
| [${referVo.labelOrder}] | Nam S, Tratnyek P G. 2000. Reduction of azo dyes with zero-valent iron[J]. Water Research, 34(6) : 1837–1845. DOI:10.1016/S0043-1354(99)00331-0 |
| [${referVo.labelOrder}] | Sayles G D, You G, Wang M, et al. 1997. DDT, DDD, and DDE dechlorination by zero-valent iron[J]. Environmental Science and Technology, 31(12) : 3448–3454. DOI:10.1021/es9701669 |
| [${referVo.labelOrder}] | Song H, Elizabeth R. 2005. Reduction of chlorinated ethanes by nanosized zero-valent iron:kinetic, pathway, and effects of reaction conditions[J]. Carraway Environmental Science & Technolog, 39(16) : 6237–6245. |
| [${referVo.labelOrder}] | Szecsody J E, Fruchter J S, Wiliams M D, et al. 2004. In situ chemical reduction of aquifer sediments:enhancement of reactive iron phases and TCE dechlorination[J]. Environmental Science and Technology, 38(17) : 4656–4663. DOI:10.1021/es034756k |
| [${referVo.labelOrder}] | Shih Y, Hsu C, Su Y. 2011. Reduction of hexachlorobenzene by nanoscale zero-valent iron:Kinetics, pH effect, and degradation mechanism[J]. Separation and Purification Technology, 76(3) : 268–274. DOI:10.1016/j.seppur.2010.10.015 |
| [${referVo.labelOrder}] | Tang S, Yang Q, Shang H T. 2010. Removal of nitrate by auto sulfurotrophic denitrifying bacteria:optimization, kinetics and thermodynamics study[J]. Fresenius Environmental Bulletin, 19(12) : 3193–3198. |
| [${referVo.labelOrder}] | 王小呈, 汤月明. 2003. 我国四氯化碳现状和出路[J]. 中国氯碱, 2003(4) : 20–23, 37. |
| [${referVo.labelOrder}] | Wei J J, Xu X H, Liu Y, et al. 2006. Catalytic hydrodechlorination of 2, 4-dichlorophenol over nanoscale Pd/Fe:Reaetion pathway and some experimental parameters[J]. Water Research, 40(2) : 348–354. DOI:10.1016/j.watres.2005.10.017 |
| [${referVo.labelOrder}] | William A A, Roberts A L. 2000. Pathways and kinetics of chlorinated ethylene and chlorinated acetylene reaction with Fe (0) particles[J]. Environmental Science &Technology, 4(9) : 1794–1805. |
| [${referVo.labelOrder}] | 向锋. 1998. 一级动力学反应方程参数估计中若干问题的讨论[J]. 农村生态环境, 1998, 14(3) : 20–25. |
| [${referVo.labelOrder}] | Yang G C C, Lee H L. 2005. Chemical reduction of nitrate by nanosized iron:kinetics and pathways[J]. Water Research, 39(5) : 884–894. DOI:10.1016/j.watres.2004.11.030 |
| [${referVo.labelOrder}] | 曾爱斌, 汪丽娟, 沈卓贤, 等. 2006. 废水中四氯化碳的碱性水解脱氯研究[J]. 沈阳农业大学学报, 2006, 37(4) : 635–638. |
| [${referVo.labelOrder}] | Zhang X L, Deng B L, Guo J, et al. 2011. Ligand-assisted degradation of carbon tetrachloride by microscale zero-valent iron[J]. Journal of Environmental Management, 92(4) : 1328–1333. DOI:10.1016/j.jenvman.2010.12.020 |
| [${referVo.labelOrder}] | 张达政, 陈鸿汉, 李海明, 等. 2002. 浅层地下水卤代烃污染初步研究[J]. 中国地质, 2002, 29(3) : 326–329. |
| [${referVo.labelOrder}] | Zhang W X, Wang C B, Lien H L. 1998. Treatment of chlorinated organic contaminants with nanoscale bimetallic particles[J]. Catalysis Today, 40(4) : 387–395. DOI:10.1016/S0920-5861(98)00067-4 |
| [${referVo.labelOrder}] | 张军, 白孝康, 李晶晶, 等. 2015. 超声协同下镍铁双金属化合物催化降解水溶液中的四氯化碳[J]. 环境工程学报, 2015, 9(4) : 1693–1697. |
| [${referVo.labelOrder}] | Zhang L, Manthiram A. 1997. Chains composed of nanosize metal particles and identifying the factors driving their formation[J]. Applied Physics Letters, 70(18) : 2469–2471. DOI:10.1063/1.118859 |
| [${referVo.labelOrder}] | 周红艺, 徐新华, 汪大翬. 2004. Pd/Fe双金属对水中m-二氯苯的催化脱氯[J]. 化工学报, 2004, 55(21) : 1912–1915. |
 2017, Vol. 37
2017, Vol. 37


