邻苯二甲酸酯(Phthalic Acid Esters, PAEs)作为环境激素中的一类重要化合物, 是目前世界上生产量大、应用面广的人工合成有机化合物之一(张银华等, 1995), 也是引起世界上环境污染和食品安全问题的重要因素之一(Wang et al., 2013).邻苯二甲酸二异辛酯(Di-(2-ethylhexy)-phthalate, DEHP)就是一种典型的邻苯二甲酸酯类物质, 被广泛应用于塑料产品、皮革、建筑材料、个人护理产品、洗涤剂、油漆、药物等产品中(孟雪征等, 2014).DEHP可以通过多种方式危害人体和生物, 对动物的致畸、致癌、致突变以及生理毒性十分明显(White et al., 1995; Kaun Yu et al., 2004; Swan et al., 2008), 目前已被美国环保局(EPA)和中国国家环境监测中心(CNEMC)列为优先控制污染物(刘庆等, 2012).DEHP属于中等极性物质, 蒸气压低, 难溶于水(张蕴晖等, 2003), 进入环境后会强烈地吸附于土壤和沉积物上, 从而影响到它在土壤中的活性和生物有效性(王天竹等, 2010).
土壤是一个组成复杂的微生态系统, 包括有机质、矿物质、微生物等组分.其中, 微生物是土壤中的活性胶体, 比表面大, 代谢活动旺盛, 它们不仅参与土壤有机质的分解, 而且还可作为载体吸附、固定DEHP等有机污染物并对其进行解毒(王宏等, 1995; Aksu et al., 2005; Julinová et al., 2012) .据研究报道, 有机污染物在土壤中的环境行为很大程度上受控于各界面效应的影响, 例如有机质-微生物界面, 有机质-矿物界面, 矿物-微生物界面, 以及土壤-根系界面等(辛佳等, 2013; 刘维屏等, 1996).目前, 对于有机污染物在土壤有机质表面的环境行为研究报道较多, 但就其在土壤矿物-微生物上的分配问题还缺乏系统认知.可见, 针对PAEs在土壤矿物-微生物间的界面行为展开研究具有重要的科学意义.
研究选取DEHP作为目标污染物, 对其在土壤耐性微生物及矿物-微生物界面上的吸附解吸行为进行深入研究.主要内容包括DEHP耐性微生物的分离鉴定、耐性实验、动力学实验、等温吸附实验、pH的影响以及细菌与矿物混合比例对吸附解吸的影响, 从而为揭示土壤中DEHP等PAEs类的矿物-微生物界面行为提供了依据, 为完善其迁移转化规律奠定了理论基础.
2 材料与方法(Materials and methods) 2.1 实验药品与仪器实验药品:邻苯二甲酸二异辛酯(DEHP, 苏州工业园区正兴化工研究院, 化学纯)、正己烷(国药集团化学试剂有限公司)、丙酮(成都市科龙化工试剂厂)、乙酸(国药集团化学试剂有限公司)均为分析纯;傅立叶变换红外用KBr(光谱纯).
无机盐培养基:KH2PO4 0.5 g·L-1、K2HPO4 0.5 g·L-1、MgSO4·7H2O 0.2 g·L-1、CaC12 ·2H2O 0.1 g·L-1、NaCl 0.2 g·L-1、MnSO4·H2O微量0.03 g·L-1、FeSO4·7H2O微量0.03 g·L-1、NH4NO3 1.0 g·L-1、柠檬酸钠5 mmol·L-1(碳源)、蒸馏水1000 mL、pH 7.0~7.5, 若为固体培养基, 则加入1.5%~2.0% 的琼脂, 121 ℃高压锅蒸汽灭菌后备用.
高岭土、蒙脱石:由上海五四化学试剂厂和上海山浦化工有限公司提供.高岭土、蒙脱石均用沉降法提纯得到<2 μm的部分, 用0.45 μm微孔滤膜抽滤, 并用乙醇和超纯水各洗两次, 50 ℃下烘干, 研磨, 过100目筛备用.
针铁矿:按Atkinson等(1967) 的方法在实验室合成针铁矿.在825 mL超纯水中加入50 g Fe(NO3)3·9H2O, 并快速搅拌, 将提前配制的200 mL 2.5 mol·L-1 KOH溶液以5 mL·min-1的速度逐渐滴入, 使溶液pH为12.在60 ℃水浴锅内老化24 h, 沉淀后用KOH溶液(pH=9) 洗涤2次, 再分别用超纯水和95%的CH3OH洗涤3次, 110 ℃下干燥24 h, 过100目筛, 备用.
实验仪器:7890A气相色谱仪(美国安捷伦(Agilent)公司);TGL-16aR 高速冷冻离心机(深圳安亭科学仪器厂);FT-IR 65傅立叶变换红外光谱仪(珀金埃尔默仪器有限公司);SKY-2102摇床(SUKUN, 上海);PHS-3C 精密pH计(上海雷磁精密科学仪器有限公司);KQ-300GDV 超声清洗器(昆山市超声仪器有限公司).
2.2 实验方法 2.2.1 耐性菌株的分离与鉴定以湖南酸性菜园土为研究土壤, 经风干、碾碎、过筛等步骤后, 向其中添加一定量的DEHP储备液, 彻底混合均匀并待溶剂挥发后加入超纯水, 保持土壤含水率为25%~30%, DEHP质量分数为100 mg·kg-1, 并将土壤置于恒温培养箱中黑暗培养7 d, 作为污染土壤样品.
取1 g土壤样品制成悬浊液, 置于摇床上振荡20 min, 取0.2 mL悬浊液涂布于含DEHP浓度为100 mg·L-1的无机盐平板上, 在30 ℃生化培养箱中培养2~3 d, 待菌落长出后, 挑取能够在此浓度下生长的单菌落, 反复划线以进行纯化培养, 从而获得具有DEHP耐性的微生物.
把纯化后的菌体移至无机盐液体培养基中振荡培养(30 ℃, 160 r·min-1), 对分离菌株进行鉴定, 微生物的生理生化鉴定项目及其方法参照《常见细菌系统鉴定方法》16S rDNA分子测序参照文献中的方法(RE 布坎南等, 1984; 东秀株等, 2001).
2.2.2 不同DEHP浓度对Burkholderia sp.生长的影响无机盐培养基中DEHP浓度为0、5、10、20、50和100 mg·L-1, 接种菌液后不同时间取样, 测定菌液在600 nm波长处的吸光度, 确定细菌对不同浓度DEHP的耐性.
2.2.3 吸附实验DEHP唯一碳源证明实验:以DEHP为唯一碳源配置上述无机盐培养基溶液, 观察该菌体生长状况并测定DEHP含量变化.
除特殊说明, 各吸附实验中采用溶液为DEHP浓度5 mg·L-1的无机盐培养基溶液.取5 mL DEHP溶液到10 mL灭菌玻璃试管中, 加入0.2 mL菌液(菌液提前接种培养24 h), 30 ℃、160 r·min-1恒温振荡, 在培养后3、6、9、12、15、18、21、24、27 h取样, 10000 r·min-1离心10 min, 弃去上清液, 加入5 mL正己烷, 旋涡混合萃取, 离心分离后取1 mL上清液用正己烷稀释至气谱测定范围, 利用气相色谱仪测定DEHP的浓度, 每次实验设置3组平行.
等温吸附实验:在相同初始pH、温度条件下, 配制DEHP浓度为1、2、3、4、5、6、8、10 mg·L-1, 吸附15 h后取样分析, 其他操作同吸附动力学实验.
初始pH值影响:用0.5 mol·L-1 HCl或NaOH溶液调节体系pH值为3.0~9.0之间, 培养15 h后取样, 其他实验步骤同上.
2.2.4 细菌与矿物混合比例对吸附能力的影响按照不同的混合比例(菌体所占质量百分比分别为0%、25%、50%、75%、100%)将细菌与矿物加入50 mL玻璃离心管中, 保证其中吸附剂总浓度为0.2 g·L-1, 5 mg·L-1 DEHP溶液浓度的体积为20 mL, 调节体系pH, 30 ℃、160 r·min-1恒温振荡培养15 h后取样, 其它操作同上.
2.2.5 解吸实验将0.2 g·L-1的微生物、矿物及其复合体(混合质量比为1:1) 加入50 mL玻璃离心管中, 加入20 mL浓度为5 mg·L-1的DEHP溶液, 30 ℃、160 r·min-1恒温振荡培养15 h, 离心分离, 弃去上清液, 1组实验同上测吸附量, 1组加入20 mL 0.5 mol·L-1乙酸进行解吸实验, 在30 ℃、160 r·min-1条件下恒温振荡培养24 h后, 离心分离, 加入20 mL正己烷, 经旋涡混合萃取后, 稀释上机测定DEHP的浓度, 每次实验设置3组平行.
2.2.6 傅立叶变换红外光谱(FTIR)分析通过FTIR分析吸附前后官能团和物质结构变化.称取2 mg冷冻干燥后的菌体和吸附DEHP菌体, 在清洁后的玛瑙研钵中加入200 mg光谱纯KBr, 分别充分混匀, 通过压片机压片并放入样品室, 测定红外光谱图.红外光谱记录为4000~450 cm-1, 分辨率为4 cm-1.
2.3 DEHP的分析方法气相色谱条件:HP-5石英弹性毛细管色谱柱(30.0 m × 0.32 mm × 0.25 μm);载气、尾吹气均为高纯度氮气, 载气流量:2 mL·min-1;检测器温度:280 ℃;进样口温度:280 ℃;程序升温条件:初温120 ℃, 保持1 min, 以8 ℃·min-1升温至180 ℃, 保持8 min;尾吹气流速:45 mL·min-1;不分流进样;进样体积1 μL;外标法定量.
3 结果与讨论(Results and discussion) 3.1 耐性菌株的分离与鉴定将分离菌株的16S rDNA序列输入GenBank, 利用BLASTn对所得序列进行相似性搜索和同源性比对, 发现该细菌与伯克霍尔德菌(Burkholderia sp.)的同源性达到了99.9%, 根据16S rDNA比对, 可初步确定该菌(图中Bkc)为伯克霍尔德菌(Burkholderia sp.).采用ClustalX 1.8进行序列匹配分析, 利用DNAStar软件分析该分离菌株的同源性, 通过MEGA 5.0软件, 采用邻接法(Neighbor-Joining method)构建发育进化树如图 1所示.从系统发育树可见, 依据16S rDNA序列的同源性密切程度, Bkc与Burkholderia sp. HSL52亲缘关系最近.
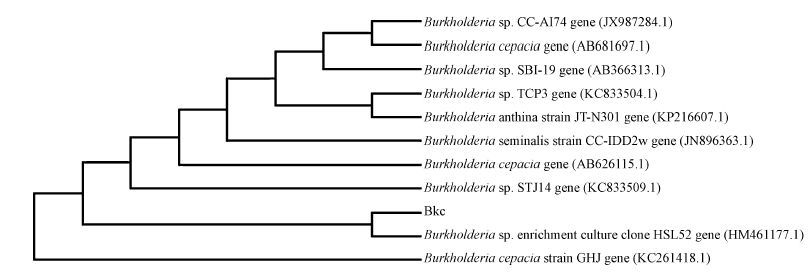 |
| 图 1 菌株Bkc基于部分长度的16S rDNA序列的系统发育树 Fig. 1 Phylogenetic tree derived from 16S rDNA sequence data of strain Bkc and other related species |
图 2为Burkholderia sp.在DEHP浓度为0、5、10、20、50、100 mg·L-1培养基中的生长曲线.从图中可以看出, 菌株在DEHP溶液中表现出长达大约8~9 h的适应期, 10 h左右进入对数生长期, 12 h以后进入减速期增长, 14~16 h左右达到峰值.菌株在DEHP溶液中的生长曲线与空白对照的生长曲线十分相似, 而且随着DEHP浓度的增加, 反而促进了该菌株生长.该结果与王宏等利用降解菌株得到的结果相类似(王宏等, 1995).总而言之, 细菌的生长情况在培养基中DEHP较大浓度变化范围内并未发生明显变化, 充分表明该细菌对DEHP具有较强的耐受性, 为后述实验过程分析提供依据.
 |
| 图 2 不同浓度DEHP 对Burkholderia sp.生长的影响 (A600为分光光度计600 nm波长下细菌培养液的吸光度) Fig. 2 Growth of Burkholderia sp. in the presence of DEHP |
在以DEHP为唯一碳源的无机盐培养基溶液中, Burkholderia sp.无法生长.此外, 在实验进行过程中, DEHP总量并未发生改变, 这表明细菌对DEHP不存在降解作用.
图 3为Burkholderia sp.对DEHP吸附量随时间的变化曲线.在0~5 h内, 细菌的吸附量迅速增加, 而后增加较为缓慢, 在15 h达到峰值, 之后吸附量逐渐减少.对比图 2和图 3可知, 吸附动力学曲线与细菌生长情况曲线之间呈现相似的变化趋势, 处于对数生长期和稳定期的细菌对DEHP的吸附量明显高于在衰亡期时的吸附量, 这充分说明细菌对DEHP的吸附与细菌生长繁殖阶段关系密切.整个吸附过程可分为3个阶段:①上升阶段, 在0~5 h内可完成, 此阶段细菌处于快速繁殖增长阶段, 因此, 对DEHP的吸附量也显著上升;②5~15 h为缓慢递增阶段, 随着细菌分裂变慢, 细菌数增加减缓, 其DEHP吸附量也呈现逐渐上升趋势;③15 h以后进入递减阶段, 在这个时期的细菌大量死亡, 吸附能力显著减弱.基于吸附动力学实验结果, 以下的实验中吸附时间均设定为15 h.
 |
| 图 3 反应时间对细菌DEHP吸附量的影响 Fig. 3 DEHP sorption of the bacteria with the reaction time |
针对吸附过程的作用规律, 利用溶液初始浓度C0与平衡浓度Ce之差计算吸附量Qe.计算公式见式(1) .
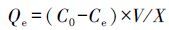
|
(1) |
式中, X为吸附菌体质量(g);V为溶液体积(L);Qe为细菌平衡吸附量(mg·g-1);C0、Ce分别为吸附前后DEHP溶液浓度(mg·L-1).
由于细菌对DEHP表现出较强的耐性, 随着DEHP初始浓度的增加, 细菌的吸附量逐渐变大.由图 4a可知, 在DEHP初始浓度为1 mg·L-1时, 细菌吸附量为2.5 mg·g-1, 在初始浓度为10 mg·L-1时, 细菌的吸附量可达到16 mg·g-1.有研究表明, 两相界面间吸附质浓度差将成为吸附过程的推动力, 吸附质的浓度增加提高了两相界面之间的传质推动力(唐琳等, 2007), 所以溶液中DEHP浓度的增加会引起吸附量的连续增加, 同时可能由于吸附位点的逐渐减少, 细菌的吸附量并未呈现出线性的变化.
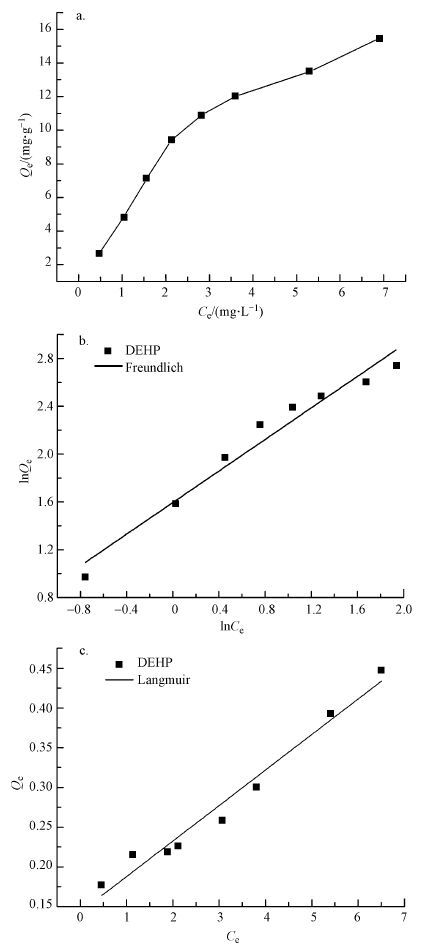 |
| 图 4 DEHP的吸附等温曲线(a)、Langmuir(b)和Freundlich(c)直线型等温线 Fig. 4 Adsorption isothermal curve of DEHP(a), the linear isotherm of Langmuir(b)and Freundlich(c) |
通过对等温吸附的数据进行Langmuir等温吸附模型和Freundlich吸附模型的拟合, 如图 4b、4c所示, 根据拟合参数比较发现, Langmuir吸附模型(R2>0.97) 比Freundlich模型更适用于描述Burkholderia sp.对DEHP的吸附, 其具体参数见表 1.Langmuir吸附等温模型认为吸附质在吸附剂表面的吸附是单分子层的排列(Aksu et al., 1996), 其吸附等温模型见式(2) .
| 表 1 Burkholderia sp.对DEHP的Freundlich和Langmuir吸附等温式的拟合参数表 Table 1 Freundlich and Langmuir Isotherm parameters for the DEHP adsorption onto Burkholderia sp. |

|
(2) |
式中, Qm为单位表面上饱和吸附时的最大吸附量(mg·g-1), b为与结合位点亲和力有关的常数.
经拟合后, 其吸附等温式中饱和吸附量Qm为22.22 mg·g-1, b值为0.31, 其中饱和吸附量明显高于动力学实验中细菌对DEHP的最大吸附量.Burkholderia sp.对DEHP的等温吸附模型符合Langmuir吸附等温线, 表明该菌对于DEHP为单分子层吸附, 其表面所有的吸附位点对DEHP影响相同, 在后述FTIR分析中将有所体现.
3.4 初始pH的影响由于pH对细菌表面电性、疏水性等表面性质、细胞壁上的活性基团、细胞膜的通透性产生较大影响, 从而对于细菌的吸附行为会产生巨大影响(陈燕飞等, 2009; Husmark et al., 1990; van der Wal et al., 1997), 所以研究不同初始pH值对于微生物吸附DEHP的影响显得尤为重要.在初始pH为3.0~9.0, Burkholderia sp.对DEHP的吸附量呈现以下变化趋势(图 5):在pH为7.0~8.0时, 细菌对DEHP的吸附能力最强, 吸附量为13~15 mg·g-1左右;而在酸性和碱性条件下, 吸附量都会出现降低的趋势.当pH从7.0变化到4.0时, 吸附量下降了约3 mg·g-1;当pH从8.0变化为9.0时, 细菌对DEHP的吸附量从14.1 mg·g-1降低到10.8 mg·g-1, 下降十分明显.由此可以看出Burkholderia sp.对DEHP的吸附在碱性环境下更为敏感, 其吸附量变化幅度较酸性条件更为明显.
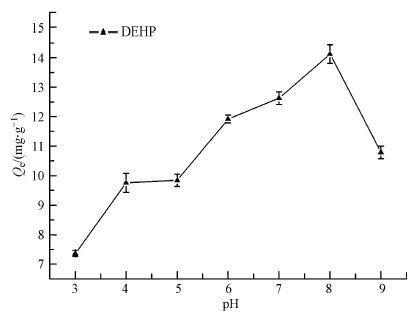 |
| 图 5 初始pH对Burkholderia sp.吸附DEHP的影响 Fig. 5 Effect of initial pH on sorption capacity of DEHP by Burkholderia sp. |
根据相关研究, pH主要影响细菌表面的电荷、酶的活性变化和目标物质的赋存状态( Julinová et al., 2012) , 因而对微生物与DEHP之间的亲和力产生影响.对于碱性条件较酸性条件变化更大, 主要源于细菌的表面电荷、等电位点、疏水性质等发生了不同类型的变化, 导致其细菌表面结构和细菌细胞壁的通透性发生不同程度的改变(Husmark et al., 1990; van der Wal et al., 1997);此外, 由于细菌是由酸性土壤中进行分离纯化, 酸性对其体内酶的活性影响较小, 细菌在pH较低情况下的适应性更强, 因此在碱性条件下相对于酸性条件对DEHP吸附行为产生的影响更明显.
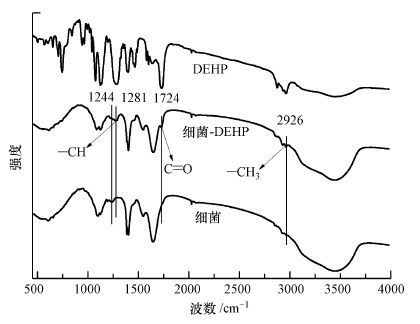
3.5 傅立叶变换红外光谱(FTIR)测定利用傅立叶变换红外光谱对DEHP以及吸附前后的菌体进行分析, 得到的红外光谱如图 6所示.在1724 cm-1和1281 cm-1处出现的新吸收峰, 经Hong等(1999) 证明这两个基团是PAHs类物质的特征基团, 它们分别代表酯基团和—CH基团(许辅乾等, 2014).而2926 cm-1和2960 cm-1的谱峰分别来自蛋白质和脂类的—CH2和—CH3的不对称伸缩振动, 是典型的脂碳链的C—H键的伸展振动吸收带, 它反映了脂肪酸、各种膜和细胞壁组分的亲水脂分子的信息(代群威等, 2009).由图中可以看出细菌的—CH吸收峰从1244 cm-1迁移到1281 cm-1, 以及2926 cm-1波峰的出现, 结合Langmuir吸附等温模型分析, 细菌表面均匀分布的基团如细菌表面蛋白质和脂类成分C—H键在细菌吸附DEHP过程中发挥了重要作用, 同时在吸附过程中, DEHP结合细菌表面基团形成了酯键.其中, 疏水性作用是微生物吸附有机物的主要因素(廖丽莎等, 2007), 也是PAEs在土壤中吸附迁移的控制因素(张建等, 2010), 而且微生物表面蛋白质和脂质上的酯基、烃基等结合基团决定其疏水性作用, 因此疏水性作用可能为DEHP迁移及与细菌结合的主要因素.
 |
| 图 6 伯克霍尔德菌(Burkholderia sp.)吸附DEHP前后的红外光谱图 Fig. 6 FT-IR spectra of Burkholderia sp. before and after adsorption |
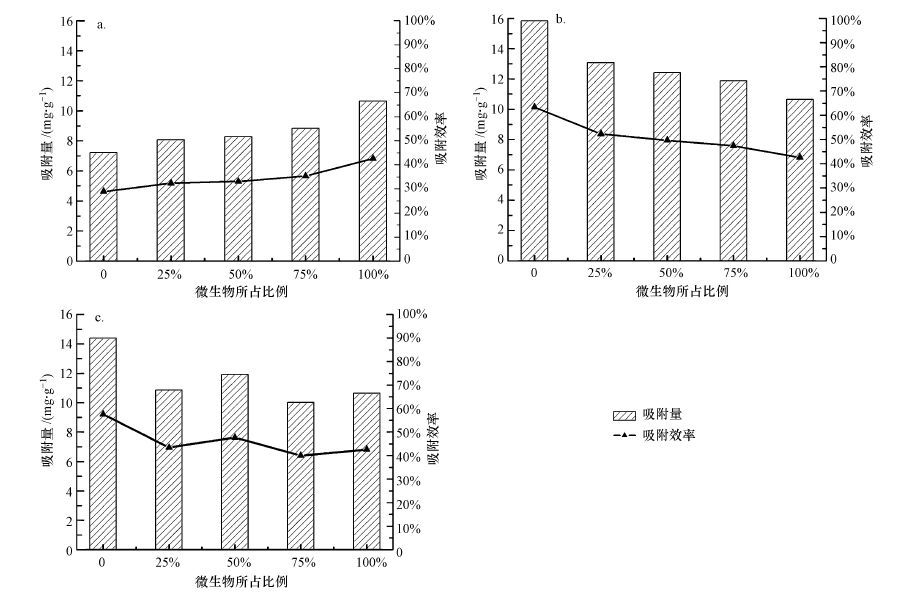
不同比例细菌-矿物复合体对DEHP的吸附情况如图 7所示.结果表明, 在初始溶液浓度为5 mg·L-1且吸附达到平衡的情况下, 针铁矿、高岭土、蒙脱石对DEHP的吸附量分别为14.38、7.22、15.85 mg·g-1, 而细菌的吸附量为10.65 mg·g-1.与此同时, 蒙脱石、针铁矿、高岭土的吸附效率分别为63.39%、57.54%、28.89%, 细菌吸附效率为42.59%.由吸附量和吸附效率的对比可知, 3种矿物及Burkholderia sp.对DEHP的吸附性能排序为:蒙脱石>针铁矿>伯克霍尔德菌>高岭土.除此之外, 随着复合体中细菌比例的增加, 高岭土复合体对DEHP的吸附量明显增加, 表明高岭土复合体对DEHP的亲和力随细菌比例增加而显著增加;而蒙脱石复合体的吸附发生明显的下降, 细菌-针铁矿复合体系对DEHP的吸附中则表现出一定的不稳定性.
 |
| 图 7 不同比例微生物-矿物对DEHP吸附量及吸附效率的影响 (a. 高岭土, b. 蒙脱石, c. 针铁矿复合体) Fig. 7 Adsorption efficincy and capacity of DEHP adsorped by mixtures containing different amounts of Burkholderia sp. and clay.(a. kaolinite, b. montmorillonite, c. goethite) |
根据研究表明, 蒙脱石与细菌通过疏水作用等能结合成较松散的复合物(Peakall et al., 1975), 细菌和蒙脱石之间的疏水基团可能相互结合, 从而导致复合体在溶液中暴露基团以亲水基团为主, 因此细菌-蒙脱石复合体对DEHP的吸附能力降低.而针铁矿与细菌表面官能团发生络合反应(方临川等, 2011; Omoike et al., 2006), 有可能掩蔽或暴露部分吸附位点, 所以其复合物显示出较高的吸附效率但表现出一定的不稳定性.此外, 有研究表明细菌在针铁矿、蒙脱石表面形成聚合, 高岭土则不能(Appel et al., 2003), 这可能是导致高岭土吸附效率较低的原因.在细菌-矿物的复合体中可能还存在一些相互作用机理, 通过对复合体的实际吸附值与理论吸附值比较, 可以进行更进一步的探讨.
表 2为不同比例菌体与矿物复合体的实测吸附值与理论值之间的比较.实测吸附值即为在实验过程中3种矿物与细菌的复合体对DEHP的吸附量;理论吸附值是在已确定3种矿物及细菌单独作用下吸附量的情况下, 根据比例对矿物和细菌的吸附量进行加权求和, 代表矿物和细菌相互独立进行对DEHP的吸附作用.通过对实测吸附值与理论吸附值差值计算, 可以更深入的探究细菌与实际矿物的相互作用机制.
| 表 2 不同混合比例下菌体-矿物复合体实测吸附量与理论值之间的比较 Table 2 Comparison of the DEHP-binding capacities of clay-living cell mixtures with theoretically predicted values under different proportion of the mixture |
可以看出, 1:3的细菌-高岭土复合体以及3:1的细菌-蒙脱石复合体对DEHP吸附的实测值与理论值十分接近, 而其他情况均略低于理论值;细菌-针铁矿的实测吸附值均小于理论值, 尤其在1:3和3:1的混合比例下.这些差异说明细菌与3种矿物结合过程中掩蔽了一些吸附位点, 导致复合体尤其是针铁矿复合体吸附量降低.已有研究表明针铁矿与一些微生物之间由于存在强烈的静电引力而具有较大的吸附亲和力(荣兴民, 2008; Jiang et al., 2007), 这种亲和力可能导致细菌表面蛋白质及脂质部分与针铁矿表面的羟基发生络合反应, 从而使复合体的部分吸附位点消失, 吸附能力明显下降(方临川等, 2011; Omoike et al., 2006; 康凯丽, 2013).蒙脱石与高岭土和活菌体的结合较为松散(方临川等, 2011), 暴露出来的原有吸附位点较多, 因此其吸附量与理论值相比并未发生明显下降.
3.7 细菌及复合体对DEHP的解吸行为表 3为Burkholderia sp.及其矿物复合体对DEHP的解吸性能, 通过对吸附解吸的分析可以进一步探讨DEHP在微生物-矿物的界面行为.根据表中可得出, 复合体系及细菌对DEHP解吸率大小为:高岭土体系>细菌>针铁矿体系>>蒙脱石体系, 结果与其吸附能力结果相一致.其中, 细菌表现出较高的解吸效率, 为31.57%;细菌-高岭土与细菌-针铁矿的解吸率分别为38.68%和27.17%;而细菌-蒙脱石的解吸率仅为7.50%, 明显低于细菌及其他矿物复合体.这表明微生物与不同矿物复合对DEHP的亲和力差异较大, 其中细菌-蒙脱石复合体系对DEHP的吸附量最大, 而且结合力最强;而高岭土和针铁矿-细菌复合体系对DEHP的结合强度较小.
| 表 3 微生物及其矿物复合体对DEHP的吸附解吸 Table 3 Capacities of DEHP of 5 mg·L-1 adsorbed and desorbed with a 0.5 mol·L-1 CH3COOH solution from Burkholderia sp., clay and the mixture |
已有研究表明, 针铁矿和高岭土与菌体结合时, 部分矿物颗粒表面完全被微生物所覆盖, 从而掩蔽了一些高亲和力位点(Fang et al., 2010; 吴华勇, 2015);而蒙脱石与活菌体的结合则以黏附为主, 相对于针铁矿和高岭土而言这种结合较为松散(欧亚西, 2009), 因此其吸附位点暴露于表面, 使DEHP与蒙脱石体系结合更紧密.而且, 相对于高岭土体系, 细菌能在针铁矿、蒙脱石表面形成聚合(Appel et al., 2003), 这可能是导致高岭土-细菌复合体解吸率高、吸附量较小的原因.
4 结论(Conclusions)1) 经分离后的细菌经过鉴定为伯克霍尔德菌(Burkholderia sp.), 其对于DEHP的耐受性极强, 适量的DEHP反而有利于该类细菌的生长, Burkholderia sp.对于DEHP的吸附过程与细菌的生长繁殖阶段密切相关.经过对等温吸附模型的拟合, 发现DEHP在土壤中微生物界面上的吸附符合Langmuir吸附方程, 其中Qm为22.22 mg·g-1, 吸附过程较容易发生;当pH为7.0~8.0, 微生物对DEHP吸附最强烈, 碱性条件下吸附量的下降比酸性条件更为明显.
2) 通过傅里叶变换红外光谱分析, 细菌表面蛋白质和脂质的疏水键对于土壤微生物吸附DEHP作用明显, 在微生物与DEHP吸附过程中, 疏水性作用是微生物结合DEHP的主要原因.
3) 采用不同比例矿物-细菌混合比例复合吸附DEHP研究发现:3种矿物及细菌对DEHP的吸附性能排序为:蒙脱石>针铁矿>细菌>高岭土, 而且细菌在与矿物结合过程中会掩蔽部分DEHP吸附位点.通过矿物-细菌复合体对DEHP的吸附解吸行为的研究, 根据吸附量和解吸情况比较分析, 发现各复合体系对DEHP结合能力大小为:活菌体-蒙脱石>活菌体-针铁矿>活菌体-高岭土, 活菌体-蒙脱石体系对DEHP固定效果较好, 而高岭土和针铁矿与细菌复合体系对DEHP的结合强度较小.
| [${referVo.labelOrder}] | Aksu Z, Özer D, Ekiz H I, et al. 1996. Investigation of biosorption of chromium (VI) on C[J]. crispata in two-staged bateh reaetor[J]. Environmental Technology, 17(2) : 215–220. |
| [${referVo.labelOrder}] | Aksu Z. 2005. Application of biosorption for the removal of organic pollutants:a review[J]. Process Biochemistry, 40(3/4) : 997–1026. |
| [${referVo.labelOrder}] | Appel C, Ma L Q, Rhue R D, et al. 2003. Point of zero charge determination in soils and minerals via traditional methods and detection of electroacoustic mobility[J]. Geoderma, 113(1/2) : 77–93. |
| [${referVo.labelOrder}] | Atkinson R J, Posner A M, Quirk J P. 1967. Adsorption of potential-determining ions at the ferric oxide aqueous electrolyte interface[J]. Physical Chemistry, 71(3) : 550–558. DOI:10.1021/j100862a014 |
| [${referVo.labelOrder}] | 陈燕飞. 2009. pH对微生物的影响[J]. 太原师范学院学报(自然科学版), 2009, 8(3) : 121–131. |
| [${referVo.labelOrder}] | 代群威, 董发勤. 2009. FTIR技术在几株细菌鉴定中的应用[J]. 四川建材学院学报, 2009, 24(1) : 114–118. |
| [${referVo.labelOrder}] | 东秀株, 蔡妙英. 2001. 常见细菌系统鉴定手册[M]. 北京: 科学出版社: 370–412. |
| [${referVo.labelOrder}] | 方临川. 2011. 重金属与细菌-土壤活性颗粒微界面互作的分子机制[D]. 武汉:华中农业大学 |
| [${referVo.labelOrder}] | Fang L C, Cai P, Li P X, et al. 2010. Microcalorimetric and potentiometric titration studies on the adsorption of copper by P. putida and B. thuringiensis and their composites with minerals[M]//Molecular Environmental Soil Science at the Interfaces in the Earth's Critical Zone. Springer Berlin Heidelberg. 62-65 |
| [${referVo.labelOrder}] | Hong K, Sun S, Tian W, et al. 1999. A rapid method for detecting bacterial polyhydroxyalkanoates in intact cells by Fourier transform infrared spectroscopy[J]. Applied Microbiology & Biotechnology, 51(4) : 523–526. |
| [${referVo.labelOrder}] | Husmark U, Rönner U. 1990. Forces involved in adhesion of Bacillus cereus spores to solid surfaces under different environmental conditions[J]. Journal of Applied Bacteriology, 69(4) : 557–62. DOI:10.1111/jam.1990.69.issue-4 |
| [${referVo.labelOrder}] | Jiang D, Huang Q, Cai P, et al. 2007. Adsorption of Pseudomonas putida on clay minerals and iron oxide[J]. Colloids and surface B, Biointerfaces, 54(2) : 217–221. DOI:10.1016/j.colsurfb.2006.10.030 |
| [${referVo.labelOrder}] | Julinová M, Slavík R. 2012. Removal of phthalates from aqueous solution by different adsorbents:A short review[J]. Journal of Environmental Management, 94(1) : 13–24. DOI:10.1016/j.jenvman.2011.09.006 |
| [${referVo.labelOrder}] | 康凯丽. 2013. 蒙脱石、针铁矿-细菌-腐殖酸复合体对Cd(Ⅱ)的吸附机理初探[D]. 武汉:华中农业大学 |
| [${referVo.labelOrder}] | 廖丽莎. 2007. 有机物生物吸附研究进展[J]. 四川理工学院学报:自然科学版, 2007, 26(2) : 96–100. |
| [${referVo.labelOrder}] | 刘庆, 杨红军, 史衍玺, 等. 2012. 环境中邻苯二甲酸酯类(PAEs)污染物研究进展[J]. 中国生态农业学报, 2012, 20(8) : 968–975. |
| [${referVo.labelOrder}] | 刘维屏, 季瑾. 1996. 农药在土壤-水环境中归宿的主要支配因素——吸附和脱附[J]. 中国环境科学, 1996, 16(1) : 25–30. |
| [${referVo.labelOrder}] | Kaun Y L, Fu Wei T, Chia Jung W, et al. 2004. Suppression by phthalates of the calcium signaling of human nicotinic acetylcholine receptors in human neuroblastoma SH-SY5Y cells[J]. Toxicology, 200(2/3) : 113–121. |
| [${referVo.labelOrder}] | 孟雪征, 牛贵龙, 曾明, 等. 2014. 增塑剂邻苯二甲酸二(2-乙基己基)酯的危害、分布及生物降解[J]. 生态环境, 2014, 23(8) : 1384–1389. |
| [${referVo.labelOrder}] | Omoike A, Chorover J. 2006. Adsorption to goethite of extracellular polymeric substances from Bacillus subtilis[J]. Geochimica Et Cosmochimica Acta, 70(4) : 827–838. DOI:10.1016/j.gca.2005.10.012 |
| [${referVo.labelOrder}] | 欧亚西. 2009. 锰氧化细菌在粘土矿物表面的吸附及其对Mn(Ⅱ)的氧化[D]. 武汉:华中农业大学 |
| [${referVo.labelOrder}] | Peakall D B. 1975. Phthalate esters:Occurrence and biological effects[M]//Residue Reviews. Springer New York. 1-41 |
| [${referVo.labelOrder}] | RE 布坎南, NE 杰本斯. 1984. 伯杰细菌鉴定手册[M]. 第8版. 北京: 科学出版社: 922–934. |
| [${referVo.labelOrder}] | 荣兴民. 2008. 几种细菌与土壤粘粒矿物相互作用的热力学研究[D]. 武汉:华中农业大学 |
| [${referVo.labelOrder}] | Swan S H. 2008. Environmental phthalate exposure in relation to reproductive outcomes and other health endpoints in humans[J]. Environmental research, 108(2) : 177–184. DOI:10.1016/j.envres.2008.08.007 |
| [${referVo.labelOrder}] | 唐琳. 2007. 吸附及变压吸附分离回收丙酮蒸气的数学模拟[D]. 长沙:湖南大学 |
| [${referVo.labelOrder}] | van der Wal A, Norde W, Zehnder A J B, et al. 1997. Determination of the total charge in the cell walls of Gram-positive bacteria[J]. Colloids and surfaces B:Biointerfaces, 9(1) : 81–100. |
| [${referVo.labelOrder}] | Wang K R, Cui M M, Shi Y X. 2013. Phthalic acid esters (PAEs) pollution in farmland soils:A review[J]. Chinese Journal of Applied Ecology, 24(9) : 2699–2708. |
| [${referVo.labelOrder}] | White R, Sumpter J P, Jobling S, et al. 1995. A variety of environmentally persistent chemicals, including some phtalate plasticizers, are weakly estrogenic[J]. Environmental Health Perspectives, 103(6) : 582–587. DOI:10.1289/ehp.95103582 |
| [${referVo.labelOrder}] | 王宏, 叶常明. 1995. 邻苯二甲酸二丁酯在天然水中的生物降解及其颗粒物界面效应[J]. 环境科学学报, 1995, 15(4) : 393–398. |
| [${referVo.labelOrder}] | 王天竹. 2010. 高效降解DEHP复合菌群的构建及降解特性研究[D]. 吉林:东北师范大学, 29-30 |
| [${referVo.labelOrder}] | 吴华勇. 2015. 土壤活性颗粒对细菌吸附及活性影响的机制[D]. 武汉:华中农业大学 |
| [${referVo.labelOrder}] | 辛佳. 2013. 典型多溴联苯醚在土壤中的吸附及对其生物降解性的影响[D]. 北京:清华大学 |
| [${referVo.labelOrder}] | 许辅乾. 2014. 嗜热螯台球菌产聚羟基脂肪酸酯的研究[D]. 广州:华南理工大学 |
| [${referVo.labelOrder}] | 张建. 2010. 邻苯二甲酸酯类污染物的微生物去除作用及物理吸附研究[D]. 山东:山东大学 |
| [${referVo.labelOrder}] | 张银华, 陈旭东, 李植生, 等. 1995. 湖泊沉积物中邻苯二甲酸酯类的GC/MS分析[J]. 分析测试学报, 1995, 14(5) : 17–21. |
| [${referVo.labelOrder}] | 张蕴晖, 陈秉衡, 郑力行, 等. 2003. 环境样品中邻苯二甲酸酯类物质的测定与分析[J]. 环境与健康杂志, 2003, 20(5) : 283–286. |
 2017, Vol. 37
2017, Vol. 37


