2. 中国水产科学研究院资源与环境研究中心, 北京 100141
2. Fishery Resource and Environment Research Center, Chinese Academy of Fishery Sciences, Beijing 100141
嘧菌酯是最具影响力的甲氧丙烯酸酯类杀菌剂之一, 其杀菌机制是抑制细胞色素b和细胞色素c1之间的电子传递, 阻碍菌类的线粒体呼吸, 进而抑制ATP生成(Furzer et al., 2006; Bubici et al., 2006). 由于嘧菌酯杀菌效率高、杀菌谱广, 目前已经被应用于80余种作物上的超过400种病害的防治中(Boudina et al., 2007). 据2009年的统计数据, 嘧菌酯在世界范围的总用量超过4000 t, 年销售额超过10亿美金, 是最畅销的杀菌剂之一(Parra et al., 2012).
随着嘧菌酯的大量使用, 其对水环境的污染也引起了全球范围的关注. Battaglin等(2011) 检测了12种杀菌剂在美国主要河流中的含量, 发现嘧菌酯是其中检出率最高的杀菌剂, 检出率达45%. 与此同时, Smalling等(2013) 在美国加州中部的入海口附近对多种杀菌剂进行了全年监测, 结果表明, 嘧菌酯的检出率高达84%. 相比于环境水域, 嘧菌酯在稻田水中的检出情况更为严重. 最近的研究表明, 在以506.25 g·hm-2(约为推荐剂量的1.5倍)的剂量施药后, 嘧菌酯在稻田水中的浓度达到1.5 mg·L-1, 半衰期为6 d(谢惠等, 2013). 在我国南方, 许多地区采用稻田养殖的方法来提高经济效益(王雨林, 2009), 而嘧菌酯作为水稻中的常用杀菌剂, 其对稻田水养殖生物的潜在威胁值得关注.大量毒理学研究已经证明, 嘧菌酯对哺乳动物、鸟类和蜜蜂的毒性均为低毒(Bartlett et al., 2002; USEPA, 1997), 但其对水生生物的毒性却很高(PMRA, 2000; Gustafsson et al., 2010). 近期研究发现, 嘧菌酯对大型溞(Daphnia magna)和水生浮游生物均具有较高毒性(Ochoa-Acuña et al., 2009; Zafar et al., 2012). 综上所述, 为揭示嘧菌酯对生态环境的潜在风险, 开展其对水生生物的毒理学研究十分必要.
鱼类作为水生环境中最主要的脊椎动物, 是化学污染物的主要危害对象. 鱼类在水生环境中的非正常生长、发育、死亡, 提醒我们必须对农药等化学品的使用引起的水环境污染给予足够的重视.目前, 鱼类毒性试验是评价污染物环境风险的主要方法之一, 一些有代表性的模式鱼类, 例如, 虹鳟鱼(Oncorhynchus mykiss)、日本青鳉(Oryzias latipes)和斑马鱼(Danio rerio)等被用于污染物的毒性评价试验中(Feng et al., 2012; Zhang et al., 2008; Martínez-Sales et al., 2015). 作为环境毒理学模式动物, 斑马鱼具备个体小、生命周期短、繁殖快、易于大规模饲养等优点(Lele et al., 1996). 斑马鱼胚胎具备体外发育、发育快和发育过程透明等特点, 可在显微镜下全程、完整观察其内部所有器官和结构的变化(Yang et al., 2009), 目前已成为研究环境污染物对水生生物影响的良好模型.
确定生物的最敏感阶段对于该物种的保护工作具有重要指导意义(Newman et al., 2002). 胚胎-仔鱼阶段一直被认为是鱼类整个生命过程中对外来干扰最为敏感的阶段(王蕊等, 2004), 因为处于生命早期阶段的鱼代谢解毒能力应弱于成年个体, 因此, 对有毒物质更加敏感.但也有人提出相反的观点, 认为鱼类胚胎的外膜能够起到阻碍有毒化合物与生命体接触的作用, 因此, 鱼类胚胎可能会表现出比成年个体更强的耐受能力(Embry et al., 2010). 另外, 有研究证明, 处于不同生命阶段的斑马鱼在被同一污染物处理后, 死亡率、酶活性和基因表达量等指标的反应差异很大(Domingues et al., 2010; Zucchi et al., 2011). 综上所述, 仅通过单一生命阶段的毒性试验, 难以全面系统地评价某种有毒物质对鱼类的危害.
鱼类多阶段毒性试验不仅能够全面系统地反映污染物对鱼类的影响, 对鱼类敏感阶段的确定也有重要指导作用, 因此, 多阶段鱼类试验逐渐开始被应用于污染物环境安全性评价的研究中(Brion et al., 2004; Wang et al., 2013; Mu et al., 2013). 目前按照试验用斑马鱼所处的生命阶段划分, 斑马鱼毒性试验大体可分为成鱼毒性实验、胚胎毒性试验和早期生命阶段(包括胚胎及仔鱼)试验. 本研究采用斑马鱼成鱼、胚胎和仔鱼3个阶段的毒性实验, 评价嘧菌酯对鱼类的毒性, 并确定斑马鱼对嘧菌酯的最敏感生命阶段. 另外, 通过6 d的胚胎发育试验, 评价嘧菌酯的发育毒性. 上述研究有助于揭示嘧菌酯对水生生态环境的潜在威胁, 对嘧菌酯的科学使用及鱼类资源的保护工作具有指导意义.
2 材料与方法(Materials and methods) 2.1 试验生物与饲养条件斑马鱼亲鱼(约10月龄), 体长3.50~4.50 cm, 体重0.30~0.60 g, 在实验室条件下长期驯养, 驯养用水经曝气去氯处理, pH值为7.0~8.5, 水中溶氧量大于空气饱和值的80%, 水质硬度为(200±25) mg·L-1(以CaCO3计), 温度为(27±1) ℃. 采用自然光照与白炽灯光照, 光照周期为14 h/10 h(光/暗).期间死亡率小于5%. 驯养期间每天喂食2次去壳活丰年虾(Eubranchipus vernalis).
斑马鱼成鱼(约5月龄), 体长3.00~4.00 cm, 体重0.15~0.30 g.在试验室驯养30 d以上, 驯养条件与亲鱼相同, 期间正常死亡率保持在5%以下.
斑马鱼胚胎由试验室亲鱼(驯养期2个月以上)产卵获得, 产卵前至少1周把雌雄斑马鱼分开饲养. 实验前1天喂食后, 将4条雌鱼、2条雄鱼放入斑马鱼专用产卵盒, 用透明隔板隔开, 傍晚时用黑布遮挡, 第2天早上拿走黑布, 抽掉隔板, 借助微弱的光线刺激雌雄鱼追逐产卵. 收集0.5 h之内产的卵, 用重组水迅速清洗鱼卵, 去除杂物, 通过显微镜筛选受精成功的胚胎(以能进入四细胞期作为受精成功的标准), 置于盛有重组水的烧杯中以备暴露试验.
斑马鱼仔鱼, 暴露用的仔鱼为孵化后约72 h的仔鱼.
2.2 药品与试剂96%嘧菌酯(CAS No 131860-33-8, 96%)原药由农业部农药检定所提供;原药由丙酮(分析纯)配制成一定浓度的农药储存液, 储存液进一步用重组水稀释至指定浓度.重组水配置方法参考OECD的推荐方法(OECD, 1992), 配好的重组水中分别含有2 mmol·L-1 Ca2+、0.5 mmol·L-1 Mg2+、0.75 mmol·L-1 Na+和0.074 mmol·L-1 K+.
2.3 嘧菌酯暴露试验 2.3.1 胚胎毒性试验参照OECD试验指导(OECD, 2013a)和Fraysse等(2006) 的方法进行试验, 将斑马鱼胚胎暴露在0.35、0.42、0.50、0.60、0.66、0.72 mg·L-1系列浓度的嘧菌酯溶液中(实验用水均为重组水). 设助剂对照(含丙酮, 用量为0.1 mL·L-1)和重组水空白对照.分别把受精卵转移到24孔板中, 每板使用20个孔, 每孔含有2 mL试验药液和1枚受精卵, 1张板为1个重复, 对照和各暴露组均设置3个重复. 保证在胚胎发育囊胚期阶段(产卵受精后2 h)开始前完成暴露. 把孔板盖好放在人工气候箱中培养, 27~28 ℃, 光照/黑暗为14 h/10 h.分别在暴露后6、24、48、72、96 h, 按照Nagel(2002) 提出的致死终点(卵凝结、发育停滞、心跳停止)记录胚胎的死亡情况.
2.3.2 成鱼毒性试验参照国标《化学农药环境安全评价试验准则》中“鱼类毒性试验”和OECD-203设计试验(国家质量监督及检验检疫总局, 2011;OECD, 1992), 将随机挑选的斑马鱼成鱼暴露于0.98、1.10、1.24、1.40、1.60 mg·L-1 5个浓度的嘧菌酯溶液中;设助剂对照(含丙酮, 用量为0.1 mL·L-1)、空白对照, 每个浓度组和对照组各设3个重复, 每个重复10条成鱼.暴露试验在5 L烧杯中进行, 每个烧杯中盛有药液5 L和10条鱼, 作为一个重复.观察6、24、48、72、96 h的死亡数、中毒症状, 及时清理死鱼, 判断死鱼的标准是玻璃棒轻触鱼的尾部无可见运动. 每24 h更换全部药液.
2.3.3 仔鱼毒性试验参考Giari等(2012) 的方法, 挑选孵化后72 h的正常仔鱼用于急性毒性试验, 将挑选的仔鱼暴露于0.20、0.35、0.42、0.50、0.60 mg·L-1 5个浓度的嘧菌酯溶液中;设助剂对照(含丙酮, 用量为0.1 mL·L-1)、空白对照, 每个浓度组和对照组各设3个重复.暴露试验在200 mL烧杯中进行, 每个烧杯中盛有药液100 mL和10条仔鱼, 作为一个重复. 观察6、24、48、72、96 h的死亡数、中毒症状, 以显微观察无可见心跳作为判断仔鱼死亡的标准, 及时清理死鱼.每24 h更换80%药液.
2.4 胚胎发育试验胚胎发育试验暴露方法与胚胎毒性试验相同, 将斑马鱼胚胎暴露于0.05、0.25、0.50、0.60、0.70 mg·L-1的嘧菌酯水溶液中.暴露容器为24孔板, 每板使用20个孔, 每孔含有2 mL试验药液和1枚受精卵, 1张板为1个重复, 对照和各暴露组均设置3个重复. 暴露时间为6 d. 参考Nagel(2002) 提出的毒理指标, 用倒置显微镜观察其致死效应、亚致死效应和致畸效应. 其中, 亚致死效应的观察统计包括:每天观察所有胚胎的发育情况, 记录发育异常和畸形的个体;每天统计孵化的仔鱼数量, 计算孵化率, 每24 h更换3/4体积的药液;24 hpf(hours post fertilization)时, 从每个重复随机取5粒有活性的卵, 在倒置显微镜下观察斑马鱼胚胎自主运动情况, 记录20 s内自主运动的次数;分别在48和96 hpf时, 在倒置显微镜下观察斑马鱼心跳情况, 每个重复随机取5粒活卵, 记录20 s内心跳次数;在96 hpf时, 从每个重复随机取5条存活的孵化仔鱼在GE-5观测器下测量体长.
2.5 暴露溶液中嘧菌酯浓度分析在第一次配好药液后, 以及第一次换药液前, 从每个重复中取水样10 mL进行嘧菌酯浓度分析, 每个处理组取3个重复样品. 将样品倒入分液漏斗中, 用5 mL乙酸乙酯萃取两次后, 合并萃取液, 每个样品取1.5 mL萃取液移入到装有无水硫酸镁的离心管, 振荡摇匀后在10000 r·min-1下离心3 min, 取上清液1 μL进样. 分析仪器为搭载电子捕获检测器的气相色谱仪(Agilent 6869n), 使用的色谱柱为HP-5毛细管气相色谱柱(5%苯基甲基硅氧烷, 30 m×0.25 mm×0.25 mm). 色谱条件如下:检测器温度300 ℃;进样口温度280 ℃;升温程序:120 ℃保留1 min, 以30 ℃·min-1升温至280 ℃, 保持13 min;载气(氮气)流量为1.0 mL·min-1. 在上述色谱条件下, 嘧菌酯的保留时间为16.5 min. 使用软件GC ChemStation Rev.A.10.02进行色谱数据分析. 上述方法的检测限(LOD)和定量限(LOQ)分别为0.005和0.02 mg·L-1. 使用3个浓度(0.05、0.5、2.0 mg·L-1)进行回收率试验, 得到的回收率在88.2%~106.7%之间.
2.6 数据统计与分析使用SPSS 16.0对试验所得数据进行统计分析. 采用One-Way ANOVA 法进行单因素方差分析, 以Dunnett post hoc方法完成显著性比较; p<0.05 表示差异显著, p<0.01表示差异极显著.
3 结果与讨论(Results and discussion) 3.1 溶剂效应显著性分析结果表明, 溶剂对照组和空白对照组中试验涉及的所有指标的检测结果之间不存在显著差异(数据未给出). 在本文中出现的对照组(Control)数据均来自于溶剂对照.
3.2 暴露溶液中嘧菌酯浓度分析结果分析结果表明, 所有处理组水样的实测浓度与理论浓度偏差均小于20%(表 1), 根据OECD试验指导的要求, 本试验中的理论浓度能够代表其实际浓度(OECD, 1992;2013a;2013b).
| 表 1 嘧菌酯暴露溶液实测浓度 Table 1 Chemical analysis result of difenoconazole solution |
嘧菌酯对斑马鱼胚胎、仔鱼和成鱼3个阶段均有一定致死能力. 根据96 h-LC50(表 2), 斑马鱼3个生命阶段对嘧菌酯的敏感性顺序为:仔鱼(0.39 mg·L-1)>胚胎(0.61 mg·L-1)>成鱼(1.37 mg·L-1). 除致死以外, 嘧菌酯还能导致斑马鱼成鱼和仔鱼出现多种行为异常, 包括游动失衡、活跃度下降及游动翻转等.
| 表 2 嘧菌酯对不同阶段斑马鱼急性毒性结果 Table 2 Acute toxicity of azoxystrobin to zebrafish during three life stages |
上述结果表明, 嘧菌酯对所试验的处于3个生命阶段的斑马鱼均有致死能力, 且其对胚胎和仔鱼的毒性明显强于成鱼, 因此, 嘧菌酯对鱼类早期生命阶段的毒性效应更值得重视. 表 3中列出了嘧菌酯对3种硬骨鱼类成年个体的急性毒性结果, 通过比较发现, 已有结果与本研究中嘧菌酯对斑马鱼成鱼的急性毒性结果相接近(96h-LC50, 1.37 mg·L-1). 另外, Liu等(2013) 的研究发现, 嘧菌酯对草鱼(Ctenopharyngodon idellus)稚鱼的48 h-LC50为0.549 mg·L-1, 而本研究中嘧菌酯对斑马鱼仔鱼的48 h-LC50为0.43 mg·L-1, 该结果与Liu(2013) 等的研究表现出良好的一致性.
| 表 3 嘧菌酯对硬骨鱼成鱼的急性毒性结果参考值 Table 3 Reported acute toxicity data of azoxystrobin in other fish species |
胚胎绒毛膜的保护作用和成年个体具备的代谢解毒系统被认为是鱼类自身缓解外源污染物毒性的两个可能途径(Embry et al., 2010), 本研究中的多阶段毒性试验结果表明, 斑马鱼仔鱼对嘧菌酯敏感性最强, 这可能是因为该阶段既不具备完善的代谢解毒能力, 同时也丧失了胚胎膜的保护.目前很多研究发现, 水生生物早期生命阶段对化学物质的敏感性要高于成年阶段. 有研究发现, 大型溞胚胎对苯胺衍生物、次氯酸钠和甲醛的敏感性要显著高于成年大型溞(Abe et al., 2001; Ton et al., 2012). Şişman等(2011) 的研究表明, 氯化亚锡对斑马鱼胚胎和仔鱼的毒性要显著高于其对成鱼的毒性. 与此同时, 一些研究得到了相反的结果, Domingues等(2010) 的试验证明, 斑马鱼成鱼对六价铬的敏感性是胚胎的4倍.Mu等(2013) 的研究发现, 三唑类杀菌剂苯醚甲环唑对斑马鱼成鱼的毒性明显高于胚胎. 综合上述结果, 生物的不同生命阶段对不同有毒物质的敏感性顺序可能存在差异, 而影响这一敏感性顺序的因素还有待进一步研究确定, 一个可能的因素是该物质渗入胚胎膜的能力(Embry et al., 2010).
3.4 嘧菌酯对斑马鱼胚胎发育的影响 3.4.1 嘧菌酯对胚胎孵化的抑制作用如图 1所示, 对照组和低浓度暴露组(0.05和0.25 mg·L-1)从48 hpf开始出现完成孵化的个体, 在96 hpf时绝大部分存活的胚胎均完成孵化. 0.50 mg·L-1暴露组中胚胎的孵化率显著低于对照组, 但在144 hpf时, 该组中所有存活的胚胎均完成孵化. 0.60 mg·L-1暴露组中胚胎孵化率被抑制的情况更加严重, 在暴露试验结束时, 仍有约60%的胚胎没有完成孵化. 而在0.70 mg·L-1暴露组中未观测到有胚胎完成孵化.
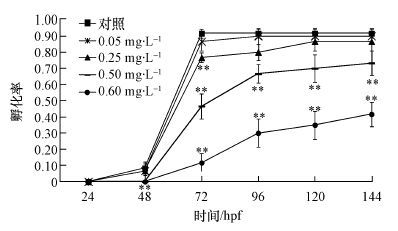 |
| 图 1 不同时间下斑马鱼孵化率 (星号表示处理组与对照组间的显著性差异, *p<0.05, **p<0.01, 误差线表示标准偏差, 下同) Fig. 1 Hatching rate at each observation |
孵化率与孵化后仔鱼的质量有着直接的关系(Zha et al., 2005), 是胚胎发育阶段的重要毒理学指标. 已有研究表明, 甲氧丙烯酸酯类农药能抑制水生生物的胚胎孵化.如Zhu等(2014) 的研究发现, 0.1 mg·L-1肟菌酯可显著抑制青鳉鱼胚胎的孵化率, 并延长孵化时间.本研究发现, 0.50 mg·L-1及更高浓度的嘧菌酯能够显著抑制斑马鱼胚胎的发育, 这一结果与Zhu等(2014) 的研究相符合. 在斑马鱼胚胎的孵化过程中, 有两个关键步骤:①孵化酶对胚胎绒毛膜的分解;②胚胎个体通过自身的运动破膜而出(Winnicki et al., 1970; Yamamoto, 1975). 斑马鱼孵化酶1(ZHE1) 是一种含锌离子的金属蛋白酶(Sano et al., 2008), 它能够裂解绒毛膜蛋白, 使其膨胀并软化.在此基础上, 胚胎通过收缩运动进一步使绒毛膜破裂, 从而完成孵化(Kawaguchi et al., 2007). 很多研究曾尝试探究污染物抑制鱼类胚胎孵化的机理. 如Mu等(2013) 发现, 苯醚甲环唑暴露后, 斑马鱼胚胎孵化率显著降低, 同时伴随卵黄囊水肿(斑马鱼胚胎孵化腺位于卵黄囊外膜), 作者由此推测孵化率下降可能源于卵黄囊水肿引起的孵化腺功能异常.Zhou等(2009) 曾对杀螟丹引起的斑马鱼孵化率下降的机制进行研究, 认为孵化率下降是由于高浓度杀螟丹引起了孵化酶分泌受阻.本研究中, 斑马鱼胚胎孵化延迟的原因可能是由于嘧菌酯暴露后, 胚胎自身发育缓慢造成的.
3.4.2 嘧菌酯对胚胎自主运动和心跳的影响斑马鱼胚胎发育到24 hpf时, 会出现有规律的自主运动.自主运动统计结果表明, 低浓度(0.25和0.50 mg·L-1)嘧菌酯暴露能显著诱导胚胎24 h自主运动(图 2a).而当暴露浓度达到 0.70 mg·L-1时, 斑马鱼胚胎自主运动被显著抑制.
与对自主运动的影响趋势类似, 不同剂量的嘧菌酯对斑马鱼胚胎的心跳影响也存在差异.在48 hpf, 0.50 mg·L-1嘧菌酯对斑马鱼胚胎的心跳具有促进作用, 而高浓度(0.70 mg·L-1)暴露组中, 胚胎的心跳频率低于对照组(图 2b).在96 hpf, 心跳的变化趋势与48 hpf时相同, 低浓度(0.25和0.50 mg·L-1)嘧菌酯对斑马鱼胚胎心跳具有诱导作用, 而高浓度嘧菌酯对胚胎心跳表现为抑制作用.0.05和0.60 mg·L-1暴露组中胚胎心跳次数与对照组接近.
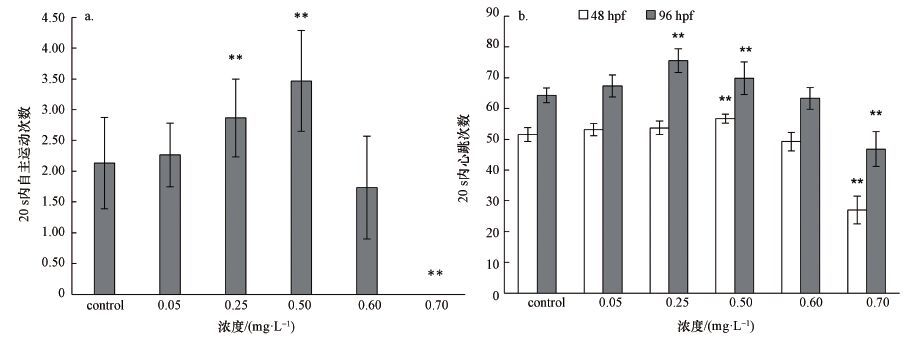 |
| 图 2 嘧菌酯对斑马鱼胚胎自主运动(a)和心跳(b)的影响 (以20 s内自主运动次数和心跳数为检测指标) Fig. 2 Effects of azoxystrobin on spontaneous movement(a)and heartbeatsb)of embryos |
心脏是斑马鱼胚胎发育过程中的第一个功能性器官, 同时也是鱼类胚胎试验的重要毒理学终点(OECD, 2013a; Glickman et al., 2002).之前的研究已经发现, 甲氧丙烯酸酯类化合物能影响鱼类的心率, 如Liu等(2013) 的试验证明, 0.16 mg·L-1的嘧菌酯可导致草鱼稚鱼心跳速率下降.而在本研究中, 不同剂量的嘧菌酯暴露后, 斑马鱼胚胎心率的变化趋势存在很大差异, 其中, 低浓度嘧菌酯能促进斑马鱼胚胎的心率, 而高浓度嘧菌酯对斑马鱼胚胎心率有抑制作用.
3.4.3 嘧菌酯对胚胎发育的抑制作用嘧菌酯能造成斑马鱼胚胎发育延迟, 具体症状包括黑色素附着率下降、卵黄囊面积较大和组织器官分化缓慢等.正常的胚胎在24 hpf时即可看到明显的黑色素附着, 而0.25和0.50 mg·L-1组中的胚胎在24 hpf时黑色素附着率明显下降, 0.60和0.70 mg·L-1暴露组的胚胎中完全观测不到黑色素(图 3).
正常的胚胎在24 hpf时, 应能明显观测出体节和眼睛, 同时尾部应不再与卵黄囊粘连. 0.05和0.25 mg·L-1暴露组中胚胎的主要器官分化情况基本能与对照组保持一致(图 3、图 4). 0.50 mg·L-1暴露组中, 斑马鱼胚胎眼睛、体节和尾部的发育完成率较对照组略有下降(图 4). 而暴露于0.60和0.70 mg·L-1嘧菌酯的胚胎在体节形成、眼睛发育和尾部分离上明显落后于对照组. 在72 hpf时, 除0.70 mg·L-1组外, 各处理组中胚胎均完成了眼睛、体节和尾部的发育;而0.70 mg·L-1组的胚胎直到96 hpf时才完成了这3个器官的基本分化. 在48 hpf, 对照组和低浓度(0.05、0.25、0.50 mg·L-1)暴露组的胚胎均可观测到心脏及较明显的血液循环;0.60 mg·L-1暴露组中心脏发育率低于对照组;而0.70 mg·L-1暴露组中, 仅有50%的存活胚胎完成了心脏发育.
 |
| 图 3 嘧菌酯暴露组和对照组胚胎各时间点发育情况 Fig. 3 Embryonic development process of typical embryos exposed to all test dosages and control |
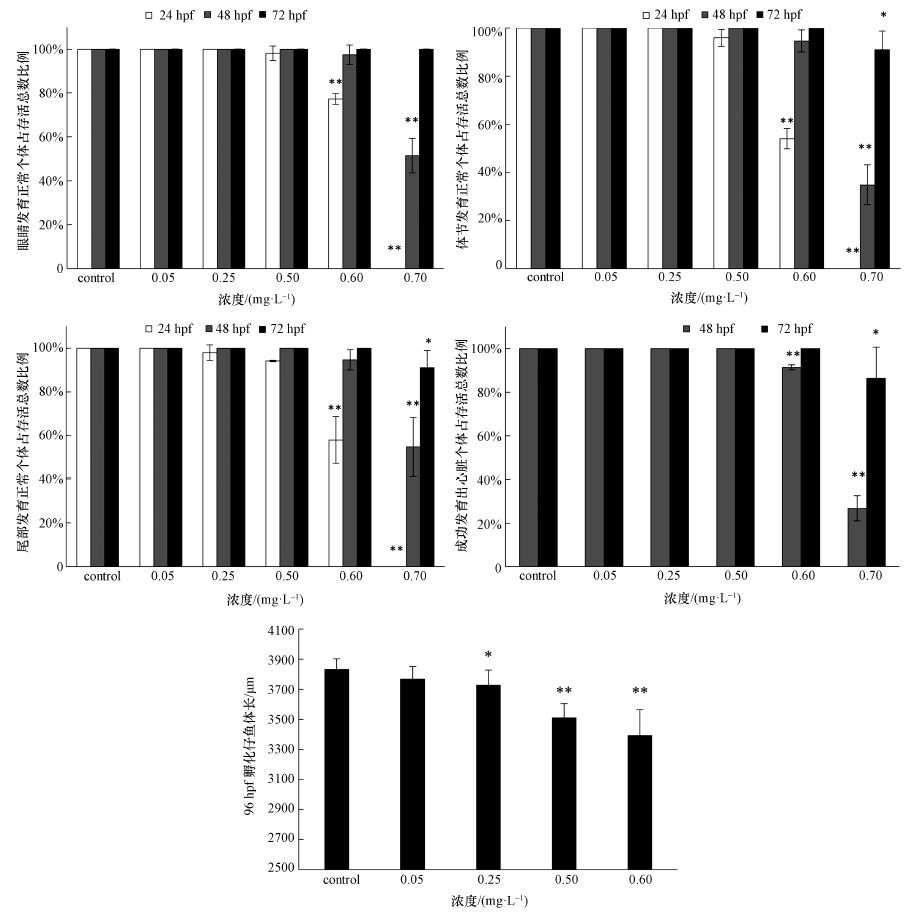 |
| 图 4 各处理组中胚胎眼睛、体节、尾部和心脏的发育比率和96 hpf各处理组孵化后仔鱼体长 Fig. 4 Percentage of developed eyes, somite, tail and heart of the total survival during each observation as well as the body length of the hatched larvae at 96 hpf |
哺乳动物试验发现, 嘧菌酯能抑制大鼠的心肌细胞分化, 50%抑制浓度为5 μmol·L-1(Kelly et al., 2011), 该研究表明嘧菌酯可能具备影响心脏发育的能力. 本研究中, 0.60 mg·L-1(约为 1.5 μmol·L-1)及更高浓度的嘧菌酯可明显抑制斑马鱼胚胎心脏的发育(图 4), 该剂量与Kelly等(2011) 的试验结果处于同一数量级. Olsvik等(2010) 研究报道, 0.352 mg·L-1的嘧菌酯暴露后, 大西洋鲑鱼(Salmo salar)肝脏中类胰岛素生长因子结合蛋白(IGFBP)1基因表达显著上调, 而该基因的上调会结合大量的IGF1, 进而导致生长被抑制, 作者因此认为甲氧丙烯酸酯类化合物长期暴露可能会对鱼类的生长造成影响.Liu等(2013) 进一步证明, 嘧菌酯暴露可导致草鱼稚鱼体内IGF-1、IGF-2及GHR3个发育相关基因表达水平下降, 这3个基因的下调可能进一步导致幼鱼发育延迟, 甚至造成畸形.上述结果从分子生物学角度提出了嘧菌酯抑制鱼类生长发育的潜在可能. 而本研究进一步发现, 嘧菌酯暴露后, 斑马鱼胚胎出现黑色素附着率下降、器官发育延迟和孵化后仔鱼的平均体长较短等症状, 本研究结果从形态学角度证实了嘧菌酯抑制鱼类胚胎发育的能力, 与Liu等(2013) 和Olsvik等(2010) 的结果相符.
3.5 嘧菌酯对斑马鱼胚胎的致畸作用嘧菌酯能诱导斑马鱼胚胎出现一系列畸形症状(图 5), 包括心包水肿(PE)、卵黄囊水肿、脊椎弯曲和卵黄囊畸形, 而对照组胚胎中未观测到异常.其中, 最明显的畸形是心包水肿.在72 hpf, 当嘧菌酯暴露浓度达到0.25 mg·L-1, 即可引起斑马鱼胚胎出现心包水肿, 畸形率为3.3%.随着暴露时间和暴露浓度的增加, 胚胎的畸形率进一步升高, 在96 hpf时, 0.70 mg·L-1暴露组中斑马鱼胚胎的心包水肿率可达40%.
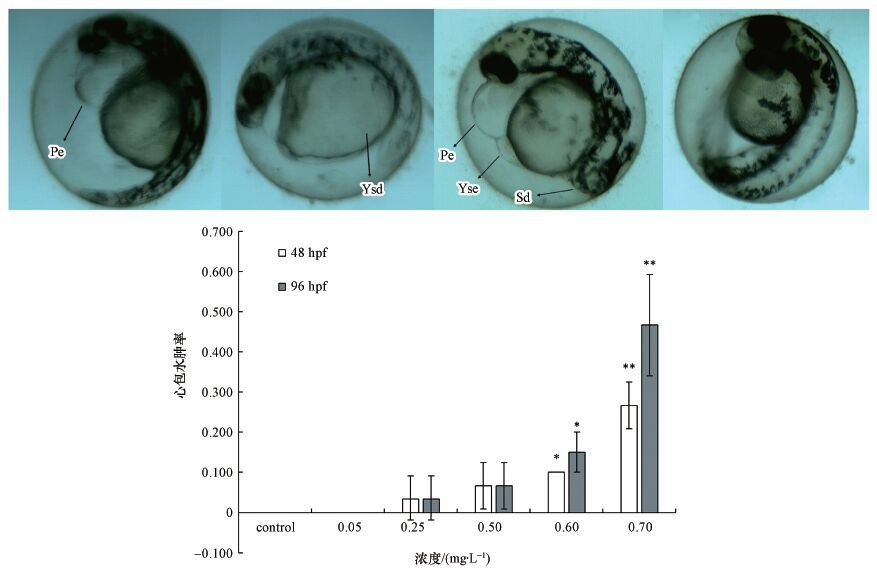 |
| 图 5 嘧菌酯对斑马鱼胚胎的致畸作用 (包括心包水肿(Pe)、卵黄囊水肿(Yse)、脊柱畸形(Sd)和卵黄囊畸形(Ysd))和斑马鱼胚胎的心包水肿率 Fig. 5 Teratogenic effects caused by azoxystrobin(including pericardial edema(Pe), yolk sac edema(Yse), spine deformity(Sd)and yolk sac deformity(Ysd))and the rate of pericardial edema at 48 and 96 hpf |
心包水肿是斑马鱼胚胎发育阶段最典型的畸形症状之一. 很多有毒物质均被证明能够诱导斑马鱼胚胎出现此类畸形, 但不同类别的化合物引起心包水肿的机制存在差异.已有研究证明, 视黄酸缺乏是引起斑马鱼胚胎出现心包水肿的原因之一(侯佳, 2008), Mu等(2016) 的研究发现, 苯醚甲环唑处理后的斑马鱼胚胎出现明显心包水肿, 同时伴随视黄酸代谢基因CYP26A1表达显著上调, 由此作者推断苯醚甲环唑引起的斑马鱼心包水肿可能与CYP26A1上调引起的视黄酸缺乏有关. 在本研究中, 0.60 mg·L-1的嘧菌酯可显著诱导斑马鱼胚胎出现心包水肿. 心脏的正常工作需要消耗大量的能量, 而这些能量主要通过线粒体呼吸作用来提供. 当生物体内能量供给不足时, 心脏的正常工作会受到影响, 并可能导致心脏病变(Kodde et al., 2007). 而嘧菌酯能阻碍线粒体呼吸电子传递进而抑制ATP合成(Bubici et al., 2006). 因此, 本研究中斑马鱼胚胎的心包水肿和心率下降等心脏异常, 可能是由于嘧菌酯抑制线粒体呼吸, 进而引起能量供应不足导致的.
3.6 环境中嘧菌酯对鱼类的风险根据本研究的结果, 0.25 mg·L-1的嘧菌酯可显著影响斑马鱼胚胎发育, 包括促进胚胎自主运动和心率, 以及抑制孵化后仔鱼体长.目前, 关于嘧菌酯在天然水样中被检出的报道很多(Battaglin et al., 2011;Reilly et al., 2012). Rodrigues等(2013) 对嘧菌酯在环境水域中的浓度进行了综述, 发现在已报道的结果中, 嘧菌酯在德国下萨克森州的河流中检出浓度最高, 为0.03 mg·L-1. 这一浓度与本研究中嘧菌酯对斑马鱼的最低致毒剂量(0.25 mg·L-1)还相差较大. 然而应注意的是, 在按照推荐剂量田间施药后, 嘧菌酯在稻田水中的检测浓度远高于0.25 mg·L-1(谢惠等, 2013), 高浓度的嘧菌酯可能对田间养殖的鱼类尤其是鱼苗产生影响. 因此, 嘧菌酯对稻田养殖水域中鱼类的危害应受到重视.
4 结论(Conclusions)1) 急性毒性结果表明, 嘧菌酯对斑马鱼成鱼96 h-LC50值为1.37 mg·L-1, 为中毒;而对斑马鱼胚胎和仔鱼96 h-LC50值分别为0.61和0.39 mg·L-1, 均为高毒. 因此, 嘧菌酯对鱼类早期生命阶段的影响值得关注.
2) 胚胎发育试验结果表明, 嘧菌酯可导致斑马鱼胚胎出现一系列发育异常, 包括孵化抑制、心率异常、器官分化延迟、生长抑制及心包水肿.
3) 0.25 mg·L-1的嘧菌酯即可对斑马鱼胚胎造成显著影响, 该浓度低于嘧菌酯在稻田水中的检出浓度, 因此, 其对稻田养殖的鱼类尤其是鱼苗的危害应受到重视.
| [${referVo.labelOrder}] | Abe T, Saito H, Niikura Y, et al. 2001. Embryonic development assay with Daphnia magna:application to toxicity of aniline derivatives[J]. Chemosphere, 45(4) : 487–495. |
| [${referVo.labelOrder}] | Bartlett D W, Clough J M, Godwin J R, et al. 2002. Review:the strobilurin fungicides[J]. Pest Management Science, 58(7) : 649–662. DOI:10.1002/(ISSN)1526-4998 |
| [${referVo.labelOrder}] | Battaglin W A, Sandstrom M W, Kuivila K M, et al. 2011. Occurrence of azoxystrobin,propiconazole,and selected other fungicides in US streams,2005-2006[J]. Water,Air,& Soil Pollution, 218(1/4) : 307–322. |
| [${referVo.labelOrder}] | Boudina A, Emmelin C, Baaliouamer A, et al. 2007. Photochemical transformation of azoxystrobin in aqueous solutions[J]. Chemosphere, 68(7) : 1280–1288. DOI:10.1016/j.chemosphere.2007.01.051 |
| [${referVo.labelOrder}] | Brion F, Tyler C R, Palazzi X, et al. 2004. Impacts of 17β-estradiol,including environmentally relevantconcentrations,on reproduction after exposure during embryo-larval-juvenile-and adult-life stages in zebrafish (Danio rerio)[J]. Aquatic Toxicology, 68(3) : 193–217. DOI:10.1016/j.aquatox.2004.01.022 |
| [${referVo.labelOrder}] | Bubici G, Amenduni M, Colella C, et al. 2006. Efficacy of acibenzolar-S-methyl and two strobilurins,azoxystrobin and trifloxystrobin,for the control of corky root of tomato and verticillium wilt of eggplant[J]. Crop Protection, 25(8) : 814–820. DOI:10.1016/j.cropro.2005.06.008 |
| [${referVo.labelOrder}] | Domingues I, Oliveira R, Lourenço J, et al. 2010. Biomarkers as a tool to assess effects of chromium (VI):comparison of responses in zebrafish early life stages and adults[J]. Comparative Biochemistry and Physiology,Part C, 152(3) : 338–345. |
| [${referVo.labelOrder}] | Embry M R, Belanger S E, Braunbeck T A, et al. 2010. The fish embryo toxicity test as an animal alternative method in hazard and risk assessment and scientific research[J]. Aquatic Toxicology, 97(2) : 79–87. DOI:10.1016/j.aquatox.2009.12.008 |
| [${referVo.labelOrder}] | Feng C, Xu Y, He Y, et al. 2010. Debrominated and methoxylated polybrominated diphenyl ether metabolites in rainbow trout (Oncorhynchus mykiss) after exposure to decabromodiphenyl ether[J]. Journal of Environmental Sciences, 22(9) : 1425–1434. DOI:10.1016/S1001-0742(09)60271-0 |
| [${referVo.labelOrder}] | Fraysse B, Mons R, Garric J. 2006. Development of a zebrafish 4-day embryo-larval bioassay to assess toxicity of chemicals[J]. Ecotoxicology and Environment Safety, 63(2) : 253–267. DOI:10.1016/j.ecoenv.2004.10.015 |
| [${referVo.labelOrder}] | Furzer G S, Veldhuis L, Hall J C. 2006. Development and comparison of three diagnostic immunoassay formats for the detection of azoxystrobin[J]. Journal of Agricultural and Food Chemistry, 54(3) : 688–693. DOI:10.1021/jf052424o |
| [${referVo.labelOrder}] | Giari L, Dezfuli B S, AStolfi L, et al. 2012. Ultrastructural effects of cisplatin on the inner ear and lateral line system of zebrafish (Danio rerio) larvae[J]. Journal of Applied Toxicology, 32(4) : 293–299. DOI:10.1002/jat.v32.4 |
| [${referVo.labelOrder}] | Glickman N S, Yelon D. 2002. Cardiac development in zebrafish:coordination of form and function[J]. Seminars in Cell and Developmental Biology, 13(6) : 507–513. DOI:10.1016/S1084952102001040 |
| [${referVo.labelOrder}] | Gustafsson K, Blidberg E, Elfgren I K, et al. 2010. Direct and indirect effects of the fungicide azoxystrobin in outdoor brackish water microcosms[J]. Ecotoxicology, 19(2) : 431–444. DOI:10.1007/s10646-009-0428-9 |
| [${referVo.labelOrder}] | 侯佳.2008.视黄酸缺乏对斑马鱼心脏发育影响的机制研究[D].上海:复旦大学 |
| [${referVo.labelOrder}] | Kawaguchi M, Yasumasu S, Hiroi J, et al. 2007. Analysis of the exon-intron structures of fish,amphibian,bird and mammalian hatching enzyme genes,with special reference to the intron loss evolution of hatching enzyme genes in Teleostei[J]. Gene, 392(1) : 77–88. |
| [${referVo.labelOrder}] | Kelly J C, Marianne B, Susan J, et al. 2011. Evaluation of 309 environmental chemicals using a mouse embryonic stem cell adherent cell differentiation and cytotoxicity assay[J]. PLoS One, 6(6) : 1–11. |
| [${referVo.labelOrder}] | Kodde I F, van der Stok J, Smolenski R T, et al. 2007. Metabolic and genetic regulation of cardiac energy substrate preference[J]. Comparative Biochemistry and Physiology Part A, 146(1) : 26–39. DOI:10.1016/j.cbpa.2006.09.014 |
| [${referVo.labelOrder}] | Lele Z, Krone P H. 1996. The zebrafish as a model system in developmental,toxicological and transgenic research[J]. Biotechnology Advances, 14(1) : 57–72. DOI:10.1016/0734-9750(96)00004-3 |
| [${referVo.labelOrder}] | Liu L, Jiang C, Wu Z, et al. 2013. Toxic effects of three strobilurin (trifloxystrobin,azoxystrobin and kresoxim-methyl) on mRNA expression and antioxidant enzymes in grasscarp (Ctenopharyngodon idella) juveniles[J]. Ecotoxicology and Environmental Safety, 98 : 297–302. DOI:10.1016/j.ecoenv.2013.10.011 |
| [${referVo.labelOrder}] | Martínez-Sales M, García-Ximénez F, Espinós F J. 2015. Zebrafish as a possible bioindicator of organic pollutants with effects on reproduction in drinking waters[J]. Journal of Environmental Sciences, 33 : 254–260. DOI:10.1016/j.jes.2014.11.012 |
| [${referVo.labelOrder}] | Mu X, Chai T, Wang K, et al. 2016. The developmental effect of difenoconazole on zebrafish embryos:A mechanism research[J]. Environmental Pollution, 212 : 18–26. DOI:10.1016/j.envpol.2016.01.035 |
| [${referVo.labelOrder}] | Mu X, Pang S, Sun X, et al. 2013. Evaluation of acute and developmental effects of difenoconazole via multiple stage zebrafish assays[J]. Environmental Pollution, 175 : 147–157. DOI:10.1016/j.envpol.2012.12.029 |
| [${referVo.labelOrder}] | Nagel R. 2002. DarT:the embryo test with the zebrafish Danio rerio-a general model in ecotoxicology and toxicology[J]. Altex, 19 : 38–48. |
| [${referVo.labelOrder}] | Newman M C, Unger M A. 2002. Fundamentals of Ecotoxicology(2nd edtion)[M]. LLC,Boca Raton: CRC Press. |
| [${referVo.labelOrder}] | Ochoa-Acuña H G, Bialkowski W, Yale G, et al. 2009. Toxicity of soybean rust fungicides to freshwater algae and Daphnia magna[J]. Ecotoxicology, 18(4) : 440–446. DOI:10.1007/s10646-009-0298-1 |
| [${referVo.labelOrder}] | OECD.1992.OECD Guidelines for the Testing of Chemicals. In:Section 2:Effects on Biotic Systems Test No.203:Acute Toxicity for Fish[S]. Paris:Organization for Economic Cooperation and Development |
| [${referVo.labelOrder}] | OECD.2013a.OECD Guidelines for the Testing of Chemicals. In:Section 2:Effects onBiotic Systems Test No.236:Fish Embryo Acute Toxicity (FET) Test[S]. Paris:Organization for Economic Cooperation and Development |
| [${referVo.labelOrder}] | OECD.2013b.OECD Guidelines for the Testing of Chemicals. In:Section 2:Effects onBiotic Systems Test No.210:Fish,Early-life Stage Toxicity Test[S]. Paris:Organization for Economic Cooperation and Development |
| [${referVo.labelOrder}] | Olsvik P A, Kroglund F, Finstad B, et al. 2010. Effects of the fungicide azoxystrobin on Atlantic salmon (Salmo salar L.) smolt[J]. Ecotoxicology and Environmental Safety, 73(8) : 1852–1861. DOI:10.1016/j.ecoenv.2010.07.017 |
| [${referVo.labelOrder}] | Parra J, Mercader J V, Agullo C, et al. 2012. Synthesis of azoxystrobin transformation products and selection of monoclonal antibodies for immunoassay development[J]. Toxicology Letters, 210(2) : 240–247. DOI:10.1016/j.toxlet.2011.07.030 |
| [${referVo.labelOrder}] | PMRA.2000. Pest management regulatory agency of health Canada, regulatory note:azoxystrobin[OL]2011-04-18. http://www.hc-sc.gc.ca/cps-spc/pubs/pest/_decisions/reg2000-15/index-eng.php |
| [${referVo.labelOrder}] | Reilly T J, Smalling K L, Orlando J L, et al. 2012. Occurrence of boscalid and other selected fungicides in surface water and groundwater in three targeted use areas in the United States[J]. Chemosphere, 89(3) : 228–234. DOI:10.1016/j.chemosphere.2012.04.023 |
| [${referVo.labelOrder}] | Rodrigues E T, Lopes I, Pardal M A. 2013. Occurrence,fate and effects of azoxystrobin in aquatic ecosystems:A review[J]. Environment International, 53 : 18–28. DOI:10.1016/j.envint.2012.12.005 |
| [${referVo.labelOrder}] | ŞişmanT. 2011. Early life stage and genetic toxicity of stannous chloride on zebrafish embryos and adults:Toxic effects of tin on zebrafish[J]. Environmental Toxicology, 2011, 26(3) : 240–249. |
| [${referVo.labelOrder}] | Sano K, Inohaya K, Kawaguchi M, et al. 2008. Purification and characterization of zebrafish hatching enzyme,an evolutionary aspect of the mechanism of egg envelope digestion[J]. FEBS Journal, 275(23) : 5934–5946. DOI:10.1111/j.1742-4658.2008.06722.x |
| [${referVo.labelOrder}] | Smalling K L, Kuivila K M, Orlando J L, et al. 2013. Environmental fate of fungicides and other current-use pesticides in a central California estuary[J]. Marine Pollution Bulletin, 73(1) : 144–153. DOI:10.1016/j.marpolbul.2013.05.028 |
| [${referVo.labelOrder}] | Ton S, Chang S, Hsu L, et al. 2012. Evaluation of acute toxicity and teratogenic effects of disinfectants by Daphnia magna embryo assay[J]. Environmental Pollution, 168 : 54–61. DOI:10.1016/j.envpol.2012.04.008 |
| [${referVo.labelOrder}] | US EPA,2012.ECOTOX database:aquatic report[OL].2012-07-07.http://cfpub.epa.gov/ecotox/advanced_query.htm |
| [${referVo.labelOrder}] | US EPA,1997.Azoxystrobin pesticide fact sheet[OL].2012-04-18.http://www.epa.gov/opprd001/factsheets/azoxystr.pdf |
| [${referVo.labelOrder}] | Wang R, Liu J, Yang X, et al. 2013. Biological responseof high-back crucian carp (Carassius auratus) during different life stages towastewater treatment plant effluent[J]. Environmental Science and Pollution Research, 20(12) : 8612–8620. DOI:10.1007/s11356-013-1817-4 |
| [${referVo.labelOrder}] | 王蕊, 殷浩文. 2004. 斑马鱼胚胎发育中适宜的毒理学指标分析[J]. 劳动医学, 2004, 21(2) : 88–89. |
| [${referVo.labelOrder}] | 王雨林. 2009. 稻田养鱼发展的现实意义分析[J]. 安徽农业科学, 2009, 37(27) : 13256–13258. |
| [${referVo.labelOrder}] | Winnicki A, Radziun M S, Radziun K. 1970. Structural and mechanical changes in the egg membranes of Salmo gairdneri Rich[J]. during the period of hatching of the larvas[J].Acta Ichthyol Piscat, 1(1) : 7–18. DOI:10.3750/AIP |
| [${referVo.labelOrder}] | 谢惠, 龚道新. 2013. 嘧菌酯在稻田水、土壤及水稻植株中的残留降解行为研究[J]. 湖南农业科学, 2013(1) : 80–83. |
| [${referVo.labelOrder}] | Yamamoto, M. 1975. Hatching Gland and Hatching Enzyme,in Medaka (Killifish):Biology and Strains[M]. Tokyo: Keigaku Publishing Company: 73–79. |
| [${referVo.labelOrder}] | Yang L, Ho N Y, Alshut R, et al. 2009. Zebrafish embryos as models for embryotoxic and teratological effects of chemicals[J]. Reproductive Toxicology, 28(2) : 245–253. DOI:10.1016/j.reprotox.2009.04.013 |
| [${referVo.labelOrder}] | Zafar M I, Belgers J D M, van Wijngaarden R P, et al. 2012. Ecological impacts of time-variable exposure regimes to the fungicide azoxystrobin on freshwater communities in outdoor microcosms[J]. Ecotoxicology, 21(4) : 1024–1038. DOI:10.1007/s10646-012-0856-9 |
| [${referVo.labelOrder}] | Zhang Z, Hu J. 2008. Effects of p,p'-DDE exposure on gonadal development and gene expression in Japanese medaka (Oryzias latipes)[J]. Journal of Environmental Sciences, 20(3) : 347–352. DOI:10.1016/S1001-0742(08)60054-6 |
| [${referVo.labelOrder}] | Zha J, Wang Z. 2005. Assessing technological feasibility for wastewater reclamation based on early life stage toxicity of Japanese medaka (Oryzias latipes)[J]. Agricultural Ecosystems & Environment, 107(2) : 187–198. |
| [${referVo.labelOrder}] | 国家质量监督及检验检疫总局.2011.化学品鱼类急性毒性试验[S]. 北京:国家质量监督及检验检疫总局 |
| [${referVo.labelOrder}] | Zhou S, Dong Q, Li S, et al. 2009. Developmental toxicity of cartap on zebrafish embryos[J]. Aquatic Toxicology, 95(4) : 339–346. DOI:10.1016/j.aquatox.2009.10.006 |
| [${referVo.labelOrder}] | Zhu L, Wang H, Liu H, et al. 2014. Effect of trifloxystrobin on hatching,survival,and gene expression of endocrine biomarkers in early life stages of medaka (Oryzias latipes)[J]. Environmental Toxicology, 30(6) : 648–655. |
| [${referVo.labelOrder}] | Zucchi S, Blüthgen N, Ieronimo A, et al. 2011. The UV-absorber benzophenone-4 alters transcripts of genes involved in hormonal pathways in zebrafish (Danio rerio) eleuthero-embryos and adult males[J]. Toxicology and Applied Pharmacology, 250(2) : 137–146. DOI:10.1016/j.taap.2010.10.001 |
 2017, Vol. 37
2017, Vol. 37


