β-HCH是一种典型的有机氯农药及持久性有机污染物,具有化学性质稳定、不易降解、残留期长、易在土壤中蓄积等特点.虽然我国已于1983年开始禁止使用β-HCH,但由于其持久性,各种环境介质特别是土壤中仍然能检测到β-HCH的残留(时磊等,2015; Yanget al.,2012).
吸附作用是有机污染物在土壤中迁移转化的重要途径.溶解性有机质是最活跃的有机质之一,尽管占有机质的比例很小,但对有机污染物在土壤中的吸附行为起着决定作用(Wanget al.,2012;Flores Céspedes et al.,2006).一方面,DOM中的疏水基团容易与疏水性有机污染物结合形成配合物,既可以促进有机物在溶液中的溶解,也可以导致有机物与DOM产生共迁移,使其从土壤环境中迁移和扩散出来( Williams et al.,2000),从而抑制土壤对有机污染物的吸附.Smith等(2011)研究表明,DOM能促进多环芳烃(PAHs)从非水相向水相迁移,增加其表观溶解态的浓度;雷秋霜等(2014)的研究则表明,DOM具有表面活性剂的性质.另一方面,DOM在土壤表面以累积吸附的形式增加了土壤有机碳含量,使土壤表面吸附点位增加,对有机物的吸附容量也随之增加.赵晓丽等(2014)研究指出,DOM可以与有机污染物先结合形成复合物,然后以复合物的形式被吸附到土壤中.不同的DOM组分对DOM在土壤中的环境行为影响很大.Wu等(2012)研究表明,PAHs与大分子量DOM组分结合的分配系数明显大于小分子量的DOM组分,这与大分子量DOM组分具有更低的极性、更强的疏水性与芳香性有关.Stumpe等(2010)研究发现,污泥中芳香性组分与土壤DOM中非芳香性组分存在动态交换过程,芳香性组分的增加可促进土壤和沉积物对雌二醇的吸附.总之,DOM对有机污染物在土壤中的迁移吸附作用机理影响复杂,有必要结合其组分特征进行深入的研究.
目前,关于DOM对有机氯农药的吸附影响研究较少,并且主要集中于外源DOM上.而内源DOM作为土壤的固有组分之一,对污染物的吸附影响不容忽视.因此,本文选取β-HCH作为有机氯农药的代表,结合土壤内源DOM及不同外源DOM的紫外-可见荧光光谱和三维荧光光谱特征,探讨内、外源DOM的不同结构组分对土壤吸附β-HCH的作用,以期进一步揭示有机氯农药在土壤中的环境行为.
2 材料与方法(Materials and methods) 2.1 实验材料 2.1.1 实验试剂与仪器主要试剂β-HCH标准品购自美国AccuStandard公司;甲醇(农残级)购自美国TEDIA公司;NaN3和无水CaCl2均为分析纯.
主要仪器:气相色谱仪(Agilent-7890A),紫外-可见分光光度计,荧光光谱仪,恒温振荡仪(SHA-B),氮空吹扫浓缩仪(SPT-24),总有机碳(TOC)分析仪(Apollo9000).
2.1.2 供试土样作吸附剂的土样供试土壤采自江汉平原四湖流域上区长湖至汉江一带的农田.江汉平原是我国重要的产粮基地,农田众多,曾是有机氯农药使用的重灾区,因此,研究该区土壤对β-HCH的吸附影响因素极具代表性.本次研究在水稻地和蔬菜地各选取1个采样点采集土样,编号分别为A水稻土和B菜地土,经纬度分别为30°32′54.5″N、112°40′11.5″E和30°27′10.5″N、112°35′15.2″E.采集的土壤样品在室内自然风干后,去除石块、动植物残体等杂质,研碎后过20目筛;按丛鑫等(2012)的分类方法对土壤进行分析,其主要理化性质见表 1,矿物含量见表 2.
| 表 1 土壤样品的主要理化性质 Table 1 Major physicochemical properties of the soils |
| 表 2 土壤的矿物含量 Table 2 Content of mineralin the soils |
去除DOM的土样:分别称取若干份12 g的A、B土样,每份土样分别与120 mL超纯水混合,于200 r·min-1、25 ℃恒温条件下振荡2 h,离心后,取滤液测定DOC,计算DOM的去除量.重新加入等量超纯水,重复该过程至DOC测定结果不再变化.结果表明,A土和B土DOM的去除率均能达到90%以上.土样风干后磨碎,过20目筛,作为去除内源DOM的土样.本实验中,去除内源DOM的A、B土样分别编号为A-DOM和B-DOM.
营养土:营养土是为了满足幼苗生长发育而专门配制的含有多种矿质营养,一般由肥沃的大田土与腐熟厩肥混合配制而成的床土.本实验所用购自花圃.
污泥:取自小河底部,自然风干后,去除石块、动植物残体等杂质,研碎后过20目筛
2.1.3 溶液的配制背景电解质溶液准确称取1.1098 g无水CaCl2(背景电解质)和100 mg NaN3(抑菌剂),加超纯水溶解并定容至1000 mL,配得浓度为0.01 mol·L-1的背景电解质溶液,现配现用.
β-HCH标准液:准确称取0.0100 g β-HCH标准品,用25 mL甲醇溶解定容,得到β-HCH浓度为400 μg·mL-1的标准液;吸取5 mL β-HCH标准液,用背景电解质溶液定容至1000 mL,配得的储备液β-HCH浓度为2 μg·mL-1.
DOM提取液:将供试土样B土、淤泥、营养土风干,过20目筛,备用.分别取3种土样各10 g于15 mL具塞锥形瓶中,加入100 mL超纯水溶解,于200 r·min-1、25 ℃恒温条件下振荡12 h,离心30 min,上清液过0.45 μm的滤膜,所得滤液即为各土壤DOM溶液.将上述方法提取的3种DOM溶液经TOC分析仪测定后,统一稀释到45 mg·L-1浓度备用.
2.2 实验方法 2.2.1 去除内源DOM后的吸附实验称取若干份A土、B土、A-DOM土、B-DOM土,质量均为0.20 g,置于一系列25 mL锥形瓶中,分别加入10 mL β-HCH浓度分别为10、20、30、50、80 ng·mL-1等系列浓度的溶液.采用批量实验的方法,在(25±1)℃和200 r·min-1条件下恒温振荡24 h至吸附平衡(根据吸附动力学实验研究,吸附平衡时间定为24 h)后,以3000 r·min-1离心10 min,取5 mL上清液经C18固相萃取柱用二氯甲烷萃取后,过无水Na2SO4干燥,并用正己烷置换,氮吹浓缩至0.2 mL,加入内标五氯硝基苯(PCNB).每组实验重复3次.通过分析β-HCH溶液的初始浓度和平衡浓度的差值,确定土壤对 β-HCH的吸附量.
2.2.2 加入外源DOM后的吸附实验称取若干份质量均为0.20 g的A土样于一系列25 mL锥形瓶中,分别加入10 mL DOM浓度均为20 mg·L-1的淤泥DOM溶液、营养土DOM溶液和B土DOM溶液.在上述锥形瓶中分别加入10 mL浓度分别为10、20、30、50、80 ng·mL-1等系列浓度的 β-HCH溶液,采取批量实验的方法,吸附平衡后的处理和分析方法同2.2.1 节.
2.2.3 紫外-可见光谱实验紫外-可见光谱在岛津UV-2550紫外-可见分光光度计上进行测定.扫描波长设定为200~700 nm,程序自动绘制扫描光谱曲线.根据光谱数据计算特征紫外吸光系数SUVA254和SUVA260.
2.2.4 三维荧光光谱实验DOM的三维荧光光谱测定在FP-6500型荧光光谱仪上进行.激发光源为150 W氙弧灯;PMT电压700 V;信噪比>110;带通(Bandpass):激发波长λEx=3 nm,发射波长λEm=5 nm;响应时间设为自动;扫描速度1000 nm·min-1;扫描波长范围为:λEx=200~450 nm,λEm=200~600 nm;扫描光谱进行仪器自动校正.
2.2.5 仪器检测DOM的测定是通过TOC仪测定溶液中DOC的含量而得.β-HCH利用气相色谱仪测定.配63Ni电子捕获检测器,色谱柱为HP-5石英毛细管柱(30 m×0.32 mm×0.25 μm),进样口温度230 ℃,检测器温度280 ℃.待测样品采用无分流进样,内标法定量.本实验溶液中β-HCH的方法回收率为89%.
3 结果与讨论(Results and discussion) 3.1 光谱特征分析 3.1.1 紫外-可见光谱特征分析对A土、B土、营养土、淤泥4种土壤的DOM进行紫外-可见光谱特征分析,紫外光谱特征光谱参数如表 3所示.
| 表 3 4种土壤DOM的特征光谱参数 Table 3 Feature spectral parameter of different DOM |
紫外-可见光谱特征可以反映DOM本身的性质(共轭体系、腐殖化程度、腐殖物质组成等).SUVA254主要用来表征DOM芳香性及腐殖程度的强弱,SUVA254值越大,DOM芳香化程度越高( et al,2003),腐殖程度也越高(谢理等,2013).而SUVA260与DOM中疏水性有机组分含量成正比(Jaffrain et al.,2007).由表 3可知,4种DOM的SUVA254、SUVA260大小排序一致,由大到小顺序为:营养土>A土>淤泥>B土,表明DOM的芳香性、腐殖程度和疏水性由强到弱的分别是:营养土、A土、淤泥、B土.
E253/E203和E253/E220的值能反映芳香环的取代程度及取代基种类,E253/E203和E253/E220值较小时,芳香环上的取代基脂肪链含量较多,而值较大时,芳香环上的取代基中羰基、羧基、羟基、酯类含量较高(Korshin et al.,1997).由各种土壤DOM的E253/E203和E253/E220的大小,结合其芳香性和疏水性,推测营养土DOM芳香环上的取代基中羰基、羧基、羟基、酯类含量最高,淤泥DOM中脂肪链最多.A土中羰基、羧基、羟基、酯类含量含量少于B土.
E250/E365的大小与DOM的分子量大小呈负相关,该值越大则DOM的分子量越小(Dorado et al.,2003).由4种土壤DOM的E250/E365值可知,各土壤DOM分子量大小排序为:B土>营养土>A土>污泥.
3.1.2 三维荧光光谱特征分析利用三维荧光光谱对4种土的DOM进行组分分析,结果见图 1和表 4.Baker等(2002)研究表明,不同来源的溶解有机质具有不同的荧光基团,并且荧光峰的位置和荧光强度也不相同,故可利用三维荧光峰位置区分DOM的来源及组成.一般而言,天然环境中各种溶解性有机质的λEx/λEm荧光峰位置可概述如下:ClassI(λEx约为350~440 nm,λEm约为430~510 nm)、ClassII(λEx约为310~360 nm,λEm约为370~450 nm)、ClassIII(λEx约为260~290 nm,λEm约为300~350 nm)、ClassIV(λEx约为240~270 nm,λEm约为370~440 nm).其中,ClassI 为类腐殖酸荧光,ClassII与ClassIV为类富里酸荧光,ClassIII为类蛋白荧光(Wu et al.,2001; Leenheer et al.,2003).由图 1、表 4可知,对4种土壤DOM的对比可知,除B土DOM外,其他3种土壤DOM的三维荧光谱峰位置(λEx/λEm)均为350 nm/430 nm,且出峰区域更多的处于类腐殖质荧光峰区域,故可推断A土、淤泥、营养土的DOM成分以类腐殖质为主.而营养土DOM谱峰的荧光强度明显高于比其他3种样品,说明营养土DOM中类腐殖质的含量最多.
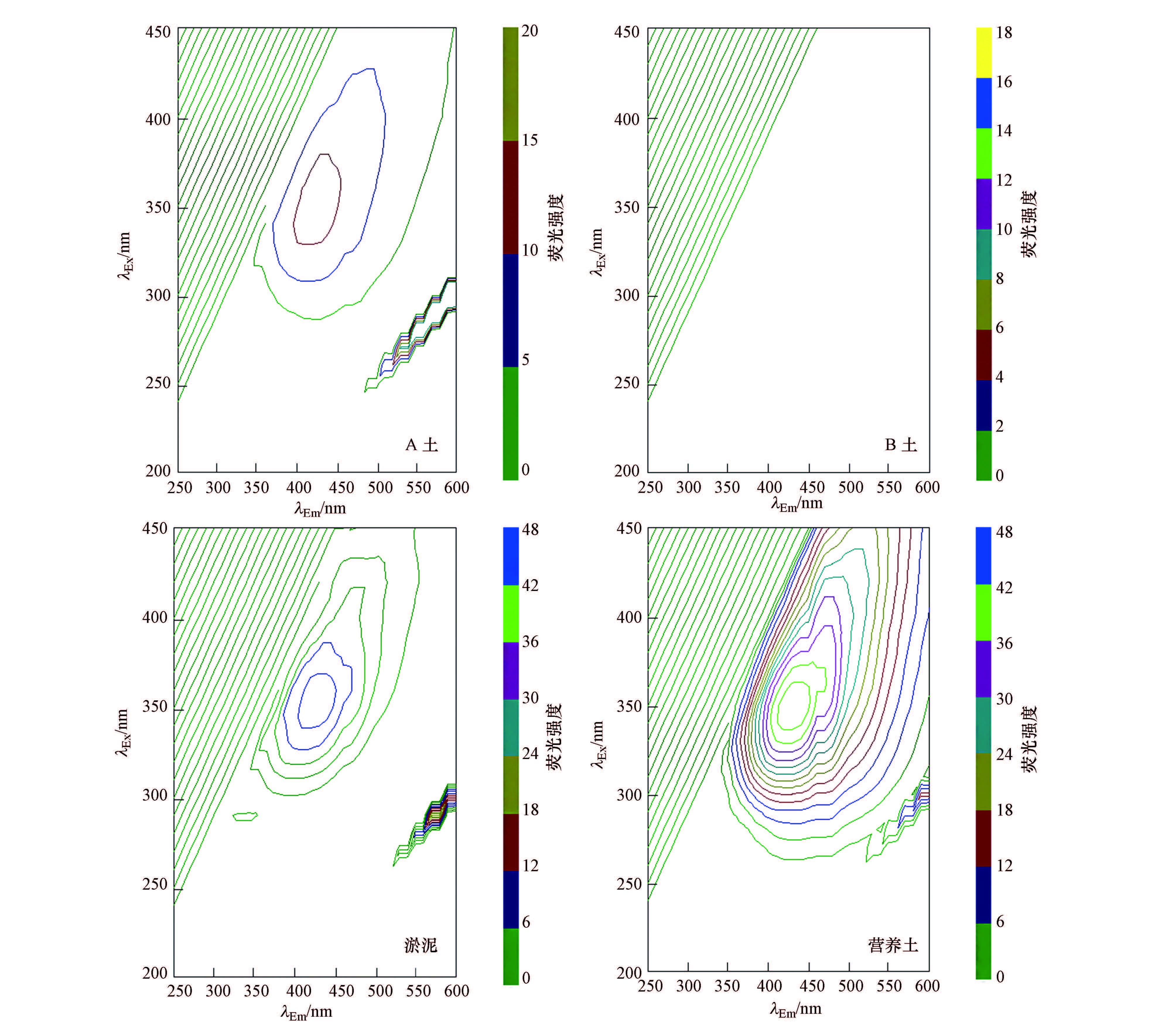 |
| 图 1 土壤中DOM样品的三维荧光光谱 Fig. 1 Three-dimensional fluorescence spectrum of DOM in different soils |
| 表 4 土壤DOM样品的三维荧光光谱参数 Table 4 Three-dimensional fluorescence parameters of soils |
Hernández等(1990)的研究表明,土壤中类腐殖质类物质和土壤中的腐殖酸(具有弱酸性、亲水性)相比,具有更低的含碳量、羧酸量及总酸度,类腐殖质中的主要官能团有脂肪基、甲基、亚甲基和肽键,并以长链烷烃为主,具有疏水酸性.结合图 1、表 3可知,营养土的DOM中含有最多的疏水组分和芳香基团,且类腐殖质的含量和种类最多,具有疏水酸性.淤泥DOM中类腐殖质组分荧光信号较弱,芳香环取代基上脂肪链含量较多,相比营养土DOM,其疏水酸性要弱很多.A土中DOM除含有少量的芳香性官能团和共轭双键外,芳香环取代基上还含有羧基、羰基等吸电子基团,且A土DOM的疏水性强于淤泥,故A土中DOM主要含有疏水性的组分.B土DOM中并未检测到荧光信号,且其芳香性非常弱,几乎没有共轭结构,推断其DOM以不产生荧光信号的亲水性组分为主.
3.2 内源DOM对 β-HCH在土壤上的吸附影响图 2显示了在内源DOM存在和去除内源DOM的条件下,β-HCH在土壤中的线性吸附等温线.分别对比图 2中A土、A-DOM和B土、B-DOM的吸附等温线可以发现,去除DOM后,土壤对β-HCH的吸附量均有不同程度的增加,说明土壤中的内源DOM抑制了β-HCH在土壤中的吸附,这可能是由于内源DOM存在时,与β-HCH竞争土壤中有限的吸附位点,从而减少了土壤对β-HCH的吸附(占新华等,2007).另外,A、B土中的DOM都含有芳香环,内源DOM还可能与β-HCH通过NH-π、π-π、分配作用及疏水作用形成配合物,从而对β-HCH产生增溶作用(Magee et al.,1991),以致减少了土壤对β-HCH吸附.
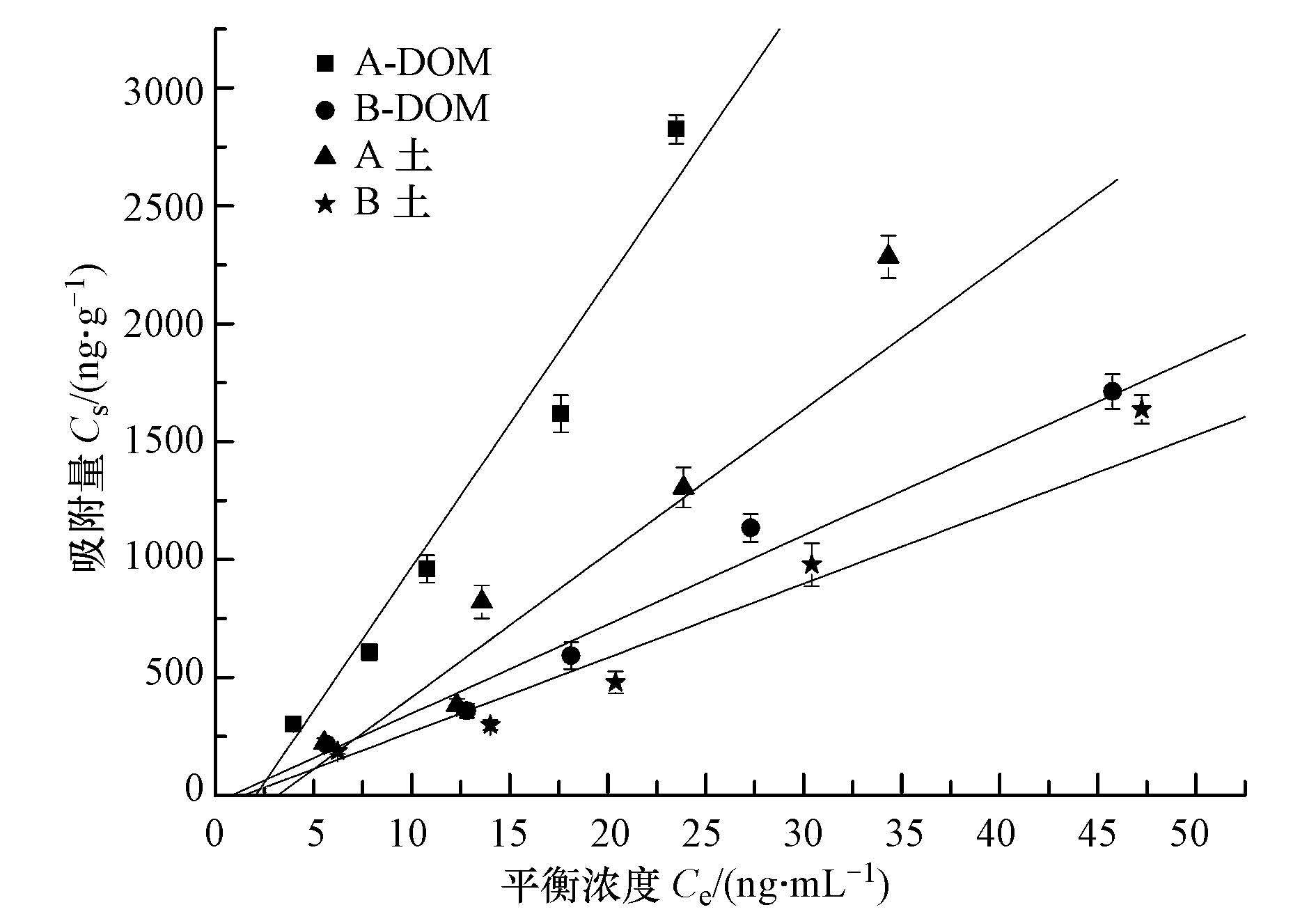 |
| 图 2 内源DOM对β-HCH在土壤中吸附等温线的影响 Fig. 2 The effect of endogenous DOM on the adsorption isotherms of β-HCH in the soils |
将图 2中各吸附等温线数据用线性方程拟合,结果列于表 5.由表 5可以看出,β-HCH在A土、A-DOM、B土、B-DOM中的吸附等温线的R2值分别为0.9634、0.9663、0.9766、0.9808,均大于0.963,表明线性方程能够很好地描述去除内源DOM后对β-HCH在土壤上的吸附影响,说明去除DOM前和去除DOM后β-HCH在土壤上的吸附均是以分配作用为主.线性吸附系数Kd值的大小可以反映吸附能力的强弱.去除DOM后,β-HCH在A-DOM和B-DOM上的吸附系数Kd值分别达到了125.99 mL·g-1和39.47 mL·g-1,比A土和B土均有增加,说明内源DOM对有机污染物在土壤上的吸附具有一定的抑制作用.A-DOM的Kd值增加幅度较大,说明DOM对A土的吸附抑制作用更强.由于腐殖质是天然水体中最重要的有机螯合剂,可以与β-HCH发生络合和螯合作用,从而促进β-HCH在水中的溶解,减少β-HCH在土壤中的吸附.另外,Perminova等(1999)研究表明,DOM对PAHs的吸附容量与其芳香度有关,DOM芳香性增加,聚合体极性增强,与有机污染物的吸附结合能力也随之增强,从而制约有机污染物迁移到土壤中.根据3.1节中的光谱分析,A土DOM的成分以类腐殖质为主,且腐殖程度和芳香性都强于B土,这可能是DOM对A土的吸附抑制作用强于B土的一个原因.再者,据Raber等(1998)的研究,DOM的疏水性组分含量越高,与疏水性有机污染物的配合能力越强,从而能增加疏水性有机污染物在水中的溶解度,抑制土壤对污染物的吸附.光谱分析得到的结果表明,A土中DOM的疏水性强于B土,故A土中的DOM与β-HCH的配合能力更强,它对土壤吸附β-HCH的抑制作用也越大.
| 表 5 β-HCH在A、B土壤中吸附等温线的线性方程拟合结果 Table 5 The fired results for isotherms of β-HCH in the A,B soils by the linear models |
加入不同外源DOM后β-HCH在A土上的吸附等温线见图 3,其中,试验时加入的提取自淤泥的DOM溶液、营养土的DOM溶液及B土的DOM溶液的吸附等温线分别用A+DOM淤、A+DOM营、A+DOMB表示.
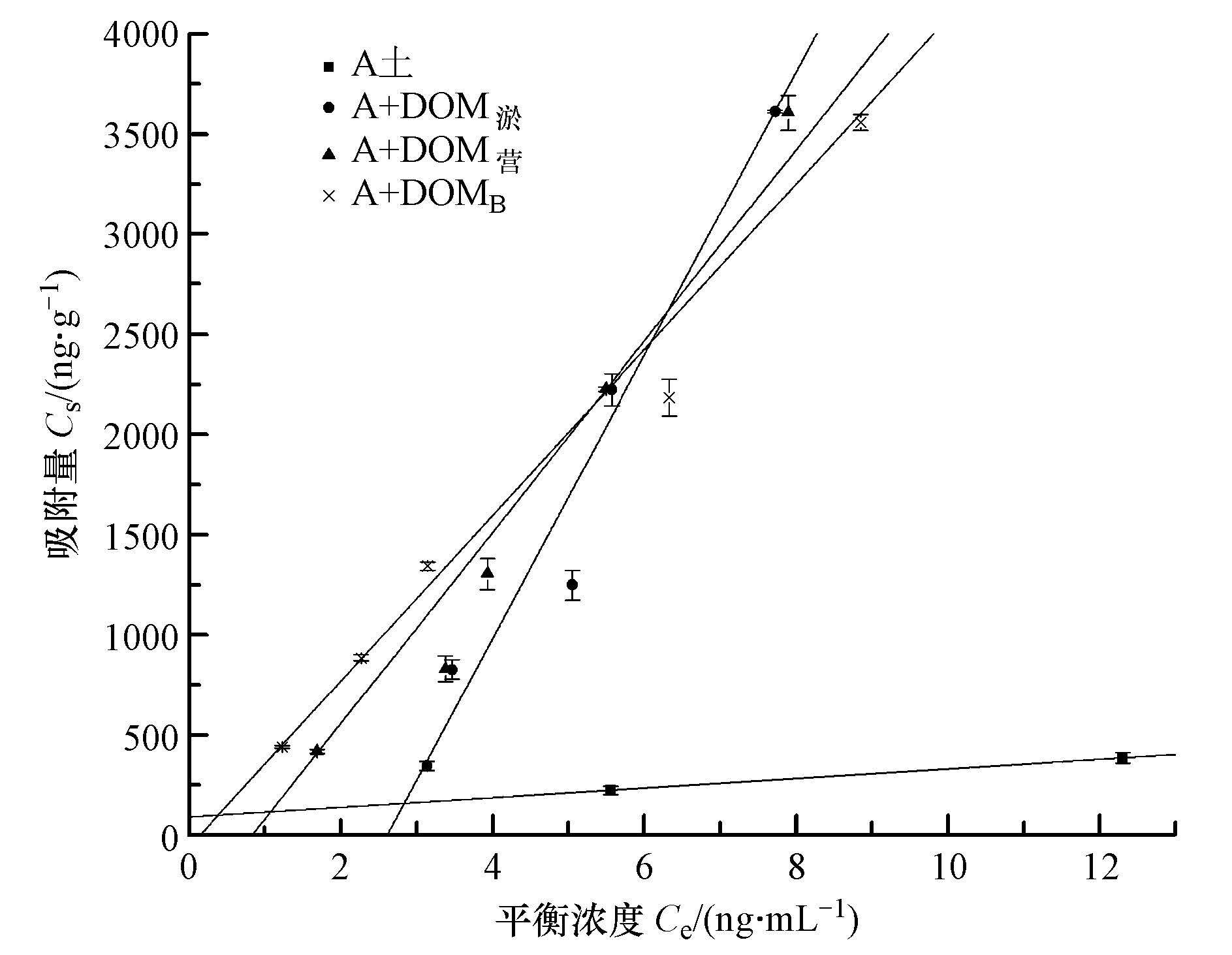 |
| 图 3 加入外源DOM后A土对β-HCH的吸附等温线 Fig. 3 The effect of exogenous DOM on the adsorption isotherms of β-HCH in the soils |
将图 3中各吸附等温线数据用线性方程拟合,结果列于表 6.拟合结果表示,其可决系数均达到0.95以上,说明线性模型能较好地描述它们的吸附过程.线性模型的吸附系数(Kd)可以反映土壤对污染物的吸附能力,Kd越大,表明吸附能力越强.由表 6可见,β-HCH在添加了淤泥、营养土、B土DOM溶液后Kd分别达到了688.60、535.77、387.22 mL·g-1,与未添加任何外源DOM的A土Kd(72.34 mL·g-1)相比有显著的增强.说明加入外源DOM之后,土壤对 β-HCH的吸附能力有了明显的增强.可能是由于加入外源DOM后,与β-HCH在土壤表面发生共吸附和累积吸附作用,增加了土壤的有机质含量,形成新的吸附位点,从而促进了土壤对β-HCH的吸附.并且,Kaiser等(1998)研究表明,通常含高分子量或疏水性组分较高的DOM更容易被土壤吸附.在本试验添加的来源于营养土、淤泥和B土的3种DOM中,B土DOM的分子量最大,营养土和淤泥的DOM具有疏水性,这可能是3种DOM均能明显促进β-HCH在土壤中吸附的原因.
| 表 6 β-HCH在A土中的吸附等温线的线性方程拟合结果 Table 6 The fired results for isotherms of β-HCH in the A soil by the linear models |
对比加入各DOM后A土对β-HCH的吸附能力,其大小顺序为:A+DOM淤>A+DOM营>A+DOMB,说明不同来源的DOM对 β-HCH的吸附能力的影响不同.这可能与构成DOM大分子的某些基团的含量不同有关,如DOM中的羰基会与β-HCH中的氢形成氢键;还有可能与DOM中的大分子的骨架有关,如骨架中的苯环可能会与β-HCH中的平面苯环π电子重迭而形成共轭( Xing et al.,1998);也可能是DOM骨架中的非极性烃类与非极性的有机物之间的范德华力引起的.
为进一步说明不同外源DOM影响土壤吸附β-HCH的原因,结合3种土壤DOM的化学结构进行分析.对比3种土壤DOM的三维荧光光谱图发现,B土具有亲水性,且芳香环上面的取代基最少,故其促进作用最弱.营养土的DOM中含有最多的疏水组分和最多的芳香基团,且类腐殖质含量最高.淤泥DOM中类腐殖质组分荧光信号较弱,芳香环取代基上脂肪链含量较多.理论上营养土DOM的促进作用应大于淤泥.但是一方面,由于营养土具有疏水酸性,且酸性强于淤泥,土壤与具有疏水酸性的DOM结合后,通过疏水组分形成疏水区域,该区域内部是疏水性的,外部由亲水性的和离子化的基团构成,这就使得土水界面更具亲水性(Bo et al.,2008),更易吸附水分子而不是β-HCH,从而在一定程度上降低了土壤对β-HCH的吸附.另一方面,DOM对有机化合物的亲和力大小很大程度上取决于DOM的分子量组成,尤其是它们的大分子组分( Kögel Knabner et al.,1997).DOM中大分子组分含量越高,其内部疏水区也越多,对疏水有机污染物的亲和力也越大,从而会在一定程度上阻碍土壤对污染物的吸附.在本试验中,DOM分子量由大到小的顺序依次为B土、营养土、淤泥,因此,最终呈现出的吸附能力最强的是A+DOM淤,最弱的是A+DOMB.
4 结论(Conclusions)1) 营养土DOM芳香性和腐殖化程度最高,疏水性最强;淤泥DOM中芳香环取代基上脂肪链含量较多,疏水酸性弱于营养土;A土DOM中含有芳香性官能团、共轭双键及较多的吸电子基团;B土DOM芳香性较弱,以亲水性组分为主.
2) 内源DOM抑制了土壤对 β-HCH的吸附,A土疏水性强于比B土,使其内源DOM对土壤吸附 β-HCH有更强的抑制作用;外源DOM促进了土壤对 β-HCH的吸附,加入外源DOM后促进作用的强弱顺序为:淤泥>营养土>B土,土壤DOM的疏水组分、芳香基团及类腐殖质含量均能促进土壤对 β-HCH吸附,但疏水酸性会减弱土壤对 β-HCH的吸附能力.
| [${referVo.labelOrder}] | Baker A. 2002. Fiuorescence excitation-emission matrix characterization of river waters impacted by a tissue miii effiuent[J]. Environmental Science & Technology, 36(7) : 1377–1382. |
| [${referVo.labelOrder}] | Bo P, Saikat G, Baoshan X. 2008. Dissolved organic matter conformation and its interaction with pyrene as affected by water chemistry and concentration[J]. Environmental Science & Technology, 42(5) : 1594–1599. |
| [${referVo.labelOrder}] | 丛鑫, 燕云仲, 薛杨, 等. 2012. 污染场地不同深度土壤有机-矿质复合体中有机氯农药的分布[J]. 环境工程学报, 2012, 6(8) : 2882–2886. |
| [${referVo.labelOrder}] | Dorado J, González-Vila F J, Zancada M C, et al. 2003. Pyrolytic descriptors responsive to changes in humic acid characteristics after long-term sustainable management of dry land farming systems in Central Spain[J]. Journal of Analytical & Applied Pyrolysis, 68-69(16) : 299–314. |
| [${referVo.labelOrder}] | Flores Céspedes F, Fernández Pérez M, Villafranca-Sánchez M, et al. 2006. Cosorption study of organic pollutants and dissolved organic matter in a soil[J]. Environmental Pollution, 142(3) : 449–56. DOI:10.1016/j.envpol.2005.10.019 |
| [${referVo.labelOrder}] | Hernández M T, Moreno J I, Costa F, et al. 1990. Structural features of humic acidlike substances from sewage sludges[J]. Soil Science, 149(2) : 63–68. DOI:10.1097/00010694-199002000-00001 |
| [${referVo.labelOrder}] | Jaffrain J, Gerard F, Meyer M, et al. 2007. Assessing the quality of dissolved organic matter in forest soils using ultraviolet absorption spectrophotometry[J]. Soil Science Society of America Journal, 71(6) : 1851–1858. DOI:10.2136/sssaj2006.0202 |
| [${referVo.labelOrder}] | Kaiser K, Zech W. 1998. Rates of dissolved organic matter release and sorption in forest soils[J]. Soil Science, 163(9) : 714–725. DOI:10.1097/00010694-199809000-00005 |
| [${referVo.labelOrder}] | Kögel Knabner I, Totsche K U, Danzer J. 1997. Dissolved organic matter-enhanced retention of polycyclic aromatic hydrocarbons in soil miscible displacement experiments[J]. Journal of Environmental Quality, 26(4) : 1090–1100. |
| [${referVo.labelOrder}] | Korshin G V, Benjamin M M, Sletten R S. 1997. Adsorption of natural organic matter (NOM) on iron oxide:Effects on NOM composition and formation of organo-halide compounds during chlorination[J]. Water Research, 31(7) : 1643–1650. DOI:10.1016/S0043-1354(97)00007-9 |
| [${referVo.labelOrder}] | Leenheer J A, Crou J P. 2003. Characterizing aguatic dissolved organic matter[J]. Environmental Science & Technology, 37(1) : 19–26. |
| [${referVo.labelOrder}] | 雷秋霜, 杨秀虹, 方志文, 等. 2014. 森林新近凋落叶溶出DOM的性质及其对菲增溶作用的影响[J]. 生态环境学报, 2014, 23(1) : 170–177. |
| [${referVo.labelOrder}] | Magee B R, Lion L W, Lemley A T. 1991. Transport of dissolved organic macromolecules and their effect on the transport of phenanthrene in porous media[J]. Environmental Science & Technology, 25(2) : 323–331. |
| [${referVo.labelOrder}] | Perminova I V, Petrosyan V S. 1999. Relationships between structure and binding affinity of humic substances for polycyclic aromatic hydrocarbons:Relevance of molecular descriptors[J]. Environmental Science & Technology, 33(21) : 3781–3787. |
| [${referVo.labelOrder}] | Raber B, Köge1 K I, Stein C, et al. 1998. Partitioning of polycyclic aromatic hydrocarbons to dissolved organic matter from different soils[J]. Chemosphere, 36(1) : 79–97. DOI:10.1016/S0045-6535(97)00352-4 |
| [${referVo.labelOrder}] | 时磊, 孙艳艳, 吕爱娟. 2015. 苏南典型土壤中22种有机氯农药的垂直分布特征[J]. 生态环境学报, 2015, 24(9) : 1547–1553. |
| [${referVo.labelOrder}] | Smith K E C, Thullner M, Wick L Y, et al. 2011. Dissolved organic carbon enhances the mass transfer of hydrophobic organic compounds from nonaqueous phase liquids (NAPLs) into the aqueous phase[J]. Environmental Science & Technology, 45(20) : 8741–8747. |
| [${referVo.labelOrder}] | Stumpe B, Marschner B. 2010. Dissolved organic carbon from sewage sludge and manure can affect estrogen sorption and mineralization in soils[J]. Environmental Pollution, 158(1) : 148–154. DOI:10.1016/j.envpol.2009.07.027 |
| [${referVo.labelOrder}] | Wang X P, Sheng J J, Gong P, et al. 2012. Persistent organic pollutants in the Tibetan surface soil:Spatial distribution,air-soil exchange and implications for global cycling[J]. Environmental Pollution, 170(8) : 145–51. |
| [${referVo.labelOrder}] | Weishaar J L, Aiken G R, Bergamaschi B A, et al. 2003. Evaluation of specific ultraviolet absorbance as an indicator of the chemical composition and reactivity of dissolved organic carbon[J]. Environmental Science & Technology, 37(20) : 4702–4708. |
| [${referVo.labelOrder}] | Williams C F, Agassi M, Letey J, et al. 2000. Facilitated transport of napropamide by dissolved organic matter through soil columns[J]. Soil Science Society of America Journal, 64 : 590–594. DOI:10.2136/sssaj2000.642590x |
| [${referVo.labelOrder}] | Wu F C, Tanoue E. 2001. Isoiation and partiai characterization of dissolved copper-compiexing iigands in stream waters[J]. Environmental Science & Technology, 35(18) : 3646–3652. |
| [${referVo.labelOrder}] | Wu J Z, Sun H W, Wang C P, et al. 2012. Binding of pyrene to different molecular weight fractions of dissolved organic matter:effects of chemical composition and steric conformation[J]. Chemical Research in Chinese Universities, 28(4) : 624–630. |
| [${referVo.labelOrder}] | 谢理, 杨浩, 渠晓霞, 等. 2013. 滇池典型陆生和水生植物溶解性有机质组分的光谱分析[J]. 环境科学研究, 2013, 26(1) : 72–79. |
| [${referVo.labelOrder}] | Xing B, Chen Z, Zheng Q. 1998. Spectroscopic evidence for condensed domains in soil organic matter[J]. Soil Science, 164(1) : 40–47. |
| [${referVo.labelOrder}] | Yang D, Qi S H, Zhang J Q. 2012. Residues of organochlorine pesticides(OCPs) in agricultural soils of Zhangzhou City,China[J]. Pedosphere, 22(2) : 178–189. DOI:10.1016/S1002-0160(12)60004-6 |
| [${referVo.labelOrder}] | 占新华, 周立祥, 杨红, 等. 2007. 水溶性有机物与多环芳烃结合特征的红外光谱学研究[J]. 土壤学报, 2007, 44(1) : 47–53. |
| [${referVo.labelOrder}] | 赵晓丽, 毕二平. 2014. 水溶性有机质对土壤吸附有机污染物的影响[J]. 环境化学, 2014, 33(2) : 256–261. |
 2017, Vol. 37
2017, Vol. 37


