2. 华南理工大学亚热带建筑科学国家重点实验室, 广州 510640
2. State Key Laboratory of Subtropical Building Science, South China University of Technology, Guangzhou 510640
随着“十三五”规划的推行,国家对废水排放的要求日趋严格,而我国水环境质量现状依然十分严峻,氮污染排放呈现浓度增高、排放量增大的趋势(文宇立等,2015),同时由于能源日益紧缺,污染治理过程中的能耗问题逐渐被重视起来. 微生物燃料电池(Microbial Fuel Cell,MFC)是一种以产电微生物为催化剂,通过生物降解作用将存储在污染物中的化学能直接转化为电能的装置(Wang et al.,2013),将其应用于脱氮过程当中,可以在高效去除废水中氮元素的同时回收电能,提供了一条新的污水治理思路(Tao et al.,2015).
MFC中的脱氮过程通常分为阴极和阳极2种脱氮形式. 阴极脱氮过程在Holmes等(2004)的研究中被首次发现,并证明了微生物同步脱氮产电的可能性;随后Clauwaert等(2007)设计的双室型MFC首次实现了同步脱氮、除碳及产电的电化学系统,该系统成为阴极脱氮型MFC系统的设计典型. 阳极脱氮过程最早在Min等(2005)使用MFC处理养猪废水的实验中被发现,后来He等(2009)构建了以氨为唯一能源的MFC,并利用PRC技术证明了阳极氨氧化和电压输出之间的因果关系. 然而目前脱氮型MFC研究主要基于氨氧化、短程硝化反硝化或同步硝化反硝化反应脱氮,但其共同的缺陷在于反应路线长、能耗高、剩余污泥量大,且氨氧化菌、硝化菌和反硝化菌的活性在高氮荷环境下会受到较大抑制(刘涛等,2013),另外其需要一定的有机物补给,反应系统较为复杂,反应过程不易控制.
在新型脱氮工艺中,厌氧氨氧化工艺(Anammox)可以在自养型细菌厌氧氨氧化菌(AnAOB)作用下,以CO2作为无机碳源进行代谢生长,以氨为电子供体,亚硝酸盐为电子受体,代谢产物为氮气(陈重军等,2014),反应方程式为1NH4+ + 1.32 NO2- + 0.066 HCO3- + 0.13H+ → 1.02N2 + 0.26 NO3- + 0.066 CH2O0.5N0.15 + 2.03H2O(周少奇,2006). 其可一步同时去除2种形态的氮污染物,具有很高的容积效能,而且菌体对氨氮和亚硝态氮的耐负荷能力强,适合处理高氮浓度、低C/N比废水(王元月等,2013). 因此将Anammox反应和MFC耦合进行同步脱氮产电,具有一定的应用价值和发展潜力.
Lee 等(2013)曾在MFC反应器中引入部分厌氧氨氧化菌处理高氨氮含量的垃圾渗滤液,获得了94%的总氮去除率和12 mW·m-2的输出功率密度,通过其与氨氧化MFC的对比,说明电子受体从硝酸盐变为亚硝酸盐后,MFC产能可以增加50%. 谢作甫(2014)借助高锰酸钾化学阴极成功启动阳极型Anammox-MFC,输出电压为131 mV,总氮容积去除速率为1.64~2.38 kg·m-3·d-1,其同课题组张吉强(2014)使用类似反应体系探究了Anammox在MFC中的电化学特性,通过基质转化实验说明了在NO2-的存在下,Anammox菌可利用NH4+作为电子库,展现出产电耦合性,通过功能空间实验说明其阳极生物膜和阳极液中悬浮污泥均具有同步厌氧氨氧化产电功能,其研究为本文提供了一定理论基础.
目前基于Anammox反应的脱氮型MFC研究较少,本实验针对Anammox在MFC中的阳极和阴极2种电化学耦合机制,特引入了空气阴极和厌氧降解乙酸盐的生物阳极,以避免化学阴极造价高、可持续能力弱、电极易受污染的缺陷,并利用双室型MFC可隔离阴阳极,提供相互独立工作环境,易于控制反应条件的特点,通过电化学关系建立Anammox-MFC耦合系统,并探究其反应性能及机理.
2 材料与方法(Materials and methods) 2.1 实验组设置及实验装置如表 1所示,实验设计4种MFC构型,菌体A为AnAOB菌,菌体B为乙酸盐降解菌,其中a、b-MFC分别为阳极型和阴极型Anammox-MFC实验组;c、d-MFC的设计旨在与b-MFC对比,进行Anammox阴极与传统的空气阴极各方面性能的比较,同时探究乙酸盐降解菌阳极对反应体系的作用. 其中,为了保证空气阴极性能的可比性,对a、c-MFC空气阴极碳布材料靠近阴极液的一侧涂抹0.5 mg·cm-2的10%铂碳催化层(罗净净等,2016),同时使空气阴极液与其对应的阳极液底物浓度相同,以避免质子交换膜两端电导率差别对实验结果造成影响,并调节空气阴极液初始pH为3.0,以促进其O2还原. 各实验组全周期置于(33±1)℃的恒温培养箱(赛福SPX-250)中.
| 表 1 MFC实验组设置 Table 1 MFC reactors′ setting |
反应器装置参照同课题组Tao等(2014)研究,即将2个管式有机玻璃单室反应器(Liu et al.,2004)拼合为一个双室MFC. 如图 1所示,反应器分阴阳2个极室,中间以质子交换膜(杜邦Nafion 117)相隔,每个极室内腔直径约3 cm,长度4 cm,有效截面面积7 cm2,有效体积约28 mL. 阳极电极材料采用碳纸(上海河森HCP030),阴极为碳布(上海河森HCP330),使用前分别在1 mol·L-1盐酸和去离子水中煮沸条件下水浴处理1 h,以去除其表面的杂质. 每组反应器的阴、阳两电极通过钛丝与外接电路相连,由导线连接至数据采集器(美国Keithley M2700)进行实时电压数据记录,外电路串联接入一个旋钮式变阻箱,电池稳定运行期间设置外电阻值为1500 Ω,使用参比电极(上海雷磁甘汞232电极)测量阴、阳两极电极电势. 极室溶液取样及周期换液过程使用一次性注射器完成,反应产生的N2用低摩擦阻力的蓝芯全玻璃注射器收集,更换注射器过程中利用三通阀保持反应器的严格厌氧. 空气阴极部分由蠕动泵将阴极液导入至一个外置的250 mL锥形瓶进行曝气完成,并通过气体流量计控制溶解氧浓度.
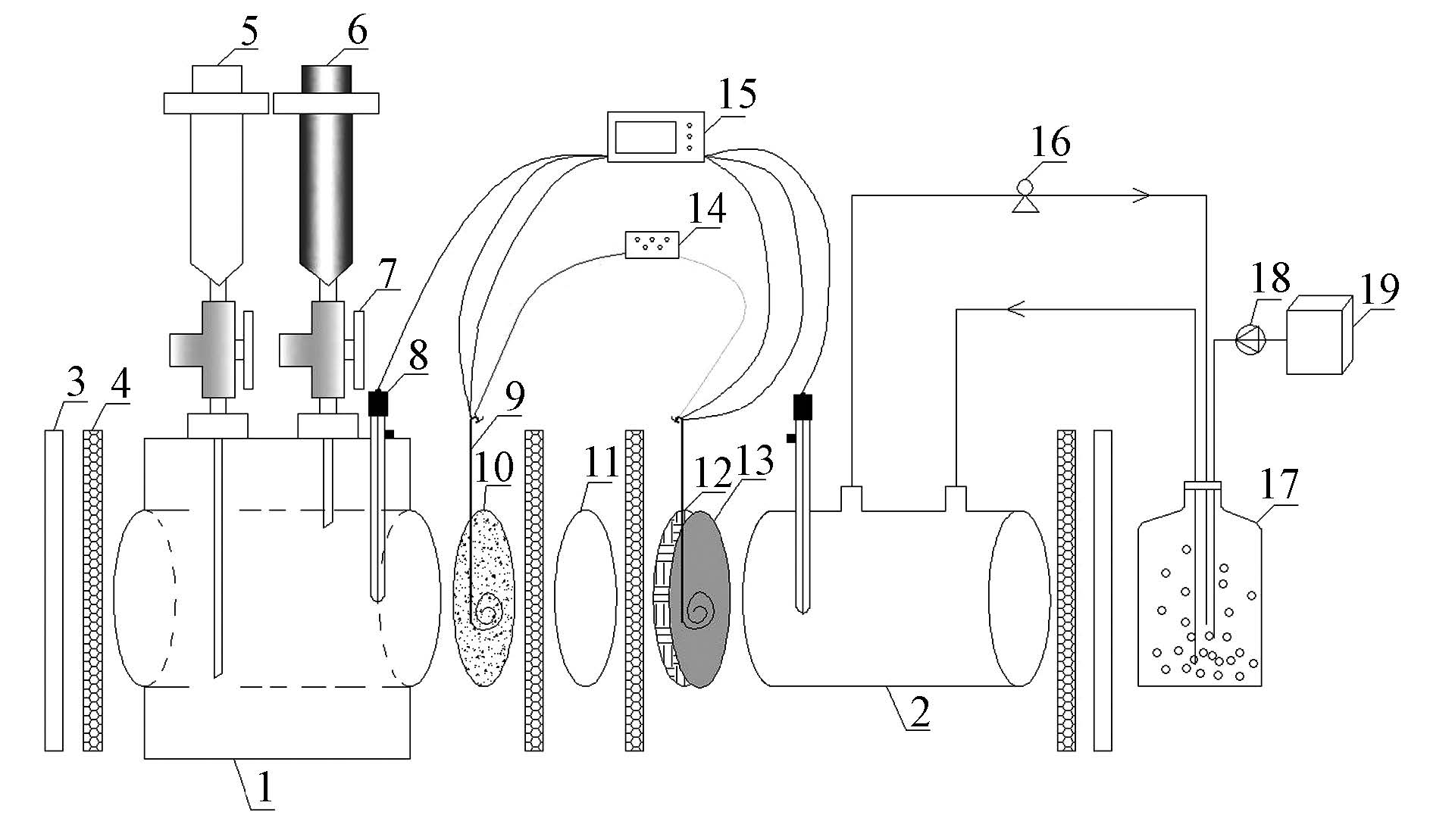 |
| 图 1 双室MFC反应器示意图 (1. 阳极室,2. 阴极室,3. 外层隔板,4. 垫片,5. 一次性注射器(5 mL),6. 蓝芯全玻璃注射器(5 mL),7. 医用三通阀,8. 参比电极,9. 钛丝,10. 碳纸,11. 质子交换膜,12. 碳布,13. 铂碳催化层,14. 旋钮式变阻箱,15. 数据采集器,16. 蠕动泵,17. 250 mL棕色瓶,18. 气体流量计,19. 空气泵) Fig. 1 Schematic of single chamber MFC (1. Anode chamber,2. Cathod chamber,3. acrylic barrier,4. gasket,5. disposable syringe(5 mL),6. All-glass syringes with blue plunger(5 mL),7. Three-way Stopcock,8. reference electrode,9. titanium wire,10. cabon paper,11. PEM,12. cabon cloth,13. 10% platinum catalyst layers,14. spiral rheostat,15. data acquisition unit,16. peristaltic pump,17. amber(250 mL),18. gas flowmeter,19. air pump) |
分别采用紫外分光光度法、N-(1-萘基)-乙二胺光度法和纳氏试剂光度法测定样品中硝态氮(NO3--N)、亚硝态氮(NO2--N)、氨氮(NH4+-N)、总氮(TN)特指这3种形态氮浓度值之和. 采用紫外分光光度计(上海尤尼柯UV2800)测定样品光度值,使 用pH计(上海精科雷兹PHS-25)测定样品pH值,利用场发射扫描电子显微镜(德国蔡司Merlin)完成SEM图制作.
2.3 菌体选择及培养液配方菌体A:以AnAOB为主体的混菌,革兰氏阴性菌,因含有羟胺氧化还原酶中亚铁血红素,菌体宏观呈砖红色颗粒状形态,菌落粒径为1~2.2 mm(van Niftrik et al.,2008),由于后代细菌常覆盖于前代死亡细菌钙化后形成的白色壳状物上,其总粒径达到3~8 mm. 细菌采自课题组运行超过5 a的Anammox-UASB反应器(张锦耀等,2016),长期处于零有机碳源条件下,非厌氧氨氧化的杂菌较少. 储备液为培养液Ⅰ的基础上加入定量(NH4)2SO4和NaNO2,每2 d更换配水,使NH4+-N浓度保持于200 mg·L-1水平,NO2--N浓度保持于240 mg·L-1水平. 在MFC中使用菌体A时,取菌约(3.0 ± 0.3)g(湿重),全周期不更换细菌,使用液为培养液Ⅰ的基础上加入高浓度的(NH4)2SO4和NaNO2,使极室液初始NH4+-N浓度为400 mg·L-1水平,NO2--N浓度为528 mg·L-1水平,以构建高氮负荷型MFC.
菌体B:G. sulfurreducens纯菌,无色浑浊悬浮态,厌氧条件下富集储备. 储备液为培养液Ⅱ的基础上加入定量NaAc,每24 h更换配水,使乙酸盐浓度保持于0.01 mol·L-1水平. 在MFC的阳极中使用菌体B时,将储备液中的菌体与MFC中阳极液进行直接替换,换液方式如下:吸出14 mL原阳极液,补充14 mL含菌储备液,进行下一个反应周期(陶琴琴,2015).
培养液Ⅰ和培养液Ⅱ基质配方如表 2和表 3所示,调节培养液ⅠpH为7.0±0.5水平,培养液ⅡpH为8.0±0.5水平.
| 表 2 培养液Ⅰ基质配方 Table 2 Composition of synthetic mediumⅠ |
| 表 3 培养液Ⅱ基质配方 Table 3 Composition of synthetic mediumⅡ |
在MFC中接种乙酸盐降解菌和AnAOB的初期,为了使细菌适应反应器的体积和新的极室液环境,需对其进行闭路条件下驯化,驯化期分别为a-MFC 18 d、b-MFC 24 d、c-MFC 15 d,驯化后均得到稳定可测输出电压. 在反应器稳定运行过程中,以更换阴阳极液为周期开始,电压输出值低于1 mV为周期结束,每1 min读取1次电压值,记录周期内电压变化,评估各反应器产电性能.
根据图 2结果,可见a-MFC全周期约6700 min(合4.7 d),无明显电压骤升、骤降现象,电压升高至48 mV后缓慢下降,平均输出电压24.5 mV;b-MFC全周期约2900 min(合2 d),其在周期初段出现电压瞬升,稍微下降后工作电压稳定输出,稳定工作期约2170 min,占全周期74.8%,最高输出电压达到502.2 mV,平均输出电压448.4 mV,周期末段电压因底物耗尽迅速下降;c-MFC全周期约7000 min(合4.9 d),在周期初段电压骤升后,工作期电压继续缓慢上升,到达最高值430.9 mV后缓慢下降,电池工作期时长约4700 min,占全周期67.2%,平均输出电压392.5 mV,周期末段电压迅速下降,但其下降速率相较b-MFC慢;d-MFC作为对照组,因其阳极无微生物存在,阳极无电子供体,故电子流动较缓,全周期记录电压范围为0.02~2.38 mV,其电压产生可能来自于离子流动产生的电导率变化所带来的瞬时阴阳极电势差,或测量仪器的系统误差.
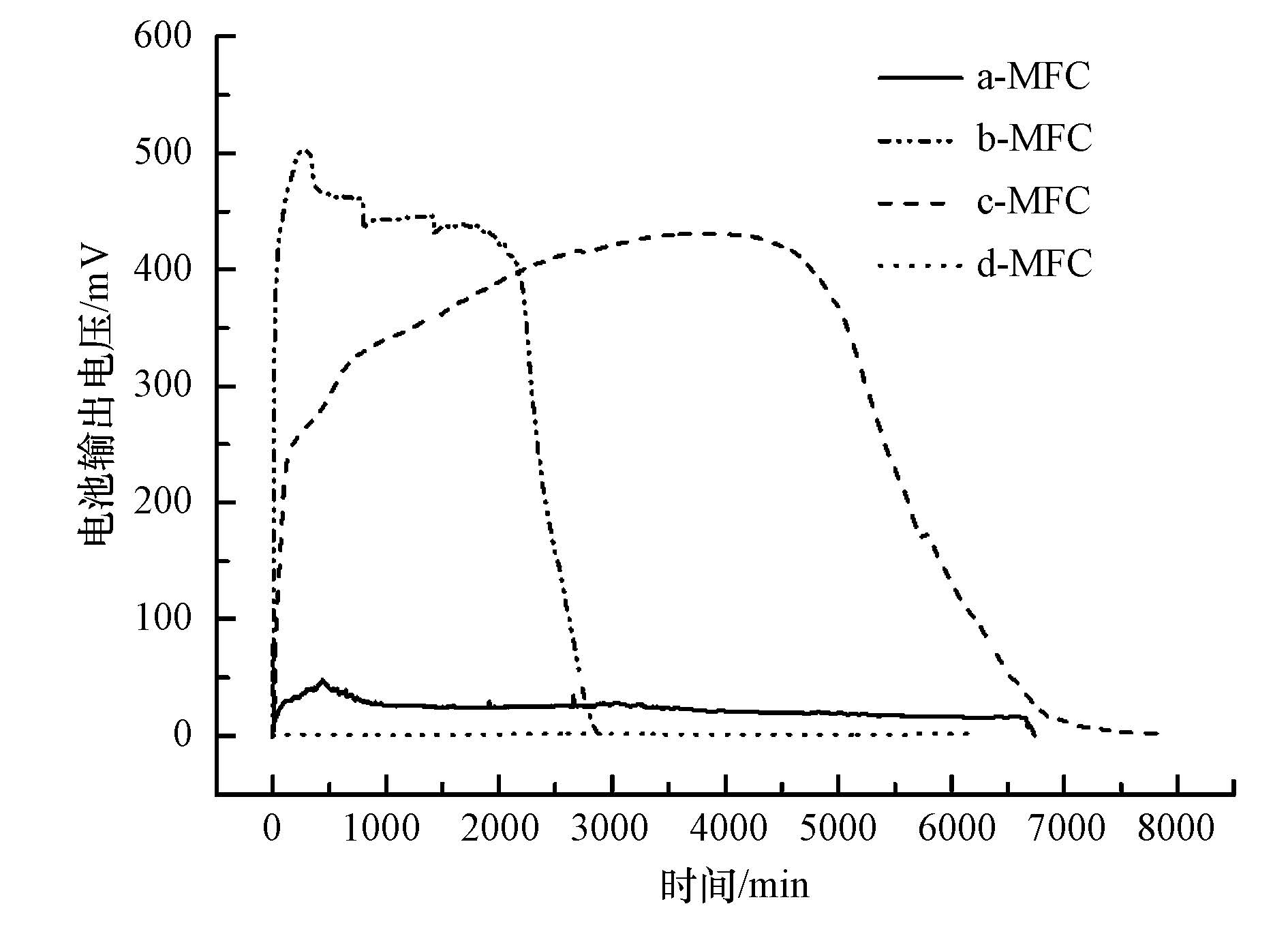 |
| 图 2 4种MFC输出电压随时间变化示意图 Fig. 2 Electricity production of a,b,c,d-MFC |
取a、b-MFC稳定期运行的3个周期脱氮数据进行分析,每个周期内取6批次a-MFC阳极液和b-MFC阴极液样品,进行氨氮、亚硝态氮、硝态氮浓度测定并绘制浓度-时间变化关系图(图 3),图上每点为3组数据的平均值. 每次取样后按照实际浓度补充极室液,以维持MFC系统的稳定性.
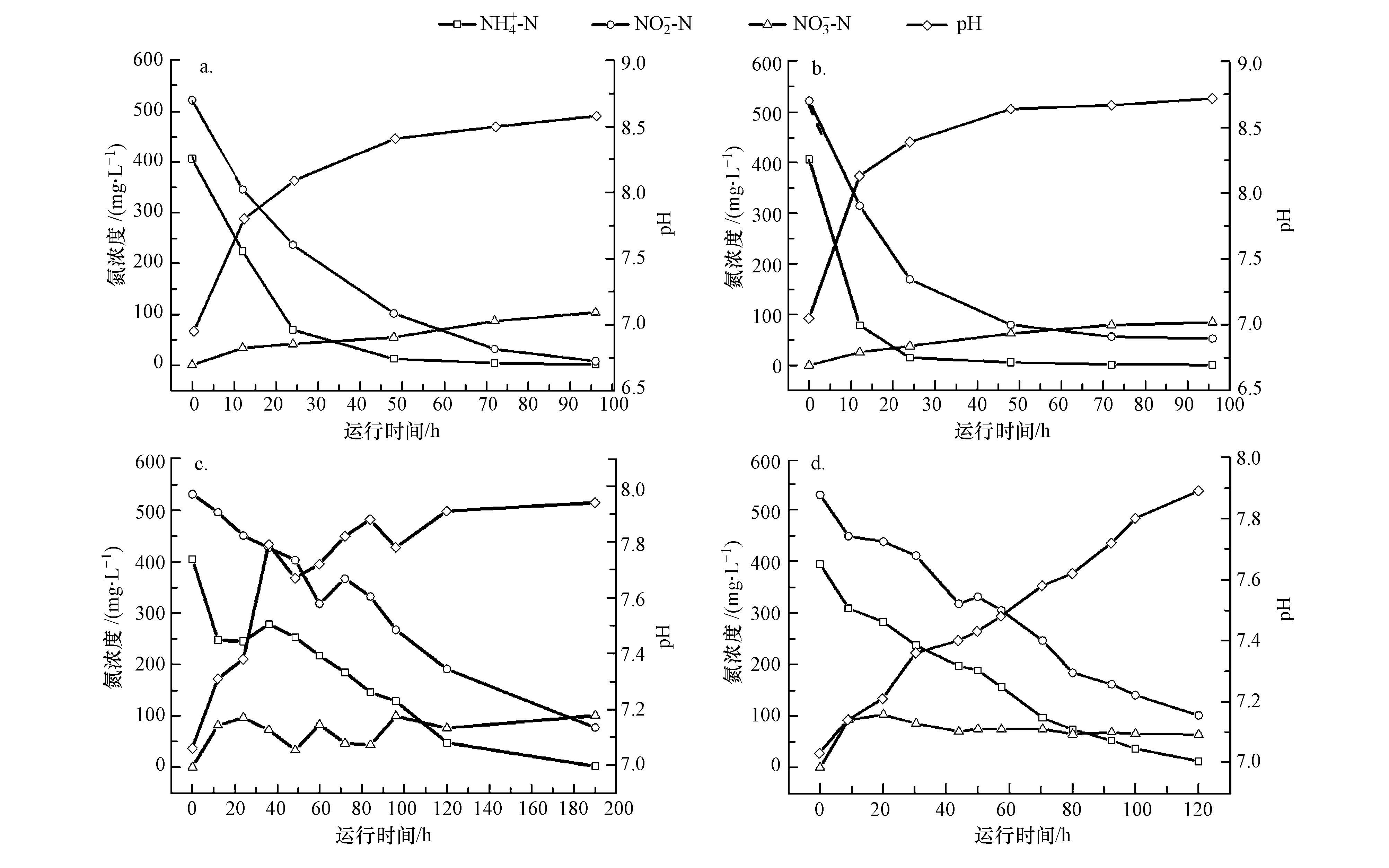 |
| 图 3 a-MFC阳极液在闭路(a)开路条件(c),b-MFC阴极液在闭路(b)开路(d)条件下各形态氮浓度和pH随时间变化示意图 Fig. 3 Comparisons of the time courses of Nitrogen concentration and pH change in anolyte of a-MFC under closed circuit(a)and open circuit condition(c)and catholyte of b-MFC under closed circuit(b)and open circuit condition(d) |
如图 3a、3b所示,可以看出2者NH4+-N、NO2--N浓度均随时间呈单指数关系衰减变化,NO3--N浓度随时间呈线性增加,其动力学方程拟合结果如下:
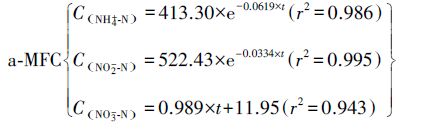
|
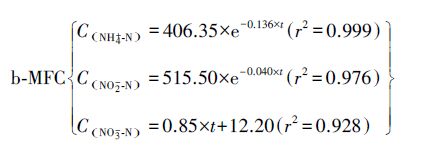
|
显然,2者的氨氮、亚硝态氮降解均符合一级动力学方程模型,带入方程模型通式C=C0×e-kOBS×t,得知a-MFC中氨氮降解速率(0.0619)比亚硝态氮(0.0334)略高,但仍处于同一数量级,可以看作2者通过一个反应同步去除;b-MFC中氨氮降解速率(0.136)明显比亚硝态氮(0.040)高,而硝态氮生成量略低于a-MFC,因此b-MFC中NH4+在Anammox基础上可看作有额外的去除路线.
而在开路状态下,如图 3c、3d所示,a、b-MFC氨氮和亚硝态氮浓度均呈线性降低,但在硝态氮变化方面略有区别,a-MFC呈波动上升趋势,从表观上分析,其在Anammox反应基础上,0~20 h阶段还出现了硝化反应特征,20~50 h阶段出现了反硝化反应特征;b-MFC硝态氮浓度在上升后在稳定维持在65~75 mg·L-1水平.
3.3 扫描电镜结果在反应器运行约4个月后停止并拆除反应器,取a-MFC阳极碳纸、b-MFC阳极碳纸和阴极碳布各约1 cm2,前处理后进行SEM扫描. 由图 4a、b、e、f可以看出a-MFC的阳极碳纸和b-MFC阴极碳布纤维上离散分布着簇团状菌群,增加放大倍数后可以看出菌体呈椭球或圆球状,与AnAOB形态特征相符(Yang et al.,2010; 张肖静等,2014). 图 4c、d可以看出b-MFC的阳极碳纸纤维聚团分布菌群,增加放大倍数后可以看出菌体呈杆状或棒状,与乙酸盐降解菌G. sulfurreducens的形态特性相符(Bond et al.,2005).
 |
| 图 4 扫描电镜结果图a-MFC阳极碳纸(a)(b),b-MFC阳极碳纸(c)(d)和b-MFC阴极碳布(e)(f) Fig. 4 SEM image of a carbon paper anode of a-MFC(a)(b),a carbon paper anode of b-MFC(c)(d)and a carbon cloth cathode of b-MFC(e)(f) |
由上述结果可以看出,a-MFC产电性能相对较差,可能原因是AnAOB作为自养型细菌,其反应速率较慢,在与氧化还原电位绝对值同样较低的空气阴极相结合后,电子转移速度慢,电池内阻大,回路电流小,因此路端电压低. 但是相对开路状态,其在闭路时脱氮效果更加稳定,脱氮速率明显提高,说明闭路时的电耦合状态促进了阳极Anammox过程的进行. 原因可能是在开路的静态反应器中,电子的局部积累对反应的进行有抑制作用,硝化、反硝化反应的出现削弱了Anammox反应的进行,但在闭路条件下,电子能够得到及时转移,促进了反应的稳定进行.
4.1.2 开闭路状态下电池性能对比如图 5a所示,a-MFC反应器闭路状态下运行72 h后,阳极液中NH4+-N、NO2--N、TN去除率分别达到99.1%、94.0%和86.9%,容积氮去除负荷(NRR)平均值为0.417 kg·m-3·d-1. 而开路条件下,NH4+-N去除率在反应器运行190 h后超过99%,NO2--N和TN去除率仅为85.4%和80.7%,NRR平均值仅为0.128 kg·m-3·d-1. 在图 5b所展示的化学计量比-时间关系中,上方虚线代表ΔNO2--N∶ΔNH4+-N的理论值1.32,下方虚线代表ΔNO3--N∶ΔNH4+-N的理论值0.26,可以看出随着反应的进行,开闭路条件下ΔNH4+-N∶ΔNO2--N∶ΔNO3--N最终趋向于理论值1∶1.32∶0.26. 但在反应初期,闭路条件下NO2--N和NO3--N相对于NH4+-N的比值均偏低,说明氨氮降解速率较理论值偏快,可能原因是在通路后阳极形成氧化环境,促进了NH4+-N的失电子氧化,电子被及时转移至阴极进行氧气的还原;而开路条件下的3者计量关系在反应初期展现出亚硝态氮降解偏慢而硝态氮生成偏快,说明初期出现硝化反应特征,与上文描述相符.
 |
| 图 5 a-MFC阳极液各形态氮去除率(a)计量关系(b)随时间变化示意图 Fig. 5 Comparisons of the time courses of Nitrogen removal rate(a)and Stoichiometric ratio change(b)in anolyte of a-MFC |
通过a-MFC的开闭路比较说明Anammox反应在与电化学系统进行阳极型耦合后,脱氮速率和稳定性均得到了提高,在通过与空气阴极的耦合后,电极反应可表示为:阳极NH4+-e-+NO2-→N2+NO3-+H+;阴极O2+e-+H+→+H2O.
4.2 b-MFC性能分析 4.2.1 总体产电、脱氮性能分析与a-MFC相比,b-MFC产电能力明显更高,原因是阳极氧化乙酸钠的过程反应速率较更快,电子转移也随即加快,回路中形成的电流相对增加,获得了可观的电压输出. 将b-MFC与c-MFC比较可以发现,使用AnAOB生物阴极,在产电强度和产电稳定性方面均比铂碳空气阴极有优势,说明Anammox反应具备电子受体功能,也从侧面说明AnAOB成功地耦合在了MFC系统之中. 2者最高输出电压值差距不大,说明阳极乙酸盐氧化反应仍然是产电过程的贡献主体. 由上文所述,b-MFC的另一特征是氨氮去除率明显较快,甚至超过了同步去除的亚硝态氮,其额外的氨氮去除路线可能是随着Anammox反应的进行,阴极液pH升高,碱性环境下溶液中形成NH3分子,并被N2的上升流气泡夹带逸出. 而由于NH4+-N的过快脱除,Anammox反应后期受到抑制,因此其NO2--N总去除率低于a-MFC.
b、c-MFC之间周期长短的差异可以解释为,b-MFC阴极液为序批式进水,输出电压随着底物的消耗殆尽快速降低,而c-MFC阴极液为连续流式进水,可保持阴极溶解氧浓度,保证电子受体(O2)供给充足,因此其周期更长,电压下降更为缓慢.
4.2.2 开闭路状态下电池性能对比与a-MFC类似,b-MFC在开路状态下相对闭路时的脱氮效率明显更低,而且其硝氮浓度在反应后期并未上升,原因可能是阳极有机物降解所产生的H+通过离子交换膜进入阴极,降低了阴极液的pH,抑制了Anammox反应,促进了反硝化反应进行.
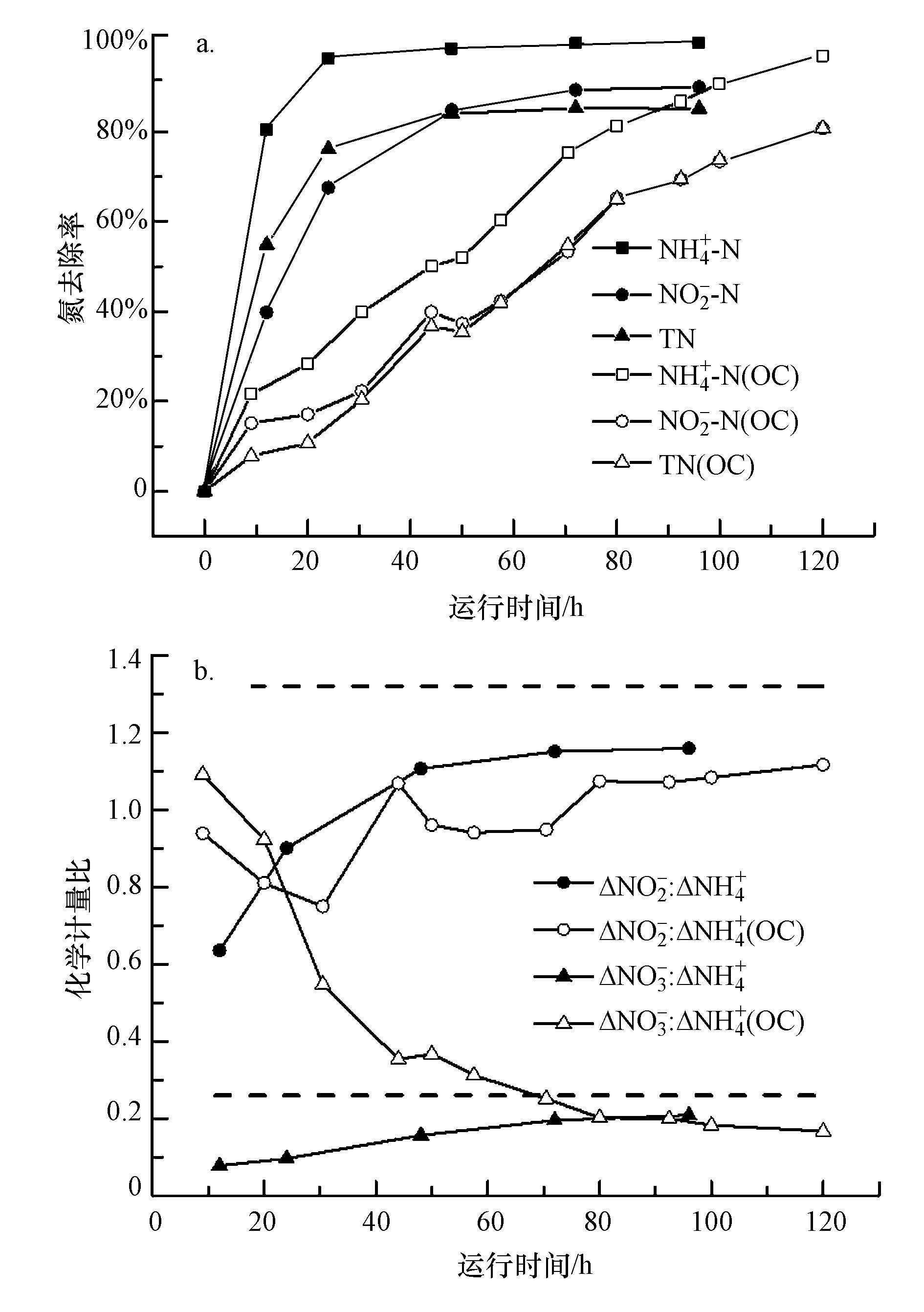 |
| 图 6 b-MFC阴极液各形态氮去除率(a)计量关系(b)随时间变化示意图 Fig. 6 Comparisons of the time courses of(a)Nitrogen removal rate(b)Stoichiometric ratio change in catholyte of b-MFC |
如图 6a所示,b-MFC反应器闭路状态下运行24 h 后NH4+-N去除率达到96.4%,48 h后超过99%; NO2--N和TN去除率在48 h时为84.8%和84.1%,96 h后均接近90%;NRR平均值0.516 kg·m-3·d-1. 开路条件下,NH4+-N获得96.9%的去除率需要120 h,此时NO2--N和TN去除率均仅为80.8%,NRR平均值仅为0.163 kg·m-3·d-1. 在图 6b所展示的化学计量比-时间关系中,可以看出随着反应的进行,开闭路条件下3种形态的氮之比趋向但无法达到理论值1∶1.32∶0.26. 闭路条件下下NO2--N和NO3--N相对于NH4+-N的比值始终偏低,反应初期氨氮和亚硝态氮的去除不同步;而开路条件下,NO3--N∶NH4+-N计量比从1.09下降至0.167,说明反应初期大量生成的硝态氮在末期被反硝化去除.
通过b-MFC的开闭路比较说明Anammox反应在与异养菌G. sulfurreducens阳极电耦合后,电子交换速率提高的同时脱氮速率得到了显著提高,2者呈正相关关系. b-MFC的电极反应可表示为:(阳极)CH3COO--e-→CO2+H+,(阴极) NH4++NO2-+H3++e-→N2+NH3+NO-+H2O.
5 总结(Conclusions)1) 实验成功建立了耦合Anammox反应的高氮负荷型双室MFC,阳极脱氮型a-MFC和阴极脱氮型b-MFC均可在400 mg·L-1 NH4+-N、528 mg·L-1 NO2--N的条件下稳定启动并运行. b-MFC中乙酸盐降解菌阳极的引入显著加快了电子交换速率,获得最大输出电压502.2 mV,产电周期为2900 min. 其各形态氮去除速率也相对显著增加,48 h内NH4+-N、NO2--N、TN去除率分别达到99%、84.8%和84.4%,NRR平均值达到0.516 kg·m-3·d-1,而a-MFC达到相同去除水平则需要72 h.
2) 另外,相对于各自开路状态,2种耦合方式闭路状态下的NH4+-N、NO2--N浓度均呈单指数关系衰减变化,脱氮能力和稳定性均有明显提高. 其脱氮过程均以Anammox反应为基础,电化学耦合后因为半反应效应,使其ΔNH4+-N∶ΔNO2--N∶ΔNO3--N的化学计量比倾向但始终未达到1∶1.32∶0.26. 2者的NH4+-N去除相对NO2--N更快,其可能的额外去除路线分别为a-MFC阳极失电子氨氧化,b-MFC阴极形成NH3分子随N2逸出. SEM扫描结果说明a、b-MFC在电耦合前后,AnAOB和乙酸盐降解菌在表面上保持各自表观形态特征.
| [${referVo.labelOrder}] | Bond D R, Lovley D R. 2005. Evidence for involvement of an electron shuttle in electricity generation by geothrix fermentans[J]. Appllied and Environmental Microbiology, 71(4) : 2186–2189. DOI:10.1128/AEM.71.4.2186-2189.2005 |
| [${referVo.labelOrder}] | 陈重军, 王建芳, 张海芹, 等. 2014. 厌氧氨氧化污水处理工艺及其实际应用研究进展[J]. 生态环境学报, 2014, 23(3) : 521–527. |
| [${referVo.labelOrder}] | Clauwaert P, Rabaey K, Aelterman P, et al. 2007. Biological denitrification in microbial fuel cells[J]. Environmental Science &Technology, 41(9) : 3354–3360. |
| [${referVo.labelOrder}] | He Z, Kan J, Wang Y, et al. 2009. Electricity production coupled to ammonium in a microbial fuel cell[J]. Environmental Science &Technology, 43(9) : 3391–3397. |
| [${referVo.labelOrder}] | Holmes D E, Bond D R, O'Neil R A, et al. 2004. Microbial communities associated with electrodes harvesting electricity from a variety of aquatic sediments[J]. Microbial Ecology, 48(2) : 178–190. DOI:10.1007/s00248-003-0004-4 |
| [${referVo.labelOrder}] | Lee Y, Martin L, Grasel P, et al. 2013. Power generation and nitrogen removal of landfill leachate using microbial fuel cell technology[J]. Environmental Technology, 34(19) : 2727–2736. DOI:10.1080/09593330.2013.788040 |
| [${referVo.labelOrder}] | Liu H, Logan B E. 2004. Electricity generation using an air-cathode single chamber microbial fuel cell in the presence and absence of a proton exchange membrane[J]. Environmental Science &Technology, 38(14) : 4040–4046. |
| [${referVo.labelOrder}] | 刘涛, 李冬, 曾辉平, 等. 2013. 氨氮浓度对canon工艺功能微生物丰度和群落结构的影响[J]. 环境科学, 2013, 34(2) : 773–780. |
| [${referVo.labelOrder}] | 罗净净, 周少奇, 许明熠, 等. 2016. 单室微生物燃料电池产电与脱氮除磷的研究[J]. 环境科学学报, 2016, 36(6) : 1955–1961. |
| [${referVo.labelOrder}] | Min B, Kim J R, Oh S E, et al. 2005. Electricity generation from swine wastewater using microbial fuel cells[J]. Water Research, 39(20) : 4961–4968. DOI:10.1016/j.watres.2005.09.039 |
| [${referVo.labelOrder}] | Tao Q, Luo J, Zhou J, et al. 2014. Effect of dissolved oxygen on nitrogen and phosphorus removal and electricity production in microbial fuel cell[J]. Bioresource Technology, 164 : 402–407. DOI:10.1016/j.biortech.2014.05.002 |
| [${referVo.labelOrder}] | Tao Q, Zhou S, Luo J, et al. 2015. Nutrient removal and electricity production from wastewater using microbial fuel cell technique[J]. Desalination, 365 : 92–98. DOI:10.1016/j.desal.2015.02.021 |
| [${referVo.labelOrder}] | 陶琴琴. 2015. 微生物燃料电池同步脱氮除磷及产电性能研究[D].广州:华南理工大学 |
| [${referVo.labelOrder}] | Wang H, Ren Z J. 2013. A comprehensive review of microbial electrochemical systems as a platform technology[J]. Biotechnol Advances, 31(8) : 1796–1807. DOI:10.1016/j.biotechadv.2013.10.001 |
| [${referVo.labelOrder}] | 王元月, 魏源送, 张树军. 2013. 厌氧氨氧化技术处理高浓度氨氮工业废水的可行性分析[J]. 环境科学学报, 2013, 33(9) : 2359–2368. |
| [${referVo.labelOrder}] | 文宇立, 叶维丽, 刘晨峰, 等. 2015. "十三五"总氮、总磷总量控制政策建议[J]. 环境污染与防治, 2015, 37(3) : 27–30. |
| [${referVo.labelOrder}] | Van Niftrik L, Geerts W J C, van Donselaar E G, et al. 2008. Linking ultrastructure and function in four genera of anaerobic ammonium-oxidizing bacteria:Cell plan, glycogen storage, and localization of cytochrome c proteins[J]. Journal of Bacteriology, 190(2) : 708–717. DOI:10.1128/JB.01449-07 |
| [${referVo.labelOrder}] | 谢作甫. 2014. Mfc脱氮产电性能及电导率研究[D]. 杭州:浙江大学 |
| [${referVo.labelOrder}] | Yang J, Zhang L, Fukuzaki Y, et al. 2010. High-rate nitrogen removal by the anammox process with a sufficient inorganic carbon source[J]. Bioresource Technology, 101(24) : 9471–9478. DOI:10.1016/j.biortech.2010.07.087 |
| [${referVo.labelOrder}] | 张吉强. 2014. 微生物燃料电池同步脱氮产电性能及机理研究[D].杭州:浙江大学 |
| [${referVo.labelOrder}] | 张锦耀, 周少奇, 王敬平, 等. 2016. 磷酸盐对canon工艺的脱氮特性研究[J]. 环境科学学报, 2016, 36(5) : 1615–1621. |
| [${referVo.labelOrder}] | 张肖静, 李冬, 梁瑜海, 等. 2014. 氨氮浓度对canon工艺性能及微生物特性的影响[J]. 中国环境科学, 2014(7) : 1715–1721. |
| [${referVo.labelOrder}] | 周少奇. 2006. 厌氧氨氧化与反硝化协同作用化学计量学分析[J]. 华南理工大学学报(自然科学版), 2006, 34(5) : 1–4. |
 2017, Vol. 37
2017, Vol. 37


