中国是抗生素生产和消费大国(Bruce et al., 2005),在使用过程中抗生素会不可避免的以原药或代谢产物形式进入周围环境中,成为一类典型的药品和个人护理用品(PPCP)类污染物(Boxall et al., 2004).目前,在土壤及水体环境中均检测到了不同程度的抗生素残留(邰义萍等, 2010; Golet et al., 2001; Kummerer et al., 2003; Calamari et al., 2003; Xu et al., 2007).喹诺酮类抗生素毒性较低、组织穿透力强、药物耐受性高、半衰期长,被广泛使用于兽药以及饲料添加剂中(Lee et al., 2007).其中,第三代喹诺酮类抗生素诺氟沙星(norfloxacin)的产量大约占喹诺酮类抗生素总产量的50%(吕咏梅, 2004).因此,如何有效去除水体中的诺氟沙星等喹诺酮类抗生素成为亟待解决的问题.
目前,水体中诺氟沙星的处理方法主要有:物理处理法(Ahmed et al., 2014; Dorival García et al., 2013)、生物处理法(Radjenović et al., 2009; Zhou et al., 2013)、化学处理法(Cokgor et al., 2004; Chen and Chu, 2016)等.其中,生物处理法主要是通过生物(主要为微生物)对抗生素的作用,使抗生素的结构发生改变,将抗生素从大分子化合物降解为小分子化合物,从而引起其化学和物理性质发生改变.相对于其他处理方法,生物处理法更加经济有效,是抗生素在环境中降解的重要途径(季秋洁, 2012).因此,生物处理法通常是处理抗生素类废水的首选工艺(徐森等, 2011).Kim等(2011)从污水处理厂分离得到一株微杆菌属4N2-2,该菌株可通过羟基化、氧化脱氟、去甲基化和N-乙酰化4种方式降解诺氟沙星.然而,由于抗生素对微生物的抑制作用,传统生物处理法对抗生素的去除率普遍较低(Alexy et al., 2004).如何有效提高生物处理法对抗生素类污染物的处理效率,成为当前的研究热点(Felczak et al., 2014; Igor et al., 2012).
共代谢降解是指在特定生长基质存在的情况下,微生物对其他非生长基质类有机物的氧化降解过程(Leadbetter et al., 1959).在共代谢过程中将易被微生物利用的与污染物有相似结构的物质定义为一级基质,将目标污染物定义为二级基质(孙雪景等, 2010).作为一种独特的代谢方式,共代谢降解机制在处理废水中难降解污染物方面已受到广泛关注(董春娟等, 2003).研究表明,利用特异性微生物通过共代谢机制降解有机污染物,可以有效提高传统生物处理法的处理效果(罗玮, 2012).在建立共代谢体系时,一般选择易被微生物分解利用的物质,如葡萄糖、果糖、蔗糖等作为一级基质,它们有利于微生物的快速繁殖,增强微生物的活性.此外,与目标污染物结构类似的一级基质可以诱导微生物产生相关降解酶,实现对目标污染物的降解(Wang et al., 2007).然而,采用共代谢机制生物降解诺氟沙星的研究还极其缺乏.由于在诺氟沙星中存在一个哌嗪环结构,因此,我们推测哌嗪可能可以作为诺氟沙星的共代谢基质,促进微生物对诺氟沙星的降解.因此,本研究选取哌嗪作为共代谢基质并研究其对微生物降解诺氟沙星的影响.系统考察了温度、pH、盐浓度对于菌株生长以及诺氟沙星降解效率的影响,并确定最佳生长条件,同时,比较哌嗪添加量对菌株共代谢降解诺氟沙星效率的影响,并通过分析诺氟沙星降解中间产物,阐明可能存在的生物降解途径,为共代谢降解诺氟沙星提供必要的理论依据.
2 材料与方法(Materials and methods) 2.1 材料活性污泥取自某地医药厂污水处理站活性污泥池.实验中所用诺氟沙星由阿拉丁试剂公司生产,纯度为98%.称取1.0 g诺氟沙星,加入100 mL去离子水中,滴加HCl至完全溶解,配制成诺氟沙星储备液(浓度约为10000 mg·L-1).分析纯无水哌嗪购自国药集团(含量≥99.5%).
无机盐培养基:NaCl 1.0 g,(NH4)2SO4 1.0 g,K2HPO4 1.5 g,KH2PO4 0.5 g,MgSO4·7H2O 0.2 g,去离子水补足至1000 mL,pH 7.0.
LB培养基:胰蛋白胨10.0 g,NaCl 10.0 g,酵母粉5.0 g,去离子水补足至1000 mL,pH 7.2.
2.2 降解菌株的富集与分离筛选筛选诺氟沙星降解菌的污泥样品采自某地医药厂活性污泥.在2 L烧杯制作的简易曝气装置中,投加活性污泥使其初始污泥沉降比约为10%,有效体积为1.5 L.加入75 mL诺氟沙星储备液,使诺氟沙星初始浓度约为500 mg·L-1,同时加入100 mg·L-1葡萄糖、120 mg·L-1 (NH4)2SO4以及22 mg·L-1 KH2PO4作为外加碳源、氮源以及磷源进行驯化.驯化结束后,取5 mL污泥接种至共代谢无机盐培养基(含有5 mg·L-1诺氟沙星和25 mg·L-1哌嗪)中,培养10 d后转接.连续转接4次后,取0.5 mL富集液做梯度稀释,取10-2~10-8稀释度的富集液各0.1 mL涂布于共代谢无机盐固体培养基上培养,挑取单菌落划线分离.纯化后的菌株转接至共代谢无机盐培养基中培养10 d后,通过HPLC分析检测其降解效果.细菌生物量釆用分光光度计,在波长为600 nm处的吸光度表示(OD600 nm)(范秀容, 2001).
2.3 化学分析的QA/QC方法以无机盐培养基作为加标基质.在基质中加入诺氟沙星标样,根据分析过程中诺氟沙星标样的回收率,考察分析效果以及基质的影响.在100 mL无机盐培养基中加入诺氟沙星标样,加样后的培养基中诺氟沙星浓度为5 mg·L-1.进行6次平行加标回收实验和测样.
2.4 菌株鉴定 2.4.1 菌株生理生化鉴定将降解菌株采用平板涂布法接种于LB固体培养基上,30 ℃恒温培养48 h后观察菌落形态,并用光学显微镜和电子显微镜观察菌体形态.参照《常见细菌系统鉴定册》(东秀珠, 2001)和《伯杰氏细菌鉴定手册》(布坎南, 1984)进行生理生化鉴定.
2.4.2 菌株16S rDNA基因序列分析采用SDS高盐沉淀法提取菌体总DNA (Miller et al., 1988).16S rDNA基因采用通用引物(Stackebrandt et al., 1991)进行PCR扩增(张剑鸣等, 2009),上游引物为5′-AGAGTTTGATCCTGGCTCAG-3′ (Escherichia coli bases 8 to 27),下游引物为5′-TACCTTGTTACGACTT-3′(Escherichia coli bases 1507 to 1492).PCR产物回收采用试剂盒(AK1303)回收,与pMD19-T Vector连接后,转化至大肠杆菌DH5α中,提质粒验证,将质粒正确的转化子送金斯瑞生物科技有限公司测序.测序结果与NCBI数据库中核酸序列比对,并采用MEGA4.0软件NJ方法构建系统发育树.
2.5 菌株种子液的制备挑取LB固体平板上生长出的菌株NOR-36单菌落,接种至LB液体培养基中,30 ℃、160 r·min-1摇床中振荡培养至对数期(OD600 nm=0.6)后,离心分离,小心弃去上清液后收集菌体.用缓冲液洗涤菌体2次,再重悬于等体积的无菌水中作为种子液.
2.6 菌株生长曲线的测定将新鲜的NOR-36种子液接入400 mL灭菌的LB培养基中,接种量1%(体积比),160 r·min-1,30 ℃摇床恒温培养.每隔1 h取样离心分离,用等体积缓冲溶液重悬,以缓冲溶液作为参比液,采用分光光度计测定其生物量.
2.7 菌株生长条件的研究按1%的接种量将种子液接入LB培养基中,分别研究不同温度(15、20、25、30、35、40、45 ℃)、pH (4、5、6、7、8、9、10)、盐浓度(0、5、10、15、20、25、30 g·L-1)对菌株生长的影响.
2.8 菌株共代谢降解条件的优化配置诺氟沙星浓度为5 mg·L-1的基础盐培养基,并添加哌嗪,使哌嗪最终浓度分别为10、15、20、25、30、35、40、45、50、55、60 mg·L-1.以5%的接种量接入菌株种子液,置于30 ℃、160 r·min-1摇床培养10 d后取样,测定诺氟沙星浓度.
在250 mL三角瓶中加入100 mL无机盐培养基,添加浓度为25 mg·L-1的哌嗪,同时加入5 mg·L-1诺氟沙星.以5%的接种量接入菌株种子液,置于30 ℃、160 r·min-1摇床培养,同时设置不加一级基质空白对照.每隔2 d取样,测定其中诺氟沙星残留浓度.
以实验所得最佳哌嗪添加量为一级基质添加量,分别研究不同温度(15、20、25、30、35、40、45 ℃)、pH (4、5、6、7、8、9、10)、盐浓度(0、5、10、15、20、25、30 g·L-1)对菌株共代谢降解的影响,每个处理重复3次.
2.9 诺氟沙星分析方法诺氟沙星的浓度采用福立FL2200高效液相色谱仪测定.色谱柱为:Ultimate XB-C18柱(4.6 mm×200 mm, 5 μm);流动相由50%的乙腈溶液(含10%乙腈、0.4%三氟乙酸)及50%甲醇溶液配置组成,流速为0.8 mL·min-1;每次进样量为20 μL;紫外检测波长为278 nm.
利用Agilent G6410B三重四级杆质谱仪,以ESI正离子模式对代谢产物进行分析,电喷雾毛细管电压为4500 V,毛细管温度为350 ℃,m/z扫描范围:50~500.色谱柱为Agilent XDB-C18 (50 mm ×4.6 mm, 1.8 μm);柱温25 ℃;流动相为V(甲醇):V(水)=20:80,流速1 mL·min-1.
3 结果与讨论(Result and discussion) 3.1 化学分析的QA/QC数据在95%的置信水平下,平行测样6次时t值为3.36,分析方法的检测限为:MDL=3.36×s,结果如表 1所示.在测定分析方法对诺氟沙星的检测限时,诺氟沙星进样的浓度均为5 mg·L-1,进行6次平行测试,采用6点校正曲线定量,并计算样品的标准偏差.根据分析方法的检测限和偏差,得出无机盐培养基中诺氟沙星分析方法的QA/QC汇总表(表 1).
| 表 1 诺氟沙星分析方法的QA/QC数据表 Table 1 Quality assurance/quality control (QA/QC) data of determination method of Norfloxacin |
由表 1可见,对含诺氟沙星的无机盐培养基进行HPLC分析,得出无机盐培养基中诺氟沙星的回收率为97.3%,相对标准偏差为9.0%,方法检测限为1.48 mg·L-1.
图 1为检测诺氟沙星的标准曲线,图中以诺氟沙星浓度为横坐标,液相出峰的峰面积为纵坐标,如图可知呈现良好的线性关系.
 |
| 图 1 诺氟沙星检测标准曲线 Fig. 1 The standard curve of Norfloxacin |
通过富集、平板划线分离得到一株能以哌嗪为一级基质共代谢降解诺氟沙星的菌株,命名为NOR-36.菌株NOR-36在LB平板上正常生长其菌落形态见图 2a.在30 ℃下培养48 h后肉眼可看到清晰的淡黄色圆形菌落,表面光滑湿润,边缘整齐、中央隆起;菌株NOR-36革兰氏染色呈阳性,其生理生化鉴定结果见表 2.电镜观察该菌呈圆球状、无芽孢、无鞭毛(图 2b).
| 表 2 NOR-36的生理生化特性1) Table 2 Physiological characteristics of strain NOR-36 |
 |
| 图 2 菌株NOR-36的形态特征 Fig. 2 Colonial morphology of strain NOR-36 |
菌株系统发育树见图 3.菌株NOR-36与Staphylococcus caprae同源性为99%,因此菌株被鉴定为Staphylococcus caprae.
 |
| 图 3 菌株NOR-36的系统发育树 Fig. 3 Phylogenetic tree of the NOR-36 |
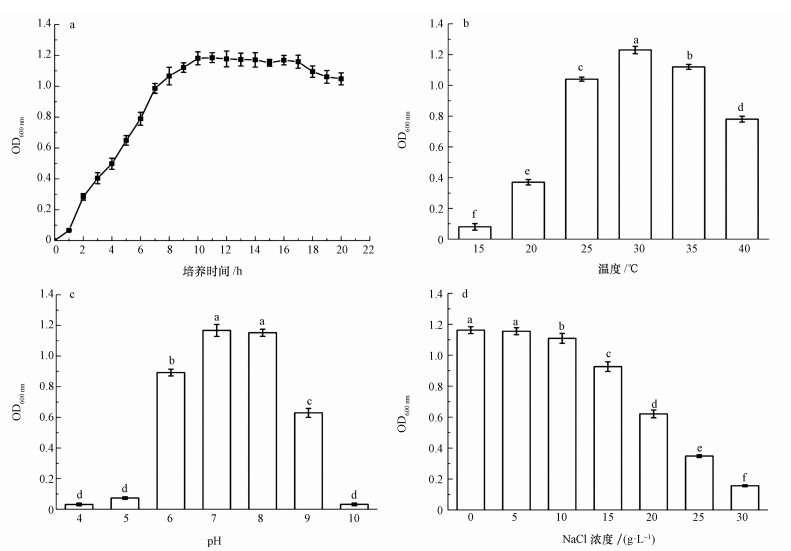
NOR-36在30 ℃时培养24 h的生长曲线如图 4a所示, 菌株在3 h时进入对数增长期,菌株生物量快速增长;到10 h时菌株进入稳定期菌种增长趋于平缓,菌株生物量基本不变;培养至17 h时菌种进入衰亡期,其生物量出现下降.
 |
| 图 4 菌株NOR-36生长特性 Fig. 4 Growth characteristics of the NOR-36 |
不同温度条件下菌株NOR-36在LB培养基中的生长情况见图 4b.由图可知,不同温度时菌株生物量差异显著(p < 0.05).15~40 ℃时,菌株生物量随温度增加,呈现先升高后降低的趋势.在30 ℃时,菌株生长最旺盛,在8 h后,菌株生物量达到最高.在25~35 ℃时,菌体生长良好,而当温度过高(>40 ℃)或过低( < 20 ℃)时,菌株生长都会受到明显的抑制.
不同pH条件下LB培养基中生长情况见图 4c,由结果可知, pH为7.0和8.0时菌株生物量较高,并且两者无显著性差异.pH为6.0和9.0时菌株生物量差异显著(p < 0.05),明显低于最高值.pH为4.0、5.0和10.0时菌株生物量最低,三者无显著性差异.菌株在pH 6.0~8.0范围内OD600 nm值都达0.9以上,在pH为7.0时菌株生长最佳,OD600 nm值达到1.167.当pH低于6.0、高于9.0菌株生长受到抑制,OD600 nm值在0.2以下.pH值过小或过大都不利于菌种的生长,当pH为7.0时菌株生长最佳.
不同盐浓度条件下LB培养基中培养24 h后,培养基OD600 nm值如图 4d所示,由结果可知, 盐浓度为0和5 g·L-1时菌株生物量最大且无显著性差异,其它盐浓度条件下菌株生物量差异显著(p < 0.05).菌株盐度耐受范围广,在0~20 g·L-1均能生长,在高于20 g·L-1时菌株生长受到抑制.
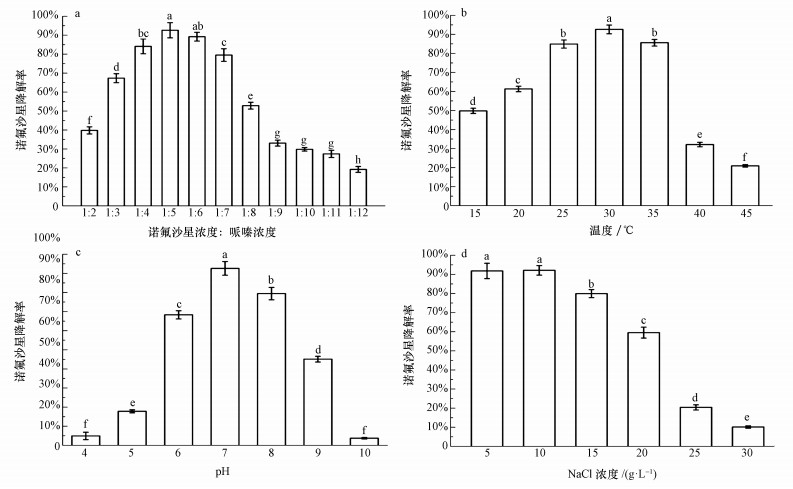
3.6 共代谢降解条件的优化如图 5a可知, 哌嗪与诺氟沙星浓度比为5:1和6:1时诺氟沙星的降解率较高,两者之间差异不显著,且当哌嗪与诺氟沙星浓度比为5:1时,菌株降解效果最佳达到92.6%.当浓度比为4:1时降解率略微下降与浓度比为6:1时差异不显著.当浓度比升高至7:1时与4:1时差异不显著,而与6:1时存在显著性差异(p < 0.05).当哌嗪与诺氟沙星浓度比大于5,随着比值增大,哌嗪浓度升高,使哌嗪与诺氟沙星产生竞争性抑制,关键酶结合位点被哌嗪抢占,诺氟沙星的降解效率降低,且当浓度比为9:1、10:1和11:1时诺氟沙星降解率无显著性差异,其余过高浓度降解率差异显著(p < 0.05).相反当浓度比小于5,随着比值减小,哌嗪浓度降低,过低浓度的哌嗪不能诱导产生足量的关键酶用以降解目标污染物,降解率同样逐渐减小,且各浓度比之间降解率差异显著(p < 0.05).可见微生物共代谢降解诺氟沙星同样可以达到较高的降解率.陈世界(2014)利用树脂碳化和水热两步法制备了新型的光催化剂C/Fe-BiVO4,并与Fenton技术相结合建立了光催化氧化工艺,用以上工艺处理250 mL初始浓度为10 mg·L-1的诺氟沙星模拟废水,反应60 min后,降解率最高可达91.66%.丁佳丽等(2015)研究利用MBR法去除养猪废水中残留的11类抗生素,处理60 d后,其中起始浓度为3.11~7.76 μg·L-1喹诺酮类抗生素的去除率仅为52.2%,并且其中生物分解和污泥吸附分别占了27.3%和23.6%.可知相比其它处理方法,NOR-36对诺氟沙星具有同样显著的去除效果,并且其去除效果明显优于已报道的其它诺氟沙星生物处理法,所以更具应用前景.
 |
| 图 5 菌株NOR-36共代谢降解特性 Fig. 5 Co-metabolic degradation characteristics of the NOR-36 |
而由图 5b、5c、5d可知:温度为25 ℃和35 ℃时降解率无显著性差异,其余温度条件下降解率差异显著(p < 0.05).在25~35 ℃菌株共代谢作用效果较好,30 ℃时菌株共代谢作用效果最好,降解率达到91.8%.当温度低于20 ℃、高于40 ℃时菌株共代谢作用受到明显抑制.菌株在pH为5.0~9.0范围内降解率差异显著(p < 0.05),当pH为10.0和4.0时降解率较低且无显著性差异.菌株在pH 6.0~8.0范围内可正常进行共代谢作用,当pH < 6时菌株共代谢降解效率较差,pH为7.0时降解率最高达92.6%,pH>8时菌株共代谢受到明显抑制.当盐浓度为0和5 g·L-1时降解率无显著性差异,其它盐浓度条件下降解率差异显著(p < 0.05).菌株在0~15 g·L-1盐浓度范围内可正常进行共代谢作用降解诺氟沙星,当浓度高于15 g·L-1时菌株降解性能受到明显抑制.
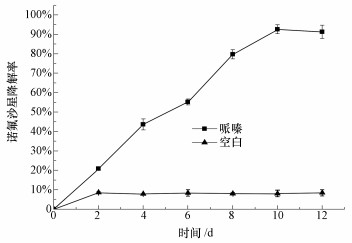
从图 6可以看出, 菌株共代谢在第10 d达到最大降解率,哌嗪作为一级基质可大大提高菌株对于诺氟沙星的降解效率.由于诺氟沙星结构中含有哌嗪环取代基,以哌嗪作为一级基质可有效诱导菌体产生降解哌嗪的关键酶,在降解诺氟沙星过程中,以关键酶诱发降解起点打开哌嗪环降解诺氟沙星.
 |
| 图 6 哌嗪对菌株NOR-36共代谢降解的影响 Fig. 6 The effect of difference factors on co-metabolic degradation of Norfloxacin by NOR-36 |
由以上NOR-36降解特性实验可知,温度、pH、盐浓度对于NOR-36共代谢降解的影响与对NOR-36生长的影响基本一致,当pH为7.0、温度为30 ℃、哌嗪与诺氟沙星浓度比为5:1时,NOR-36降解效率最高,对初始浓度为5 mg·L-1诺氟沙星的降解率达92.6%.温度过高NOR-36降解性能下降可能是因为部分代谢过程所需的酶因高温失活,导致无法实现正常的共代谢降解作用,温度过低则会降低酶活性,同样会阻碍共代谢降解作用.当pH过高或过低时会使酶失活,而导致菌株共代谢降解性能降低,这在工程实践上具有重要意义.NOR-36在盐浓度 < 15 g·L-1时均可正常生长,有一定的盐浓度耐受性,在盐浓度较高时微生物会通过自身的渗透压调节机制来平衡细胞内的渗透压,调节自身新陈代谢,以适应相应盐度环境(董滨等, 2011).
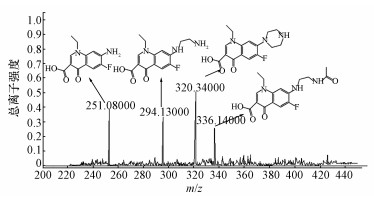
3.7 诺氟沙星降解产物与降解途径研究根据一级质谱图(图 7)中各产物碎片的质荷比,可推测诺氟沙星降解后得到3种产物,m/z分别为336.14、294.13、251.08;初步推测其分子式为产物1为C16H18FN3O4、产物2为C14H16FN3O3、产物3为C12H11FN2O3.由NOR-36降解诺氟沙星的共代谢机理可推测其降解起点为哌嗪环上碳氮键的断裂,初步推测3种产物的结构如图 7所示.为进一步确认产物的结构,对二级质谱图(图 8)中各种碎片峰进行分析可知,NOR-36降解诺氟沙星的主要过程为哌嗪环的开环氧化,并且确认了产物的结构.
 |
| 图 7 诺氟沙星一级质谱图 Fig. 7 First-order mass spectrogram of Norfloxacin |
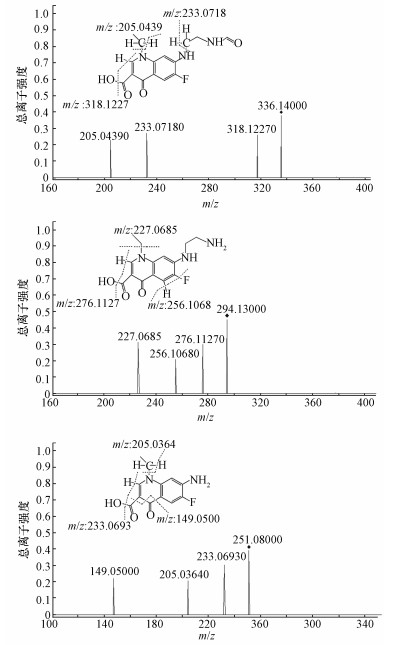 |
| 图 8 诺氟沙星二级质谱图 Fig. 8 Secondary mass spectrogram of Norfloxacin |
由降解产物的结构推测NOR-36降解诺氟沙星的降解途径如图 9所示.首先在共代谢关键酶(Elangov, 2010)作用下哌嗪环上碳氮键断裂,中间位置碳原子被氧原子氧化,加氧形成羰基得到产物1;之后产物1继续被氧化,碳氮键继续断裂,-COCH3基团被去除生成产物2(Kim et al., 2011; 陈世界, 2014),最后产物2经氧化后,-CH2CH2NH2基团被去除,最终得到产物3(陈世界, 2014).Liu等(2012)研究了废水经臭氧处理后其中所含诺氟沙星的降解途径,并且在检测到的20种产物中含有以上的产物2与产物3,说明本文诺氟沙星降解途径与其类似.施华顺等(2011)利用湿式氧化分解诺氟沙星对其降解途径进行研究,检测到9种产物,推测降解途径,结果同样与本文类似.
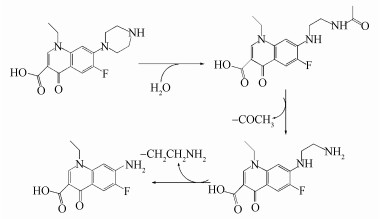 |
| 图 9 降解途径 Fig. 9 the proposed Degradation pathway of Norfloxacin by NOR-36 |
1)从医药厂污水池中分离得到菌株NOR-36,初步鉴定为山羊葡萄球菌(Staphylococcus caprae),该菌株能通过共代谢机制以哌嗪为降解基质有效降解水体中的诺氟沙星.
2)共代谢降解过程的最佳条件为pH为7.0、温度为30 ℃、哌嗪与诺氟沙星浓度比为5:1,在该条件下,NOR-36对初始浓度为5 mg·L-1的诺氟沙星的降解率为92.6%.
3)通过HPLC-MS/MS分析推断出诺氟沙星的降解途径为, 哌嗪环上碳氮键断裂并加氧氧化,之后断开的哌嗪环继续被氧化,最终哌嗪环被完全去除.
| [${referVo.labelOrder}] | Ahmed M J, Theydan S K. 2014. Fluoroquinolones antibiotics adsorption onto microporous activated carbon from lignocellulosic biomass by microwave pyrolysis[J]. Journal of the Taiwan Institute of Chemical Engineers, 45(1) : 219–226. DOI:10.1016/j.jtice.2013.05.014 |
| [${referVo.labelOrder}] | Alexy R, Kumpel T, Kummerer K. 2004. Assessment of degradation of 18 antibiotics in the Closed Bottle Test[J]. Chemosphere, 57(6) : 505–512. DOI:10.1016/j.chemosphere.2004.06.024 |
| [${referVo.labelOrder}] | Boxall A B A, Fogg L A, Blackwell P A, et al. 2004. Veterinary medicines in the environment[J]. Reviews of Environmental Contamination and Toxicology, 180 : 1–91. |
| [${referVo.labelOrder}] | Bruce J R, Paul K S L, Michael M. 2005. Emerging chemicals of concern:Pharmaceuticals and personal care products (PPCPs) in Asia, with particular reference to Southern China[J]. Marine Pollution Bulletin, 50(9) : 913–920. DOI:10.1016/j.marpolbul.2005.06.034 |
| [${referVo.labelOrder}] | 布坎南R E, 吉N E. 1984. 伯杰氏细菌鉴定手册[M]. 北京: 科学出版社. |
| [${referVo.labelOrder}] | Calamari D, Zuccato E, Castiglioni S R, et al. 2003. Strategic survey of therapeutic drugs in the rivers Po and Lambro in Northern Italy[J]. Environmental Science & Technology, 37(2) : 1241–1248. |
| [${referVo.labelOrder}] | Chen M J, Chu W. 2016. H2O2 assisted degradation of antibiotic norfloxacin over simulated solar light mediated Bi2WO6:Kinetics and reaction pathway[J]. Chemical Engineering Journal, 296 : 310–318. DOI:10.1016/j.cej.2016.03.083 |
| [${referVo.labelOrder}] | 陈世界. 2014.二种氟喹诺酮类抗生素光催化氧化处理方法研究[D].哈尔滨:哈尔滨工业大学. 102-104 |
| [${referVo.labelOrder}] | Cokgor E U, Alaton I A, Karahan O, et al. 2004. Biological treatability of raw and ozonated penicillin formulation effluent[J]. Journal of Hazardous Materials, 116(1/2) : 159–166. |
| [${referVo.labelOrder}] | 丁佳丽, 刘锐, 郑炜, 等. 2015. 养猪废水和污泥中11种兽用抗生素的同时分析技术及其在生物降解过程的应用[J]. 环境科学, 2015, 36(10) : 3919–3925. |
| [${referVo.labelOrder}] | 董滨, 王凤花, 林爱军, 等. 2011. 乙草胺降解菌A-3的筛选及其降解特性[J]. 环境科学, 2011, 32(2) : 542–547. |
| [${referVo.labelOrder}] | 董春娟, 吕丙南. 2003. 处理生物难降解物质的有效方式一共代谢[J]. 化工环保, 2003, 23(2) : 82–85. |
| [${referVo.labelOrder}] | 东秀珠, 蔡妙英. 2001. 常见细菌系统鉴定手册[M]. 北京: 科学出版社. |
| [${referVo.labelOrder}] | Dorival Garcia N, Navalon A, Gonzalez J, et al. 2013. Removal of quinolone antibiotics from wastewaters by sorption and biological degradation in laboratory-scale membrane bioreactors[J]. Science of the Total Environment, 442 : 317–328. DOI:10.1016/j.scitotenv.2012.10.026 |
| [${referVo.labelOrder}] | Elangov.2010.Biodegradation and bioremediation of hexachlorocyclohexane isomers, chlorinated ethenes, chlorinated benzenes and benzene[D]. Clemson:Clemson University |
| [${referVo.labelOrder}] | 范秀容, 李广武, 沈萍. 2001. 微生物学实验[M]. 北京: 高等教育出版社: 75–7. |
| [${referVo.labelOrder}] | Felczak A, Zawadzka K, Lisowska K. 2014. Efficient biodegradation of quinolone-Factors determining the process[J]. International Biodeterioration & Biodegradation, 96 : 127–134. |
| [${referVo.labelOrder}] | Golet E M, Alder A C, Hartmann A, et al. 2001. Traces determination of fluoroquinolone antibacterial agents in urban wastewater by solid-phase extraction and liquid chromatography with fluorescence detection[J]. Analytical Chemistry, 73(15) : 3632–3638. DOI:10.1021/ac0015265 |
| [${referVo.labelOrder}] | Igor A, Parshikov J B, Sutherland. 2012. Microbial transformations of antimicrobial quinolones and related drugs[J]. Journal of Industrial Microbiology & Biotechnology, 39(12) : 1731–1740. |
| [${referVo.labelOrder}] | 季秋洁. 2012. 3种氟喹诺酮类抗生素在猪粪中的残留与降解[D].合肥:安徽农业大学. 7-8 |
| [${referVo.labelOrder}] | Kim D W, Kim B S, Laura K. 2011. Modification of Norfloxacin by a Microbacterium sp[J]. Strain Isolated from a Wastewater Treatment Plant[J]. Applied and Environmental Microbiolog, 77(17) : 6100–6108. |
| [${referVo.labelOrder}] | Kummerer K, Henninger A. 2003. Promoting resistance by the emission of antibioties from hospital and households into effluents[J]. Clinical Microbiology and Infection, 9(12) : 1203–1214. DOI:10.1111/j.1469-0691.2003.00739.x |
| [${referVo.labelOrder}] | Leadbetter E R, Foster J W. 1959. Oxidation products formed from gaseous alkane by the bacterium Arch[J]. Biochemical and Biophysical Research Communications, 82 : 491–492. |
| [${referVo.labelOrder}] | Lee H B, Peart T E, Svoboda L. 2007. Determination of ofloxacin, norfloxacin, liquid chromatography with fluorescence detection, and liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography A, 1139(1) : 45–52. DOI:10.1016/j.chroma.2006.11.068 |
| [${referVo.labelOrder}] | Liu C, Nanaboina V, Korshin G V, et al. 2012. Spectroscopic study of degradation products of ciprofloxacin, norfloxacin and lomefloxacin formed in ozonated wastewater[J]. Water Research, 46(16) : 5235–5246. DOI:10.1016/j.watres.2012.07.005 |
| [${referVo.labelOrder}] | 罗玮. 2012. 难降解污染物微生物共代谢作用研究进展[J]. 土壤通报, 2012, 43(6) : 1516–1521. |
| [${referVo.labelOrder}] | 吕咏梅. 2004. 氟喹诺酮类药物市场分析与发展前景[J]. 化工文摘, 2004(5) : 23–25. |
| [${referVo.labelOrder}] | Miller S A, Dykes D D, Polesky H F. 1988. A simple salting out procedure for extracting DNA from human nucleated cells[J]. Nucleic Acids Research, 16(3) : 1215. DOI:10.1093/nar/16.3.1215 |
| [${referVo.labelOrder}] | 瞿福平, 张晓健, 何苗. 1997. 氯苯类有机物生物降解性及共代谢作用研究[J]. 中国环境科学, 1997, 17(2) : 142–145. |
| [${referVo.labelOrder}] | Radjenović J, Petrovic M, Barcelo D. 2009. Fate and distribution of pharmaceuticals in wastewater and sewage sludge of the conventional activated sludge (CAS) and advanced membrane bioreactor (MBR) treatment[J]. Water Research, 43(3) : 831–841. DOI:10.1016/j.watres.2008.11.043 |
| [${referVo.labelOrder}] | 施华顺, 孙青郁, 胡芸. 2011. 诺氟沙星水溶液的湿式氧化分解及其产物的生成途径[J]. 环境工程学报, 2011, 5(6) : 1258–1262. |
| [${referVo.labelOrder}] | 孙雪景. 2010. 微生物共代谢作用的研究与应用[J]. 农业与技术, 2010, 30(4) : 57–60. |
| [${referVo.labelOrder}] | Stackebrandt E, Goodfellow M. 1991. Nucleic Acid Techniquesn Bacterial Systematics[M]. UK: John Wiley & Sons: 371–375. |
| [${referVo.labelOrder}] | Wang S G, Liu X W, Zhang H Y, et al. 2007. Aerobic granulation for 2, 4-dichlorophenol biodegradation in a sequencing batch reactor[J]. Chemosphere, 69(5) : 769–775. DOI:10.1016/j.chemosphere.2007.05.026 |
| [${referVo.labelOrder}] | Xu W H, Zhang G, Zou S C, et al. 2007. Determination of selected antibiotics in the Victoria Harbour and the Pearl River, South China using high-performance liquid chromatography-electrospray ionization tandem mass spectrometry[J]. Environmental Pollution, 145(3) : 672–679. DOI:10.1016/j.envpol.2006.05.038 |
| [${referVo.labelOrder}] | 徐森, 胡晓东, 郑秋辉. 2011. 生物组合工艺处理抗生素废水现状及展望[J]. 工业水处理, 2011, 31(2) : 5–8. |
| [${referVo.labelOrder}] | 邰义萍, 莫测辉, 李彦文, 等. 2010. 长期施用粪肥土壤中喹诺酮类抗生素的含量与分布特征[J]. 中国环境科学, 2010, 30(6) : 816–821. |
| [${referVo.labelOrder}] | 张剑鸣, 贾燕, 江栋. 2009. 一株高效脱硫脱氨氮菌的分离鉴定及系统发育分析[J]. 环境工程学报, 2009, 3(5) : 881–885. |
| [${referVo.labelOrder}] | Zhou L J, Zhao J L, Liu S, et al. 2013. Occurrence and fate of eleven classes of antibiotics in two typical wastewater treatment plants in South China[J]. Science of the Total Environment, 452-453 : 365–376. DOI:10.1016/j.scitotenv.2013.03.010 |
 2017, Vol. 37
2017, Vol. 37


