2. 南方科技大学环境科学与工程学院, 深圳 518055
2. School of Environmental Science and Engineering, South University of Science & Technology of China, Shenzhen 518055
四溴双酚A (tetrabromobisphenol-A, TBBPA)是世界上产量和用量最大的溴代阻燃剂之一(Alaee et al., 2003), 因其具有良好的阻燃特性和低廉的成本优势, 常作为添加型和反应型阻燃剂及反应中间体被广泛应用于塑料、橡胶、纤维和造纸等工业产品及电路板等电子产品中(Choi et al., 2009; Zhou et al., 2014).在这些产品的生产、使用及处理过程中, 四溴双酚A会暴露于环境中.近年来, TBBPA在世界范围内的河流、沉积物及污泥中被频繁检出(Sellström et al., 1995; Gorga et al., 2013; Huang et al., 2014; Deng et al., 2014; 王俊霞等, 2014).Harrad等在英国的9个湖泊中检测到TBBPA, 浓度为140~3200 pg·L-1(Harrad et al., 2009);Berg等也在瑞士的22座污水处理厂污泥中检出TBBPA含量为300 ng·g-1湿重(Öberg et al., 2002).在中国, Yang等对巢湖湖水及湖底沉积物进行检测, 发现TBBPA在湖水中浓度高达4.87 μg·L-1, 在湖底沉积物中为518 ng·g-1干泥, 严重高出同时期其他河流中TBBPA浓度(Yang et al., 2012).由于TBBPA能够长时间存在于环境中, 并通过食物链最终积累在生物体内(Johnson Restrepo et al., 2008; Shi et al., 2009; 杨苏文等, 2012), 对水生植物、鱼类及人体健康造成严重危害(Strack et al., 2007; Kling et al., 2009; 杜青平等, 2012).因此, TBBPA的环境污染问题日益受到关注, 尤其是电子企业、化工厂等工厂废水中的TBBPA不能被常规污水处理工艺去除, 所以找到高效降解方法使其转化为无毒或低毒性物质便成为问题之关键.
目前, 降解TBBPA的方法有热解法(Barontini et al., 2004)、还原法(Liu et al., 2006)、臭氧氧化法(Zhang et al., 2009; Zhang et al., 2011)、光催化法(Guo et al., 2012)、UV/芬顿法(Zhong et al., 2012)、微生物降解法(Lin et al., 2009)等, 这些方法各具优点, 在温度、臭氧、光及各种催化剂等辅助条件下能够有效降解TBBPA或将其转化为其他物质.然而, 由于TBBPA结构稳定且溴原子物化性质特殊, 这些方法对实验条件要求严格, 使得其难以大范围应用于废污水处理中.例如, 热解法对温度要求极高, 且高温下易有二次污染物如二英(PBDD/Fs)产生, 对环境和人体健康危害更大(Grause et al., 2008);微生物降解法在筛选及培养细菌方面条件较为严苛(Ronen et al., 2000; Chang et al., 2012);还原法等其他降解法在降解程度、降解时间、实验操作等方面都需要进一步提高改进(Luo et al., 2010; Liu et al., 2006).因此, 有必要寻找更为先进实用和高效便捷的TBBPA降解新技术.
电化学法作为一种高级氧化法, 近些年来被不断用于降解废水中的难降解有机污染物, 如全氟羧酸类(PFCAs)(Niu et al., 2012)、全氟辛酸(PFOA)(Zhao et al., 2013)、溴代联苯醚(PBDEs)(Liu et al., 2014)、多氯联苯(PCBs)(Janderka et al., 1995)及丙烯腈(褚衍洋等, 2009)等.电化学法不仅操作简便、反应周期短、降解彻底, 而且拥有强氧化性能、反应条件温和、成本低及环境兼容性等诸多优点.因此,可考虑尝试用电化学降解法来降解水中TBBPA.目前对于电化学法降解TBBPA的研究报道较少(Luo et al., 2011; 占春荣等, 2011; 刘立平等, 2015), 且反应大多进行到脱溴阶段, 降解并不彻底.用于电化学法的电极有很多种, Ti/RuO2-IrO2电极是一种多金属混合氧化层电极, 具有导电性能高、催化活性强、性质稳定等优点, 且应用很广泛, 常用于降解难降解有机物如反应型二氯三嗪染料(Kusmierek et al., 2011)、抗生素(Wu et al., 2012; Zhang et al., 2009)及反渗透浓缩废水(Radjenovic et al., 2011)等.电化学的主要过程是阳极氧化反应(Oturan et al., 2013; Pipi et al., 2014; Comninellis, 1994), 首先溶液中H2O或OH-在阳极表面放电并形成具有强氧化性的羟基自由基(· OH), 然后·OH将物理吸附或化学吸附在电极表面.当溶液中目标污染物靠近电极表面时, 物理吸附的·OH在电化学氧化过程中起主要氧化作用, 而化学吸附的·OH与阳极上现存的氧反应, 并使羟基自由基中的氧转移给金属氧化物晶格而形成高价态氧化物的活性氧, 参与电化学转化过程;最终这两种形态的自由基共同氧化目标污染物分子, 将其氧化成低分子形态物质, 最终降解为H2O和CO2.因此, 根据电化学降解原理, 可以推测用电化学法降解TBBPA会是一种合理的且具有潜力的方法.
本文采用对难降解有机物具有良好降解效果的Ti/RuO2-IrO2电极, 考察其对溶液中TBBPA的电化学降解效果;探究了电流密度、溶液初始pH、极板间距和电解质浓度等主要因素对降解速率的影响;通过分析检测中间产物, 提出了可能的降解途径;并计算了电化学方法降解TBBPA的能量消耗, 以期为实际废污水中TBBPA的降解提供基础数据.
2 实验材料与方法(Experimental materials and methods) 2.1 试剂与材料TBBPA、BPA、2-溴苯酚、2, 6-二溴苯酚和苯酚, 纯度均为99.0%, 购自德国Dr. Ehrenstorfer GmbH公司, 并于4 ℃低温下保存;氢氧化钠、硫酸、硫酸钠及乙酸铵等药品, 购自北京Sinopharm公司;甲醇、乙腈等有机试剂均为国产分析纯.Ti/RuO2-IrO2电极和铁板(15 cm × 15 cm, 1 mm厚), 购自北京恒立钛公司;电解槽(长度15 cm;宽度15 cm;厚度10~30 mm)由有机玻璃制成;直流稳压电源(DH1715A), 购自北京大华电子有限公司;pH计(pH 211)购自美国EUTECH公司.
2.2 实验方法实验装置见图 1, Ti/RuO2-IrO2电极和铁板分别作为阳极板和阴极板, 置于装有100 mL电解液的电解槽中.在恒流模式下进行电解实验, 温度为(25±1) ℃.每次实验均以含有初始浓度为5 mg·L-1的TBBPA电解液(30%甲醇, V/V)作为反应对象, 加入Na2SO4作为电解质, 考察在不同电解质浓度、电流密度、pH值和不同极板间距影响下TBBPA的降解率.利用5%的硫酸溶液和5%的氢氧化钠溶液调节电解液的初始pH.电解反应时长60 min, 在不同时间间隔(0、3、5、10、15、20、30、60 min)取样, 分析测定TBBPA浓度等.每组实验均做3组平行样.
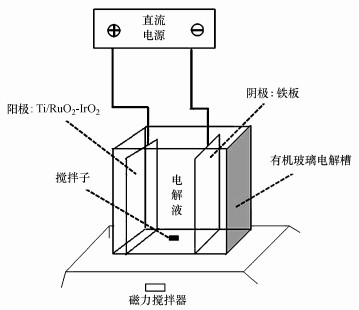 |
| 图 1 电化学降解实验装置示意图 Fig. 1 Schematic diagram of electrochemical apparatus |
电解反应中溶液的TBBPA浓度, 采用高效液相色谱(HPLC, U-3000, Dionex公司, 美国)测定, 色谱条件:色谱柱为CNW Athena C18-WP柱(4.6 mm× 250 mm, 5 μm, 上海安谱科学仪器有限公司);流动相为乙腈(80%)和0.5%的硫酸(20%);流速:1.0 ml·L-1;UV检测波长:210 nm;进样量:10 μL;进样时间:10 min.通过对添加不同浓度的甲醇电解液中TBBPA进行分析, 结果表明, 甲醇对TBBPA的浓度检测影响可以忽略不计.
TBBPA电解过程中产生的芳香族中间产物BPA和2-溴苯酚, 采用高效液相色谱和三重四极杆串联质谱联用系统(LC-MS/MS, API3200, Applied Biosystems公司, 美国)测定.色谱条件:色谱柱为Arcus EP-C18 column (4.6 mm × 150 mm, 5 μm, 上海伍丰科学仪器有限公司);流动相A:乙腈, 流动相B:水;流速0.7 mL min-1, 柱温40 ℃, 进样量10 μL;采用梯度洗脱方式, 洗脱程序:0~2 min, 流动相A从5%线性变化到85%;2~10 min, 流动相A保持在85%;10~11 min, 流动相A从85%线性变化到5%;11~14 min, 流动相A保持在5%.质谱条件:采用电喷雾离子源ESI负离子模式, 质谱扫描范围(m/z):50~1000.对于BPA, Q1/Q3为227.2/133.1;DP为-50 V;CE为-35 V.对于2-溴苯酚, Q1/Q3为172.9/155.0;DP为-45 V;CE为-55 V.
电解过程中, 能量消耗的计算公式参考了Elaoud等(2011)的报道.
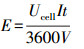
|
(1) |
式中:E为电解过程中消耗的能量(kWh·m-3); Ucell为槽电压(V);I为实际应用电流(A);t为电解时间(s);V为电解液体积(m3).
3 结果与讨论(Results and discussion) 3.1 Ti/RuO2-IrO2电极和电解槽对TBBPA的降解Ti/RuO2-IrO2电极能否有效降解TBBPA, 所采用电极和电解槽是否会对电解效率产生影响, 这些问题值得探究.由图 2可知, 当阳极和阴极插入电解槽(TBBPA浓度为5 mg·L-1)并通电后, 发现电解液中TBBPA浓度急剧下降, 在20 min内降低了80%, 且在60 min时, TBBPA几乎完全消失, 可初步判断电化学法可有效移除溶液中TBBPA, 但尚不能说明TBBPA是被降解.接着进行了两组空白实验:第一组空白实验是指在不插入极板亦不通电情况下, 将电解液于电解槽中静置60 min, 发现TBBPA浓度几乎没有变化, 结果表明电解槽对TBBPA没有吸附作用;第二组空白实验是指将阳极和阴极极板插入电解槽但并未通电的情况下, 电解液静置30 min时, TBBPA浓度发生轻微下降, 约为5%, 但之后保持平衡不再发生变化, 结果表明阴极和阳极电极对TBBPA有一定的物理吸附作用, 但吸附作用很小.因此, 上述实验结果表明, 采用Ti/RuO2-IrO2电极的电化学方法可有效降解溶液中的TBBPA.对接下来所有降解实验进行动力学分析, 发现降解过程符合一级反应动力学(R2 > 0.98), 表 1为所有反应条件下的反应速率常数(k)、半衰期(t1/2)和标准差(R2).
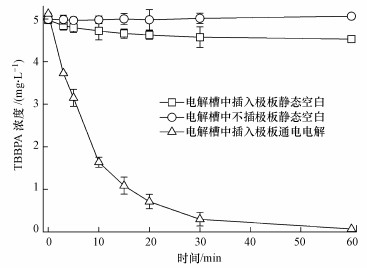 |
| 图 2 电解槽和电极对TBBPA降解效率影响的空白对照实验 Fig. 2 The blank control experiment of electrolysis cell and electrodes to TBBPA degradation |
| 表 1 电化学降解TBBPA效率及动力学常数 Table 1 The efficiency and kinetics of TBBPA degradation |
由于氯化钠在通电条件下会生成具有强氧化性的活性氯形态, 因此,研究报道多认为氯化钠作为电解质比硫酸钠更有利于有机物的降解(Aquino Neto et al., 2009; Can, 2015).但是Vallejo等(2013)在降解2-氯苯酚时发现, 活性态的氯离子容易与苯环结合, 产生多氯衍生物如氯代二英(PCDD/Fs).因此,考虑到本实验中目标污染物TBBPA在降解过程中很可能产生大量带有苯环的中间产物, 为避免有活性态的氯离子存在时进一步结合产生多氯衍生物, 造成二次污染, 故选择硫酸钠作为电解质.
图 3比较了不同硫酸钠浓度(1、5、10、20、40 mmol·L-1)条件下TBBPA的降解情况.由图 3可知, 较低的硫酸钠浓度有利于TBBPA的降解.如表 1所示, 当硫酸钠浓度由1 mmol·L-1升高到40 mmol·L-1过程中, TBBPA的降解率逐渐降低, 依次为98.9%、97.2%、96.2%、95.4%和95.1%, 相应的半衰期变大.本文的实验结果与Fernandes等(2004)及Aquino Neto等(2009)报道的并不一致, 这是由于溶液中大量存在的Na+、SO42-(相对于TBBPA的浓度), 以及TBBPA在降解过程不断生成的中间产物, 对TBBPA及其溶解态离子(TBBPA-和TBBPA2-)向电极表面附近的迁移形成了一定的传质阻力, 且随着电极表面附近TBBPA的不断消耗, 远离电极的污染物离子需要克服更大的传质阻力到达电极表面, 间接降低了TBBPA的降解效率(Dai et al., 2014).
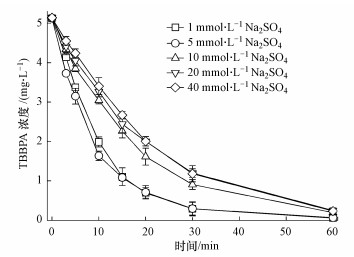 |
| 图 3 电解质浓度对TBBPA降解效率的影响(电流密度:10 mA·cm-2, 极板间距:1 cm, pH=6, 温度:25 ℃) Fig. 3 The variation of TBBPA concentration with the electrolysis time at 25 ℃under different electrolyte concentration (current density: 10 mA·cm-2, plate distance: 1 cm and pH=6) |
本文利用能耗的计算公式(1)探讨了电解质浓度对能耗的影响.由表 2可知, 当硫酸钠浓度由1 mmol·L-1升高到40 mmol·L-1时, 能耗由211.99 kWh·m-3下降到58.52 kWh·m-3, 这是由于当电解质浓度升高时, 溶液的欧姆电阻下降, 而电流恒定, 则电压下降, 使得能耗降低, 与Yıldız等(2008)报道的结果一致.当电解质浓度为1和5 mmol·L-1时, TBBPA降解率较高, 综合考虑到能量消耗, 本研究选择5 mmol·L-1作为最适电解质浓度.
| 表 2 电解质浓度对能量消耗及槽电压的影响 Table 2 The effect of electrolyte concentration on cell voltage and energy consumption |
电流密度是影响电化学降解TBBPA的主要因素, 如图 4所示, 随着电流密度的增加(5、10、15和20 mA·cm-2), TBBPA的降解速率明显增大, 降解效率也不断提高, 这是由于溶液中TBBPA的降解率主要由电子转移能力和羟基自由基(·OH)的生成能力主导(Comninellis, 1994; Li et al., 2005; Martínez Huitle et al., 2006), 而·OH的生成能力主要由电流密度控制, 电流密度越大, ·OH生成速率越大, 进而TBBPA的降解速率越大.由表 1可知, 当电流密度由5 mA·cm-2升至20 mA·cm-2时, TBBPA的降解速率常数由0.047 min-1明显增大到0.135 min-1, 降解率也由93.0%提高至99.4%.然而当电流密度增大到10 mA·cm-2时, TBBPA的降解率已在97%以上, 继续增大电流密度对增加降解率的效果并不明显, 却大大缩短了电极的寿命, 增加了降解成本且不利于降解方法的大范围应用, 综合考虑, 本研究采用10 mA·cm-2作为最适电流密度.
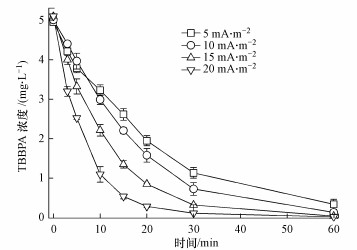 |
| 图 4 电流密度对TBBPA降解效率的影响(电解质浓度:5 mmol·L-1 Na2SO4, 极板间距:1 cm, pH=6, 温度:25 ℃) Fig. 4 The variation of TBBPA concentration with the electrolysis time at 25 ℃under different current density (electrolyte concentration:5 mmol·L-1 Na2SO4, plate distance: 1 cm and pH=6) |
pH值影响溶液中TBBPA的溶解度及存在形式, 进而影响其在溶液中的分散程度.图 5比较了不同溶液初始pH值条件下TBBPA的降解情况.由图 5可知, 与较高的pH值(pH=11)条件相比, 较低的pH值(pH=3, 5)条件下TBBPA的降解速率较大, 降解速率更高.这是由于酸性条件更有利于·OH的生成, 进而促进TBBPA的降解速率(Boye et al., 2003; Niu et al., 2013).然而, 从表 1可知, 当溶液pH升高到9时, TBBPA的降解速率却又增大, 这可能是因为在弱碱性条件下, 虽然·OH生成速率下降, 对TBBPA的降解不利, 但TBBPA在溶液中的溶解度得到提高, 由难溶的分子态不断转化为溶解态(TBBPA-或TBBPA2-), 极有利于其向电极表面附近的扩散, 我们的实验结果正好与Li等(2013)的报道结果相吻合.由于溶液pH值对TBBPA的降解率影响较为复杂, 需要进一步做深入研究.
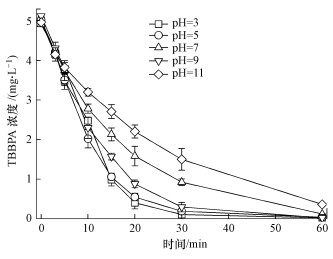 |
| 图 5 溶液初始pH对TBBPA降解效率的影响(电流密度:10 mA·cm-2, 电解质浓度:5 mmol·L-1 Na2SO4, 极板间距:1 cm, 温度:25 ℃) Fig. 5 The variation of TBBPA concentration with the electrolysis time at 25 ℃under different initial pH (current density: 10 mA·cm-2, electrolyte concentration:5 mmol·L-1 Na2SO4, and plate distance:1 cm) |
极板间距主要影响物质的传输, 间距越大, TBBPA向阳极表面迁移的传输速率越慢.如图 6所示, 随着极板间距从1 cm增大至3 cm, TBBPA的降解速率明显降低.由表 1可知, 当极板间距分别为1、2和3 cm时, 相应的TBBPA降解率分别为97.2%, 67.0%和48.1%, 降解程度相差很大.而且极板间距为1 cm时, TBBPA的降解速率最大, 降解速率常数约为间距为2和3 cm时的3倍和5倍.由此可见, 过大的极板间距会造成物质传输局限, TBBPA需要较长的时间到达阳极表面, 不利于其被降解(Lin et al., 2012; Niu et al., 2012).本研究采用1 cm作为最适极板间距.
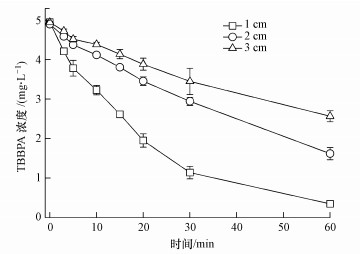 |
| 图 6 极板间距对TBBPA降解效率的影响(电流密度:10 mA·cm-2, 电解质浓度:5 mmol·L-1 Na2SO4, pH=6;温度:25 ℃) Fig. 6 The variation of TBBPA concentration with the electrolysis time at 25 ℃under different plate distance (current density:10 mA·cm-2, electrolyte concentration:5 mmol·L-1 Na2SO4, and pH=6) |
本实验利用HPLC-MS/MS (ESI-MRM)对降解过程中不同电解时间的电解液进行检测发现, 在7、20 min时检测到降解产物BPA和2-溴苯酚, 但60 min时却没有检测到上述两种降解产物, 由此推测BPA和2-溴苯酚是降解中间产物, 将被进一步降解.基于以上推测, 并考虑到BPA和2-溴苯酚仍然具有生态毒性, 本实验又进一步在与TBBPA同等条件下, 开展了5 mg·L-1上述两种中间产物的降解试验.如图 7所示, 60 min内, BPA和2-溴苯酚几乎完全被降解, 表明在Ti/RuO2-IrO2电极作用下, TBBPA及其中间产物可连续降解.
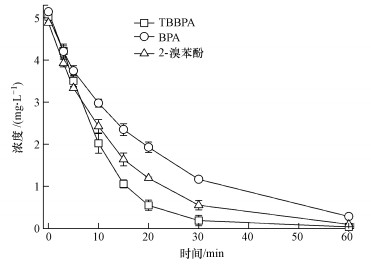 |
| 图 7 与TBBPA相同降解条件下BPA和2-溴苯酚的电化学降解过程中的浓度变化(电流密度:10 mA·cm-2;极板间距:1 cm;电解质浓度:5 mmol·L-1;pH=6;温度:25 ℃) Fig. 7 Changes in the concentration of BPA and 2-bromophenol during the electrochemical degradation of TBBPA under the same degradation conditions (current density: 10 mA·cm-2, plate distance: 1 cm, electrolyte concentration:5 mmol·L-1 Na2SO4, pH=6, and T=25 ℃) |
根据检测到的两种降解中间产物BPA和2-溴苯酚, 既有简单脱溴后的产物, 也有较为简单的低分子产物.推测TBBPA的降解途径有两种, 如图 8所示.在途径1中, 溶液中的H2O或者OH-在阳极放电并形成吸附性的·OH, 所形成的·OH作用于TBBPA苯环, 使其C-Br键断裂, 直接导致TBBPA脱溴生成BPA, 或者连续脱溴依次生成TriBBPA、DiBBPA和monoBBPA, 最终生成BPA.另一方面, 在脱溴过程中, ·OH也可作用于TBBPA的苯环与异丙基之间的C-C键, 使其断裂, 生成2-溴苯酚或其他中间产物.途径1常见于高级氧化法如光催化氧化、臭氧氧化及photo-Fenton法降解TBBPA过程(An et al., 2013; An et al., 2011; Xu et al., 2011).在途径2中, ·OH先作用于苯环与异丙基之间的C-C键, 使其断裂生成2, 6-二溴苯酚, 之后·OH继续攻击C-Br键, 脱溴生成2-溴苯酚(Zhong et al., 2012).电化学氧化降解有机物过程比较复杂, 本研究为进一步深入开展TBBPA降解机理研究方面提供了研究基础.
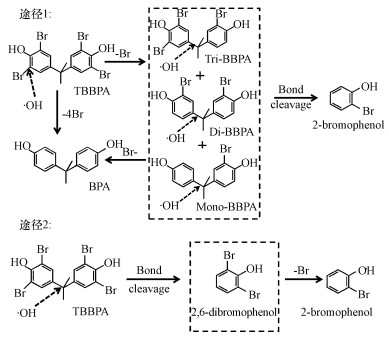 |
| 图 8 TBBPA可能的电化学降解途径 Fig. 8 Proposed reaction pathways for TBBPA degradation |
1) Ti/RuO2-IrO2电极可有效降解溶液中TBBPA, 且电化学降解反应遵循一级动力学方程.
2) TBBPA的降解效率会随着电流密度的增大、电解质浓度减少以及极板间距的缩小而增加.
3) pH对TBBPA电化学降解的影响较为复杂, 酸性条件(pH=3、5)较中性条件(pH=7、8)有利于TBBPA的降解, 但弱碱性条件(pH=9)可以促进TBBPA向电极表面附近扩散, 提高TBBPA降解效率.
4)电解质浓度越低, TBBPA电化学降解的能量消耗越小.
5) TBBPA降解产生的中间产物BPA和2-溴苯酚可以进一步被降解, 其降解途径可能为连续的脱溴过程以及苯环与异丙基之间C-C键的断裂过程.
6)采用Ti/RuO2-IrO2电极的电化学法是一种高效的、有潜力的降解难降解有机污染物的方法, 本研究将为实际废污水中TBBPA的降解提供参考依据.
| [${referVo.labelOrder}] | Alaee M, Arias P, Sjödin A, et al. 2003. An overview of commercially used brominated flame retardants, their applications, their use patterns in different countries/regions and possible modes of release[J]. Environment International, 29(6) : 683–689. DOI:10.1016/S0160-4120(03)00121-1 |
| [${referVo.labelOrder}] | An J, Zhu L, Wang N, et al. 2013. Photo-Fenton like degradation of tetrabromobisphenol A with grapheneBiFeO3 composite as a catalyst[J]. Chemical Engineering Journal, 219 : 225–237. DOI:10.1016/j.cej.2013.01.013 |
| [${referVo.labelOrder}] | An T, Zu L, Li G, et al. 2011. One-step process for debromination and aerobic mineralization of tetrabromobisphenol-A by a novel Ochrobactrum sp[J]. T isolated from an e-waste recycling site[J]. Bioresource Technology, 102(19) : 9148–9154. |
| [${referVo.labelOrder}] | Aquino Neto S, de Andrade A R. 2009. Electrooxidation of glyphosate herbicide at different DSA® compositions:pH, concentration and supporting electrolyte effect[J]. Electrochimica Acta, 54(7) : 2039–2045. DOI:10.1016/j.electacta.2008.07.019 |
| [${referVo.labelOrder}] | Barontini F, Cozzani V, Marsanich K, et al. 2004. An experimental investigation of tetrabromobisphenol A decomposition pathways[J]. Journal of Analytical and Applied Pyrolysis, 72(1) : 41–53. DOI:10.1016/j.jaap.2004.02.003 |
| [${referVo.labelOrder}] | Boye B, Marième Dieng M, Brillas E. 2003. Electrochemical degradation of 2, 4, 5-trichlorophenoxyacetic acid in aqueous medium by peroxi-coagulation[J]. Effect of pH and UV light[J]. Electrochimica Acta, 48(7) : 781–790. |
| [${referVo.labelOrder}] | Can O T. 2015. Removal of TOC from fertilizer production wastewater by electrooxidation[J]. Desalination and Water Treatment, 53(4) : 919–927. |
| [${referVo.labelOrder}] | Chang B V, Yuan S Y, Ren Y L. 2012. Aerobic degradation of tetrabromobisphenol-A by microbes in river sediment[J]. Chemosphere, 87(5) : 535–541. DOI:10.1016/j.chemosphere.2011.12.057 |
| [${referVo.labelOrder}] | 陈满堂, 宋洲, 王楠, 等. 2015. 铋银氧化物混合物高效氧化降解四溴双酚A的研究[J]. 环境科学, 2015, 36(1) : 209–214. |
| [${referVo.labelOrder}] | Choi K, Lee S, Osako M. 2009. Leaching of brominated flame retardants from TV housing plastics in the presence of dissolved humic matter[J]. Chemosphere, 74(3) : 460–466. DOI:10.1016/j.chemosphere.2008.08.030 |
| [${referVo.labelOrder}] | Comninellis C. 1994. Electrochemical oxidation of organic pollutants for wastewater treatment[J]. Studies in Environmental Science, 59 : 77–102. DOI:10.1016/S0166-1116(08)70548-X |
| [${referVo.labelOrder}] | Dai Q, Xia Y, Sun C, et al. 2014. Electrochemical degradation of levodopa with modified PbO2 electrode:Parameter optimization and degradation mechanism[J]. Chemical Engineering Journal, 245 : 359–366. DOI:10.1016/j.cej.2013.08.036 |
| [${referVo.labelOrder}] | 杜青平, 彭润, 刘伍香, 等. 2012. 四溴双酚A对斑马鱼胚胎体内外发育的毒性效应[J]. 环境科学学报, 2012, 32(3) : 739–744. |
| [${referVo.labelOrder}] | Deng J, Guo J, Zhou X, et al. 2014. Hazardous substances in indoor dust emitted from waste TV recycling facility[J]. Environmental Science and Pollution Research, 21(12) : 7656–7667. DOI:10.1007/s11356-014-2662-9 |
| [${referVo.labelOrder}] | Elaoud S C, Panizza M, Cerisola G, et al. 2011. Electrochemical degradation of sinapinic acid on a BDD anode[J]. Desalination, 272(1) : 148–153. |
| [${referVo.labelOrder}] | Fernandes A, Morão A, Magrinho M, et al. 2004. Electrochemical degradation of C. I. Acid Orange 7[J]. Dyes and Pigments, 61(3) : 287–296. DOI:10.1016/j.dyepig.2003.11.008 |
| [${referVo.labelOrder}] | Gorga M, Martínez E, Ginebreda A, et al. 2013. Determination of PBDEs, HBB, PBEB, DBDPE, HBCD, TBBPA and related compounds in sewage sludge from Catalonia (Spain)[J]. Science of The Total Environment, 444 : 51–59. DOI:10.1016/j.scitotenv.2012.11.066 |
| [${referVo.labelOrder}] | Grause G, Furusawa M, Okuwaki A, et al. 2008. Pyrolysis of tetrabromobisphenol-A containing paper laminated printed circuit boards[J]. Chemosphere, 71(5) : 872–878. DOI:10.1016/j.chemosphere.2007.11.033 |
| [${referVo.labelOrder}] | Guo Y, Chen L, Yang X, et al. 2012. Visible light-driven degradation of tetrabromobisphenol A over heterostructured Ag/Bi5Nb3O15 materials[J]. RSC Advances, 2(11) : 4656. DOI:10.1039/c2ra01278b |
| [${referVo.labelOrder}] | Harrad S, Abdallah M A, Rose N L, et al. 2009. Current-Use Brominated Flame Retardants in Water, Sediment, and Fish from English Lakes[J]. Environmental Science & Technology, 43(24) : 9077–9083. |
| [${referVo.labelOrder}] | Huang D, Zhao H, Liu C, et al. 2014. Characteristics, sources, and transport of tetrabromobisphenol A and bisphenol A in soils from a typical e-waste recycling area in South China[J]. Environmental Science and Pollution Research, 21(9) : 5818–5826. DOI:10.1007/s11356-014-2535-2 |
| [${referVo.labelOrder}] | Öberg K, Warman K, Öberg T. 2002. Distribution and levels of brominated flame retardants in sewage sludge[J]. Chemosphere, 48(8) : 805–809. DOI:10.1016/S0045-6535(02)00113-3 |
| [${referVo.labelOrder}] | Janderka P, Brož P. 1995. Electrochemical degradation of polychlorinated biphenyls[J]. Collection of Czechoslovak chemical communications, 60(6) : 917–927. DOI:10.1135/cccc19950917 |
| [${referVo.labelOrder}] | Johnson Restrepo B, Adams D H, Kannan K. 2008. Tetrabromobisphenol A (TBBPA) and hexabromocyclododecanes (HBCDs) in tissues of humans, dolphins, and sharks from the United States[J]. Chemosphere, 70(11) : 1935–1944. DOI:10.1016/j.chemosphere.2007.10.002 |
| [${referVo.labelOrder}] | Kling P, Förlin L. 2009. Proteomic studies in zebrafish liver cells exposed to the brominated flame retardants HBCD and TBBPA[J]. Ecotoxicology and Environmental Safety, 72(7) : 1985–1993. DOI:10.1016/j.ecoenv.2009.04.018 |
| [${referVo.labelOrder}] | Kusmierek E, Chrzescijanska E, Szadkowska Nicze M, et al. 2011. Electrochemical discolouration and degradation of reactive dichlorotriazine dyes:reaction pathways[J]. Journal of Applied Electrochemistry, 41(1) : 51–62. DOI:10.1007/s10800-010-0206-7 |
| [${referVo.labelOrder}] | Li J, Bai J, Zhou B, et al. 2013. Solubility of 2, 2', 6, 6'-Tetrabromo-4, 4'-isopropylidene Phenol in Aqueous Pollutant Solutions[J]. Journal of Chemical & Engineering Data, 58(11) : 3150–3154. |
| [${referVo.labelOrder}] | Li X, Cui Y, Feng Y, et al. 2005. Reaction pathways and mechanisms of the electrochemical degradation of phenol on different electrodes[J]. Water Research, 39(10) : 1972–1981. DOI:10.1016/j.watres.2005.02.021 |
| [${referVo.labelOrder}] | Lin H, Niu J, Ding S, et al. 2012. Electrochemical degradation of perfluorooctanoic acid (PFOA) by Ti/SnO2-Sb, Ti/SnO2-Sb/PbO2 and Ti/SnO2-Sb/MnO2 anodes[J]. Water Research, 46(7) : 2281–2289. DOI:10.1016/j.watres.2012.01.053 |
| [${referVo.labelOrder}] | Lin K, Liu W, Gan J. 2009. Reaction of Tetrabromobisphenol A (TBBPA) with Manganese Dioxide:Kinetics, Products, and Pathways[J]. Environmental Science & Technology, 43(12) : 4480–4486. |
| [${referVo.labelOrder}] | Liu G, Dai L, Gao X, et al. 2006. Reductive degradation of tetrabromobisphenol A (TBBPA) in aqueous medium[J]. Green Chemistry, 8(9) : 781. DOI:10.1039/b605261d |
| [${referVo.labelOrder}] | Liu Y, Chen S, Quan X, et al. 2014. Nitrogen-doped nanodiamond rod array electrode with superior performance for electroreductive debromination of polybrominated diphenyl ethers[J]. Applied Catalysis B:Environmental, 154 : 206–212. |
| [${referVo.labelOrder}] | 刘立平, 于永辉. 2015. 四溴双酚A废水处理工艺研究[J]. 盐业与化学, 2015, 44(6) : 22–25. |
| [${referVo.labelOrder}] | Luo S, Yang S, Wang X, et al. 2010. Reductive degradation of tetrabromobisphenol A over iron-silver bimetallic nanoparticles under ultrasound radiation[J]. Chemosphere, 79(6) : 672–678. DOI:10.1016/j.chemosphere.2010.02.011 |
| [${referVo.labelOrder}] | Luo S, Yang S, Sun C, et al. 2011. Feasibility of a two-stage reduction/subsequent oxidation for treating Tetrabromobisphenol A in aqueous solutions[J]. Water Research, 45(4) : 1519–1528. DOI:10.1016/j.watres.2010.10.039 |
| [${referVo.labelOrder}] | Martínez Huitle C A, Ferro S. 2006. Electrochemical oxidation of organic pollutants for the wastewater treatment:direct and indirect processes[J]. Chemical Society Reviews, 35(12) : 1324–1340. DOI:10.1039/B517632H |
| [${referVo.labelOrder}] | Niu J, Bao Y, Li Y, et al. 2013. Electrochemical mineralization of pentachlorophenol (PCP) by Ti/SnO2-Sb electrodes[J]. Chemosphere, 92(11) : 1571–1577. DOI:10.1016/j.chemosphere.2013.04.035 |
| [${referVo.labelOrder}] | Niu J, Lin H, Xu J, et al. 2012. Electrochemical Mineralization of Perfluorocarboxylic Acids (PFCAs) by Ce-Doped Modified Porous Nanocrystalline PbO2[J]. Environmental Science & Technology, 46(18) : 10191–10198. |
| [${referVo.labelOrder}] | Oturan N, Wu J, Zhang H, et al. 2013. Electrocatalytic destruction of the antibiotic tetracycline in aqueous medium by electrochemical advanced oxidation processes:Effect of electrode materials[J]. Applied Catalysis B:Environmental, 140-141 : 92–97. DOI:10.1016/j.apcatb.2013.03.035 |
| [${referVo.labelOrder}] | Pipi A R F, Sirés I, De Andrade A R, et al. 2014. Application of electrochemical advanced oxidation processes to the mineralization of the herbicide diuron[J]. Chemosphere, 109 : 49–55. DOI:10.1016/j.chemosphere.2014.03.006 |
| [${referVo.labelOrder}] | Radjenovic J, Bagastyo A, Rozendal R A, et al. 2011. Electrochemical oxidation of trace organic contaminants in reverse osmosis concentrate using RuO2/IrO2-coated titanium anodes[J]. Water Research, 45(4) : 1579–1586. DOI:10.1016/j.watres.2010.11.035 |
| [${referVo.labelOrder}] | Ronen Z, Abeliovich A. 2000. Anaerobic-aerobic process for microbial degradation of Tetrabromobisphenol A[J]. Applied and Environmental Microbiology, 66(6) : 2372–2377. DOI:10.1128/AEM.66.6.2372-2377.2000 |
| [${referVo.labelOrder}] | Sellström U, Jansson B. 1995. Analysis of tetrabromobisphenol A in a product and environmental samples[J]. Chemosphere, 31(4) : 3085–3092. DOI:10.1016/0045-6535(95)00167-7 |
| [${referVo.labelOrder}] | Shi Z, Wu Y, Li J, et al. 2009. Dietary exposure assessment of chinese adults and nursing infants to tetrabromobisphenol A and hexabromocyclododecanes:Occurrence measurements in foods and human milk[J]. Environmental Science & Technology, 43(12) : 4314–4319. |
| [${referVo.labelOrder}] | Strack S, Detzel T, Wahl M, et al. 2007. Cytotoxicity of TBBPA and effects on proliferation, cell cycle and MAPK pathways in mammalian cells[J]. Chemosphere, 67(9) : S405–S411. DOI:10.1016/j.chemosphere.2006.05.136 |
| [${referVo.labelOrder}] | Vallejo M, San Román M F, Ortiz I. 2013. Quantitative Assessment of the Formation of Polychlorinated Derivatives, PCDD/Fs, in the Electrochemical Oxidation of 2-Chlorophenol As Function of the Electrolyte Type[J]. Environmental Science & Technology, 47(21) : 12400–12408. |
| [${referVo.labelOrder}] | 王俊霞, 刘莉莉, 郭杰, 等. 2014. 溴代阻燃剂在中国川藏地区的污染和分布特征[J]. 环境科学学报, 2014, 34(11) : 2823–2831. |
| [${referVo.labelOrder}] | Wu J, Zhang H, Oturan N, et al. 2012. Application of response surface methodology to the removal of the antibiotic tetracycline by electrochemical process using carbon-felt cathode and DSA (Ti/RuO2-IrO2) anode[J]. Chemosphere, 87(6) : 614–620. DOI:10.1016/j.chemosphere.2012.01.036 |
| [${referVo.labelOrder}] | Xu J, Meng W, Zhang Y, et al. 2011. Photocatalytic degradation of tetrabromobisphenol A by mesoporous BiOBr:Efficacy, products and pathway[J]. Applied Catalysis B:Environmental, 107(3/4) : 355–362. |
| [${referVo.labelOrder}] | 杨苏文, 王圣瑞, 闫振广, 等. 2012. 四溴双酚A在5种巢湖鱼类体内的组织分布与生物浓缩因子研究[J]. 环境科学, 2012, 33(6) : 1852–1857. |
| [${referVo.labelOrder}] | Yang S, Wang S, Liu H, et al. 2012. Tetrabromobisphenol A:tissue distribution in fish, and seasonal variation in water and sediment of Lake Chaohu, China[J]. Environmental Science and Pollution Research, 19(9) : 4090–4096. DOI:10.1007/s11356-012-1023-9 |
| [${referVo.labelOrder}] | Yıldız Y Ş, Koparal A S, Keskinler B. 2008. Effect of initial pH and supporting electrolyte on the treatment of water containing high concentration of humic substances by electrocoagulation[J]. Chemical Engineering Journal, 138(1/3) : 63–72. |
| [${referVo.labelOrder}] | 占春荣, 黄颖, 肖佳, 等. 2011. 四溴双酚A在玻碳电极上的电化学行为[J]. 福建师范大学学报, 2011, 27(5) : 63–66. |
| [${referVo.labelOrder}] | Zhang H, Liu F, Wu X, et al. 2009. Degradation of tetracycline in aqueous medium by electrochemical method[J]. Asia-Pacific Journal of Chemical Engineering, 4(5) : 568–573. DOI:10.1002/apj.286 |
| [${referVo.labelOrder}] | Zhang J, He S L, Hou M F, et al. 2011. Kinetics of the Ozonation of Tetrabromobisphenol-A in Wastewater[J]. Advanced Materials Research, 383 : 2945–2950. |
| [${referVo.labelOrder}] | Zhang J, He S, Ren H, et al. 2009. Removal of tetrabromobisphenol-A from wastewater by ozonation[J]. Procedia Earth and Planetary Science, 1(1) : 1263–1267. DOI:10.1016/j.proeps.2009.09.195 |
| [${referVo.labelOrder}] | Zhao H, Gao J, Zhao G, et al. 2013. Fabrication of novel SnO2-Sb/carbon aerogel electrode for ultrasonic electrochemical oxidation of perfluorooctanoate with high catalytic efficiency[J]. Applied Catalysis B:Environmental, 136-137 : 278–286. DOI:10.1016/j.apcatb.2013.02.013 |
| [${referVo.labelOrder}] | Zhong Y, Liang X, Zhong Y, et al. 2012. Heterogeneous UV/Fenton degradation of TBBPA catalyzed by titanomagnetite:Catalyst characterization, performance and degradation products[J]. Water Research, 46(15) : 4633–4644. DOI:10.1016/j.watres.2012.06.025 |
| [${referVo.labelOrder}] | Zhou X, Guo J, Zhang W, et al. 2014. Tetrabromobisphenol A contamination and emission in printed circuit board production and implications for human exposure[J]. Journal of Hazardous Materials, 273 : 27–35. DOI:10.1016/j.jhazmat.2014.03.003 |
| [${referVo.labelOrder}] | 褚衍洋, 甘明强, 钱翌, 等. 2009. 两种高级氧化法处理丙烯腈生产废水的对比研究[J]. 环境科学学报, 2009, 4 : 764–769. |
 2017, Vol. 37
2017, Vol. 37


