水体富营养化是国际上共同面临的环境难题, 其中氮是引起富营养化的主要因素之一, 其转化过程极其复杂且难以定量, 一直是农业、环境、生态领域的研究热点.环境介质中氮闭合循环终点是形成气态产物 N2O、N2(Babbin et al., 2015), 一方面对降低过量 N 负荷带来的负面效应具有重大意义;另一方面也是温室气体排放的重要来源.
前期研究通常认为水体生态系统N2O的释放主要通过空气与水体间不同的浓度梯度扩散进行(宴维金等, 2008).最近, Gao等(2013) 发现在富营养化水体中, 由于藻类初级生产的固碳作用和大量有机物质的输入, 底泥有机质厌氧分解以及水层的氮生物转化过程强烈, 以气泡形式直接释放的N2O量也非常可观.在生长水生维管束植物的条件下, 生成的N2O还可能通过植物通气组织排放到大气中.水生维管束中的挺水植物被公认为具有发达的通气组织, 用于气体交换和输导, 将氧气输送到底泥中的根系供植物呼吸作用, 同时其通气组织还能为CO2 、N2O、CH4等的传输提供通道(成水平等, 2003;傅志强等, 2012;胡泓等, 2014).
通常, 水生植物通气量的大小直接关系到植物生长的水深和根系在底泥中的扩展程度.水生维管束植物中的漂浮植物在水面漂浮生长, 根系悬浮在水体当中, 不扎根于底泥, 吸收养分速度快, 易于收获处置, 具有高效净化污水的能力(Kim and Kim, 2000; Jayaweera, 2004; Fox et al., 2008).凤眼莲是漂浮水生植物的代表, 其叶柄中部具有葫芦状气囊, 海绵组织发达, 构成了许多相互连接的大大小小的气室和气道, 因此具有显著的气体贮藏和气体交换能力(Qaisar et al., 2005).然而, 关于漂浮植物通气组织对水体中产生温室气体的传输作用方面的研究还很匮乏.
Gao等(2012) 前期研究发现凤眼莲根系能够调节富营养化水体中微生物对氮的转化过程.在密闭及半开放的植物生长系统中种植凤眼莲能够促进氮气态产物N2O、N2的生成(Gao et al., 2012;2014) ;然而, 利用研发的水体释放气体收集装置收集凤眼莲种植区域内的水体产生气体时, 却发现种植凤眼莲区域内采集到的N2O、N2量明显少于未种植凤眼莲的水体(张力等, 2015;张芳等, 2015).植物密闭生长系统与研发的气体收集装置区别在于:研发的气体收集装置仅收集水体释放出的气体, 未能包括通过植物通气组织排放的气体;而封闭及半开放的植物生长系统中采集的顶空气体样品来源于水体释放的气体和可能通过植物通气组织排放的气体.这些结果说明漂浮植物很可能也具有大量传输水体产生N2O的能力.
因此, 本研究以漂浮水生植物凤眼莲为对象, 利用稳定氮同位素示踪技术, 通过设计能够分隔根室和叶室的漂浮水生植物生长系统, 通过微宇宙实验定量追踪N-15标记的氮素在漂浮植物凤眼莲根系介导下的转化途径、N2O产生规律及N2O通过通气组织从根系向空气的传输过程.结果将有助于揭示漂浮植物对水体中微生物驱动的气态脱氮过程及脱氮气态产物输移途径的调节作用, 为水生植物-微生物为核心的生态修复工程技术的高效实施提供理论基础.
2 材料与方法 (Materials and methods) 2.1 供试植物凤眼莲(Eichhornia crassipes), 又名水葫芦, 雨久花科, 维管束多年生漂浮水生植物, 它的茎短缩, 基生叶排列成莲座状, 叶柄的中下部膨大, 形成气囊, 利于植株漂浮在水面.试验开始前, 在江苏省农业科学院2#塘凤眼莲种养区选取植株健壮且长势一致的凤眼莲进行移栽.
2.2 实验用N-15标记富营养化水体泵取江苏省农业科学院1#塘的生活污水, 用GF/C(Whatman)过滤水样, 去除污水中的杂质, 测定总氮(TN)、总磷(TP)浓度后, 向水中加入一定量的Na15NO3、KH2PO4或15NH4Cl、KH2PO4, 配置成TN浓度接近20 mg·L-1、TP浓度接近1.5 mg·L-1的富营养化水体.该浓度接近城镇污水处理厂一级B出水标准.加入15NO3--N的处理, 配水时所取原污水背景值TN为 5.0 mg·L-1;加入15NH4+-N的处理, 配水时所取原污水背景值TN为3.1 mg·L-1.配置好的富营养化水测定初始NH4+-N、NO3--N的浓度(15NO3--N处理:NH4+-N 2.3 mg·L-1、NO3--N 15.9 mg·L-1;15NH4+-N处理:NH4+-N 10.0 mg·L-1、NO3--N 7.7 mg·L-1)及相应的N-15 丰度.
2.3 实验设计 2.3.1 分隔根室和叶室的漂浮水生植物生长系统能够分隔根室和叶室的漂浮水生植物生长系统由有机玻璃制成, 如图 1所示.装置设计为圆柱形, 外径为18 cm, 内径为17 cm, 由隔板将装置分成上下两室, 即根室和叶室.水槽上层叶室高23 cm, 下层根室高15 cm.隔板上有凹槽(直径4 cm, 深2 cm), 凹槽中间有孔(直径3 cm).漂浮植物的根系部分通过凹槽放入根室, 然后用凡士林与液体石蜡的混合物填注凹槽的空隙部分和隔板的上平面, 确保根室与叶室之间没有气体、水和营养盐的交流.根室和隔板涂成黑色为植物根部遮光.根室和叶室分别安装了采集气体样品和水样的取样接口.采集水样的接口位于叶室的底部, 采集气样的接口位于各室的上部.采集气样的接口处外接气袋以平衡压力, 同时采集气样处接乳胶软管并在其中注入少量的水, 然后用止水夹夹住, 以防止外界气体的渗入.
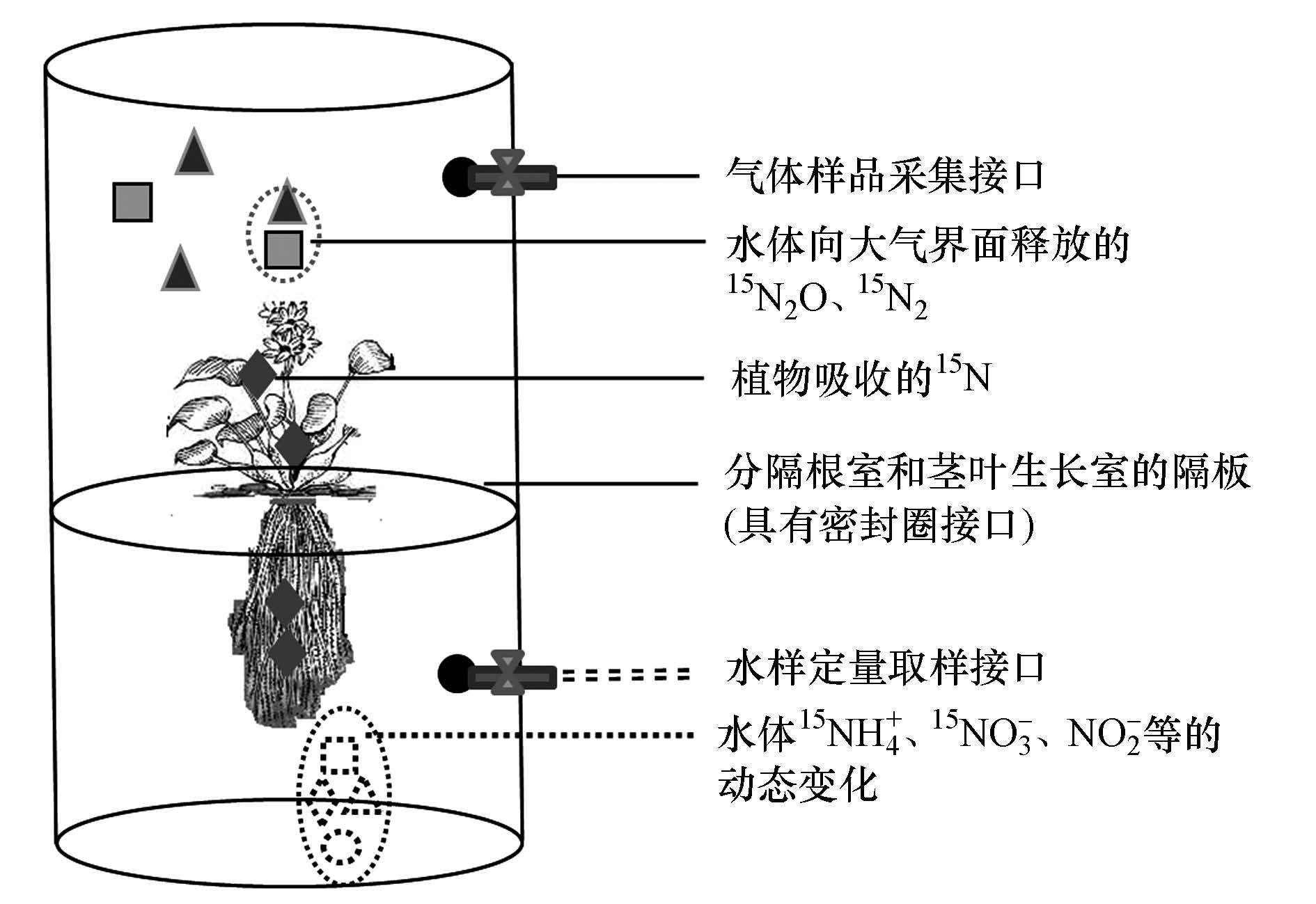 |
| 图 1 分隔根室和叶室的漂浮水生植物生长系统及氮归趋追踪示意图 Fig. 1 Schematic diagram of the plant growth system separating the root and aerial compartment, with indication of major N-15 fates |
实验设4个处理, 包括:N-15标记15NO3--N和N-15标记15NH4+-N, 及种植凤眼莲和未种凤眼莲的对照.每个处理重复3次.实验在光照培养箱中进行, 光照培养箱条件为:光照:10000 Lux/0 Lux(白天/晚上);温度:25 ℃/18 ℃(白天/晚上);时间:16 h /8 h(白天/晚上).
实验开始时, 首先在根室中装入2 L预先配置好的N-15标记富营养化水体.然后, 将准备好的凤眼莲根系清洗干净, 并用软毛刷清除叶片表面的附着藻类.每个重复选用1株长势良好、根系发达的凤眼莲, 称量初始鲜重, 将根部通过凹槽放入根室, 浸没入根室中N-15标记富营养化水体中.然后, 用凡士林与液体石蜡的混合物填注凹槽的空隙.最后, 闭合生长系统的顶盖, 放入光照培养箱中培养.同时, 随机选取3株预先准备好的凤眼莲, 测定植株水分含量、植株体内的氮含量及N-15丰度.
培养期间, 定期采集水体和气体样品, 采样间隔为第1、3、5、7、9 d.考虑到N-15标记的15NH4+-N首先要经过氨氧化过程才能为反硝化反应生成N2O过程提供底物, 经历的反应时间可能较以15NO3--N直接作为底物的反应时间长, 所以N-15标记15NH4+-N处理的采样时间维持9 d, 而15NO3--N处理采样时间维持7 d.实验期间, 所有重复均在叶室采集气体样品.采集的气体样品测定N2O(14N2O+15N2O)浓度及 N2O的N-15丰度;所有重复均在根室采集水样, 测定NH4+-N、NO3--N、NO-2-N浓度, 以及NH4+-15N和NO3--15N丰度.实验结束时, 收获凤眼莲, 将植物根与叶分开采集, 清洗干净, 烘至恒重, 研磨成粉末, 分别测定根和茎叶中氮含量和N-15丰度.
2.4 测试方法N2O 浓度由带有63Ni 电子捕获检测器的岛津GC-14B 气相色谱仪测定, 柱温65 ℃, 检测温度为300 ℃, 载气流速40 mL·min-1.气体N2O的N-15丰度送由南京师范大学地理科学院, 用具有预浓缩装置的MAT 253稳定性同位素比值质谱仪测定(赛默飞世尔科技有限公司).
水样TN浓度测定采用过硫酸钾氧化-紫外分光光度法;水样TP浓度测定采用钼酸铵分光光度法;水样经0.45 μm孔径的纤维素酯混合滤膜过滤, 用流动分析SKALAR SAN++型流动分析仪(荷兰)测定NH4+-N、NO3--N、NO-2-N浓度.水样中NH4+-15N、NO3--15N丰度, 送由南京师范大学地理科学院, 经适当前处理后分别转化为N2、N2O, 然后用具有预浓缩装置的MAT 253稳定同位素比值质谱仪(赛默飞世尔科技有限公司)测定N2、N2O气体中的N-15丰度间接获得(Gao et al., 2012).
植物样总氮含量采用浓H2SO4-H2O2消解法;植物根系及茎叶样品中的15N丰度由江苏省农业科学院中心实验室稳定同位素比值质谱仪测定(Isoprime 100, Elementar).
2.5 计算方法

|
(1) |
式中, Ex为N-15原子百分超, SA为样品中的N-15丰度;NA为N-15自然丰度(0.3663%).
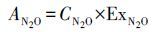
|
(2) |
式中, AN2O为15N2O中N-15的量, CN2O为N2O气体样品的浓度;ExN2O 为N2O气体样品中的N-15原子百分超.

|
(3) |
式中, AWNO3-为水体NO3--N的N-15量, CWNO3-为水体NO3--N浓度;ExWNO3-为水体NO3--N的N-15原子百分超.
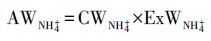
|
(4) |
式中, AWNH4+为水体NH4+-N的N-15量, CWNH4+为水体NH4+-N浓度;ExWNH4+为水体NO3--N的N-15原子百分超.
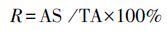
|
(5) |
式中, R为N-15回收率, AS为样品中N-15的量;TA为加入水体中N-15的总量.
3 结果(Results) 3.1 漂浮水生植物对富营养化水体生物脱氮气态产物15N2O输移过程的影响如图 2所示, 标记NO3--15N的富营养化水体且种植凤眼莲的处理, 从叶室顶空采集的气体样品N2O的N-15原子百分超在培养3 d时开始急剧升高, 但在培养末期7 d时又显著下降.7 d培养期内N2O的N-15原子百分超变幅为:0.013%±0.011%~13.030%±3.060%.未种植凤眼莲的对照处理, 从叶室顶空采集的气体样品N2O的N-15原子百分远远低于种植凤眼莲的处理, 7 d培养期内N2O的N-15原子百分超变幅为:0.003%~0.390%.
 |
| 图 2 植物生长系统叶室中顶空气体N2O-N的15N原子百分超与15N2O浓度 Fig. 2 15N atom % excess of N2O-N and 15N2O concentration in the aerial compartment of the plant growth system |
标记NH4+-15N的富营养化水体且种植凤眼莲的处理, 从叶室顶空采集的气体样品N2O的N-15原子百分超在9 d的培养期内逐渐升高, 变幅为:0.444%±0.080%~3.330%±0.400%, 远远高于未种植凤眼莲的对照处理.未种植凤眼莲的对照处理, 从叶室顶空采集的气体样品N2O的N-15原子百分超明显低于种植凤眼莲的处理, 且随着培养时间的延长无明显变化, 变幅为(0.004%~0.009%).总体上, 标记NO3--15N的水体叶室顶空中所收集的N2O的N-15原子百分超远高于标记NH4+-15N的富营养化水体.种植凤眼莲条件下, 无论标记NH4+-15N还是标记NO3--15N的富营养化水体, 叶室顶空中气体15N2O浓度与15N2O原子百分超呈现相似的变化规律.
3.2 种植及未种植漂浮水生植物的富营养化水体中氮素转化特征培养期间, 水体中NH4+-15N、NO3--15N原子百分超变化情况见图 3.在标记NO3--15N的水体中, 无论种植凤眼莲与否, 培养期间均检测到了NH4+-15N(其中15N原子百分超的变幅为1.97%±0.95%~5.58%±0.33%).种植凤眼莲的水体在培养前期NH4+-15N的原子百分超低于未种植凤眼莲的水体, 而在培养7 d时显著高于未种植凤眼莲对照水体.在标记NO3--15N的处理, 从培养3 d开始种植凤眼莲水体中NO3--15N的原子百分超略低于未种植物的对照.
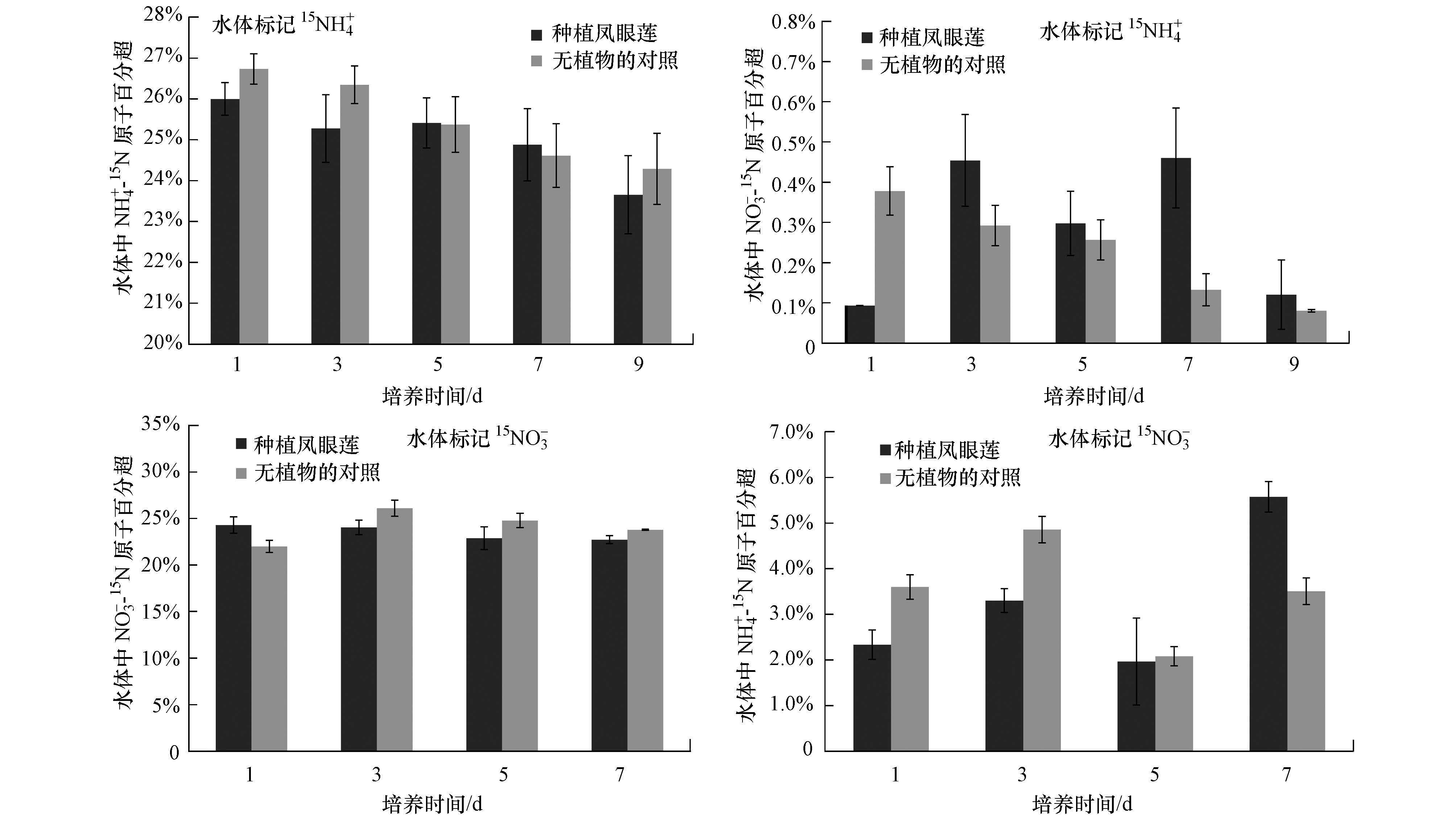 |
| 图 3 种植凤眼莲及未种植凤眼莲的水体(标记15NO3-或15NH4+)中NO3--15N和NH4+-15N原子百分超的变化规律 Fig. 3 Changes of NO3--15N and NH4+-15N atom % excess in water (labeled with 15NO3- or 15NH4+) with or without growth of E. crassipes |
在标记NH4+-15N的水体中, 无论种植凤眼莲与否, 培养期间均检测到了NO3--15N(其中NO3-15N原子百分超的变幅为0.08%±0.003%~0.46%±0.12%).未种植凤眼莲的对照水体, 培养期间NO3--15N的原子百分超逐渐减低, 而种植凤眼莲的水体从培养3 d开始NO3--15N原子百分超呈现高于未种植凤眼莲水体的趋势.在标记NH4+-15N的处理中, 种植与未种植凤眼莲的水体中NH4+-15N的原子百分超均随着培养时间增加逐渐降低, 种植凤眼莲水体中NH4+-15N的原子百分超在培养前期略低于未种植物的对照.
同时, 监测了水体中硝酸盐NO-2-N的变化情况.由图 4可以看出, 在标记NO3--15N的处理中, 种植凤眼莲水体中NO-2-N浓度呈现逐步上升的趋势((0.83±0.22) ~(4.19±0.41) mg·L-1), 而未种植物的对照水体中NO-2-N浓度呈现先升高后下降的趋势, 培养后期显著低于种植凤眼莲的水体;在标记NH4+-15N的处理, 种植与未种植凤眼莲的水体中NO-2-N浓度均随着培养时间的增加, 且无植物的对照水体NO-2-N浓度均高于种植凤眼莲的水体.
 |
| 图 4 种植凤眼莲及未种植凤眼莲的水体中亚硝态氮NO-2-N的浓度变化 Fig. 4 Changes of nitrite NO-2-N concentrations in water with or without E. crassipes |
凤眼莲对水体中的不同形态无机氮15NO3-或15NH4+表现出不同的吸收富集特征:对于水体标记了15NO3-的实验, 茎叶N-15原子百分超及N-15累积量均明显低于根系(图 5), 植物茎叶富集N-15的量变幅为:(0.011±0.001) ~(0.038±0.010) mg·g-1, 而根系富集N-15的量变幅为:(0.048±0.022~(0.102±0.024) mg·g-1;对于水体标记了15NH4+的实验中, 茎叶的N-15累积量与根系之间无显著差异, 植物茎叶富集N-15的量变幅为:(0.066±0.018) ~(0.712±0.087) mg·g-1, 根系富集N-15的量变幅为:(0.091±0.028) ~(0.686±0.173) mg·g-1.植株体对N的累积量相比较, 水体标记了15NO3-的处理低于水体标记了15NH4+的处理.
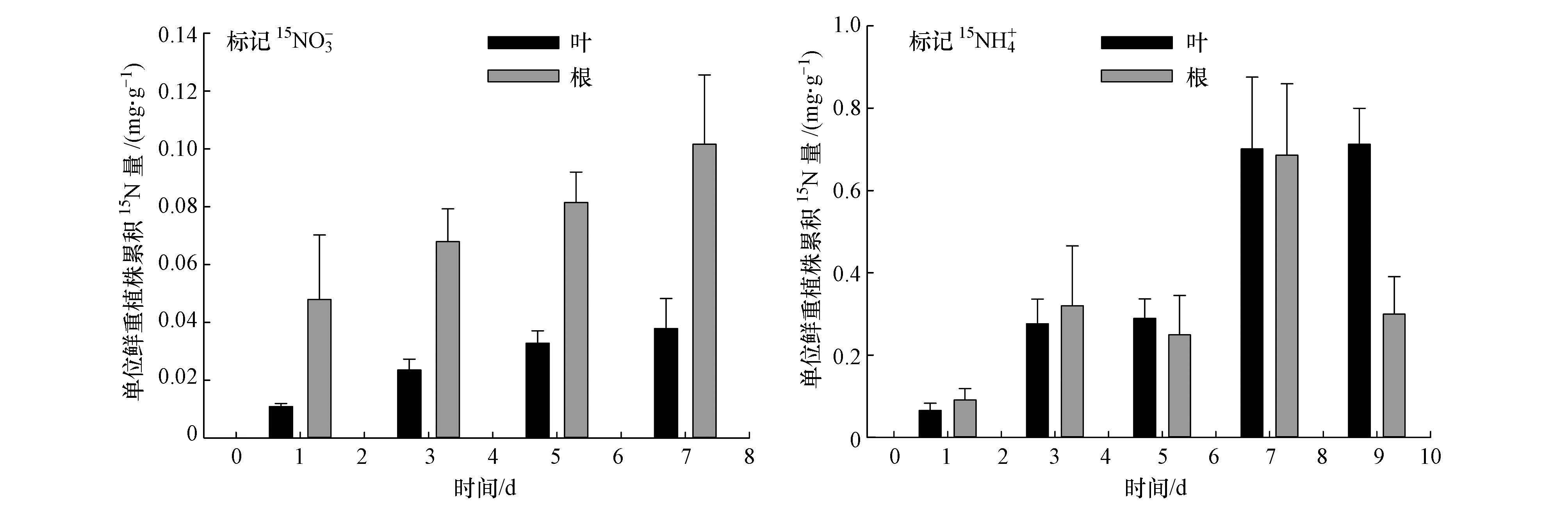 |
| 图 5 标记15NO3-或15NH4+水体中凤眼莲根系与茎叶吸收富集的15N量 Fig. 5 The 15N accumulation in roots and shoots of E. crassipes in water labeled with 15NO3- or 15NH4+ |
本研究通过设计分隔根室和叶室的植物生长系统, 阻隔两室之间气体与营养盐的交换.在此微宇宙实验系统中, 叶室中15N2O仅来源于根室中加入富营养化水体的NO3--15N或NH4+-15N, 其通过微生物驱动的硝化、反硝化或硝化-反硝化反应生成15N2O(蔡祖聪, 2003).因此, 通过定期监测叶室顶空中15N2O的变化规律, 即可证明凤眼莲植株是传输水体中过量氮通过微生物脱氮过程产生N2O的重要通道.本实验在培养期内, 种植凤眼莲处理的叶室中N2O的N-15丰度和15N2O浓度均远高于未种植凤眼莲的对照水体, 一方面说明凤眼莲根系能够调节富营养化水体中的氮微生物转化过程, 促进NO3--15N的反硝化脱氮生成15N2O过程, 以及NH4+-15N通过硝化或硝化-反硝化生成15N2O过程(Gao et al., 2012);另一方面也说明水体中产生的N2O有相当一部分通过凤眼莲植株传输到空气中.
许多水生和湿生维管束植物在根、茎叶、果皮内均形成通气组织(Yaklich et al., 1995; 程薪宇, 2014), 用于向下传输氧气, 供根系呼吸和根区的脱毒作用, 并向上输送CO2供植物光合作用或排放到大气中(Li et al., 1995).大量前期研究表明, 很多湿地植物、挺水植物通气组织还有助于排放温室气体, 包括CH4和N2O(Sorrell et al., 1994; 孔妤等, 2008).例如, 在水稻全生育期内, 90%的甲烷通过水稻植物体通气组织排放到大气中(Butterbach Bahl et al., 1997; Jia et al., 2003).对于漂浮植物凤眼莲来说, 其根系完全浸没于水中, 为了解决通气问题, 组成根系的不定根具有发达细胞间隙的表皮、呈海绵状的皮层, 共同构成了许多相互相连的大大小小的气室和通道, 因此具有显著的气体贮藏和气体交换能力(Moorhead et al., 2005);另外, 随着叶柄的发育, 皮层部分的薄壁细胞破裂加剧, 出现星散分布的大大小小的气腔, 组成了发达的海绵组织, 使得叶柄中下部膨大呈葫芦状, 除了增强植株的通气作用外, 还起着类似浮器的支持作用.因此, 漂浮植物凤眼莲传输水体中产生N2O等温室气体的能力十分可观.
在标记了NO3--15N的富营养化水体中种植凤眼莲, 其叶室中通过凤眼莲的通气组织从根室传输的15N2O在培养前期急剧升高, 而在第7 d浓度急剧下降.由于培养实验开始后, 植物生长系统内的各种气体在密闭系统中循环.因此, 推测在培养前期, 根室中富营养化水体中的NO3--15N在根系的调节作用下, 快速转化成15N2O, 根室与叶室之间形成浓度差, 15N2O通过分子扩散作用经过通气组织从根室向叶室传输, 形成动态平衡.前期研究表明当气体在不同的相连通空间存在一个浓度梯度, 并且植物茎叶通气组织孔隙足够大时, 气体便从高浓度空间流向低浓度空间, 即通过分子扩散输送气体(Laing, 1940).许多的研究结果表明了这样一种观点, 气体通过在植物内不同位置与空间的浓度差来实现扩散, 保证气体在植物与外界的交换和植物体内的传输(Dacey, 1981; 成水平等, 2003).而在培养后期, 根室中富营养化水体中的NO3--15N底物浓度大幅度降低, 根室中15N2O浓度降低, 叶室中聚积的15N2O可能通过分子扩散作用经过通气组织再向根室传输, 在根室的富营养化水体中15N2O当中可能在根际微生物的作用下进一步转化为15N2, 当两个相同空间达成新的15N2O扩散动态平衡时, 就可能导致叶室中的15N2O突然下降.
在标记NO3--15N的水体, 无论种植凤眼莲与否, 培养期间均检测到了NH4+-15N, 说明水体中发生了硝酸盐异化还原成为铵(DNRA)的过程.纯培养条件下DNRA现象早在1938年已经观察到(Tiedje, 1988).近年来的一些研究表明DNRA过程可以发生在土壤、沉积物、硝化污泥当中(Herbert, 1999; Galloway et al., 2008; Santoro, 2010; 卢伟伟等, 2012), 甚至分离出能在好氧条件下异化还原成铵的细菌菌株(刘佳, 2008).无论是好氧还是厌氧环境, 反硝化和DNRA是两个同时存在的竞争过程.从消减过量氮源的角度来看, 通过DNRA作用硝态氮转化为生物可利用的铵盐, 仍然滞留在水体当中, 不利于水体净化.而在本实验中, 水体中仅有极少部分的NO3--15N通过DNRA过程转化为NH4+-15N, 主要通过反硝化反应过程转化为气态氮产物N2O、N2.
种植凤眼莲能够促进水体反硝化、硝化-反硝化转化过程, 这可以从水体标记了不同形态无机氮后NH4+-15N与NO3--15N之间的转化规律及NO-2-N的变化情况看出来(图 2, 2.2节).并且培养期间标记NO3--15N的富营养化水体释放N2O的N-15原子百分超远高于标记NH4+-15N的富营养化水体, 这与前期的研究规律一致(Gao et al., 2012).一方面, 凤眼莲偏好吸收NH4+-N, 对15NH4+-N 的吸收速率高于15NO3--N, 导致植物与微生物竞争底物15NH4+-N, 并且需要经过化能自养微生物驱动的氨氧化过程, 从而NH4+-15N通过硝化、硝化-反硝化过程产生15N2O速率较低、强度较弱;而标记15NO3--N的富营养化水体通过微生物驱动的反硝化过程生产15N2O速率较快, 但植物吸收15NO3--N的速率相对较慢.已有的相关研究通过比较凤眼莲原位吸收污水中各种形态氮的能力发现, 每千克鲜重的凤眼莲每天平均吸收0.06 g NH4+-N和0.03 g NO3--N, 与本实验规律一致, 表明凤眼莲对NH4+-N具有偏好性(Rommens et al., 2003; Reddy, 1983).在本实验中, 从凤眼莲的根系与茎叶分别从15NH4+-N或15NO3--N 富营养化水体累积的N-15量具有明显差异, 也可以看出凤眼莲可以快速吸收水体中的15NH4+-N, 并向茎叶部转运;然而, 凤眼莲对15NO3--N的吸收在根部累积, 并未向茎叶转运, 根系脱落过程可为微生物提供丰富的碳源与氮源, 促进反硝化释放15N2O过程.
由本实验的结果可以看出, 在利用漂浮植物生态工程净化富营养化水体时, 植物吸收的氮素通过收获、处置和进一步利用才能真正将一部分过量的氮素从富营养化水体中去除;同时, 富营养化水体当中也有相当一部分氮, 通过根系介导的微生物氮转化过程以气态氮(N2O、N2)形式通过植株的通气组织释放到大气当中.在以NO3--N为主要氮源的富营养化水体中, 种植漂浮植物可能在某个时段促进温室气体N2O的排放, 但并不是整个时期持续促进N2O的释放.在合适的条件下, 也很可能将N2O进一步转化为N2(Jetten, 2008), 种植凤眼莲促进反硝化脱氮释放N2过程在前期研究中也得到了验证(Gao et al., 2014);在以NH4+-N为主要氮源的富营养化水体中, 漂浮植物吸收作用对去除富营养化水体中过量的氮素贡献较大, 但同时也会有部分NH4+-N在根系介导的硝化、硝化-反硝化反应下转化为N2O通过植株的通气组织持续、缓慢地释放到大气当中.
5 结论(Conclusions)1) 富营养化水体中能够发生硝酸盐异化还原成为铵(DNRA)过程, 但硝酸盐的微生物转化过程仍以反硝化过程为主;富营养化水体中的氨态氮主要通过微生物驱动的耦合硝化-反硝化反应生成N2O.
2) 在生长漂浮植物的富营养化水体中, 悬浮在水体当中的植物根系能够调节水体中微生物驱动的氮转化过程, 具有促进硝化、反硝化和硝化-反硝化反应的能力.
3) 水体中有相当一部分氮是以气态氮(N2O、N2)形式通过植株的通气组织释放到大气当中.在以NO3--N为主要氮源的富营养化水体中, 种植漂浮植物可能在某个时段促进温室气体N2O的排放, 在此阶段N2O释放速率较快, 但并不是整个生长时期持续促进N2O的释放.在以NH4+-N为主要氮源的富营养化水体中, 漂浮植物吸收作用对去除富营养化水体中过量的氮素贡献较大, 但同时也会有部分NH4+-N在根系介导的硝化、硝化-反硝化反应下转化为N2O通过植株的通气组织持续、缓慢地释放到大气当中.
4) 漂浮植物可能主要通过分子扩散作用将水体中产生的N2O向空气中传输, 而植物体内外或不同部位的热力学压强差所诱导的气体对流并不是主要传输机制.
| [${referVo.labelOrder}] | Babbin A R, Bianchi D, Jayakumar A, et al. 2015. Nitrogen cycling. Rapid nitrous oxide cycling in the suboxic ocean[J]. Science, 348(6239) : 1127–1129. DOI:10.1126/science.aaa8380 |
| [${referVo.labelOrder}] | Butterbach Bahl K, Papen H, Rennenberg H. 1997. Impact of gas transport through rice cultivars on methane emission from rice paddy fields[J]. Plant, Cell and Environment, 20(9) : 1175–1183. DOI:10.1046/j.1365-3040.1997.d01-142.x |
| [${referVo.labelOrder}] | 蔡祖聪. 2003. 尿素和KNO3对水稻土无机氮转化过程和产物的影响 Ⅱ. N2O生成过程[J]. 土壤学报, 2003, 40(3) : 414–419. |
| [${referVo.labelOrder}] | 成水平, 吴振斌, 夏宜. 2003. 水生植物的气体交换与输导代谢[J]. 水生生物学报, 2003, 27(4) : 413–417. |
| [${referVo.labelOrder}] | 程薪宇, 刘玫, 张欣欣, 等. 2014. 东北毛茛科植物营养器官结构及其系统学意义[J]. 草业学报, 2014, 23(3) : 62–74. |
| [${referVo.labelOrder}] | Dacey J W H. 1981. Pressurized ventilation in the yellow waterlily[J]. Ecology, 62(5) : 1137–1147. DOI:10.2307/1937277 |
| [${referVo.labelOrder}] | Fox L J, Struik P C, Appleton B L, et al. 2008. Nitrogen Phytoremediation by Water Hyacinth (Eichhornia crassipes (Mart.) Solms)[J]. Water Air and Soil Pollution, 194(1/4) : 199–207. |
| [${referVo.labelOrder}] | 傅志强, 朱华武, 陈灿, 等. 2012. 水稻根系生物特性与稻田温室气体排放相关性研究[J]. 农业环境科学学报, 2012, 30(12) : 2416–2421. |
| [${referVo.labelOrder}] | Galloway J N, Toensend A R, Erisman J W, et al. 2008. Transformation of the nitrogen cycle:recent trends,questions,and potential solutions[J]. Science, 320(5878) : 889–892. DOI:10.1126/science.1136674 |
| [${referVo.labelOrder}] | Gao Y, Liu X H, Yi N, et al. 2013. Estimation of N2 and N2O ebullition from eutrophic water using an improved bubble trap device[J]. Ecological Engineering, 57 : 403–412. DOI:10.1016/j.ecoleng.2013.04.020 |
| [${referVo.labelOrder}] | Gao Y, Yi N, Liu X H, et al. 2014. Effect of Eichhornia crassipes on production of N2 by denitrification in eutrophic water[J]. Ecological Engineering, 68 : 14–24. DOI:10.1016/j.ecoleng.2014.01.002 |
| [${referVo.labelOrder}] | Gao n, Yi N, Zhang Z Y, et al. 2012. Fate of 15NO3- and 15NH4+ in the treatment of eutrophic water using the floating macrophyte, Eichhonia crassipes[J]. Journal of Environmental Quality, 41 : 1653–1660. DOI:10.2134/jeq2011.0324 |
| [${referVo.labelOrder}] | Herbert R A. 1999. Nitrogen cycling in coastal marine ecosystems[J]. FEMS Microbiology Review, 23(5) : 563–590. DOI:10.1111/j.1574-6976.1999.tb00414.x |
| [${referVo.labelOrder}] | 胡泓, 王东启, 李杨杰, 等. 2014. 崇明东滩芦苇湿地温室气体排放通量及其影响因素[J]. 环境科学研究, 2014, 27(1) : 43–50. |
| [${referVo.labelOrder}] | Jayaweera M W. 2004. Removal of nitrogen and phosphorus from industrial wastewaters by phytoremediation using water hyacinth (Eichhornia crassipes (Mart[J]. ) Solms)[J]. Water Science and Technology, 50(6) : 217–225. |
| [${referVo.labelOrder}] | Jetten M S M. 2008. The microbial nitrogen cycle[J]. Environmental Microbiology, 10(11) : 2903–2909. DOI:10.1111/emi.2008.10.issue-11 |
| [${referVo.labelOrder}] | Jia Z, Cai Z. 2003. Effects of rice plants on methane emission from paddy fields[J]. The Journal of Applied Ecology, 14(11) : 2049–2053. |
| [${referVo.labelOrder}] | 孔妤, 王忠, 顾蕴洁, 等. 2008. 植物根内通气组织形成的研究进展[J]. 植物学通报, 2008, 25(2) : 248–253. |
| [${referVo.labelOrder}] | Kim Y, Kim W J. 2000. Roles of water hyacinths and their roots for reducing algal concentration in the effluent from waste stabilization ponds[J]. Water Research, 34(13) : 3285–3294. DOI:10.1016/S0043-1354(00)00068-3 |
| [${referVo.labelOrder}] | Laing H E. 1940. The composition of the internal atmosphere of Nuphur advenum and other water plants[J]. American Journal Botany, 27 : 862–868. |
| [${referVo.labelOrder}] | Li M, Jones M B. 1995. CO2 and O2 transport in the aerenchyma of Cyperus papyrus L[J]. Aquatic Botany, 52 : 93–106. DOI:10.1016/0304-3770(95)00484-H |
| [${referVo.labelOrder}] | 刘佳, 李大平, 刘强, 等. 2008. 一株好氧DNRA 细菌的分离鉴定及其诱导的生物矿化[J]. 四川大学学报(自然科学版), 2008, 45(3) : 651–655. |
| [${referVo.labelOrder}] | 卢伟伟, 施卫明. 2012. 养猪场处理尾水灌溉对太湖地区水稻土硝酸根异化还原为铵的影响[J]. 土壤学报, 2012, 49(6) : 1120–1127. |
| [${referVo.labelOrder}] | Qaisar M, Ping Z, Rehan S M, et al. 2005. Anatomical studies on water hyacinth (Eichhornia crassipes (Mart.) Solms) under the influence of textile wastewater[J]. Journal of Zhejiang University of Science B, 6(10) : 991–998. |
| [${referVo.labelOrder}] | Santoro A E. 2010. Microbial nitrogen cycling at the saltwater-freshwater interface[J]. Hydrogeology Journal, 18(1) : 187–202. DOI:10.1007/s10040-009-0526-z |
| [${referVo.labelOrder}] | Sorrell B K, Boon P I. 1994. Connective gas flow in Eleocharis sphacelata methane transport and release from wetlands[J]. Aquatic Botany, 47(3/4) : 197–221. |
| [${referVo.labelOrder}] | Tiedje J M. 1988. Ecology of denitrification and dissimilatory nitrate reduction to ammonium[M]. New York: John Wiley and Sons: 210–212. |
| [${referVo.labelOrder}] | Yaklich R W, Vigil E L, Wergin W P. 1995. Morphological and fine structural characteristics of aerenchyma cells in the soybean seed coat[J]. Seed science and technology, 23(2) : 321–330. |
| [${referVo.labelOrder}] | Rommens W, Maes J, Dekeza N, et al. 2003. The impact of water hyacinth (Eichhornia crassipes) in a eutrophic subtropical impoundment (Lake Chivero, Zimbabwe). I. Water quality[J]. Archiv für Hydrobiologie, 158(3) : 373–388. DOI:10.1127/0003-9136/2003/0158-0373 |
| [${referVo.labelOrder}] | Reddy K R, Tucker J C. 1983. Productivity and nutrient uptake of water hyacinth, Eichhornia crassipes I. Effect of nitrogen source[J]. Economic botany, 37(2) : 237–247. DOI:10.1007/BF02858790 |
| [${referVo.labelOrder}] | 宴维金, 王蓓, 李新艳, 等. 2008. 河流溶存N2O的环境化学过程及其在水-气界面交换过程的研究[J]. 农业环境科学学报, 2008, 27(1) : 0015–0022. |
| [${referVo.labelOrder}] | 张芳, 易能, 张振华, 等. 2015. 不同类型水生植物对富营养化水体氮转化及环境因素的影响[J]. 江苏农业学报, 2015, 31(5) : 1045–1052. |
| [${referVo.labelOrder}] | 张力, 张振华, 高岩, 等. 2014. 不同水生植物对富营养化水体释放气体的影响[J]. 生态与农村环境学报, 2014, 30(6) : 736–743. |
 2017, Vol. 37
2017, Vol. 37


