秸秆还田是当今世界范畴内改善农田生态环境的重要措施之一,它有利于改善土壤结构、提高土壤有机质含量和促进农业生态系统良性循环(Witt et al., 2000).秸秆还田过程中,秸秆在土壤中分解主要是一个微生物代谢过程.土壤微生物对秸秆腐解及其营养元素释放具有重要的作用(李学恒等,2006),土壤微生物可产生土壤纤维素酶,从而促进秸秆中有机物分解矿化,迅速释放出速效养分或转化为腐殖质(陈昕等,2013).研究表明,秸秆还田土壤中主要的细菌有β-、Υ-、δ-Proteobacteria、Cytophuga-Flavobacterium-Bacteroides、Chlorobia、Verrucomicrobia、Chloroflexi、Spirochaete、Firmicutes (Clostridia)和Actinobacteria等(Qiao et al., 2013;Tanahashi et al., 2005).
生物炭是作物秸秆等生物质材料在完全或部分缺氧的情况下经高温慢热解( < 700 ℃)产生的一类难溶的、稳定的、高度芳香化的、富含碳素的固态物质(Lehmann et al., 2006;韩光明等,2012).生物炭由于其疏松多孔的结构及巨大的表面积能够储存水分和养分,成为微生物栖息生活的微环境(Kolb et al., 2009);并且其表面含有部分易解碳和氮,可为微生物生长提供碳源和氮源(Gheorghe et al., 2009).因此,生物炭施入土壤中不仅增加了土壤肥力、改善了土壤质量,而且对土壤微生物群落结构会产生一定的影响(Lehmann et al., 2011),从而成为学者们研究的热点.Castaldi等(2011)的田间试验表明,添加木材生物炭(500 ℃热解)3个月和14个月后土壤微生物量无显著变化.O′Neill等(2009)研究发现,生物质炭可以丰富土壤细菌群落,提高土壤微生物多样性。Liang等(2010)和Wardle等(2008)在生物炭的长期应用效应中都发现土壤微生物量显著增加.何莉莉等(2014)研究发现,施加生物炭的土壤细菌丰富度最高,细菌种群较多,其次为秸秆还田处理土壤,而空白对照处理土壤细菌群落丰富度则最低.因此, 我们假设生物炭添加同样可以改变秸秆还田土壤微生物的组成结构和多样性, 从而影响秸秆还田在土壤中的分解速度.但是,目前相关研究主要集中在生物炭单独施入对土壤微生物结构与多样性的影响(Kolb et al., 2009;Lehmann et al., 2011;Warnock et al., 2007;韩光明等,2012;何莉莉等,2014),而有关生物炭与秸秆混施以探讨生物炭在秸秆还田过程中对土壤细菌群落结构和多样性影响的研究尚未见报道,其影响机制尚不清楚.实际上, 秸秆焚烧和秸秆还田是目前我国最常见的两种秸秆处理方式, 秸秆焚烧过程中会形成大量的生物炭沉积于土壤中.因此,本研究运用PCR-DGGE技术结合克隆和测序技术,以麦秆还田土壤作为研究对象,对比研究秸秆直接还田和秸秆与生物炭混施两种不同施肥处理土壤细菌群落结构与多样性, 旨在揭示生物炭添加对秸秆还田土壤细菌群落结构与多样性的影响,为生物炭对秸秆还田分解、土壤质量演变及其生产性能提高等提供科学依据.
2 材料与方法(Materials and methods) 2.1 试验材料 2.1.1 供试土壤及秸秆试验土壤为典型亚热带稻田土,采自安徽省芜湖市(31°16.804′N,118°35.164′E)稻麦轮作田表层(5 cm)土,供试土壤属于粘壤土,其中,粘土占22.4%,粉土占40.1%,砂土占37.5%.供试土壤含水率为80%,体积密度为1.30 g·cm-3,pH值为5.18,总碳(TC)含量为18 g·kg-1,总氮(TN)和总硫(TS)含量分别为5.1和1.7 g·kg-1,有效磷(AP)和有效硫(AS)含量分别为7.35和36.8 mg·kg-1.
试验秸秆(2013年5月收割后的新鲜小麦秸秆)采自同处,供试秸秆TC、TN和TS含量分别为395、4.5和0.65 g·kg-1,含水率为7%,自然风干后剪碎(5 mm)备用.
2.1.2 生物炭制备供试生物炭制备参照文献(Chen et al.,2008;安增莉,2011;陈再明等,2013)进行,即将晒干的秸秆,用自来水清洗去除灰尘后风干,粉碎过20目筛后填满于50 mL坩埚中,压实盖紧,放入马弗炉(SX-4-10型)中,于400 ℃缺氧条件下炭化4 h,取出冷却至室温,用1.0 mol·L-1的HCl溶液处理4 h,重复3次以去除灰分,过滤,用去离子水洗至中性,60 ℃过夜烘干后过100目筛,贮于干燥器中以备用.供试生物炭C、N含量分别为55.7%和1.1%,pH=6.18.
2.2 试验设计试验为室内模拟实验,采用自制不锈钢容器作为试验箱(35 cm×35 cm×35 cm),共设有两个处理,分别为秸秆还田土壤(SW,27 kg土壤与1.35 kg秸秆混合,秸秆还田量为50 g·kg-1)和添加生物炭秸秆还田土壤(SBW,27 kg土壤与1.35 kg秸秆及0.27 kg生物炭混合,秸秆还田量为50 g·kg-1,生物炭施加量为10 g·kg-1).试验温度控制在25 ℃,土壤持水量调节至最大持水量的80%,培养周期为66 d,分别于第0、4、7、12、17、24、34、44、56和66 d采用五点采样法采集土壤样品,用于细菌结构与多样性分析.
2.3 细菌群落结构与多样性分析 2.3.1 土壤细菌总DNA的提取采用土壤DNA提取试剂盒FastDNA © SPIN Kit for Soil (Q-Biogen,MP Biomedicals,CA,USA)按操作说明提取土壤细菌总DNA,提取完成的土壤样品细菌总DNA用含有EB染色剂的1%琼脂糖电泳检测提取结果(Zhao et al.,2012).
2.3.2 土壤细菌总DNA的巢氏PCR扩增以土壤细菌总DNA为模板,5′-AGAGTTTGATCMTGGCTCA G-3′(uF,Escherichia coli base 8-27)和5′-ACGGTT ACCTTGTTACGACTT-3′ (uR,Escherichia coli bases 1487-1507)为引物进行细菌16S rRNA基因PCR扩增,全长约为1500 bp. 30 μL PCR反应体系为:重蒸水(ddH2O)19 μL、10×PCR反应缓冲液(with MgCl2)5 μL、2.5 μmol·L-1 dNTP溶液2 μL、10 μmol·L-1的扩增引物uF和uR各1 μL、2.5 U·μL-1 TaqDNA聚合酶1 μL和DNA模板1 μL.PCR扩增程序为:94 ℃预变性5 min;94 ℃变性45 s,50 ℃退火45 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min. PCR扩增产物用含有EB染色剂的1%琼脂糖凝胶电泳检测.
以16S rRNA的扩增产物为模板,采用大多数细菌具有特异性的引物对5′-CCTACGGGAGG CAGCAG-3′(541F)和5′-CGCCCGCCGCGCGCGG CGGGCGGGGCGGGGGCACGGGGGGCCTACGGGAG GCAGCAG-3′(添加了GC-夹子的534R,Zhao et al., 2012),进行样品中细菌16S rRNA V3区的扩增(长度约为230 bp).添加GC-夹子的目的是防止DNA片段序列在变性梯度凝胶电泳的过程中过早解链,从而导致条带无法分离. 30 μL PCR反应体系为:重蒸水(ddH2O)18.5 μL、10×PCR反应缓冲液(with MgCl2)5 μL、2.5 μmol·L-1 dNTP溶液2 μL、10 μmol·L-1的扩增引物341F和GC-534R各1 μL、2.5 U·μL-1 TaqDNA聚合酶1 μL、2 μg·μL-1 BSA (牛血清蛋白)0.5 μL和16S rRNA扩增产物1 μL.PCR扩增程序为:94 ℃预变性5 min;94 ℃变性1 min,65 ℃退火1 min (每循环降低1 ℃),72 ℃延伸1 min,10个循环;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,20个循环;72 ℃延伸10 min.PCR扩增产物用含有EB染色剂的1%琼脂糖凝胶电泳检测.
2.3.3 PCR产物的DGGE分析采用Bio-Rad公司DcodeTM基因突变检测系统(BioRad Lab,LA,USA)对PCR反应产物进行电泳分离.电泳使用聚丙烯酰胺凝胶(浓度为8%, acrylamide与bisacrylamide,质量比为37.5:1),变性梯度30%~55%,100%的变性剂还含有7 mol·L-1尿素和40%(V/V)去离子甲酰胺.每个点样孔加12 μL 16S rRNA V3区扩增产物和10 μL Loading Buffer,电泳缓冲液为1×TAE (0.04 mol·L-1Tris-base,0.02 mol·L-1Glacial Acetic Acid,0.01 mol·L-1EDTA,溶液pH调至8),电压110 V,电泳温度60 ℃,电泳时间9 h.电泳结束后用硝酸银染色法染色(Yang et al.,2007;Zhao et al.,2012),然后拍照.
2.3.4 DGGE条带的切胶回收与克隆测序以灭菌刀片从凝胶上将待测序DGGE条带切下,冲洗后加入30 μL无菌水,4 ℃过夜,然后12000×g离心5 min,上清液作为模板进行PCR扩增.PCR反应体系与之前的V3区相同:引物对为341F和534R (无GC夹).扩增程序为:96 ℃预变性6 min;95 ℃变性1 min,55 ℃退火45 s,72 ℃延伸45 s,20个循环;最后72 ℃延伸10 min.PCR扩增产物用含有EB染色剂的1%琼脂糖凝胶电泳检测,扩增后的样品使用普通DNA产物纯化试剂盒TIANquic Midi Purification Kit (TIANGEN,Beijing,China)进行纯化,纯化后的产物采用克隆试剂盒pGM-T克隆(TIANGEN,Beijing,China),进行蓝白斑筛选后送至上海生工生物科技有限公司,使用ABI3730测序仪测定序列.
2.4 数据处理及分析实验使用Quantity-one (4.6.2版本,BIORAD Laboratories)软件对拍照所得的DGGE图谱进行分析,确定样品电泳条带的多少和亮度的峰值,设定Rolling Disk Size为10,Noise Level为4,Tolerance为4%.通过条带相对位置和相对强度计算Shannon-Wiener指数(H′),并结合丰富度(S)和均匀度(JSW)来评价试验周期不同处理土壤中细菌群落的基因多样性,H′的计算公式(Krebs,1972;马克平等,1994)和均匀度JSW的计算公式(Pielou,1969;马克平等,1994)分别如下:

|
(1) |

|
(2) |
式中,Pi代表第i条带灰度占该样品总灰度(Gauss Trace)的比值,Pi=ni/N,其中,ni为第i条带的灰度,N为该泳道样品总灰度;S为该泳道包含的条带数目.根据各样品在DGGE图谱中的表现,采用未加权算术平均组对法(Unweighted Pair Group with Mathematical Averages,UPGMA)对其相似性进行聚类分析.
3 结果与分析(Results and analysis) 3.1 DGGE图谱分析如图 1所示,SW和SBW处理不同采样时间土壤样品中的细菌16S rDNA序列均得到了比较好的分离,条带位置清晰,亮度明显;每张图谱的10个泳道均有较为丰富的条带且具有明显的变化性.SW和SBW处理在整个试验过程中分别共出现了49条和51条条带,其中,优势条带分别有17条(2、7、8、11、16、17、23、24、25、26、33、34、36、37、39、46和48号条带)和20条(1′、4′、6′、7′、8′、11′、14′、15′、17′、19′、22′、24′、28′、30′、31′、33′、36′、39′、40′和45′号条带).仅6号条带在SW处理整个试验周期均可观察到,而SBW处理则有2条条带(1′和36′号条带)在整个试验周期均可观察到.此外,SW处理中条带位置和灰度值变化主要出现在0~34 d,而44~66 d则相对稳定;SBW处理中条带位置和灰度值变化更加频繁,主要出现在0~7 d,且56~66 d条带种类仍有一个明显的变化,即在整个培养过程中土壤内细菌群落结构未达到相对稳定的状态,说明生物炭的添加促进了秸秆还田土壤细菌群落演替.
 |
| 图 1 加入生物炭-秸秆混合物(SBW)和仅加入秸秆(SW)后25 ℃下培养66 d期间土壤DGGE指纹图谱(泳道上方数字表示取样时间(0~66 d)) Fig. 1 DGGE patterns of bacterial communities during 66 d of incubation at 25 ℃ in SW and SBW treatments, respectively (The numbers above the lanes designate the sampling days (0~66)) |
SW和SBW处理土壤细菌群落Shannon-Wiener指数(H′)、丰富度(S)和均匀度(JSW)均随时间发生变化(表 1).SW处理土壤细菌群落H′指数随时间进行波动,0~7 d从3.039增加到3.251,第12 d时突然降低至最小值2.346,之后再先增后减,在第24 d达到最大值3.325;丰富度与H′指数变化趋势相似,从第0 d到第7 d略有增加,但第12 d突然下降到最低数值19,之后又有一个明显的先升再降趋势,在第24 d达到最大值28,第44~56 d比较稳定;均匀度除第12 d明显偏小外,整体改变程度不大.SBW处理细菌多样性指数随时间先增后减,在第7 d达到最大值3.357,最小值2.290出现在第66 d;丰富度也先增后减,在第7 d达到最大值38,第66 d最小(14);均匀度变化较大,最大值(0.947)出现在第44 d,最小值(0.846)出现在第66 d.此外,整个试验过程中两个处理土壤细菌群落Shannon-Wiener指数和丰富度没有显著差异(p> 0.05),说明生物炭添加对秸秆还田土壤细菌多样性影响不显著.
| 表 1 土壤微生物多样性指标 Table 1 Genetic diversity indices of bacterial communities calculated from the DGGE banding patterns |
采用NTSYS软件对2种处理土样细菌群落进行聚类分析,结果如图 2所示.同一处理不同采样时间土壤细菌群落结构相似度较低,在0.7相似水平上SW处理土壤细菌可聚为6大类群:第0 d、第4与7 d、第12与17 d、第24与34 d、第44与56 d、第66 d分别聚于同一分支;SBW处理土壤细菌可聚为5大类群:第0 d、第4与7 d、第12 d、17与24 d、第34 d、第44、56与66 d分别聚于同一分支.结果表明,两个处理均不存在跨时间聚类现象,取样时间越相近,土壤中细菌群落的相似性相对更高,这说明两种处理土壤细菌群落演替均具有一定时间规律.
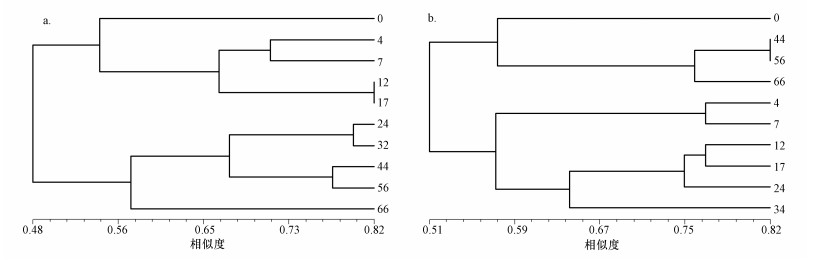 |
| 图 2 SW (a)和SBW (b)处理聚类分析 Fig. 2 Cluster analysis of bacterial DGGE patterns in SW (a) and SBW (b) treatments |
根据土壤样品的PCR-DGGE指纹图谱,从SW和SBW处理的DGGE凝胶分别切取了49个条带(1~49)和51个条带(1′~51′)进行回收、重新PCR扩增和测序,将所获得的序列在GenBank数据库(NCBI)中用BLAST进行检索和同源性比较.100条条带序列都对应于16S rRNA基因序列,与其相近序列的相似性大多在96%以上,且其相近序列多为来自土壤和底泥等环境样品中的未培养细菌.表 2列出了两个处理土壤样品DGGE图谱中主要优势条带(共37条,其中,SW和SBW处理分别为17和20条)测序BLAST结果.
| 表 2 DGGE优势条带序列比对结果 Table 2 Blast results of sequences of DGGE dominant bands |
使用RDP (Ribosomal Database Project-II)中Classifier软件获取所测100条条带序列的分类信息,2个处理不同采样时间土壤细菌门类及其所占比例结果如图 3所示,SW处理土壤所得细菌序列所属类群有8个,分别为拟杆菌门(Bacteroidetes)、TM7、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)、疣微菌门(Verrucomicrobia)、放线菌(Actinobacteria)和硝化螺菌门(Nitrospira),其中,Firmicutes、Proteobacteria、Bacteroidetes和Acidobacteria所占比例较高,分别为27.5%、21.3%、22.1%和13.1%,属于优势菌群.SW处理土壤细菌群落门类所占比例随时间发生变化.第0 d土样中Proteobacteria所占比例最大(28.6%),其次是Bacteroidetes和Acidobacteria,所占比例分别为23.8%和19.1%,Firmicutes仅占14.3%.随着试验进行,Firmicutes所占比例增加,在4~24 d和56~66 d均排首位;Proteobacteria和Acidobacteria所占比例先减后增,最大值(28.1%和19.1%)均在第0 d出现;Bacteroidetes所占比例则波动较大,最大值(31.6%)出现在第12 d,最小值(14.3%)出现在第24 d.SBW处理土壤所得细菌序列主要属于10个不同类群,包括拟杆菌门(Bacteroidetes)、TM7、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、疣微菌门(Verrucomicrobia)、WS3、螺旋体属(Spirochaetes)和芽单胞菌门(Gemmatimonadetes),其中,Firmicutes、Proteobacteria和Bacteroidetes所占比例较高,分别为34.0%、28.3%和17.8%,属于优势菌群.在整个试验周期内,SBW处理土壤细菌群落门类所占比例变化也较大;0~44 d各门类所占比例关系为Firmicutes>Proteobacteria>Bacteroidetes;55~56 d,Proteobacteria所占比例有所增加,关系变为Proteobacteria>Firmicutes>Bacteroidetes;Firmicutes、Proteobacteria、Bacteroidetes最大值出现时间分别为第0(52.6%)、56(40.9%)和34 d (23.1%).此外,Actinobacteria和Nitrospira只在SW处理土样中检测到,而Spirochaetes、Gemmatimonadetes、Chloroflexi和WS3只在SBW处理土样中出现;Firmicutes和Proteobacteria在SBW处理土壤中总体所占比例(34.0%和28.2%)明显高于在SW处理土壤中总体所占比例(27.5%和21.3%),而Bacteroidetes和Acidobacteria在SBW处理土壤中总体所占比例(17.8%和2.42%)则低于在SW处理土壤中总体所占比例(22.1%和13.1%),说明生物炭添加促进了秸秆还田土壤细菌群落组成结构变化.
 |
| 图 3 SW (a)和SBW (b)处理土壤细菌门类组成比例图 Fig. 3 Relative abundance of 16S rRNA gene phylotypes in SW (a) and SBW (b) treatments, respectively |
生物炭因具有疏松多孔的结构及巨大的表面积能够为细菌生存提供附着位点和较大空间,同时调控土壤微环境的理化性质,从而影响土壤细菌的生长、发育和代谢,改变土壤细菌多样性(Warnock et al., 2007;陈温服等,2011).研究表明,生物炭在土壤中稳定性高、分解速度慢,不管从短期效应(Hu et al., 2014)还是长期效应(Kim et al., 2007;O′Neill et al., 2009)来看,生物炭添加都有利于土壤细菌多样性.在本研究中,整个试验过程中两个处理土壤细菌群落Shannon-Wiener指数和丰富度没有显著差异(p>0.05),也就是说生物炭添加对秸秆还田土壤细菌多样性影响不明显.这与文献报道结果不一致,可能是因为添加生物炭的比例或者生物炭的制备原料的不同所导致的(Khan et al., 2011;Muhammad et al., 2014).事实上,Castaldi等(2011)在田间试验发现,添加木材生物炭3个月和14个月后土壤微生物量均无显著变化.值得注意的是,SBW处理DGGE图谱总条带和优势条带数量(分别为51和20条)总体多于SW处理(49和17条),且DGGE图谱条带位置和灰度值随时间变化较SW处理更频繁,土壤细菌丰富度也是整体上大于SW处理,说明生物炭的添加促进了秸秆还田土壤菌群演替.
对SW和SBW处理的DGGE凝胶分别切胶和测序,两个处理土壤中均检测到的细菌门类有Proteobacteria、Bacteroides、Verrucomicrobia、Firmicutes和Acidobacteria,具有3个共有的优势菌群,分别为Firmicutes、Proteobacteria和Bacteroidetes.本研究还发现,生物炭的添加会促进某些菌类的生长繁殖,同时也会抑制另外一些菌类的生长.例如,SBW处理土样中Firmicutes和Proteobacteria所占比例高于SW处理,而且SBW处理土样中还检测到SW处理未检测到的Chloroflexi和Gemmatimonadetes;但SBW处理土样中Acidobacteria和Bacteroides所占比例低于SW处理,而且未检测到Actinobacteria和Nitrospira.这与文献报道结果一致,如Fierer等(2007)研究表明,低碳土壤中优势菌落一般是贫营养的菌落如Acidobacteria,而含碳量较高的土壤中富营养菌落如Proteobacteria的相对丰度就会增加;Cleveland等(2007)发现,土壤不稳定碳的增加导致Acidobacteria相对减少,γ-Proteobacteria和Firmicutes相对增强;Chen等(2013)的研究结果表明,生物炭添加量分别为20 t·hm-2和40 t·hm-2的微酸稻田土壤中,Chloroflexi所占比例分别为21%和24%,明显高于对照土壤(17%),优势性增加.值得注意的是,在生物炭添加的土壤中Actinobacteria是代表性物种之一(Bååth et al., 2009;Khodadad et al., 2011;O′Neill et al., 2009),但在本研究SBW处理土壤中并未检测到Actinobacteria,这可能是由于土壤本身性质不同或者添加生物炭原料不同所致(Lehmann et al., 2011),也可能是因为生物炭添加使得某些菌类生长繁殖加快,消耗掉土壤中的碳或改变土壤的理化性质,从而不利于Actinobacteria的生长繁殖(Liu et al., 2014).
5 结论(Conclusions)1)生物炭添加增加了秸秆还田土壤细菌DGGE图谱条带位置和灰度值及均匀度的变化,说明生物炭的添加促进了秸秆还田土壤细菌群落演替;但两个处理土壤细菌群落Shannon-Wiener指数和丰富度没有显著差异(p>0.05),说明生物炭添加对秸秆还田土壤细菌多样性影响不明显.聚类分析结果表明,SBW处理土壤细菌群落聚为5类,SW处理土壤细菌群落可聚为6类,两个处理均不存在跨时间聚类现象,说明两种处理土壤细菌群落演替均具有一定的时间规律.
2)生物炭添加导致秸秆还田土壤中Actinobacteria、Nitrospira消失和Spirochaetes、Gemmatimonadetes、Chloroflexi、WS3出现,以及Firmicutes、Proteobacteria所占比例升高和Acidobacteria、Bacteroides所占比例降低,表明生物炭添加促进了秸秆还田土壤细菌群落组成结构变化.值得注意的是,本研究只选取了麦秆还田土壤作为研究对象,设置的处理只有添加和未添加生物炭两个处理且添加量较低(1%),培养周期也较短(66 d).考虑到生物炭对不同秸秆还田土壤微生物的影响可能存在差异性,不同生物炭添加量和培养时间也可能对土壤微生物的影响不一样,因此,很有必要进一步选取不同类型秸秆还田土壤作为研究对象,并设置不同生物炭添加量处理和实验周期,深入研究生物炭添加对秸秆还田土壤微生物的影响规律和机理.
| [${referVo.labelOrder}] | 安增莉.2011.生物炭的制备及其对Pb (II)的吸附性能研究[D].厦门:华侨大学 |
| [${referVo.labelOrder}] | Bååth E, Frostegård Å, Pennanen T, et al. 1995. Microbial community structure and pH response in relation to soil organic matter quality in wood-ash fertilized, clear-cut or burned coniferous forest soils[J]. Soil Biology and Biochemistry, 27(2) : 229–240. DOI:10.1016/0038-0717(94)00140-V |
| [${referVo.labelOrder}] | Castaldi S, Riondino M, Baronti S, et al. 2011. Impact of biochar application to a Mediterranean wheat crop on soil microbial activity and greenhouse gas fluxes[J]. Chemosphere, 85(9) : 1464–1471. DOI:10.1016/j.chemosphere.2011.08.031 |
| [${referVo.labelOrder}] | Chen B L, Zhou D D, Zhu L Z. 2008. Transitional adsorption and partition of nonpolar and polar aromatic contaminants by biochars of pine needles with different pyrolytic temperatures[J]. Environment Science & Technology, 42(14) : 5137–43. |
| [${referVo.labelOrder}] | Chen J H, Liu X Y, Zheng J W, et al. 2013. Biochar soil amendment increased bacterial but decreased fungal gene abundance with shifts in community structure in a slightly acid rice paddy from Southwest China[J]. Applied Soil Ecology, 71 : 33–44. DOI:10.1016/j.apsoil.2013.05.003 |
| [${referVo.labelOrder}] | Cleveland C C, Nemergut D R, Schmidt S K, et al. 2007. Increases in soil respiration following labile carbon additions linked to rapid shifts in soil microbial community composition[J]. Biogeochemistry, 82(3) : 229–240. DOI:10.1007/s10533-006-9065-z |
| [${referVo.labelOrder}] | 陈温服, 张伟明, 孟军, 等. 2011. 生物炭应用技术研究[J]. 中国工程科学, 2011, 13(2) : 83–89. |
| [${referVo.labelOrder}] | 陈昕, 姜成浩, 罗安成. 2013. 秸秆微生物降解机理研究[J]. 安徽农业科学, 2013, 41(23) : 9728–9731. |
| [${referVo.labelOrder}] | 陈再明, 陈宝梁, 周丹丹. 2013. 水稻秸秆生物碳的结构特征及其对有机污染物的吸附性能[J]. 环境科学学报, 2013, 33(1) : 9–19. |
| [${referVo.labelOrder}] | Fierer N, Bradford M A, Jackson R B. 2007. Toward an ecological classification of soil bacteria[J]. Ecology, 88(6) : 1354–1364. DOI:10.1890/05-1839 |
| [${referVo.labelOrder}] | Gheorghe C, Marculescu C, Badea A, et al.2009.Effect of pyrolysis conditions on biochar production from biomass[C].Proceedings of the 3rd WSEAS International Conference on Renewable Energy Sources.Bucharest, Romania:239-241 |
| [${referVo.labelOrder}] | 韩光明, 孟军, 曹婷, 等. 2012. 生物炭对菠菜根际微生物及土壤理化性质的影响[J]. 沈阳农业大学学报, 2012, 43(5) : 515–520. |
| [${referVo.labelOrder}] | 何莉莉, 杨慧敏, 钟哲科, 等. 2014. 生物炭对农田土壤细菌群落多样性影响的PCR-DGGE分析[J]. 生态学报, 2014, 34(15) : 4288–4294. |
| [${referVo.labelOrder}] | Hu L, Cao L X, Zhang R D. 2014. Bacterial and fungal taxon changes in soil microbial community composition induced by short-term biochar amendment in red oxidized loam soil[J]. World Journal of Microbiology & Biotechnology, 30(3) : 1085–1092. |
| [${referVo.labelOrder}] | Khan T F, Ahmed M M, Huq S M I. 2014. Effects of biochar on the abundance of three agriculturally important soil bacteria[J]. Journal of Agricultural Chemistry & Environment, 3(2) : 31–39. |
| [${referVo.labelOrder}] | Khodadad C L M, Zimmerman A R, Green S J, et al. 2011. Taxa-specific changes in soil microbial community composition induced by pyrogenic carbon amendments[J]. Soil Biology & Biochemistry, 43(2) : 385–392. |
| [${referVo.labelOrder}] | Kim J S, Sparovek G, Longo R M, et al. 2007. Bacterial diversity of terra preta and pristine forest soil from the Western Amazon[J]. Soil Biology & Biochemistry, 39(2) : 684–690. |
| [${referVo.labelOrder}] | Kolb S E, Fermanich K J, Dornbush M E. 2009. Effect of charcoal quantity on microbial biomass and activity in temperate soils[J]. Soil Biology & Biochemistry, 73(4) : 1173–1181. |
| [${referVo.labelOrder}] | Krebs C J. 1972. Ecology:the experimental analysis of distribution and abundance[J]. Research, 48(1) : 133–148. |
| [${referVo.labelOrder}] | Lehmann J, Gaunt J, Rondon M. 2006. Bio-char sequestration in terrestrial ecosystems-a review[J]. Mitigation and Adaptation Strategies for Global Change, 11(2) : 403–427. |
| [${referVo.labelOrder}] | Lehmann J, Rillig M C, Thies J, et al. 2011. Biochar effects on soil biota-a review[J]. Soil Biology & Biochemistry, 43(9) : 1812–1836. |
| [${referVo.labelOrder}] | Liang B Q, Lehmann J, Sohi S P, et al. 2010. Black carbon affects the cycling of non-black carbon in soil[J]. Organic Geochemistry, 41(2) : 206–213. DOI:10.1016/j.orggeochem.2009.09.007 |
| [${referVo.labelOrder}] | 李学恒, 王启发, 徐风琳. 2000. 稻草还田对土壤钾、磷、锌的吸附-解吸及其有效性的影响[J]. 华中农业大学学报, 2000, 19(36) : 227–232. |
| [${referVo.labelOrder}] | Liu W, Wang S T, Zhang J, et al. 2014. Biochar influences the microbial community structure during tomato stalk composting with chicken manure[J]. Bioresource Technology, 154(2) : 148–154. |
| [${referVo.labelOrder}] | 马克平, 刘玉明. 1994. 生物群落多样性的测度方法:Ⅰα多样性的测度方法(下)[J]. 生物多样性, 1994, 2(4) : 231–239. |
| [${referVo.labelOrder}] | Muhammad N, Dai Z, Xiao K, et al. 2014. Changes in microbial community structure due to biochars generated from different feedstocks and their relationships with soil chemical properties[J]. Geoderma, 226-227(1) : 270–278. |
| [${referVo.labelOrder}] | O'Neill B, Grossman J, Tsai M T, et al. 2009. Bacterial community composition in Brazilian anthrosols and adjacent soils characterized using culturing and molecular identification[J]. Microbial Ecology, 58(1) : 23–35. DOI:10.1007/s00248-009-9515-y |
| [${referVo.labelOrder}] | Pielou E.C1969.An Introduction to Mathematical Ecology[M].Translated by Lu Z Y.1978.Beijing:Science Press |
| [${referVo.labelOrder}] | Qiao J T, Qiu Y L, Yuan X Z, et al. 2013. Molecular characterization of bacterial and archaeal communities in a full-scale anaerobic reactor treating corn straw[J]. Bioresource Technology, 143(17) : 512–518. |
| [${referVo.labelOrder}] | Tanahashi T, Murase J, Matsuya K, et al. 2005. Bacterial communities responsible for the decomposition of rice straw compost in a japanese rice paddy field estimated by DGGE analysis of amplified 16S rDNA and 16S rRNA fragments[J]. Soil Science & Plant Nutrition, 51(3) : 351–360. |
| [${referVo.labelOrder}] | Wardle D A, Marie-Charlotte N, Olle Z. 2008. Fire-derived charcoal causes loss of forest humus[J]. Science, 320(5876) : 629. DOI:10.1126/science.1154960 |
| [${referVo.labelOrder}] | Warnock D D, Lehmann J, Kuyper T W, et al. 2007. Mycorrhizal responses to biochar in soil-concepts and mechanisms[J]. Plant & Soil, 300(12) : 9–20. |
| [${referVo.labelOrder}] | Witt C, Cassman K G, Olk D C, et al. 2000. Crop rotation and residue management effects on carbon sequestration, nitrogen cycling and productivity of irrigated rice systems[J]. Plant & Soil, 225(1/2) : 263–278. |
| [${referVo.labelOrder}] | Yang R Y, Tang J J, Xu C, et al. 2007. Effects of coexisting plant species on soil microbes and soil enzymes in metal lead contaminated soils[J]. Applied Soil Ecology, 37(3) : 240–246. DOI:10.1016/j.apsoil.2007.07.004 |
| [${referVo.labelOrder}] | Zhao J, Wu X, Nie C, et al. 2012. Analysis of unculturable bacterial communities in tea orchard soils based on nested PCR-DGGE[J]. World Journal of Microbiol & Biotechnology, 28(5) : 1967–1979. |
 2017, Vol. 37
2017, Vol. 37


