随着核电和军工的快速发展,世界各国对天然铀的需求也开始大幅度上升,形成了新一轮的铀矿开发热,然而随之带来的问题是铀矿开采和铀水冶过程中产生的放射性废水的数量和种类也越来越多(Carvalho et al.,2014;Alvarado et al.,2014).我国铀矿冶放射性废水具有浓度低、数量大、污染面积广等特点,这些废水含有铀、钍和镭等半衰期较长的天然放射性元素,若未经处理直接排放,不仅会污染地表水,而且还会慢慢渗入地下,造成地下水的污染,进而扩展到整个生物圈,最终对人和动物造成化学毒性和辐射毒性两个方面的危害(Mccombie,1997;Voitsekhovitch et al.,2006;Carvalho,2014).因此,铀污染水体的修复问题亟待研究解决.
目前,处理铀污染水体的主要方法有化学沉淀法、蒸发浓缩法、吸附法、离子交换法、离子浮选法、膜分离法等(Wang et al.,2014;Barkat et al.,2015;Banerjee et al.,2014;Zhu et al.,2015).这些传统的物理化学处理方法在实际应用中存在许多不足,主要表现为工序复杂,产生的泥浆量较大,还需对二次污染物再次处理,而且在处理低浓度、大面积铀污染水体时需要较高的费用.生物修复作为一项新兴的高效修复技术,特别是植物修复和微生物修复逐渐成为近年来国内外研究的热点(Pratas et al.,2014;王清良等,2013).生物修复具有修复成本低、环境友好等优点,但单独采用植物修复时,存在生产周期长、生物量小、受pH值、SO42-等化学因素影响较大,且超富集往往具有专一性等缺点;单独采用微生物修复时,虽然可以通过改变重金属的化合价态来降低毒性并富集重金属,但需要不断添加碳源和氮源,且微生物死后被吸附的核素又会重新释放到水中,造成修复效率降低.这就要求我们利用植物和微生物的共生或共存关系构建植物-微生物共生富集净化体系(Khan et al.,2013),充分发挥植物和微生物各自修复技术的优势,弥补单一植物或微生物修复的不足,实现含铀废水的高效修复.
满江红是一种生长在水田或池塘中的小型浮水植物,常与鱼腥藻共生,鱼腥藻能固定大气中的氮气为满江红提供氮源,是一种天然的植物(满江红)-微生物(鱼腥藻)共生体系.研究表明,满江红和鱼腥藻形成的共生体系对水中的重金属离子有较好的富集能力(Costa et al.,2009;Pandey,2012);特别是胡南等(2012)报道了满江红和鱼腥藻的共生体系对水体中的铀具有较好的去除作用.但鱼腥藻在满江红-鱼腥藻共生体系去除水中铀时的作用尚未开展相关研究.因此,本文拟分离满江红和鱼腥藻,培育出无藻满江红和鱼腥藻,研究无藻满江红、有藻满江红和鱼腥藻对水中铀的去除效果,并通过红外光谱技术分析无藻满江红、有藻满江红和鱼腥藻富集铀前后化学基团的变化,以揭示鱼腥藻在满江红-鱼腥藻共生体系去除水中铀时的作用,为建立新的植物-微生物共生富集净化体系提供理论依据.
2 材料与方法(Materials and methods) 2.1 无藻满江红的获取在湖南省衡阳市郊外采集回野生满江红(Azolla anabaena),即天然的满江红-鱼腥藻共生体系,先用自来水冲洗3~5 min,放入改良的Hoagland培养液中进行预培养,2周后取出预培养的满江红-鱼腥藻共生体系,切取其分枝顶端约5 mm左右的片段,并确保每一片段带有2~3个茎尖和15片左右的幼叶;然后将这些片段放置在小纱布袋中用自来水冲洗30~40 min,之后用0.1%的氯化汞溶液浸泡3~4 min进行消毒,取出后迅速用无菌水冲洗十余次,彻底洗去残留的氯化汞;将消毒后的萍体片段用灭菌的干燥滤纸吸去水分,然后在无菌操作台中,体式显微镜下用解剖针取其茎尖(约0.5 mm,保留几个叶原基和幼叶),接种于装有改良的Hoagland培养基的锥形瓶中,置于25 ℃光照下培养(白克智等,1979),经过25 d左右可以长成一丛丛萍体.
将分离后长成的萍体分别放在无氮源和有氮源的培养基中培养,在有氮源的培养基中萍体长势良好,而在无氮源的培养基中不能存活的萍体便是分离成功的,即不含鱼腥藻的无藻满江红(Azolla without Anabaena),下文将满江红和鱼腥藻的共生体系称为有藻满江红(Azollawith Anabaena).
应用显微操作技术从无菌有藻满江红植株叶片的叶腔中取出鱼腥藻(Anabaena),将它接种于无氮培养基,得以成活,即成功获得了自生的无菌满江红鱼腥藻(白克智等,1979),下文将从满江红中分离的无菌满江红鱼腥藻称为鱼腥藻.
改进的Hoagland’s 营养液配方如下:①大量元素:Ca(NO3)2·4H2O 945 mg·L-1,KNO3 506 mg·L-1,NH4NO3 80 mg·L-1,MgSO4·7H2O 493 mg·L-1;②铁盐溶液:2.5 mL·L-1(2.78 g FeSO4·7H2O,EDTA 3.73 g,H2O 500 mL,pH=5.5);③微量元素液:5 mL(KI 0.83 mg·L-1,H3BO3 6.2 mg·L-1,MnSO4 22.3 mg·L-1,ZnSO4 8.6 mg·L-1,Na2MoO4 0.25 mg·L-1,CuSO4 0.025 mg·L-1,CoCl2 0.025 mg·L-1,pH=6.0).
2.2 水培试验方法水培实验在3 L的烧杯中进行,分为A、B和C 3组:根据我国南方某铀尾矿库及周边地区地表水中铀的浓度,初始铀浓度设定为2.5、5.0 mg·L-1的实验组和0 mg·L-1的对照组;同时,A、B和C每个浓度设定3个平行组,溶液体积为1 L.A组中投放7 g无藻满江红,B组中投放7 g有藻满江红,C组中投放0.2 g鱼腥藻(从7 g有藻满江红可分离出0.2 g鱼腥藻).整个培养过程全部在人工气候箱中进行,白天温度设定为25 ℃,夜晚设定为22 ℃,光暗周期为14 h/10 h,空气湿度保持在80%左右.每3 d测定一次水中铀的浓度并计算水中铀的去除率,待富集达到平衡后,取出所有的萍体,用滤纸吸干水分称其鲜重,计算植株的平均生长抑制率及对铀的生物富集量.
2.3 样品处理方法水样用离心机,以3000 r·min-1的转速沉淀水中的悬浮物,取其上清液直接进行铀浓度的测量.
植物样品中铀的检测步骤参照文献(胡南等,2012):①先用自来水冲洗附着在植株体上的水培液,然后用去离子水洗净,在室温下风干;②风干后的样品放入80 ℃的烘烤箱中烘烤72 h后,转移至马弗炉中,在600 ℃下灰化8 h;③准确称取0.2 g灰分,放入聚四氟乙烯管中进行消解,最后将消解溶液定容至50 mL,待测.植物体内铀含量(mg·kg-1)以灰分计算.
红外分析样品制备参照文献(He et al.,2015):采用溴化钾压片法,首先将富集后的无藻满江红、有藻满江红和鱼腥藻烘干,磨成粉末状样品,然后每次取试样2~3 mg与0.2~0.3 g干燥的KBr粉末在玛瑙研钵中混匀,充分研细至颗粒直径小于2 μm,用不锈钢铲取70~90 mg放入压片模具内,在压片机上用5×107~10×107 Pa压力压成透明薄片,即可用于测定.
2.4 样品检测方法水样和植物样品中铀含量的检测按照标准方法(EJ 267.4-1984)进行,采用三正辛基氧膦萃取分离、2-(5-溴-2-吡啶偶氮)-5-乙氨基苯酚分光光度法测定样品的铀含量,检出限为0.02mg·L-1.
2.5 生物富集量与富集系数生物富集量(BW)是单位质量的植株在一定的铀浓度溶液中,所富集铀的质量,它反映的是单位质量的植物所能富集的最大铀的质量.生物富集系数(BCF)反映的是植物对一定铀浓度的溶液中铀的富集能力,其计算公式如下:

|
(1) |
式中,BCF为生物富集系数,BW为生物富集量(mg·kg-1),C为水中铀的浓度(mg·L-1).
2.6 生长抑制率生长抑制率(G)是指与对照组相比,铀胁迫组中植株生长所受到的抑制程度,其计算公式如下:
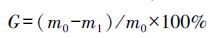
|
(2) |
式中,m0为对照组植株的质量(g),m1为铀胁迫组植株的质量(g).
2.7 统计学分析采用SPSS 17.0软件对数据进行方差分析,p<0.05表示差异显著,试验结果以平均值±标准误差表示.
3 结果与讨论(Results and discussion) 3.1 水中铀的去除效率在无藻满江红、有藻满江红和鱼腥藻作用下,水中铀浓度的变化如图 1所示.由图 1可知,初始浓度为2.5和5.0 mg·L-1的铀溶液分别经过27和36 d的生物富集后,水中铀浓度达到平衡,其中,在无藻满江红的作用下,铀溶液最终分别降至为0.38和0.84 mg·L-1,铀的去除率分别为84.8%和83.2%;而在有藻满江红的作用下,铀溶液最终分别降至为0.044和0.046 mg·L-1,铀的去除率分别为98.2%和99.1%;在鱼腥藻作用下,铀溶液最终分别降至为1.685和3.988 mg·L-1,铀的去除率分别为32.6%和20.24%.在整个富集试验过程中,有藻满江红对水中铀的富集及铀的去除率始终大于无藻满江红和鱼腥藻,而且在有藻满江红的富集作用下,水中铀浓度降低到了GB 23727-2009规定的0.05 mg·L-1排放标准以下,单独采用无藻满江红和鱼腥藻无法将水中的铀浓度降至排放标准以下.由此可知,鱼腥藻和满江红形成的共生体系对水中铀的去除效果高于单一的鱼腥藻和单一的满江红对水中铀的去除效果,满江红和鱼腥藻在水中铀的去除过程中发挥了协同的作用.Entry等(1999)在利用木薯粉草修复Sr和Cs 污染土壤时,发现在土壤中投加灌木真菌可以提高植物的生物量和植物体内Sr、Cs 的含量.Chen等(2006)通过盆栽试验研究了不同种类的菌根真菌对砷超积累植物蜈蚣草吸收复合污染土壤中铀和砷的影响,发现接种菌根真菌处理显著提高了蜈蚣草根系铀含量.由此可见,无论是在水介质中,还是在土介质中,构建植物-微生物共生体系对污染环境进行修复,其效率要高于采用单一的微生物或植物进行修复.
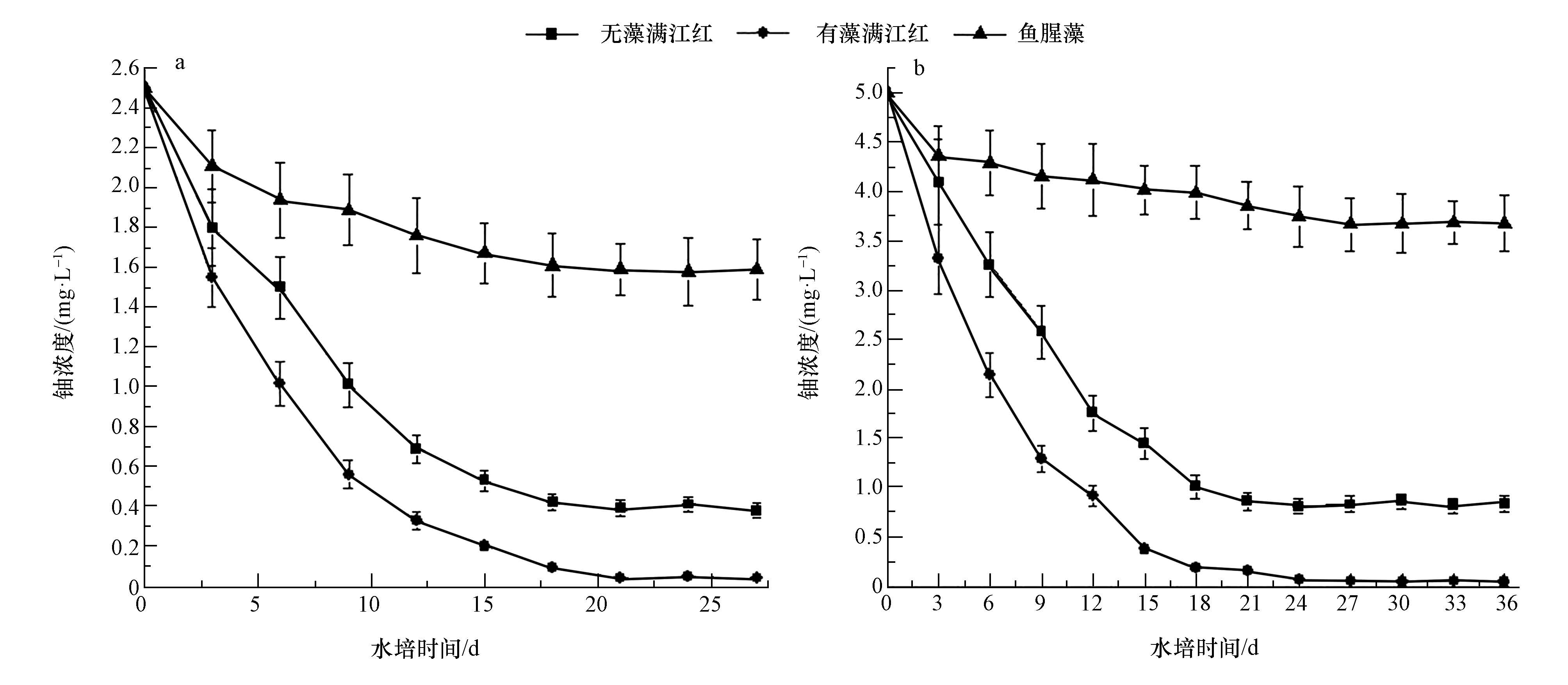 |
| 图 1 在无藻满江红、有藻满江红和鱼腥藻作用下水中铀浓度的变化(a.2.5 mg·L-1,b.5.0 mg·L-1) Fig. 1 Variation of uranium concentration in water by Azolla without Anabaena,Azolla with Anabaena and Anabaena |
在初始浓度为2.5和5.0 mg·L-1的铀溶液中,无藻满江红、有藻满江红和鱼腥藻对铀的生物富集量和生物富集系数如表 1所示.由表 1可知,无藻满江红、有藻满江红和鱼腥藻对铀的生物富集量随着水体中铀浓度的增大而增大,富集系数随着水体中铀浓度的增大而减小,且在同样的初始铀浓度下,生物富集量和生物富集系数均为鱼腥藻>有藻满江红>无藻满江红.当水体中的铀浓度分别为2.5和5.0 mg·L-1时,鱼腥藻对铀的生物富集量和富集系数都是最大的,生物富集量分别是2686和4250 mg·kg-1,生物富集系数分别是1074和850.由此可知,鱼腥藻提高了有藻满江红对铀的生物富集量和生物富集系数,从而促进了有藻满江红对铀的富集,提高了有藻满江红对水中铀的去除效率.徐俊等(2009)研究了小白菜和菠菜对铀的富集量,发现在100 mg·kg-1的铀土壤溶液中,菠菜根部的铀含量达到了433 mg·kg-1(以干重计),生物富集系数为2.32.Srivastava等(2010)研究了水生杂草黑藻在铀浓度分别为20和100 mg·L-1的溶液中的生长状况及对溶液中铀的富集情况,发现当溶液中铀浓度为100 mg·L-1时,该藻类对铀的富集量最大,为78 mg·kg-1(以干重计),富集系数为0.78.Soudek等(2011)研究了20种植物对铀浓度为0.1~1 mmol·L-1的培养液中铀的富集情况,发现玉米对铀的富集能力最高,其富集量达到160 mg·kg-1(以干重计).本试验报道的满江红和鱼腥藻组成的共生体系—有藻满江红对铀的富集量和富集系数均远高于上述报道,由此可见,与单一的植物相比,无藻满江红和鱼腥藻形成的共生体系能更加高效地富集水体中的铀.
| 表 1 无藻满江红、有藻满江红和鱼腥藻对水中铀的富集量及富集系数 Table 1 Bioaccumulating factor of Azolla without Anabaena,Azolla with Anabaena and Anabaena for uranium in water |
在初始浓度为2.5和5.0 mg·L-1的铀胁迫下,无藻满江红、有藻满江红和鱼腥藻的生长抑制率如图 2所示.从图 2中可以看出,在铀的胁迫下,无藻满江红、有藻满江红和鱼腥藻的生长都受到了不同程度的抑制,且铀的浓度越高植株生长受到的抑制越明显,但在相同浓度的铀胁迫下,生长抑制率表现为无藻满江红>有藻满江红>鱼腥藻.由此可知,鱼腥藻提高了有藻满江红对铀的耐受性,从而增加了有藻满江红的生物量,促进了有藻满江红对铀的富集,提高了有藻满江红对水中铀的去除效率.分析其原因可能是因为有藻满江红体内的微生物鱼腥藻,在富集铀的过程中产生了特异性的酶或植物激素,增强了共生体系—有藻满江红抗胁迫能力( Glicke et al,2003;韦革宏等,2010;Pan et al.,2015);另一方面的原因是鱼腥藻本身具有固氮能力,能为满江红提供氮源,促进无藻满江红的生长.
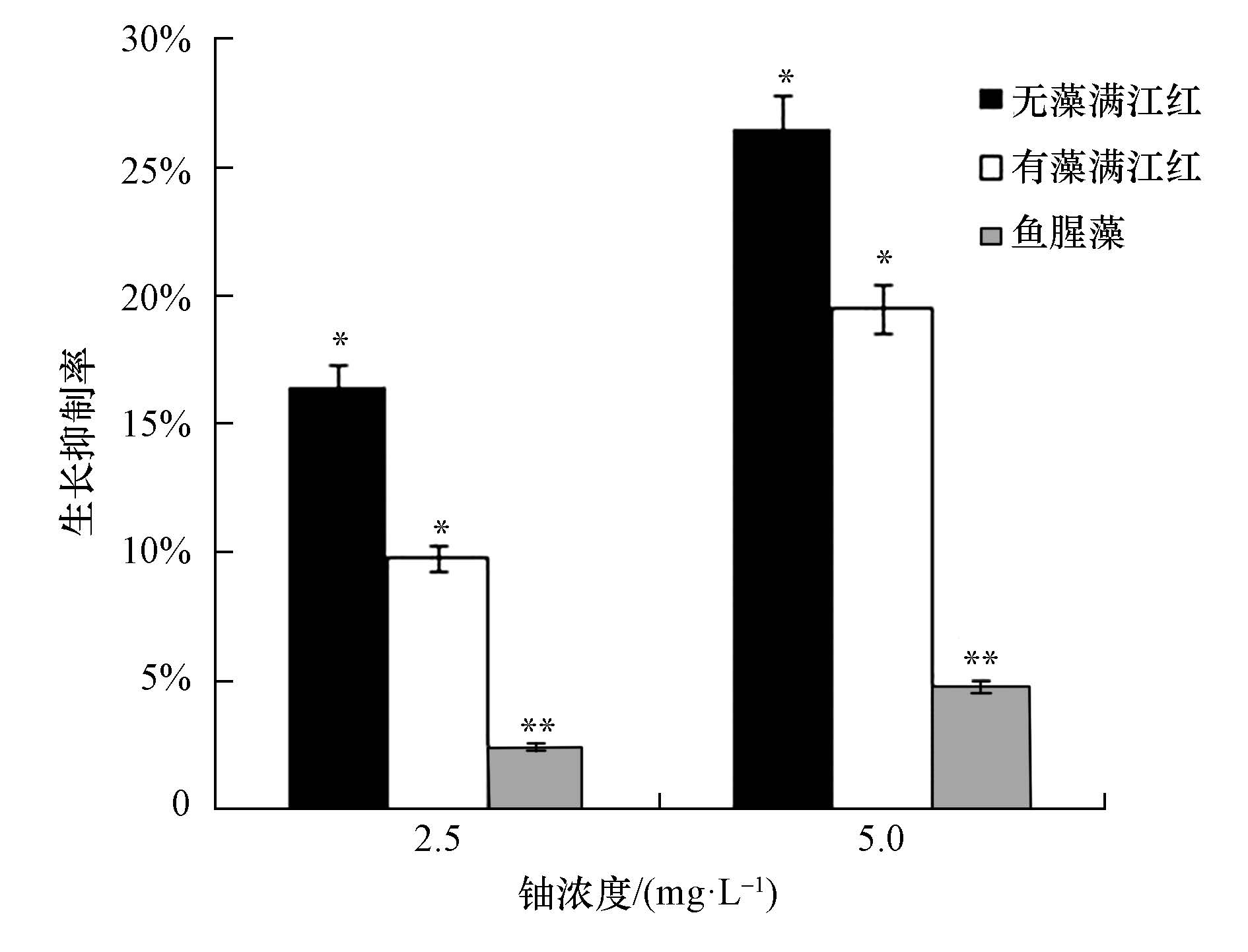 |
| 图 2 无藻满江红、有藻满江红和鱼腥藻在铀胁迫下的生长抑制率(*p<0.05,**p<0.01) Fig. 2 Growth inhibitory rate of the Azolla without Anabaena,Azolla with Anabaena and Anabaena under the stress of uranium |
无藻满江红、有藻满江红和鱼腥藻富集铀前后的红外光谱分析如图 3所示.由图 3a可知,与富集铀前相比,在富集铀后,无藻满江红在3420 cm-1处吸收峰移动到3325 cm-1处,峰型发生明显变化,说明—OH或—NH2发生了变化;1641 cm-1处吸收峰移动到1612 cm-1处,说明—CHO基团发生了变化,1161 cm-1处吸收峰消失,说明多糖分子的C—O键发生了变化.由图 3b可知,与富集铀前相比,在富集铀后,有藻满江红在3306 cm-1处吸收峰移动到3428 cm-1处,峰型发生明显变化,说明—OH或—NH2发生了变化;1632处吸收峰型发生变化,说明多糖分子的主要官能团—CHO发生了变化;1516 cm-1处出现新的吸收峰,分析为芳环CC骨架振动产生的吸收峰,说明出现了芳环类的物质;1447 cm-1处出现新的吸收峰,分析为醇类或苷类化合物中C—H弯曲振动产生的吸收峰,说明出现了醇类或苷类化合物;1117 cm-1处出现新的吸收峰,1030 cm-1处吸收峰消失,说明多糖分子的C—O键发生了变化.由图 3c可知,与富集铀前相比,在富集铀后,鱼腥藻在3445 cm-1处吸收峰移动到3426 cm-1处,峰型发生明显变化,说明—OH或—NH2发生了变化;1738 cm-1处出现新的吸收峰,分析为羧酸CO键伸缩振动产生的吸收峰,说明产生了羧酸CO键;1632 cm-1处吸收峰型移动到1641 cm-1处,说明多糖分子的主要官能团—CHO发生了变化;1447 cm-1处新出现的吸收峰,分析为醇类或苷类化合物中C—H弯曲振动产生的吸收峰,说明产生了芳环和醇类或苷类化合物;1244 cm-1处吸收峰移动到1256 cm-1处,说明醇类、羧酸类化合物中C—O发生了变化;1146 cm-1处吸收峰移动到1157 cm-1处,说明C—N发生了变化;1026 cm-1处吸收峰移动到1015 cm-1处,说明多糖分子的C—O键发生了变化.
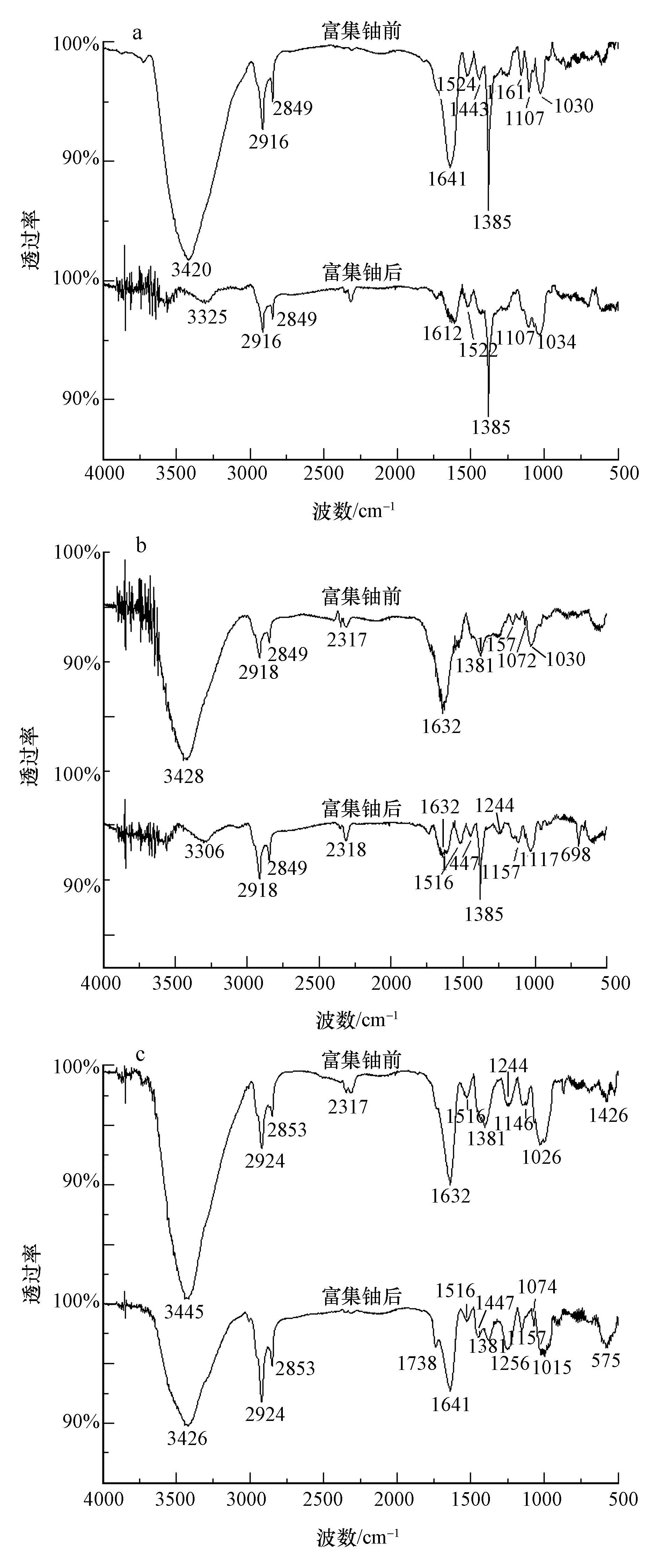 |
| 图 3 无藻满江红(a)、有藻满江红(b)和鱼腥藻(c)富集铀前后的红外光谱图 Fig. 3 FT-IR spectra of Azolla without Anabaena(a),Azolla with Anabaena(b)and Anabaena(c)before and after accumulation of uranium |
无藻满江红、有藻满江红和鱼腥藻富集铀后的红外光谱对比分析如图 4所示.由图 4可知,相对于无藻满江红,有藻满江红中和鱼腥藻中,151 cm-1处出现新的吸收峰,分析为芳环CC骨架振动产生的吸收峰,说明有藻满江红和鱼腥藻富集铀后,产生了芳环类的物质;1447 cm-1处新出现的吸收峰,分析为醇类或苷类化合物中C—H弯曲振动产生的吸收峰,说明有藻满江红和鱼腥藻富集铀后,产生了醇类或苷类化合物.因此,有藻满江红体内出现了新的芳环和醇类或苷类化合物可能是由鱼腥藻产生的.而这些新的化合物可能是微生物鱼腥藻在富集铀的过程中分泌的一些胞外物质(Homer et al.,1991),它们可选择性地与铀结合(Kajiawara et al.,2004),并降低铀对植物的危害,增加生物量,从而促进有藻满江红对铀的富集.本文的结果表明,有藻满江红富集铀的过程中,鱼腥藻也参与其中,并协同无藻满江红一起富集水中的铀.但有关满江红和鱼腥藻组成的共生体系高效除去铀的深层机制仍有待进一步的研究.
 |
| 图 4 无藻满江红(a)、有藻满江红(b)和鱼腥藻(c)富集铀后的红外光谱图 Fig. 4 FT-IR spectra of Azolla without Anabaena(a),Azolla with Anabaena(b)and Anabaena(c)after accumulation of uranium |
1) 有藻满江红对水中铀的去除效率高于单一植物无藻满江红和单一微生物鱼腥藻,初始浓度分别为2.5和5.0 mg·L-1的铀溶液,在共生体系有藻满江红的作用下,分别经过27和36 d生物富集后浓度能降低至GB 23727-2009规定的0.05 mg·L-1排放标准以下.
2) 鱼腥藻提高了有藻满江红对铀的富集量、富集系数及抗铀胁迫的能力,从而促进了有藻满江红对铀的富集.
3) 与无藻满江红相比,有藻满江红体内产生了芳环和醇类或苷类化合物,而这些物质是鱼腥藻在富集铀的过程中产生的,它们可能促进了有藻满江红对铀的富集.
| [${referVo.labelOrder}] | Alvarado J C, Balsiger B, Röllin S, et al. 2014. Radioactive and chemical contamination of the water resources in the former uranium mining and milling sites of Mailuu Suu (Kyrgyzstan)[J]. Journal of Environmental Radioactivity, 138 : 1–10. DOI:10.1016/j.jenvrad.2014.07.018 |
| [${referVo.labelOrder}] | 白克智, 于赛玲, 陈维纶, 等. 1979. 无藻满江红(Azolla) 和满江红鱼腥藻(Anabaena azollae) 的分离与培养[J]. 科学通报, 1979, 14 : 664–666. |
| [${referVo.labelOrder}] | Banerjee C, Dudwadkar N, Tripathi S C, et al. 2014. Nano-cerium vanadate:A novel inorganic ion exchanger for removal of americium and uranium from simulated aqueous nuclear waste[J]. Journal of Hazardous Materials, 280 : 63–70. DOI:10.1016/j.jhazmat.2014.07.026 |
| [${referVo.labelOrder}] | Barkat M, Nibou D, Amokrane S, et al. 2015. Uranium(VI) adsorption on synthesized 4A and P1 zeolites:Equilibrium,kinetic,and thermodynamic studies[J]. Comptes Rendus Chimie, 18(3) : 261–269. DOI:10.1016/j.crci.2014.09.011 |
| [${referVo.labelOrder}] | Carvalho F P. 2014. The National radioactivity monitoring program for the regions of uranium mines and uranium legacy sites in Portugal[J]. Procedia Earth and Planetary Science, 8 : 33–37. DOI:10.1016/j.proeps.2014.05.008 |
| [${referVo.labelOrder}] | Carvalho F P, Oliveira J M, Malta M. 2014. Radioactivity in Iberian Rivers with uranium mining activities in their catchment areas[J]. Procedia Earth and Planetary Science, 8 : 48–52. DOI:10.1016/j.proeps.2014.05.011 |
| [${referVo.labelOrder}] | Chen B D, Zhu Y, Smith F A. 2006. Effects of arbuscular mycorrhizal inoculation on uranium and arsenic accumulation by Chinese brake fern (Pteris vittata L[J]. ) from a uranium mining-impacted soil[J].Chemosphere, 62(9) : 1464–1473. |
| [${referVo.labelOrder}] | Costa M L, Santos M, Carrapiço F, et al. 2009. Azolla-Anabaena's behaviour in urban wastewater and artificial media-Influence of combined nitrogen[J]. Water Research, 43(15) : 3743–3750. DOI:10.1016/j.watres.2009.05.038 |
| [${referVo.labelOrder}] | Entry J A, Watrud L S, Reeves M. 1999. Accumulation of 137Cs and 90Sr from contaminated soil by three grass species inoculated with mycorrhizal fungi[J]. Environmental Pollution, 104(3) : 449–457. DOI:10.1016/S0269-7491(98)00163-8 |
| [${referVo.labelOrder}] | Glick B R. 2003. Phytoremediation:synergistic use of plants and bacteria to clean up the environment[J]. Biotechnology Advances, 21(5) : 383–393. DOI:10.1016/S0734-9750(03)00055-7 |
| [${referVo.labelOrder}] | He J, Wang Y, Hu N, et al. 2015. An artificially constructed Syngonium podophyllum-Aspergillus Niger combinate system for removal of uranium from wastewater[J]. Environmental Science and Pollution Research, 22(23) : 18918–18926. DOI:10.1007/s11356-015-5008-3 |
| [${referVo.labelOrder}] | 胡南, 丁德馨, 李广悦, 等. 2012. 五种水生植物对水中铀的去除作用[J]. 环境科学学报, 2012, 32(7) : 1637–1645. |
| [${referVo.labelOrder}] | Homer F A, Reeves R D, Brooks R R, et al. 1991. Characterization of the nickel-rich extract from the nickel hyperaccumulator Dichapetalum gelonioides[J]. Phytochemistry, 30(7) : 2141–2145. DOI:10.1016/0031-9422(91)83602-H |
| [${referVo.labelOrder}] | Kajiawara M, Nishida I. 2004. Properties of p-nitrocalix[6]arene and its reactivity with uranyl ion[J]. Bunseki Kagaku, 58(9) : 931–936. |
| [${referVo.labelOrder}] | Khan S, Afzal M, Iqbal S, et al. 2013. Plant-bacteria partnerships for the remediation of hydrocarbon contaminated soils[J]. Chemosphere, 90(4) : 1317–1332. DOI:10.1016/j.chemosphere.2012.09.045 |
| [${referVo.labelOrder}] | Mccombie C. 1997. The hazards presented by radioactive wastes and the safety levels to be provided by repositories[J]. Nuclear Engineering and Design, 176(1) : 43–50. |
| [${referVo.labelOrder}] | Pan C C, Hu N, Ding D X, et al. 2016. An experimental study on the synergistic effects between Azolla and Anabaena in removal of uranium from solutions by Azolla-anabaena symbiotic system[J]. Journal of Radioanalytical and Nuclear Chemistry, 307(1) : 385–394. DOI:10.1007/s10967-015-4161-y |
| [${referVo.labelOrder}] | Pandey V C. 2012. Phytoremediation of heavy metals from fly ash pond by Azolla caroliniana[J]. Ecotoxicology and Environmental Safety, 82 : 8–12. DOI:10.1016/j.ecoenv.2012.05.002 |
| [${referVo.labelOrder}] | Pratas J, Paulo C, Favas P J, et al. 2014. Potential of aquatic plants for phytofiltration of uranium-contaminated waters in laboratory conditions[J]. Ecological Engineering, 69 : 170–176. DOI:10.1016/j.ecoleng.2014.03.046 |
| [${referVo.labelOrder}] | Soudek P, Petrová Š, Benešová D, et al. 2011. Uranium uptake by hydroponically cultivated crop plants[J]. Journal of Environmental Radioactivity, 102(6) : 598–604. DOI:10.1016/j.jenvrad.2011.03.008 |
| [${referVo.labelOrder}] | Srivastava S, Bhainsa K C, D Souza S F. 2010. Investigation of uranium accumulation potential and biochemical responses of an aquatic weed Hydrilla verticillata (Lf) Royle[J]. Bioresource Technology, 101(8) : 2573–2579. DOI:10.1016/j.biortech.2009.10.054 |
| [${referVo.labelOrder}] | Voitsekhovitch O, Soroka Y, Lavrova T. 2006. Uranium mining and ore processing in Ukraine-radioecological effects on the Dnipro River water ecosystem and human health[J]. Radioactivity in the Environment, 8 : 206–214. DOI:10.1016/S1569-4860(05)08014-9 |
| [${referVo.labelOrder}] | 王清良, 胡南, 丁德馨, 等. 2013. 反硝化细菌生物反应器去除地浸采铀矿山退役采区地下水中 NO3--N 的试验研究[J]. 原子能科学技术, 2013, 47(8) : 1300–1306. |
| [${referVo.labelOrder}] | Wang Y, Gu Z, Yang J, et al. 2014. Amidoxime-grafted multiwalled carbon nanotubes by plasma techniques for efficient removal of uranium (VI)[J]. Applied Surface Science, 320 : 10–20. DOI:10.1016/j.apsusc.2014.08.182 |
| [${referVo.labelOrder}] | 韦革宏, 马占强. 2010. 根瘤菌-豆科植物共生体系在重金属污染环境修复中的地位,应用及潜力[J]. 微生物学报, 2010, 50(11) : 1421–1430. |
| [${referVo.labelOrder}] | 徐俊, 龚永兵, 张倩慈, 等. 2009. 三种植物对铀耐性及土壤中铀吸收积累差异的研究[J]. 化学研究与应用, 2009, 21(3) : 322–326. |
| [${referVo.labelOrder}] | Zhu X, Alexandratos S D. 2015. Development of a new ion-exchange/coordinating phosphate ligand for the sorption of U (VI) and trivalent ions from phosphoric acid solutions[J]. Chemical Engineering Science, 127 : 126–132. DOI:10.1016/j.ces.2015.01.027 |
 2017, Vol. 37
2017, Vol. 37


