2. 环境保护部南京环境科学研究所, 南京 210042
2. Nanjing Institute of Environmental Sciences, MEP, Nanjing 210042
羟基化多溴联苯醚(OH-PBDEs)作为一类具有内分泌干扰性质的酚类化合物已经引起人们的广泛关注,生物毒性研究(Macaulay et al., 2015a,b; Ji et al., 2011; Wiseman et al., 2011)发现OH-PBDEs与甲状腺激素(T4)具有相似的结构,可以与T4竞争结合在甲状腺转移蛋白(TTR)上,进而产生比母体多溴联苯醚(PBDEs)更大的生物毒性,同时,研究(Cantón et al., 2006; 2008)还发现OH-PBDEs能够显著抑制一些参与催化类固醇反应的细胞色素P450酶(CYP450酶)的活性(如CYP17).此外,OH-PBDEs对氧化磷酸化反应和神经系统也具有一定的干扰作用(Macaulay et al., 2015; Yu et al., 2010; Li et al., 2013).虽然OH-PBDEs比PBDEs具有较高的亲水性,但是在动物体内,甚至人体内仍然能够检测到(Zhao et al., 2014; Sun et al., 2013; Löfstrand et al., 2011; Liu et al., 2014; Dahlberg et al., 2014).
已有研究(Covaci et al., 2008; Pountney et al., 2015)发现在人体和哺乳动物肝脏组织中可以检测到高含量水平的PBDEs,而肝脏作为外源性化合物生物转化的重要器官,含有参与物质代谢的重要酶系,体外代谢研究(Stapleton et al., 2009; Erratico et al., 2013)表明PBDEs可以经肝脏中的细胞色素P450酶(CYP450酶)氧化代谢生成OH-PBDEs,且某些低溴代的OH-PBDEs(如OH-BDE-47)生成量可达母体PBDEs的31%(Lupton et al., 2009),然而OH-PBDEs在人体和动物血液中的含量却远低于母体PBDEs的含量(De la Torre et al., 2013; Zota et al., 2011),因此有必要研究OH-PBDEs代谢在其中起到的作用.目前,关于OH-PBDEs的肝脏代谢研究还相对较少,Lai等(Lai and Cai, 2012)研究了OH-PBDEs在大鼠肝微粒体中的体外代谢,结果表明CYP450酶可以将OH-PBDEs转化为溴酚和二羟基的多溴联苯醚,且苯环上不同数量的取代溴表现出不同的代谢率.Li等(2016)研究了3种OH-PBDEs在猪肝微粒体中的体外代谢,结果表明I相酶中的CYP450酶能够代谢3种OH-PBDEs,且代谢速率随溴原子取代数量的增加而降低,相对羟基化和脱溴两种代谢途径,醚键断裂是3种OH-PBDEs主要的代谢途径.此外,有研究(Lai et al., 2012; Erratico et al., 2015)还报道II相酶中的尿苷二磷酸葡萄糖醛酸(UDPGA)也能结合OH-PBDEs形成聚合物通过尿液排出体外.相对于肝脏微粒体,肝脏S9(post mitochondrial supernatant,简称S9)是肝组织去除匀浆沉淀物后含有代谢所需成分、具有完整代谢功能的混悬溶液,有完整的I相和II相代谢酶(李丹等,2011),可以全面的反映OH-PBDEs的生物转化.由于小白鼠是典型的模式动物,有利于实验结果延伸到人体,为人类的健康风险评价提供理论依据.因此,本文选择环境介质和生物体内普遍检出的4种OH-PBDEs的同分异构体,研究其在小白鼠肝脏S9部分的体外代谢行为,将有助于更加全面的评价OH-PBDEs在生物体内的持久性和蓄积性.
2 材料与方法(Materials and methods) 2.1 仪器与试剂高效液相色谱-串联质谱仪(LC-Agilent Technologies 1290 Infinity,MS-AB SCIEX QTRAP 4500,美国);AG-285电子天平(瑞士Mettle公司);2-16PK台式离心机(Sigma公司);UVmini-1240紫外分光光度计(日本Kyoto公司);Tecan Infinite 200酶标仪(Tecan公司);振荡培养箱(INNOVA 43R,NBS公司).
3-羟基-2,2′,4,4′-四溴联苯醚(3-OH-BDE-47)、 5-羟基-2,2′,4,4′-四溴联苯醚(5-OH-BDE-47)、6-羟基-2,2′,4,4′-四溴联苯醚(6-OH-BDE-47)、2′-羟基-2,3′,4,5′-四溴联苯醚(2′-OH-BDE-68)购自百灵威公司(图 1);2,4-二溴苯酚(2,4-Dibromophenol,2,4-DBP)、三(羟甲基)氨基甲烷、二硫苏糖醇(DTT)、乙二胺四乙酸二钠盐二水合物(Na2EDTA)、牛血清蛋白(BSA)、考马斯亮蓝G250、烟酰胺腺嘌呤二核苷酸磷酸(NADPH)及尿苷二磷酸葡糖醛酸(UDPGA)购自美国Sigma Aldrich公司;甲醇和乙腈(色谱纯,德国Merck公司);氨水(色谱纯,国药集团药业股份有限公司);二甲基亚砜(DMSO,药检专用,国药集团化学试剂有限公司).
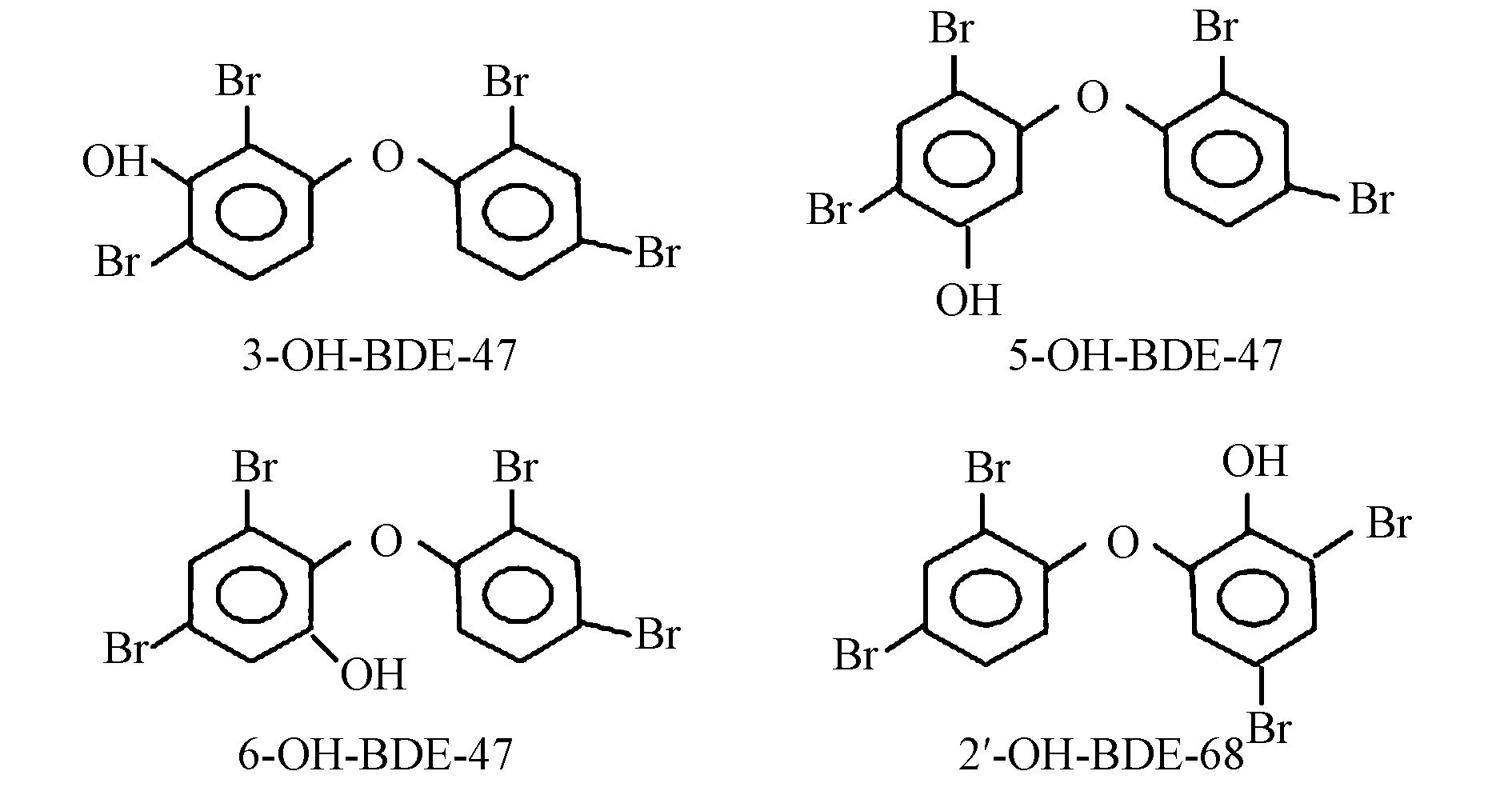 |
| 图 1 OH-PBDEs的结构图 Fig. 1 Chemical structures of OH-PBDEs |
SPF级ICR小白鼠(体重18~22 g,6周)购买自上海杰思捷实验动物有限公司,采用颈椎脱臼法处死小鼠,迅速取出肝脏,在冰浴中用冰冷的0.9%生理盐水冲洗肝脏,用滤纸拭干后称重,将肝脏剪成小块,加入3倍重量的匀浆缓冲液(20%甘油、0.15 mol · L-1 KCl、1 mmol · L-1 Na2EDTA、0.1 mmol · L-1 DTT,以0.1 mol · L-1 Tris-HCl(pH 7.4)配制)在冰浴中进行匀浆;匀浆后的肝脏组织在4 ℃和9000 g的条件下离心20 min,取上清液即为S9肝匀浆,保存至液氮中备用.用Bradford法测定S9的蛋白质含量,在595 nm下测定吸光值以确定蛋白质含量,以牛血清蛋白作为标准蛋白;蛋白浓度为34.799 mg · mL-1.
2.3 体外代谢与样品处理 2.3.1 I相酶活性(1) 7-乙氧基香豆素-O-脱乙基酶(ECOD)
ECOD活性的测定方法参考Glöockner和Müuller(1995)和Müller(1990)的所用方法稍作修改:反应体系包括1 mg · mL-1BSA、1 mmol · L-1 7-乙氧基香豆素、S9样品液,Tris-HCl缓冲液用于维持体系的pH值,整个反应体系总体积为1 mL.37 ℃预热5 min后加入NADPH开启反应,反应10 min后,添加三氯乙酸(15%)终止反应.加入2 mL三氯甲烷萃取反应产物,涡旋2 min后于3000 g下离心5 min;离心后,取1 mL下层有机相加入5 mL 0.6 mol · L-1 NaOH-甘氨酸缓冲液(pH 10.4),涡旋2 min后于3000 g条件下离心5 min,离心后取上清液于荧光酶标仪中进行检测.检测激发波长为370 nm,发射波长为450 nm,酶活性用产物7-羟基香豆素表示,单位为pmol · min-1 · mg-1.
(2) 7-乙氧基异吩唑酮-O-脱乙基酶(EROD)
EROD的测定方法参考吴若函等(2012)和沈梦楠(2012)所用方法:反应体系包括1 mg · mL-1BSA、2 μmol · L-1 乙氧基试卤灵、S9样品液,Tris-HCl缓冲液用于维持体系的pH值,整个反应体系总体积为1 mL.37 ℃预热5 min后加入NADPH开启反应,反应10 min后,添加1 mL甲醇终止反应,涡旋2 min后于5000 r · min-1条件下离心15 min后,取上清液于荧光酶标仪中进行检测.检测激发波长为535 nm,发射波长为585 nm,酶活性用产物试卤灵表示,单位为pmol · min-1 · mg-1.
2.3.2 I相酶代谢代谢反应总体积为2 mL,反应体系中包含0.1 mol · L-1 Tris-HCl(37 ℃,pH 7.4)、0.2 μmol · L-1 OH-PBDEs、0.5 mg · mL-1蛋白质,其中OH-PBDEs用DMSO助溶(反应体系中DMSO比例不大于1%),加入NADPH启动反应,37 ℃下分别振荡培养,在培养时间分别为5、10、20、30、40、60、80、100、120 min时终止反应,其中对照组为不含NADPH.实验中使用加入2 mL冰乙腈终止反应,随后放入-20 ℃冰箱10 min,经低温使蛋白沉淀后,取上清液过0.22 μm有机相膜(尼龙)后,供HPLC-MS/MS分析OH-PBDEs的剩余量.
为确定4种OH-PBDEs经小鼠S9代谢后代谢产物的量,在代谢反应经过2 h后终止反应,使用HPLC-MS/MS定量分析产物2,4-二溴苯酚的生成量.
2.3.3 I相酶酶动力学代谢反应总体积为2 mL,包含0.1 mol · L-1 Tris-HCl(37 ℃,pH 7.4)、OH-PBDEs、蛋白质(0.5 mg · mL-1),其中OH-PBDEs用DMSO助溶(反应体系中DMSO比例不大于1%),设置OH-PBDEs在反应体系中的浓度范围为0.1~1.0 μmol · L-1,每个浓度点设3个平行,加入NADPH启动反应,37 ℃下分别置于恒温培养箱中,对照组为不添加NADPH.反应结束时加入2 mL冰乙腈终止反应,涡旋1 min,放入-20 ℃冰箱10 min后取出,取上清液过0.22 μm有机相膜(尼龙)后,供UPLC-MS/MS检测OH-PBDEs的剩余量.
2.3.4 II相酶代谢代谢反应总体积为2 mL,包含0.1 mol · L-1 Tris-HCl(37 ℃ pH 7.4)、0.2 μmol · L-1 OH-PBDE、0.5 mg · mL-1蛋白质,OH-PBDEs用DMSO助溶(反应体系中DMSO比例不大于1%),在恒温摇床中预孵育5 min后,加入UDPGA启动反应,37 ℃下分别振荡培养,在培养时间分别为20、60、120 min时终止反应,其中对照组为不含UDPGA.反应结束时加入2 mL冰乙腈,放入-20 ℃冰箱10 min后,取上清液过0.22 μm有机相膜(尼龙)后,供HPLC-MS/MS分析OH-PBDEs的剩余量.
2.4 HPLC-MS/MS测定样品测定采用高效液相色谱-串联质谱(HPLC-MS/MS):质谱条件为电喷雾离子源(ESI-),多反应离子监测(MRM),负离子模式,离子源温度400 ℃,离子喷雾电压5500 V,气帘气压力206851.8 Pa,喷雾气压力241327.1 Pa,辅助加热气压力275802.4 Pa;液相色谱条件为ZORBAX Eclipse Plus C18色谱柱(150 mm×2.1 mm,3.5 μm),流动相0.02%(V/V)氨水(A)和乙腈(B),A与B的比例为3 ∶ 7,柱温40 ℃,进样体积5 μL,外标法定量.具体参数见表 1.4种OH-PBDEs和2,4-DBP均在0.004~0.400 μmol · L-1范围内线性相关,可决系数(R2)范围为0.9934~0.9995,定量限(LOQ)范围为0.02~0.17,回收率范围为68%~89%.
| 表 1 4种OH-PBDEs和2,4-DBP的质谱条件 Table 1 Mass spectrometric conditions for the analysis of the four OH-PBDEs and 2,4-DBP |
采用Sigma Plot 10.0对数据进行非线性回归分析获得酶动力学参数(米氏常数Km和酶最大反应速率Vmax).
3 结果与讨论(Results and discussion) 3.1 I相酶对OH-PBDEs的转化 3.1.1 I相酶的活性在哺乳动物体内,ECOD可以被CYP1A、2A、3A等多种CYP450亚型酶系催化(Yamazaki et al., 1996),因此ECOD活性一般可以作为表征CYP450总活性的指标.实验中空白S9的ECOD和EROD酶活性分别为(350±41)pmol · min-1 · mg-1和(32±2)pmol · min-1 · mg-1.
3.1.2 I相酶代谢小鼠肝脏中,外源性污染物的I 相酶代谢主要由细胞色素P450酶系(CYP450)介导,需要NADPH辅酶的参与完成代谢反应,图 2和图 3分别为4种OH-PBDEs的代谢率随孵育时间的变化图和典型质谱图.从图 2可以看出,3-OH-BDE-47、 5-OH-BDE-47和6-OH-BDE-47的代谢率随孵育时间的增加逐渐增大,且6-OH-BDE-47反应到10 min时,反应就基本达到平衡位置,3-OH-BDE-47和5-OH-BDE-47反应结束时也基本达到平衡位置,代谢率分别为92%、84%和46%.与上述3种OH-PBDEs不同,2′-OH-BDE-68在20 min后快速代谢,反应结束时也基本达到平衡位置,代谢率为71%.Lai等(Lai and Cai, 2012)用大鼠肝脏微粒体代谢6-OH-BDE-47和2′-OH-BDE-68,孵育80 min后代谢率也可达到80%左右,而Li等(2016)用猪肝脏微粒体代谢3-OH-BDE-47,代谢半衰期为6.48 h,这表明不同物种间CYP450酶的活性存在较大差异,有研究也已经证实了大鼠的CYP450酶活性要高于猪的CYP450酶活性(Smith et al., 1984).相对于母体PBDEs而言(吴若函等,2012),4种OH-PBDEs更容易被代谢,这在一定程度上说明羟基官能团的引入提高了母体PBDEs的生物利用性,使其不容易在体内富集.此外,从4种OH-PBDEs的结构来看(图 1),由于Br原子数量相同,OH官能团的取代位置直接影响其代谢率,结果发现醚键与OH官能团及Br原子互为邻位时代谢率最高,这与Lai等(Lai and Cai, 2012)的研究结果一致,6-OH-BDE-47表现出较高的代谢率.然而,Bastos等(2008; 2009)研究发现,6-OH-BDE-47相对于其它同分异构体在光化学降解中表现出更强的持久性,这可能是由于酶介导的代谢与化学氧化反应存在不同的降解机制.
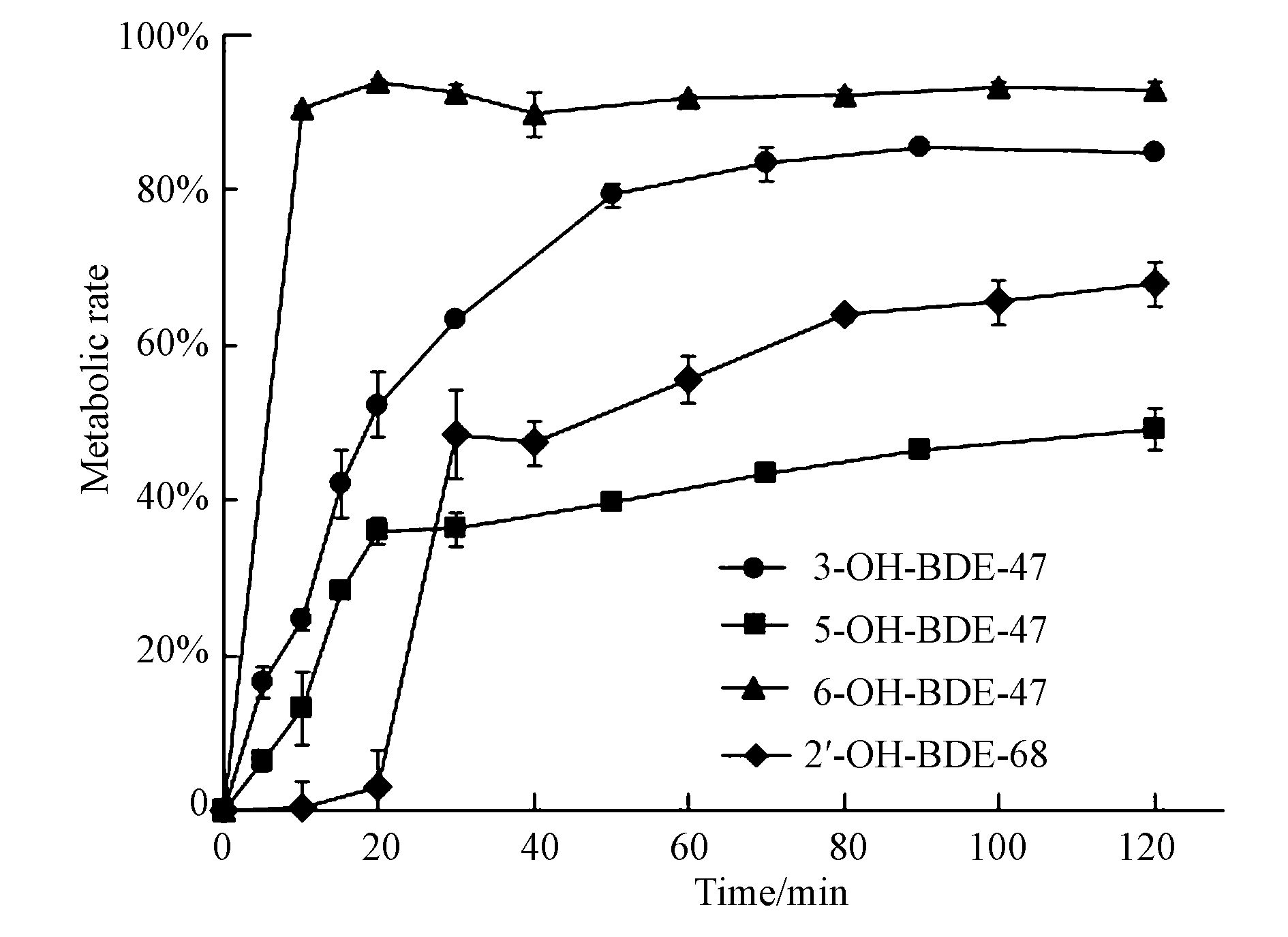 |
| 图 2 OH-PBDEs与孵育时间的关系 Fig. 2 Concentrations of OH-PBDEs as a function of incubation time |
 |
| 图 3 OH-PBDEs孵育0 min和120 min典型质谱图 Fig. 3 Typical mass chromatogram of OH-PBDEs after incubation time of 0 min and 120 min |
CYP450酶系并不是单一酶,而是由多种同工酶(亚型)组成,为方便统计分析,将CYP450酶系假设为单酶单底物酶动力学系统,通过Sigma Plot拟合计算得到4种OH-PBDEs的酶动力学参数Vmax值和Km值(表 2和图 4).由于Km值代表底物与酶的结合程度,Km越低表明结合程度越高,6-OH-BDE-47的Km值最小,表明酶代谢过程中与CYP450酶的结合程度最高,而且Vmax值在4种OH-PBDEs中也是最大的,说明6-OH-BDE-47比3-OH-BDE-47、5-OH-BDE-47和2′-OH-BDE-68更容易被CYP450酶系所代谢,这与代谢动力学得到的结果一致.
| 表 2 OH-PBDEs的酶动力学参数 Table 2 Enzyme kinetic parameters for OH-PBDEs |
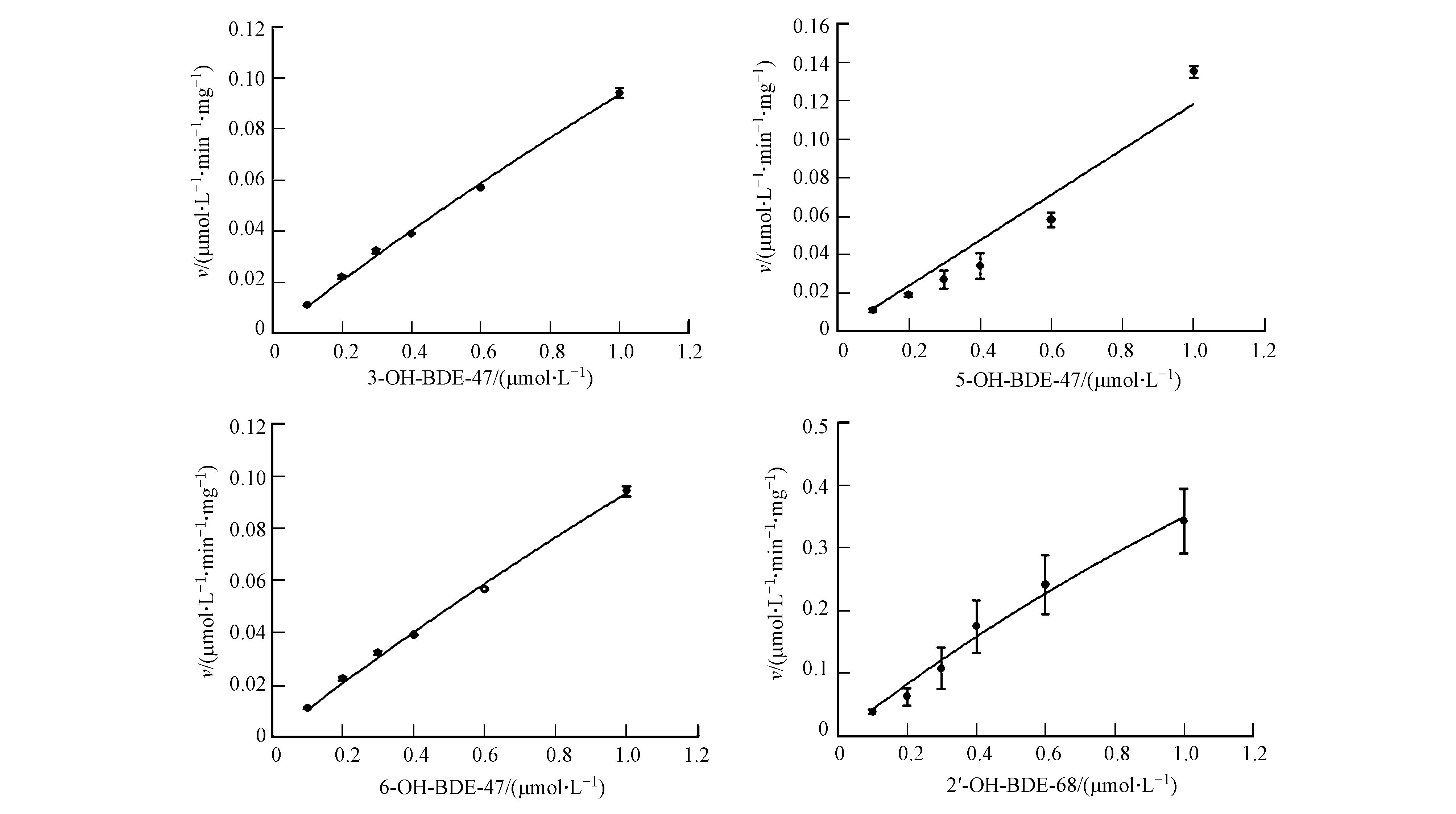 |
| 图 4 OH-PBDEs的酶促反应动力学曲线 Fig. 4 Enzymatic reaction kinetic curve of OH-PBDEs |
由于在提取液中仅检测到一种产物,通过标准样品进一步比对确定为2,4-DBP,定量分析结果表明,2,4-DBP产生量最多的OH-PBDEs是3-OH-BDE-47,依次为6-OH-BDE-47、2′-OH-BDE-68和5-OH-BDE-47(表 3),占相应母体代谢率的比例为45.8%、22.6%、20.7%和16.9%.虽然相关研究(Lai et al., 2012; Li et al., 2016)报道了OH-PBDEs在大鼠和猪肝微粒体中能够产生diOH-PBDEs,然而本研究中并没有检测到diOH-PBDEs,但是已有的研究(Bolton et al., 2000; Lai et al., 2011)也表明代谢产物diOH-PBDEs在体内很容易被氧化成毒性很高的醌类化合物,醌类化合物不稳定,会进一步代谢分解,这可能也是本研究中未检测到diOH-PBDEs代谢产物的原因之一.通过对2,4-DBP的定量分析发现(表 3),醚键断裂产生2,4-DBP占了母体代谢量的较大比重,谢晴等(2011)在研究2′-OH-BDE-68的光氧化反应时,发现2′-OH-BDE-68与 · OH的主要反应产物为2,4-DBP,这说明醚键断裂可能是4种OH-PBDEs的主要代谢途径.
| 表 3 OH-PBDEs在肝脏S9体外代谢中2,4-二溴苯酚的生成量 Table 3 Production of 2,4-dibromophenol for OH-PBDEs by mice liver S9 in vitro |
在II相酶中,尿苷二磷酸葡萄糖醛酸转移酶(UGT)可以催化尿苷二磷酸葡萄糖醛酸(UDPGA)与含有—OH、—SH、—COOH、—NH2等官能团的外源性污染物结合,生成水溶性更大的聚合物(彭金咏和栾连军,2002; Grancharov et al., 2001),因此,在UDPGA的参与下研究了4种OH-PBDEs的葡萄糖醛酸化代谢反应.图 5和图 6分别为4种OH-PBDEs的代谢率随孵育时间的变化图和典型质谱图.从图 5可以看出,4种OH-PBDEs均能被UGT催化与UDPGA相结合,且代谢率随孵育时间的增加逐渐增大,在反应120 min后,5-OH-BDE-47、3-OH-BDE-47和6-OH-BDE-47基本达到平衡位置,代谢率分别为100%、24%和58%.与上述3种OH-PBDEs不同,2′-OH-BDE-68在反应结束时未达到平衡位置,呈增加趋势,代谢率为51%.对于Br原子取代位置相同的 3种OH-PBDEs,OH官能团与醚键互为间位时代谢率最高(5-OH-BDE-47 > 6-OH-BDE-47 > 3-OH-BDE-47),这与Erratico等(2015)的研究结果一致.Erratico等(2015)研究发现,相对于3-OH-BDE-47和6-OH-BDE-47,5-OH-BDE-47在人体肝微粒体代谢反应中的米氏常数最小(Km=6.3 μmol · L-1),表明5-OH-BDE-47更容易与UDPGA发生葡萄糖醛酸结合反应.然而,Lai等(2012)的研究结果却发现OH官能团与醚键互为邻位时代谢率相对较高(6′-OH-BDE-17 > 4′-OH-BDE-17),产生差异的原因可能是由于含有OH官能团的苯环对位上增加的Br原子导致了代谢率的不同,这也间接说明Br原子的增加可能会改变OH-PBDEs的代谢途径.
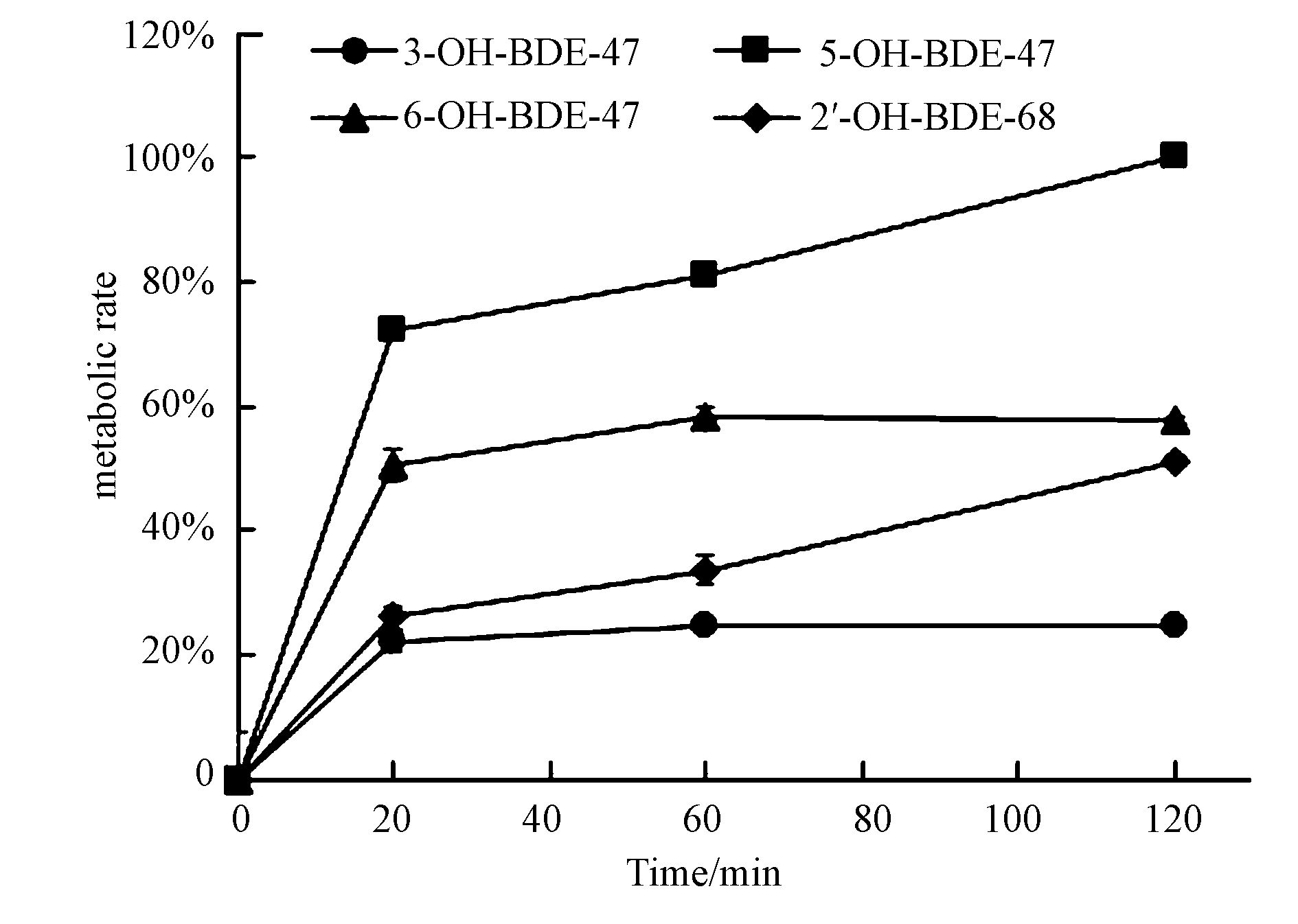 |
| 图 5 尿苷二磷酸葡萄糖醛酸酶对OH-PBDEs的作用 Fig. 5 Role of UDP-glucuronosyl transferase in OH-PBDEs in vitro metabolism |
 |
| 图 6 OH-PBDEs孵育0 min和120 min典型质谱图 Fig. 6 Typical mass chromatogram of OH-PBDEs after incubation time of 0 min and 120 min |
已有研究发现4种OH-PBDEs在肝脏中的检出率和检出量均低于其它组织(Weijs et al., 2014),而本研究结果表明4种OH-PBDEs在肝脏S9中均能发生I相和II相酶代谢反应,这可能就是4种OH-PBDEs较低检出率和检出量的原因之一.此外,OH官能团与Br原子取代位置的不同影响了4种OH-PBDEs的代谢水平和代谢途径,本研究结果发现II相酶能够快速与5-OH-BDE-47发生葡萄糖醛酸结合反应,而I相酶对5-OH-BDE-47代谢率相对较低,由于尿苷二磷酸葡萄糖醛酸转移酶(UGT)广泛分布于机体的各种组织,其中以肝脏中该酶的活性最高(彭金咏和栾连军,2002),这在一定程度上表明II相酶的葡萄糖醛酸结合反应是5-OH-BDE-47 在体内去除更重要的代谢途径.相对5-OH-BDE-47,3-OH-BDE-47、6-OH-BDE-47和2′-OH-BDE-68则更主要依赖I相酶的代谢去除.
4 结论(Conclusions)1) 4种OH-PBDEs在肝脏S9中均能发生I相酶代谢反应,其代谢率顺序为6-OH-BDE-47 > 3-OH-BDE-47 > 2′-OH-BDE-68 > 5-OH-BDE-47,而且4种OH-PBDEs经CYP450酶代谢后均能生成2,4-二溴苯酚,说明醚键断裂是其主要的I相酶代谢途径.
2) 4种OH-PBDEs在肝脏S9中均能发生II相酶代谢反应,其代谢率顺序为5-OH-BDE-47 > 6-OH-BDE-47 > 2′-OH-BDE-68 > 3-OH-BDE-47.
3) 通过结构与代谢关系的分析发现,OH官能团与Br原子取代位置的不同影响了4种OH-PBDEs的代谢水平和代谢途径.
| [1] | Bastos P M, Eriksson J, Vidarson J, et al. 2008. Oxidative transformation of polybrominated diphenyl ether congeners (PBDEs) and of hydroxylated PBDEs (OH-PBDEs)[J]. Environmental Science and Pollution Research , 15 (7) : 606–613. DOI:10.1007/s11356-008-0045-9 |
| [2] | Bastos P M, Eriksson J, Bergman Å. 2009. Photochemical decomposition of dissolved hydroxylated polybrominated diphenyl ethers under various aqueous conditions[J]. Chemosphere , 77 (6) : 791–797. DOI:10.1016/j.chemosphere.2009.08.013 |
| [3] | Bolton J L, Trush M A, Penning T M, et al. 2000. Role of quinones in toxicology[J]. Chemical Research in Toxicology , 13 (3) : 135–160. DOI:10.1021/tx9902082 |
| [4] | Cantón R F, Sanderson J T, Nijmeijer S, et al. 2006. In vitro effects of brominated flame retardants and metabolites on CYP17 catalytic activity: A novel mechanism of action?[J]. Toxicology and Applied Pharmacology , 216 (2) : 274–281. DOI:10.1016/j.taap.2006.05.007 |
| [5] | Cantón R F, Scholten D E A, Marsh G, et al. 2008. Inhibition of human placental aromatase activity by hydroxylated polybrominated diphenyl ethers (OH-PBDEs)[J]. Toxicology and Applied Pharmacology , 227 (1) : 68–75. DOI:10.1016/j.taap.2007.09.025 |
| [6] | Covaci A, Voorspoels S, Roosens L, et al. 2008. Polybrominated diphenyl ethers (PBDEs) and polychlorinated biphenyls (PCBs) in human liver and adipose tissue samples from Belgium[J]. Chemosphere , 73 (2) : 170–175. DOI:10.1016/j.chemosphere.2008.02.059 |
| [7] | Dahlberg A K, Norrgran J, Hovander L, et al. 2014. Recovery discrepancies of OH-PBDEs and polybromophenols in human plasma and cat serum versus herring and long-tailed duck plasma[J]. Chemosphere , 94 : 97–103. DOI:10.1016/j.chemosphere.2013.09.020 |
| [8] | De la Torre A, Pacepavicius G, Martínez M A, et al. 2013. Polybrominated diphenyl ethers and their methoxylated and hydroxylated analogs in Brown Bullhead (Ameiurus nebulosus) plasma from Lake Ontario[J]. Chemosphere , 90 (5) : 1644–1651. DOI:10.1016/j.chemosphere.2012.09.005 |
| [9] | Erratico C, Zheng X B, Ryden A, et al. 2015. Human hydroxylated metabolites of BDE-47 AND BDE-99 are glucuronidated and sulfated in vitro[J]. Toxicology Letters , 236 (2) : 98–109. DOI:10.1016/j.toxlet.2015.05.003 |
| [10] | Erratico C A, Szeitz A, Bandiera S M. 2013. Biotransformation of 2,2',4,4'-tetrabromodiphenyl ether (BDE-47) by human liver microsomes: identification of cytochrome P450 2B6 as the major enzyme involved[J]. Chemical Research in Toxicology , 26 (5) : 721–731. DOI:10.1021/tx300522u |
| [11] | Glöckner R, Müller D. 1995. Ethoxycoumarin O-deethylation (ECOD) activity in rat liver slices exposed to beta-naphthoflavone (BNF) in vitro[J]. Experimental and Toxicologic Pathology , 47 (4) : 319–324. DOI:10.1016/S0940-2993(11)80271-X |
| [12] | Grancharov K, Naydenova Z, Lozeva S, et al. 2001. Natural and synthetic inhibitors of UDP-glucuronosyltransferase[J]. Pharmacology & Therapeutics , 89 (2) : 171–186. |
| [13] | Ji K, Choi K, Giesy J P, et al. 2011. Genotoxicity of several polybrominated diphenyl ethers (PBDEs) and hydroxylated PBDEs, and their mechanisms of toxicity[J]. Environmental Science & Technology , 45 (11) : 5003–5008. |
| [14] | Lai Y Q, Lu M H, Gao X, et al. 2011. New evidence for toxicity of polybrominated diphenyl ethers: DNA adduct formation from quinone metabolites[J]. Environmental Science & Technology , 45 (24) : 10720–10727. |
| [15] | Lai Y Q, Cai Z W. 2012. In vitro metabolism of hydroxylated polybrominated diphenyl ethers and their inhibitory effects on 17β-estradiol metabolism in rat liver microsomes[J]. Environmental Science and Pollution Research , 19 (8) : 3219–3227. DOI:10.1007/s11356-012-0828-x |
| [16] | Lai Y Q, Lu M H, Lin S H, et al. 2012. Glucuronidation of hydroxylated polybrominated diphenyl ethers and their modulation of estrogen UDP-glucuronosyltransferase[J]. Chemosphere , 86 (7) : 727–734. DOI:10.1016/j.chemosphere.2011.10.047 |
| [17] | Langsch A, Bader A. 2001. Longterm stability of phase i and phase ii enzymes of porcine liver cells in flat membrane bioreactors[J]. Biotechnology and Bioengineering , 76 (2) : 115–125. DOI:10.1002/(ISSN)1097-0290 |
| [18] | 李丹, 韩永龙, 余涛, 等.2011. 体外肝代谢模型的优缺点及其应用[J]. 中国临床药理学与治疗学 , 2011, 16 (6) : 688–694. |
| [19] | Li J H, Zhang Y, Du Z K, et al. 2016. Biotransformation of OH-PBDEs by pig liver microsomes: investigating kinetics, identifying metabolites, and examining the role of different CYP isoforms[J]. Chemosphere , 148 : 354–360. DOI:10.1016/j.chemosphere.2016.01.056 |
| [20] | Li T, Wang W B, Pan Y W, et al. 2013. A hydroxylated metabolite of flame-retardant PBDE-47 decreases the survival, proliferation, and neuronal differentiation of primary cultured adult neural stem cells and interferes with signaling of ERK5 MAP kinase and neurotrophin 3[J]. Toxicological Science , 134 : 111–124. DOI:10.1093/toxsci/kft083 |
| [21] | Liu X T, Jiao Y, Lin C Y, et al. 2014. PBDEs, hydroxylated PBDEs and methoxylated PBDEs in bivalves from Beijing markets[J]. Chemosphere , 110 : 97–103. DOI:10.1016/j.chemosphere.2014.02.019 |
| [22] | Löfstrand K, Liu X T, Lindqvist D, et al. 2011. Seasonal variations of hydroxylated and methoxylated brominated diphenyl ethers in blue mussels from the Baltic Sea[J]. Chemosphere , 84 (4) : 527–532. DOI:10.1016/j.chemosphere.2011.01.001 |
| [23] | Lupton S J, McGarrigle B P, Olson J R, et al. 2009. Human liver microsome-mediated metabolism of brominated diphenyl ethers 47, 99, and 153 and identification of their major metabolites[J]. Chemical Research in Toxicology , 22 (11) : 1802–1809. DOI:10.1021/tx900215u |
| [24] | Macaulay L J, Chen A, Rock K D, et al. 2015a. Developmental toxicity of the PBDE metabolite 6-OH-BDE-47 in zebrafish and the potential role of thyroid receptor β[J]. Aquatic Toxicology , 168 : 38–47. DOI:10.1016/j.aquatox.2015.09.007 |
| [25] | Macaulay L J, Bailey J M, Levin E D, et al. 2015b. Persisting effects of a PBDE metabolite, 6-OH-BDE-47, on larval and juvenile zebrafish swimming behavior[J]. Neurotoxicology and Teratology , 52 : 119–126. DOI:10.1016/j.ntt.2015.05.002 |
| [26] | Müller D. 1990. Influence of xenobiotics on drug metabolism and its sensitive detection[J]. Experimental Pathology , 39 (3/4) : 187–194. |
| [27] | 彭金咏, 栾连军.2002. 尿苷二磷酸葡萄糖醛酸转移酶的研究进展[J]. 中国现代应用药学杂志 , 2002, 19 (5) : 373–376. |
| [28] | Pountney A, Filby A L, Thomas G O, et al. 2015. High liver content of polybrominated diphenyl ether (PBDE) in otters (Lutra lutra) from England and Wales[J]. Chemosphere , 118 : 81–86. DOI:10.1016/j.chemosphere.2014.06.051 |
| [29] | Smith G S, Watkins J B, Thompson T N, et al. 1984. Oxidative and conjugative metabolism of xenobiotics by livers of cattle, sheep, swine and rats[J]. Journal of Animal Science , 58 (2) : 386–395. DOI:10.2527/jas1984.582386x |
| [30] | Stapleton H M, Kelly S M, Pei R T, et al. 2009. Metabolism of Polybrominated diphenyl ethers (PBDEs) by human hepatocytes in vitro[J]. Environmental Health Perspectives , 117 (2) : 197–202. DOI:10.1289/ehp.11807 |
| [31] | Sun J T, Liu J Y, Liu Y W, et al. 2013. Hydroxylated and methoxylated polybrominated diphenyl ethers in mollusks from Chinese coastal areas[J]. Chemosphere , 92 (3) : 322–328. DOI:10.1016/j.chemosphere.2013.03.042 |
| [32] | Weijs L, Shaw S D, Berger M L, et al. 2014. Methoxylated PBDEs (MeO-PBDEs), hydroxylated PBDEs (HO-PBDEs) and hydroxylated PCBs (HO-PCBs) in the liver of harbor seals from the northwest Atlantic[J]. Science of the Total Environment , 493 : 606–614. DOI:10.1016/j.scitotenv.2014.06.028 |
| [33] | Wiseman S B, Wan Y, Chang H, et al. 2011. Polybrominated diphenyl ethers and their hydroxylated/methoxylated analogs: Environmental sources, metabolic relationships, and relative toxicities[J]. Marine Pollution Bulletin , 63 (5/12) : 179–88. |
| [34] | 吴若函, 沈梦楠, 张圣虎, 等.2012. 猪肝微粒体体外代谢2,2',4,4'-四溴联苯醚[J]. 环境科学与技术 , 2012, 35 (11) : 50–55. |
| [35] | 谢晴. 2011. 多溴联苯醚及其羟基衍生物的环境光化学转化[D]. 大连: 大连理工大学 http://cdmd.cnki.com.cn/article/cdmd-10141-1012271914.htm |
| [36] | Yamazaki H, Inoue K, Mimura M, et al. 1996. 7-Ethoxycoumarin O-deethylation catalyzed by cytochromes P450 1A2 and 2E1 in human liver microsomes[J]. Biochemical Pharmacology , 51 (3) : 313–319. DOI:10.1016/0006-2952(95)02178-7 |
| [37] | Yu Z Q, Zheng K W, Ren G F, et al. 2010. Identification of hydroxylated octa- and nona-bromodiphenyl ethers in human serum from electronic waste dismantling workers[J]. Environmental Science & Technology , 44 (10) : 3979–3985. |
| [38] | Zhao H X, Zhang G L, Liu S S, et al. 2014. Bioaccumulation and elimination kinetics of hydroxylated polybrominated diphenyl ethers (2'-OH-BDE68 and 4-OH-BDE90) and their distribution pattern in common carp (Cyprinus carpio)[J]. Journal of Hazardous Materials , 274 : 16–23. DOI:10.1016/j.jhazmat.2014.03.058 |
| [39] | Zota A R, Park J S, Wang Y Z, et al. 2011. Polybrominated diphenyl ethers, hydroxylated polybrominated diphenyl ethers, and measures of thyroid function in second trimester pregnant women in California[J]. Environmental Science & Technology , 45 (18) : 7896–7905. |
 2016, Vol. 36
2016, Vol. 36


