2. 中国农业科学院研究生院, 北京 100081;
3. 中国农业科学院农业水资源高效安全利用重点开放实验室, 新乡 453003
2. Graduate University of Chinese Academy of Agricultural Sciences, Beijing 100081;
3. Key Laboratory of High-efficient and Safe Utilization of Agriculture Water Resources of CAAS, Xinxiang 453003
再生水作为一种潜在的水资源,在缓解农业用水供需矛盾、减轻水环境污染方面发挥着重要作用(马栋山等,2015;李昆等,2014).因再生水中元素的多样性及土壤环境的复杂性,有关再生水农田灌溉的环境安全及影响机理目前还不完全清楚(栗岩峰等,2015).土壤微生物能够灵敏地反映出土壤环境的变化(Avidano et al., 2005; Geisseler et al., 2014),而不同施肥措施会影响土壤微生物群落结构和多样性(Zelles et al., 1999; 樊晓刚等,2010).目前,农业上氮素普遍施用过量,而再生水含有丰富的氮、磷等元素,因此,探究长期再生水灌溉下氮肥减量施用土壤微生物群落变化特征及微生态环境变化,对于降低农业面源污染,改善生态环境及提高土壤可持续生产力具有重要意义.同时,再生水长期灌溉下土壤微生物对土壤生态系统功能应激调控机理的相关研究相对较少.因此,本试验通过分析不同氮素水平下再生水灌溉土壤细菌群落组成及结构的变化特征,以期揭示再生水灌溉下对土壤关键环境要素起降解作用的优势菌属,为科学利用再生水资源,实现再生水灌溉农田生态环境安全提供理论依据.
2 材料与方法(Materials and methods) 2.1 试验设计本研究是在5年连续再生水灌溉和氮肥施用试验的基础上进行的,试验地点为中国农业科学院农田灌溉研究所河南新乡农业水土环境野外科学观测试验站塑料温室大棚.试验设4个氮肥处理,氮肥总量分别为270 kg·hm-2(当地施肥习惯)、216 kg·hm-2(氮肥减量20%)、189 kg·hm-2(氮肥减量30%)、135 kg·hm-2(氮肥减量50%).灌水水质设两个水平,即清水(C)、再生水(R),试验小区面积15 m2,试验共计8个处理组,分别记为CN270、CN216、CN189、CN135、RN270、RN216、RN189、RN135,每个处理设置3次重复,24个小区完全随机区组排列.供试番茄为GBS-福石1号,种植密度为4.5万株·hm-2,株距0.3 m,行距0.75 m.灌水方式为地表滴灌,番茄全生育期共灌水6次,再生水总灌溉量为3736 m3·hm-2.
2.2 样品采集及理化指标分析于2014年6月番茄收获盛期按照五点法采集0~20 cm土壤样品,将土壤样品剔除根系残体,混匀迅速装入灭菌的氟乙烯塑料袋中,用冷藏箱4 ℃保存,并迅速带回实验室.样品分两部分处理:一部分风干进行理化指标测定;剩余土壤样品于-20 ℃保存以供土壤微生物群落结构测定.
土壤全氮、全磷和硝态氮采用德国 AA3流动分析仪测定(BRAN LUEBBE);硝态氮采用2 mol·L-1 CaCl2 浸提,水土比为5∶1;土壤有机质测定采用重铬酸钾氧化-容量法;pH测定采用PHS-1型酸度计;土壤可溶性盐测定采用电导法.
再生水水质测定指标包括硝态氮、铵态氮、全氮、全磷和高锰酸盐指数(CODMn)、pH值及电导率(EC),分别采用流动分析仪(德国BRANLUEBBE AA3)和COD分析仪、PHS-1型酸度计、电导仪进行测定.再生水常规水质指标完全符合农田灌溉水质标准(GB 5084—2005)的规定,水质测定结果如表 1所示.
| 表 1 试验中灌溉水水质 Table 1 Irrigation water quality in the experiment |
基因组DNA鉴定:土壤样品总DNA提取采用土壤样品提取试剂盒MO BIO Power Soil DNA Isolation Kit,操作按照使用说明书进行.抽提到的总DNA使用1%琼脂糖凝胶电泳检测,取1 μL样品进行电泳检测,发现各个样品条带明亮清晰,符合实验要求,可以进行下一步实验.
PCR扩增反应体系:2×KAPA HiFi HotStart ReadyMixr 12.5 μL,Forward Primer(10 μmol·L-1)0.5 μL,Reverse Primer(10 μmol·L-1)0.5 μL,Template DNA12.5 ng,补ddH2O至25 μL,16S V3f/V4r引物5′~3′ TACGGRAGGCAGCAG,3′~5′ AGGGTATCTAATCCT.PCR反应参数:95 ℃预变性3 min;95 ℃变性 30 s,60 ℃退火 30 s,72 ℃延伸30 s,循环25次;72℃延伸10 min,产物保存于4 ℃冰箱待用.
取1 μL PCR扩增产物上样,经1%琼脂糖电泳检测,电泳图如图 1所示,其中,1~3、4~6、7~9、10~12、13~15、16~18、19~21、22~24分别为RN270、RN216、RN189、RN135、CN270、CN216、CN189、CN135的细菌基因扩增条带.电泳结果表明,扩增后产物条带明亮、清晰和集中,片断大小位于500~600 bp之间,扩增结果满足实验要求.
 |
| 图 1 不同处理样品PCR扩增产物琼脂糖电泳检测结果 Fig. 1 The agarose electrophoresis results of PCR amplification product of different samples |
Illumina Miseq上机测序后,舍去小于200 bp和大于400 bp的片段,保留长度为200~400 bp的片断.由于细菌相对数量过小的序列(OTU)不会对群落特性产生明显的影响(史青等,2011),故分析中舍去相对数量<1%的OTU.采用SPSS17.0进行方差分析(ANOVA)和相关分析;采用Canoco 4.5软件对环境因子与细菌群落结构进行典范对应分析(Canonical Correspondence Analysis,CCA).
3 结果与分析(Results and analysis) 3.1 再生水灌溉下土壤化学性质的变化不同氮素水平下再生水灌溉土壤的理化指标如表 2所示,相同施氮水平下,N270和N189处理清水灌溉土壤全氮含量显著高于再生水灌溉土壤(p<0.05),其它施氮水平下清水灌溉和再生水灌溉土壤全氮含量无明显差异(p>0.05).N270和N135条件下土壤全磷表现为清水处理高于再生水处理(p<0.05);N270条件下清水灌溉土壤有机质含量显著高于再生水灌溉土壤(p<0.05),其它施氮水平下,清水灌溉和再生水灌溉土壤有机质含量差异不显著(p>0.05).土壤硝态氮和土壤盐分表现为再生水处理高于清水处理.
| 表 2 不同氮素水平下再生水灌溉土壤的理化指标 Table 2 The physical and chemical indicators of soil under reclaimed water irrigation with different nitrogen levels |
如图 2所示,在α=0.03的水平上,两个处理的稀释性曲线均没有完全趋于平缓,随着测序深度的增加,可能还会有新的物种不断被发现.随着测序序列数量的增加,再生水和清水灌溉下细菌的稀释性曲线均逐渐趋于平缓,说明测序序列数量满足实验测序要求(王伏伟等,2015).
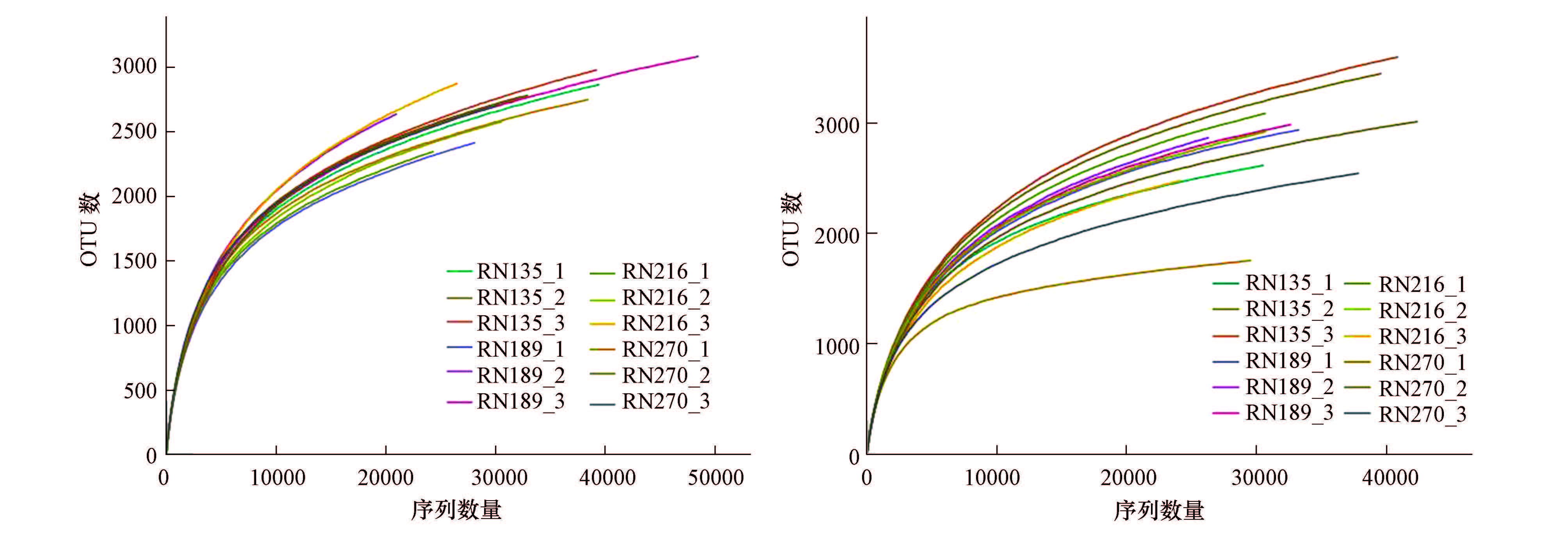 |
| 图 2 不同处理下细菌稀释性曲线(α=0.03) Fig. 2 Rarefaction curves of the different samples |
采用SAS软件对样品OUT进行聚类分析,结果如图 3所示.以相似性0.546为标准,样品可以分为3大类,第Ⅰ类:CN135;第Ⅱ类:CN270;第Ⅲ类:剩余处理(CN216、CN189、RN270、RN216、RN189、RN135).清水灌溉下高氮和低氮处理土壤微生物群落结构发生较明显的变化,再生水灌溉下不同氮肥对土壤微生物群落结构无明显影响.
 |
| 图 3 每个样品在cutoff=0.03情况下得到的细菌群落结构相似度树状图(RN270、 RN216、 RN189、 RN135、CN270、 CN216、 CN189、 CN135分别代表 1~8号样本) Fig. 3 Dendrogram of hierarchical cluster analysis of bacteria from each sample at cutoff=0.03 |
不同氮素水平下再生水灌溉土壤细菌群落多样性结果见表 3.不同施氮水平下再生水灌溉土壤细菌操作分类单元(Operational Taxonomic Unit,OTU)表现为CN135显著高于CN270(p<0.05),但与其它处理间无明显差异(p>0.05).Chao指数与ACE指数、Shannon指数、Simpson指数分别反映物种的丰富度、多样性和优势度(Chao et al., 1984; 赵彤等,2014;张薇等,2007).从表 3可以看出,CN135处理Chao指数、ACE指数和Shannon指数均显著高于CN270(p<0.05),但与其它处理无明显差异;在清水和再生水灌溉条件下,减少氮肥增加了土壤细菌种群丰富度和细菌多样性.再生水灌溉条件下,随氮素施用水平降低,土壤细菌种群优势度呈先增加后降低然后再增加的趋势(RN135>RN216>RN270>RN189);清水灌溉下随氮素施用水平降低,土壤细菌种群优势度呈先降低后增加然后再降低的趋势(CN189>CN270>CN216>CN135).在8个处理中,CN135处理Chao指数、ACE指数与Shannon指数均显著高于其它处理组,而Simpson指数低于其它处理组.Coverage指数在96%以上,在N216、N189、N135处理下Chao指数、ACE指数和多样性指数(Shannon)均表现为清水处理高于再生水处理,在N270处理下,则表现为再生水处理高于清水处理.水质和氮肥处理及水氮互作对ACE、Chao、Shannon和Simpson指数均无显著影响,但氮肥处理显著影响Coverage指数.
| 表 3 不同氮素水平下再生水灌溉对土壤细菌群落多样性的影响 Table 3 The effect of bacterial community diversity on soil under reclaimed water irrigation with different nitrogen level |
分析细菌群落的组成,需对各样本中细菌类群的相对丰富度进行评估.分类分配是基于RDP分类器的结果,每个样本读长的百分比代表每个门的相对丰度.由图 4可知,再生水和清水灌溉下变形菌门(Proteobacteria)是最丰富的门,其次为拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)、放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria),其相对丰度之和在8个处理均占到土壤细菌总量的93%以上,这在一定程度上反映出土壤环境的细菌群落主要组成.在高氮和低氮水平下再生水灌溉对Gemmatimonadetes表现为促进作用,在中氮水平下表现为抑制作用.在相同氮素水平下,与清水灌溉相比较,再生水灌溉促进Actinobacteria的增长,抑制Bacteroidetes的增长.在N270和N216下,再生水灌溉抑制Acidobacteria的增长,N189和N135下,再生水灌溉促进Acidobacteria的增长.
 |
| 图 4 细菌在门水平上的相对丰度 Fig. 4 The relative abundance of bacteria at the class level |
在属的水平上,清水灌溉土壤细菌共48个属,其中41个属是再生水和清水灌溉土壤的共有菌属,其余7个属是清水灌溉土壤的特有菌属,包括鞘氨醇单胞菌属(Sphingomonas)、鞘脂单胞菌科_未分类(Sphingomonadaceae_unclassified)、藤黄单胞菌(Luteimonas)、Ellin6067_未分类(Ellin6067_unclassified)、鞘脂杆菌科_未分类(Sphingobacteriaceae_unclassified)、着色菌科_未分类(Chromatiaceae_unclassified)和色素杆菌属(Chromobacterium)仅发现在清水处理土壤中.再生水灌溉土壤细菌共53个属,其中41个属是再生水灌溉和清水灌溉土壤的共有菌属,其余12个属是再生水灌溉土壤的特有菌属,包括农霉菌属(Agromyces)、红螺菌目_未分类(Rhodospirillales_unclassified)、NB1-i_未分类(NB1-i_unclassified)、堆囊菌亚目(Plesiocystis)、黄杆菌属(Flavobacterium)、气单胞菌属(Arenimonas)、徳沃斯氏菌(Devosia)、海杆菌属(Marinobacter)、0319-7L14_未分类(0319-7L14_unclassified)、交替单胞菌科_未分类(Alteromonadaceae_unclassified)、TM7-1_未分类(TM7-1_unclassified)和周氏菌属(Zhouia).
3.6 基于RDA排序的土壤细菌群落结构变异的环境因子分析RDA 分析前两轴特征值分别为 0.355和0.283,物种与环境因子排序轴的相关系数分别为 0.988和0.997,因此,排序图能够反映土壤细菌种群与环境因子之间的关系,前两轴解释了土壤细菌群落变异程度的63.8%,轴1与TN、TP、OM、NO3-和EC 值呈正相关,与pH呈负相关;而轴2与 OM、TN和pH呈正相关,与TP、 NO3-和EC 值呈负相关.
RDA 排序图 5a中,箭头表示环境因子;箭头连线的长短表示微生物物种分布与环境因子相关性的大小;箭头连线与排序轴夹角的大小表示土壤化学性质与排序轴相关性的大小,夹角越小说明关系越密切;箭头所处的象限表示土壤化学性质与排序轴之间的正负相关性;物种之间的线段距离长短代表了物种间的亲疏关系(张金屯,2004).由图 5可知,Acidobacteria与Proteobacteria分布差异较小,Nitrospirae与Gemmatimonadetes分布差异较小,Firmicutes与Actinobacteria分布差异较小.其中,pH 对Acidobacteria、Bacteroidetes和Proteobacteria的影响较大.由 RDA 排序图 5b可知,再生水灌溉对Nitrospirae、Gemmatimonadetes、Firmicutes、TM7和Actinobacteria的影响较大.清水灌溉对Bacteroidetes的影响明显.
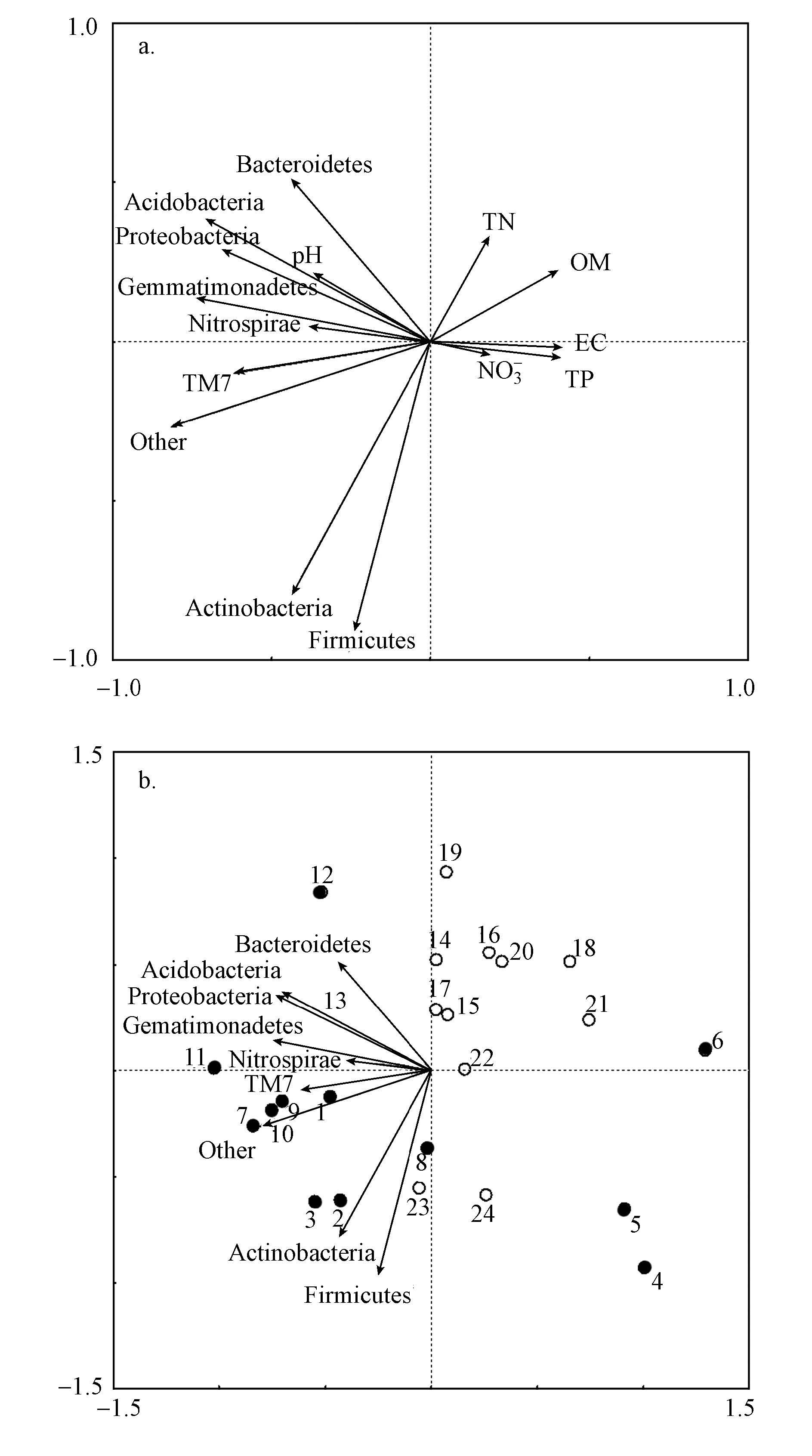 |
| 图 5 微生物群落与环境因子冗余分析(RDA)结果(a.细菌种群与环境因子,b.细菌种群与样方) Fig. 5 Results of redundancy analysis(a.species and environment variables,b. species and samples) |
本试验通过利用Illumina平台Miseq高通量测序研究了不同氮素水平下再生水灌溉土壤的细菌群落组成变化特征,结果表明,再生水灌溉诱导了微生物群落组成的动态响应.
4.1 再生水灌溉对土壤微生物群落结构和多样性的影响再生水灌溉和清水灌溉条件下,氮肥减量施用土壤细菌种群丰富度呈增加趋势.再生水灌溉条件下,氮肥减量施用对细菌的优势度表现为促进作用,而清水灌溉条件下则表现为抑制作用,说明长期合理施肥可以对土壤微生物群落结构和多样性产生促进效应,这与时鹏等(2010)的研究结果相似,亦表明再生水灌溉可以诱导微生物群落组成的动态响应.长期再生水灌溉可促进土壤微生物群落多样性的增加.再生水灌溉下随氮素施用水平的降低,土壤的微生物群落多样性先降低后增加,即RN270,RN135>RN189>RN216.土壤微生物多样性并不是随着氮肥的减少而减少,亦不是再生水高氮处理的土壤微生物的多样性一定是最高,而是有一个最佳组合的效果.
土壤微生物群落结构对再生水的响应不仅是基于个别微生物种群对再生水敏感性的反映,同时也是水质和施肥互作下种群相互作用的群体性的反映,这种变化主要由优势类群的多度变化及部分非优势类群的有无来体现(郭逍宇等,2006).再生水灌溉和清水灌溉下变形菌门(Proteobacteria)均是最丰富的门,作为细菌中最大的一个门,有研究报道其中许多类群可以进行固氮作用,并且能够适应各种复杂的环境(Liu et al., 2014;罗培宇等,2014),因此,水质和施肥互作下环境条件的变化对其分布和相对丰度影响不明显.
4.2 再生水灌溉对土壤微生物动力学特征的影响再生水灌溉在高氮和低氮水平下对Gemmatimonadetes表现为促进作用,在中氮水平下表现为抑制作用.在相同氮素水平下,与清水灌溉相比较,再生水灌溉促进Actinobacteria的增长,抑制Bacteroidetes的增长.Bacteroidetes是有机碳的主要矿化者(Guo et al., 2015),Gemmatimonadetes具有强烈的反硝化功能,Actinobacteria会参与土壤中难分解的有机质的分解,同化无机氮,分解碳水化合物等(Hani et al., 1995;许光辉等,1984).总体而言,再生水灌溉促进了土壤氮素降解相关的微生物的增长和繁殖.再生水灌溉下,减少氮素施用,可以刺激微生物对碳源、氮源的反应(侯晓杰等,2007),改善土壤微生物群落结构,这为再生水灌溉下水肥的合理利用提供了基础参考.长期再生水灌溉及施肥对农田土壤细菌群落结构的影响机制还需进一步深入研究.
4.3 土壤化学性状和土壤微生物之间的相关性分析土壤优势细菌类群相对丰度与土壤理化性质有一定的相关性(李聪等,2013).不同氮素水平下再生水灌溉土壤细菌群落主要受到pH的影响.研究表明,长期再生水灌溉和氮肥施用处理下土壤pH是影响土壤微生物群落组成和活性的主要因素(Geisseler et al., 2014;Li et al., 2015;张嘉超等,2010).本研究中,pH对Acidobacteria的影响明显,这与Jones等(2009)的研究结果相似.再生水灌溉对Nitrospirae、Gemmatimonadetes、Firmicutes、TM7和Actinobacteria的影响较大,而清水灌溉对Bacteroidetes的影响明显.Nitrospirae是硝化反应的主要参与者,Gemmatimonadetes具有很强的脱氮功能,其相对丰度随着氮素水平的增加而降低,Bacteroidetes是有机碳的主要矿化者(Guo et al., 2015),Proteobacteria是主要的致病菌群.Actinobacteria具有降解碳氢化合物的功能,在再生水灌溉后植株的腐解过程中起到重要作用,同时在自然界氮素循环中也有一定的作用(Lauber et al., 2008;Vesela et al., 2010).相同氮素水平下,再生水灌溉提高了Actinobacteria的相对丰度,这可能与再生水富含氮素、有机物有关.再生水中含有丰富的氮、磷等营养物质,COD活性较高,因此,长期再生水灌溉可促进土壤碳氮的矿化,以及微生物的繁殖,但长期灌溉下致病菌的威胁仍不容忽视.
5 结论(Conclusions)1)再生水灌溉条件下,氮肥减量施用增加了细菌的优势度和丰富度.在高氮和低氮水平下再生水灌溉对Gemmatimonadetes表现为促进作用,在中氮水平下表现为抑制作用.在相同氮素水平下,与清水灌溉相比较,再生水灌溉促进了Actinobacteria的增长,抑制了Bacteroidetes的增长.
2 )再生水灌溉对Nitrospirae、Gemmatimonadetes、Firmicutes、TM7和Actinobacteria的影响较大,清水灌溉对Bacteroidetes的影响明显.在属的水平上,清水灌溉土壤细菌共48个属,其中41个属是再生水和清水灌溉土壤的共有菌属,其余7个属是清水灌溉土壤的特有菌属;再生水灌溉土壤细菌共53个属,其中12个属是再生水灌溉土壤的特有菌属.
3)长期再生水灌溉可促进土壤微生物群落多样性的增加.再生水灌溉下随氮素水平的降低,土壤的微生物群落多样性先降低后增加,即RN270,RN135>RN189>RN216.土壤优势细菌类群相对丰度与土壤理化性质有一定的相关性.
| [${referVo.labelOrder}] | Avidano L, Gamalero E, Cossa G P, et al. 2005. Characterization of soil health in an Italian polluted site by using microorganisms as bioindicator[J]. Applied Soil Ecology, 30(1) : 21–33. DOI:10.1016/j.apsoil.2005.01.003 |
| [${referVo.labelOrder}] | Chao A N. 1984. Non-parametric estimation of the number of classes in a population[J]. Scandinavian Journal of Statistics, 11(4) : 265–270. |
| [${referVo.labelOrder}] | 樊晓刚, 金轲, 李兆君, 等. 2010. 不同施肥和耕作制度下土壤微生物多样性研究进展[J]. 植物营养与肥料学报, 2010, 16(3) : 744–751. |
| [${referVo.labelOrder}] | Geisseler D, Scow K M. 2014. Long-term effects of mineral fertilizers on soil microorganisms-A review[J]. Soil Biology and Biochemistry, 75 : 54–63. DOI:10.1016/j.soilbio.2014.03.023 |
| [${referVo.labelOrder}] | 郭逍宇, 董志, 宫辉力. 2006. 再生水灌溉对草坪土壤微生物群落的影响[J]. 中国环境科学, 2006, 26(4) : 482–485. |
| [${referVo.labelOrder}] | Guo Y H, Gong H L, Guo X Y. 2015. Rhizosphere bacterial community of Typha angustifolia L[J]. and water quality in a river wetland supplied with reclaimed water[J]. Applied Microbiology and Biotechnology, 99(6) : 2883–2893. |
| [${referVo.labelOrder}] | Hani H, Siegenthaler A, Candinas T. 1995. Soil effects due to sewage sludge application in agriculture[J]. Fertilizer Research, 43(1/3) : 149–156. |
| [${referVo.labelOrder}] | 侯晓杰, 汪景宽, 李世朋. 2007. 不同施肥处理与地膜覆盖对土壤微生物群落功能多样性的影响[J]. 生态学报, 2007, 27(2) : 655–661. |
| [${referVo.labelOrder}] | Jones R T, Robeson M S, Lauber C L, et al. 2009. A comprehensive survey of soil acidobacterial diversity using pyrosequencing and clone library analyses[J]. ISME Journal, 3(4) : 442–453. DOI:10.1038/ismej.2008.127 |
| [${referVo.labelOrder}] | Lauber C L, Strickland M S, Bradford M A, et al. 2008. The influence of soil properties on the structure of bacterial and fungal communities across land-use types[J]. Soil Biology and Biochemistry, 40(9) : 2407–2415. DOI:10.1016/j.soilbio.2008.05.021 |
| [${referVo.labelOrder}] | 李聪.2013.不同林型对林下土壤理化性质与土壤细菌多样性的影响[D].哈尔滨:东北林业大学.45-47 |
| [${referVo.labelOrder}] | Li J, Cooper J M, Lin Z A, et al. 2015. Soil microbial community structure and function are significantly affected by long-term organic and mineral fertilization regimes in the North China Plain[J]. Applied Soil Ecology, 96 : 75–87. DOI:10.1016/j.apsoil.2015.07.001 |
| [${referVo.labelOrder}] | 李昆, 魏源送, 王健行, 等. 2014. 再生水回用的标准比较与技术经济分析[J]. 环境科学学报, 2014, 34(7) : 1635–1653. |
| [${referVo.labelOrder}] | 栗岩峰, 李久生, 赵伟霞, 等. 2015. 再生水高效安全灌溉关键理论与技术研究进展[J]. 农业机械学报, 2015, 46(6) : 102–110. |
| [${referVo.labelOrder}] | Liu J J, Sui Y Y, Yu Z H, et al. 2014. High throughput sequencing analysis of biogeographical distribution of bacterial communities in the black soils of northeast China[J]. Soil Biology and Biochemistry, 70 : 113–122. DOI:10.1016/j.soilbio.2013.12.014 |
| [${referVo.labelOrder}] | 罗培宇.2014.轮作条件下长期施肥对棕壤微生物群落的影响[D].沈阳:沈阳农业大学.46 |
| [${referVo.labelOrder}] | 马栋山, 郭羿宏, 张琼琼, 等. 2015. 再生水补水对河道底泥细菌群落结构影响研究[J]. 生态学报, 2015, 35(20) : 1–10. |
| [${referVo.labelOrder}] | 时鹏, 高强, 王淑平, 等. 2010. 玉米连作及其施肥对土壤微生物群落功能多样性的影响[J]. 生态学报, 2010, 30(22) : 6173–6182. |
| [${referVo.labelOrder}] | 史青, 柏耀辉, 李宗逊, 等. 2011. 应用T-RFLP技术分析滇池污染水体的细菌群落[J]. 环境科学, 2011, 32(6) : 1786–1792. |
| [${referVo.labelOrder}] | 王伏伟, 王晓波, 李金才, 等. 2015. 施肥及秸秆还田对砂姜黑土细菌群落的影响[J]. 中国生态农业科学, 2015, 23(10) : 1302–1311. |
| [${referVo.labelOrder}] | Vesela A B, Franc M, Pelantova H, et al. 2010. Erratum to:Hydrolysis of benzonitrile herbicides by soil actinobacteria and metabolite toxicity[J]. Biodegradation, 21 : 761–770. DOI:10.1007/s10532-010-9341-4 |
| [${referVo.labelOrder}] | 许光辉, 郑洪元, 张德生, 等. 1984. 长白山北坡自然保护区森林土壤生物生态分布及其生化特性的研究[J]. 生态学报, 1984, 4(3) : 207–223. |
| [${referVo.labelOrder}] | Zelles L. 1999. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterization of microbial communities in soil:a review[J]. Biology and fertility of Soils, 29 : 111–129. DOI:10.1007/s003740050533 |
| [${referVo.labelOrder}] | 张嘉超, 曾光明, 喻曼, 等. 2010. 农业废物好氧堆肥过程因子对细菌群落结构的影响[J]. 环境科学学报, 2010, 30(5) : 1002–1010. |
| [${referVo.labelOrder}] | 张金屯. 2004. 数量生态学[M]. 北京: 科学出版社 : 157–162. |
| [${referVo.labelOrder}] | 张薇, 胡跃高, 黄国和, 等. 2007. 西北黄土高原柠条种植区土壤微生物多样性分析[J]. 微生物学报, 2007, 47(5) : 751–756. |
| [${referVo.labelOrder}] | 赵彤.2014.宁南山区植被恢复工程对土壤原位矿化中微生物种类和多样性的影响[D].杨陵:西北农林科技大学.68-69 |
 2017, Vol. 37
2017, Vol. 37


