水华蓝藻的细胞破裂可向水中释放多种毒素,其中,微囊藻毒素(Microcystins,MCs)是出现频率最高、分布较广、毒性较大的一类藻毒素(刘海燕等,2007).微囊藻毒素是由7个氨基酸残基组成的环状多肽,由于多肽中两种可变氨基酸的组成不同,使得微囊藻毒素具有多种异构体.目前存在最普遍、含量最多的是MC-LR、MC-RR、MC-YR(L、R、Y分别代表亮氨酸、精氨酸和酪氨酸)(Park et al., 2001).其中,MC-LR的毒性最强,MC-YR次之,MC-RR最弱.由于微囊藻毒素是环状七肽,结构稳定,在300 ℃高温下能够维持很长时间不分解,传统的水处理工艺很难将其从水中去除(韩志国等,2001).目前,微生物降解由于具有成本低、安全性高、利于生态修复等优点,已成为环境中MCs自然归趋的主要途径之一(胡越,2012).
迄今为止,已经分离鉴定出的微囊藻毒素降解菌有鞘氨醇单胞菌属(Sphingomonas)、铜绿假单胞菌属(Pseudomonas aeruginosa)、伯克霍尔德氏菌属(Burkholderia)、库特氏菌属(Kurthia)、假单胞菌属(Pseudomonas)、博德特氏菌属(Bordetella)、寡养单胞菌属(Stenotrophomonas)等(Jones et al.1991; Takenaka et al., 1997; Yang et al.2014; Chen et al.2010;王菲风等,2014;钟升等,2010;刘凯英等,2012).但是,目前藻毒素降解菌种的开发还很有限.本实验室近年来一直进行藻毒素降解菌的筛选研究工作(刘晓文等,2010;李现尧等,2010),推测在自然水体中必然还存在着许多未筛选出来的毒素降解新菌.基于此,本文经研究发现了一株新属即短波单胞菌属的细菌能够降解微囊藻毒素,对其降解效果进行研究,以丰富微囊藻毒素降解菌菌种,并且通过PCR技术在菌株中扩增出降解微囊藻毒素的关键基因mlrA.
2 材料与方法(Materials and methods) 2.1 材料 2.1.1 主要试剂MC-LR 标准品(分子式:C49H74N10O12,分子量:995.2)购自台湾藻研有限公司,纯度≥95%.实验菌种为缺陷短波单胞菌(Brevundimonas diminuta),实验室编号Q3,由本课题组从太湖水华蓝藻中筛选驯化得到,对MC-LR有良好的降解效果.
2.1.2 培养基无机盐培养基、牛肉膏蛋白胨培养基等引自文献(谢维等,2012).
2.2 实验方法 2.2.1 微囊藻毒素的提取太湖打捞的腐烂蓝藻经冷冻干燥机冻干后加入适量去离子水,将其pH值调到4.0,沸水浴(Metcalf et al., 2000)20 min后于10000 r·min-1下离心15 min,取上清液,调节其pH值到8.0;然后在10000 r·min-1下离心10 min,过滤,过滤后的液体经固相萃取柱净化(金丽娜等,2002)后用冷冻干燥机将其冻干成粉,溶于去离子水,用0.22 μm滤膜过滤除菌后,-20 ℃保存,用于本实验中降解菌的初步筛选与培养.
2.2.2 微囊藻毒素的分析测定采用美国Beacon公司生产的微囊藻毒素检测试剂盒,测定MC-LR含量(检测限为0.1~2 μg·L-1),检测方法为ELISA法.
2.2.3 微囊藻毒素降解菌的筛选方法将太湖腐烂的蓝藻用适量蒸馏水稀释,振荡混匀后静置1 h,吸取上层清液接种于以MC-LR为唯一碳源和氮源的无机盐液体培养基中(MC-LR浓度为1 mg·L-1),30 ℃、220 r·min-1恒温振荡避光培养至培养基浑浊,逐步增大培养基中微囊藻毒素的浓度(依次为5、10和20 mg·L-1),如此连续富集培养3次.富集后的菌液稀释涂布后培养,挑取不同的菌落,并多次划线纯化得到纯菌株.
2.2.4 菌株鉴定形态学和生理生化鉴定:将分离纯化的菌株进行革兰氏染色,通过光学显微镜观察菌体形态,并根据《伯杰氏细菌鉴定手册》和《常见细菌鉴定手册》(东秀珠等,2001)进行生理生化实验,对菌株进行初步鉴定.
16S rRNA 鉴定:用Biomiga细菌基因组提取试剂盒(型号为GD1422-01)提取菌株基因组DNA.采用细菌16S rRNA基因通用引物(27F:5′-AGAGTTTGATCATGGCTCAG-3′,1492R:5′-ACGGTTACCTTGTTACGACTT-3′)扩增Q3的16S rRNA 基因.PCR反应条件为:94.0 ℃预变性5 min;94.0 ℃变性30 s,55.0 ℃退火30 s,72.0 ℃延伸45 s,共35个循环;72.0 ℃延伸10 min.将PCR扩增产物进行1%的琼脂糖凝胶电泳后,由上海生工生物工程技术服务有限公司进行测序,将所测序列在GenBank中进行Blast比对,并构建系统发育树.
2.2.5 微囊藻毒素的生物降解将Q3接种至牛肉膏蛋白胨液体培养基中预培养至对数期,5000 r·min-1离心10 min,去上清,菌体用0.1 mol·L-1 PBS洗涤3次,无机盐培养基重悬菌体并将其吸光度调至1.0.以10%的接种量接种到含MC-LR的无机盐培养基中,30 ℃、220 r·min-1恒温振荡避光培养,空白对照只含MC-LR不加细菌.对照组及实验组均3个平行.每天定时取样用酶标仪测定600 nm下的吸光度及MC-LR的浓度,所得结果用来绘制MC-LR的降解曲线和生长曲线.
2.2.6 Q3菌中微囊藻毒素降解基因mlrA 的扩增Q3菌中mlrA基因的扩增采用Saito等(1996)报道的引物MF:5′-GACCCGATG TTCAAGATACT-3′和MR:5′-CTCCTCCCACAAATCAGGAC-3′.PCR反应条件为:94.0 ℃预变性5 min;94.0 ℃变性30 s,55.0 ℃退火30 s,72.0 ℃延伸45 s,共40个循环;72.0 ℃延伸8 min.产物经1%的琼脂糖凝胶电泳分离,EB染色,紫外检测.
3 结果与讨论(Results and discussion) 3.1 MCs降解菌的分离及鉴定 3.1.1 菌株的形态特征从太湖腐烂蓝藻中分离出1株MCs降解菌,编号为Q3.在牛肉膏蛋白胨固体培养基上培养后,菌株的菌落照片和光镜照片见图 1.由图可见,该菌株菌落白色,圆形,不透明,中间凸起,边缘光滑,易挑起;细胞呈短杆状,大小为0.5 μm×(0.1~0.3)μm,革兰氏染色呈阴性.
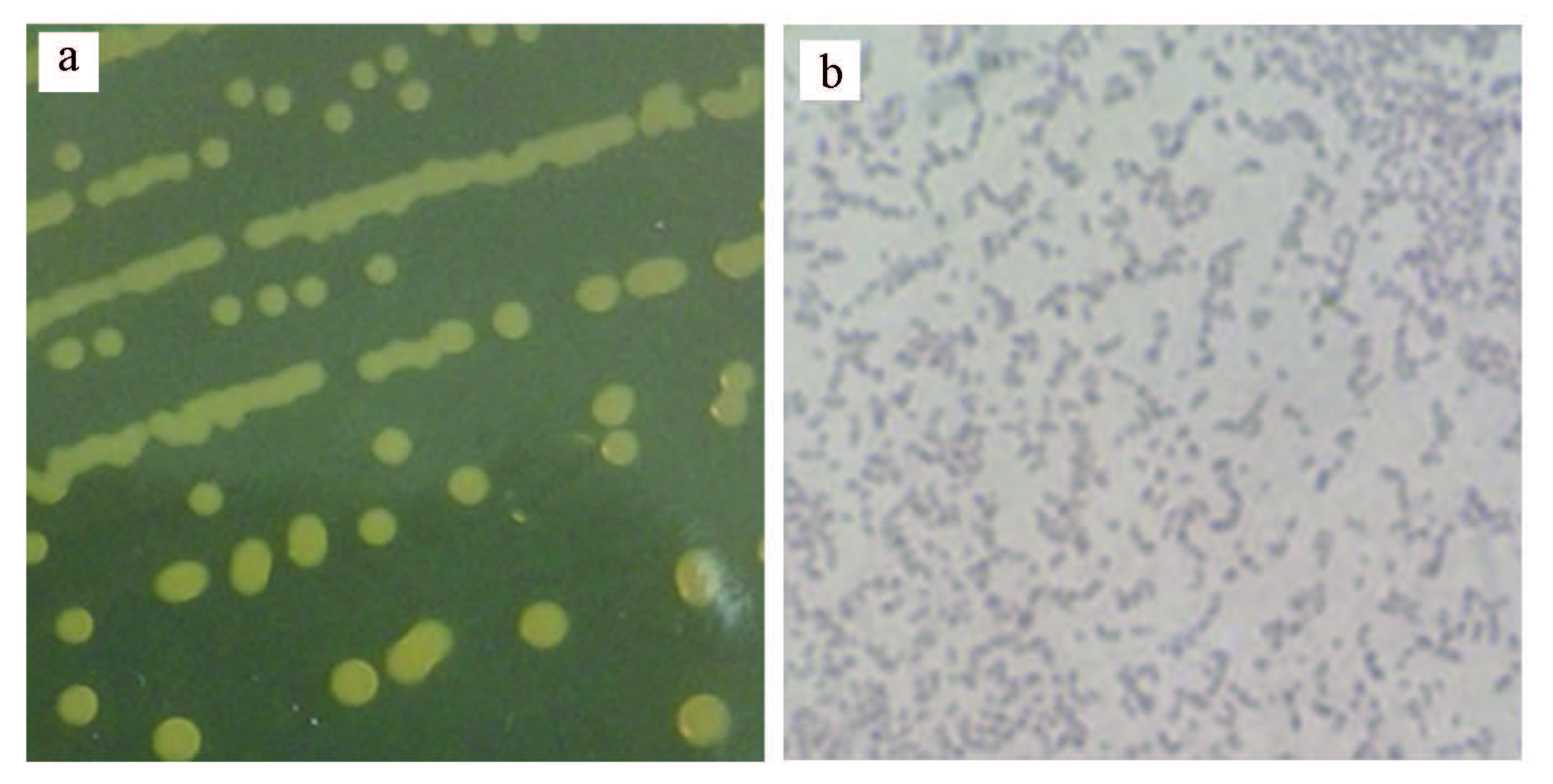 |
| 图 1 菌株的菌落图片(a)和光镜图片(b,×1000) Fig. 1 Colonies(a)and light micrograph(b,×1000)of the strain |
菌株Q3的生理生化试验结果如表 1所示.参照《常见细菌系统鉴定手册》,菌株的形态特征和生理生化试验结果显示,该菌株与短波单胞菌(Brevundimonas)主要形态特征和生理生化特征一致.
| 表 1 菌株Q3的生理生化实验结果 Table 1 Results of physiological-biochemical tests for bacterial strain Q3 |
菌株Q3的16S rRNA基因序列的长度为1370 bp,GenBank登录号为KU685402.将该序列在NCBI上进行Blast对比,发现与短波单胞菌属(Brevundimonas)有99%的同源性.选取短波单胞菌属的24个菌株,以不粘柄菌(Asticcacaulis excentricus)的2个菌株作为外组群,用PAUP 4.0b4a软件以最大简约法(Maximum Parsimony,MP)和最大似然法(Maximum Likelihood,ML)构建系统发育树.
基于16S rRNA序列构建的MP树的一致性指数(CI)为0.525,保留性指数(RI)为0.7458.如图 2a所示,MP树显示,筛选菌株Q3与缺陷短波单胞菌(Brevundimonas diminuta)位于同一分支,自展值(BP值)为80%,提示该菌株与缺陷短波单胞菌亲缘关系最近.如图 2b所示,基于16S rRNA序列构建的ML树显示,菌株Q3与缺陷短波单胞菌(Brevundimonas diminuta)位于同一分支,BP值为63%.MP树和ML树的结果一致,结合形态与生理生化试验结果,将该菌株鉴定为缺陷短波单胞菌(Brevundimonas diminuta).
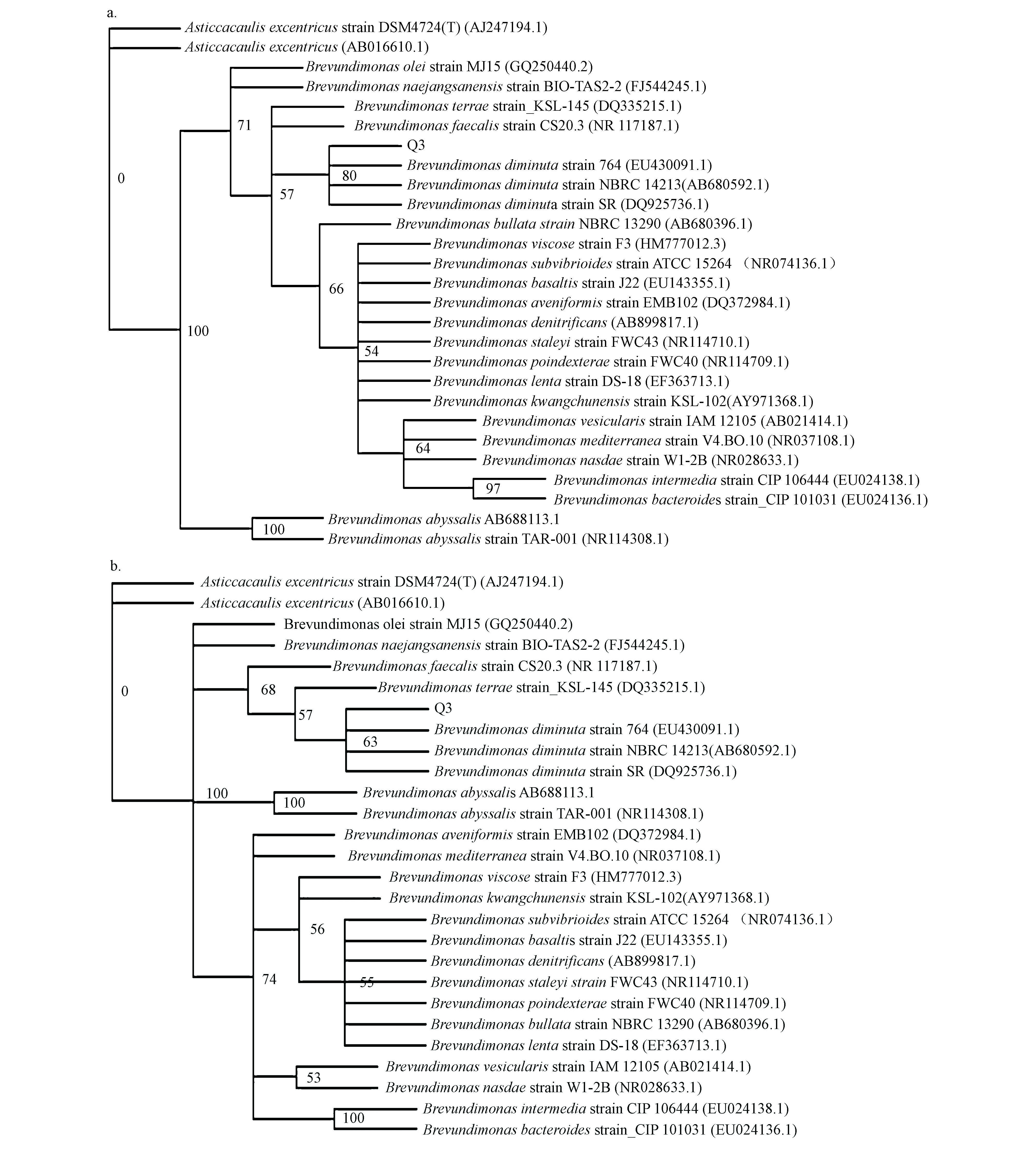 |
| 图 2 基于16S rRNA基因序列的MP(a)和ML(b)树 Fig. 2 Phylogenetic tree of MP(a)and ML(b)based on 16S rRNA sequence |
图 3为Q3菌对MC-LR的降解过程及其生长曲线.从图中可以看出,第1 d时,由于培养液中营养充足,菌株生长较快,无迟滞期,很快达到对数生长期.并且随着生物量的增大,菌株Q3对MC-LR的降解效果也逐渐增强,降解率达到43.8%,此时是该菌株对MC-LR降解能力最大的时期.第2 d时菌株仍继续生长,生物量达到最大值,Q3菌对MC-LR的降解较为迅速,降解率达到40.7%,与第1 d基本持平.第3~7 d,细菌生长趋于稳定,Q3菌对MC-LR的降解微弱.至第7 d时,已将初始浓度为0.96 mg·L-1的MC-LR降解为0.37 mg·L-1,降解效率达61.5%.由此可以看出,MC-LR的降解与菌株Q3的生长几乎是同步的,并呈正相关(p<0.05).随着MC-LR的降解,Q3菌的生物量也明显增加,说明该菌可以利用MC-LR作为唯一氮源和碳源生长.本实验结果与刘凯英等(2012)、游狄杰等(2014)、Valeria等(2006)的研究结果一致,说明MCs的降解过程与MCs降解菌的生长有关(游狄杰等,2014).
 |
| 图 3 Q3菌对MC-LR的降解 Fig. 3 Biodegradation of MC-LR by strain Q3 |
目前,NCBI上已有的缺陷短波单胞菌都没有对其降解MCs的能力进行报道,已发表的文献中也没有对此研究.因此,本实验室首次确定了缺陷短波单胞菌能够降解MC-LR.
3.3 菌株Q3降解基因mlrA的扩增结果本文利用Saito等(1996)报道的引物MF-MR对Q3进行mlrA基因的扩增,经优化扩增方法和条件后得到大小约为800 bp的PCR产物(图 4).将产物经琼脂糖凝胶电泳割胶回收后克隆至PMD19-T Vector,测序后得到片段大小为806 bp(GenBank接收号为KU685403).将序列在NCBI上比对,发现与MCs降解菌的A基因高度相似,达98%.确认扩增出的序列为缺陷短波单胞菌中的mlrA基因cDNA部分序列.
到目前为止,已检测到含有mlrA基因的微囊藻毒素降解菌大部分集中在α-变形菌纲,且多数集中在鞘脂单胞菌科.然而,在非鞘脂单胞菌科的微囊藻毒素降解菌中,却很少检测到mlrA 基因(Manage et al.2009).缺陷短波单胞菌虽属于α-变形菌纲,但并非是鞘脂单胞菌科,而本研究却在缺陷短波单胞菌中成功扩增出了降解基因mlrA的同源序列.这一结果预示着在非鞘脂单胞菌科的微囊藻毒素降解菌中可能也存在着mlrA基因,但可能由于扩增的条件、方法不成熟,或者mlrA基因在不同菌种中被扩增出的难易程度不同,导致了多数MCs降解菌未能成功扩增出该基因.
因此,推测Q3菌降解MC-LR的途径可能与Bourne等(1996; 2001)提出的类似,首先mlrA基因编码的MlrA酶将环状MC-LR中连接Adda与Arg的肽键断开,变成线型MC-LR;mlrB基因编码的MlrB酶将线性MC-LR降解产生四肽;mlrC基因编码的MlrC酶能够使四肽变为氨基酸Adda;而mlrD基因编码的MlrD酶可能负责编码一种寡肽转运蛋白酶,这种转运蛋白酶可能负责转运MC-LR及其降解产物.
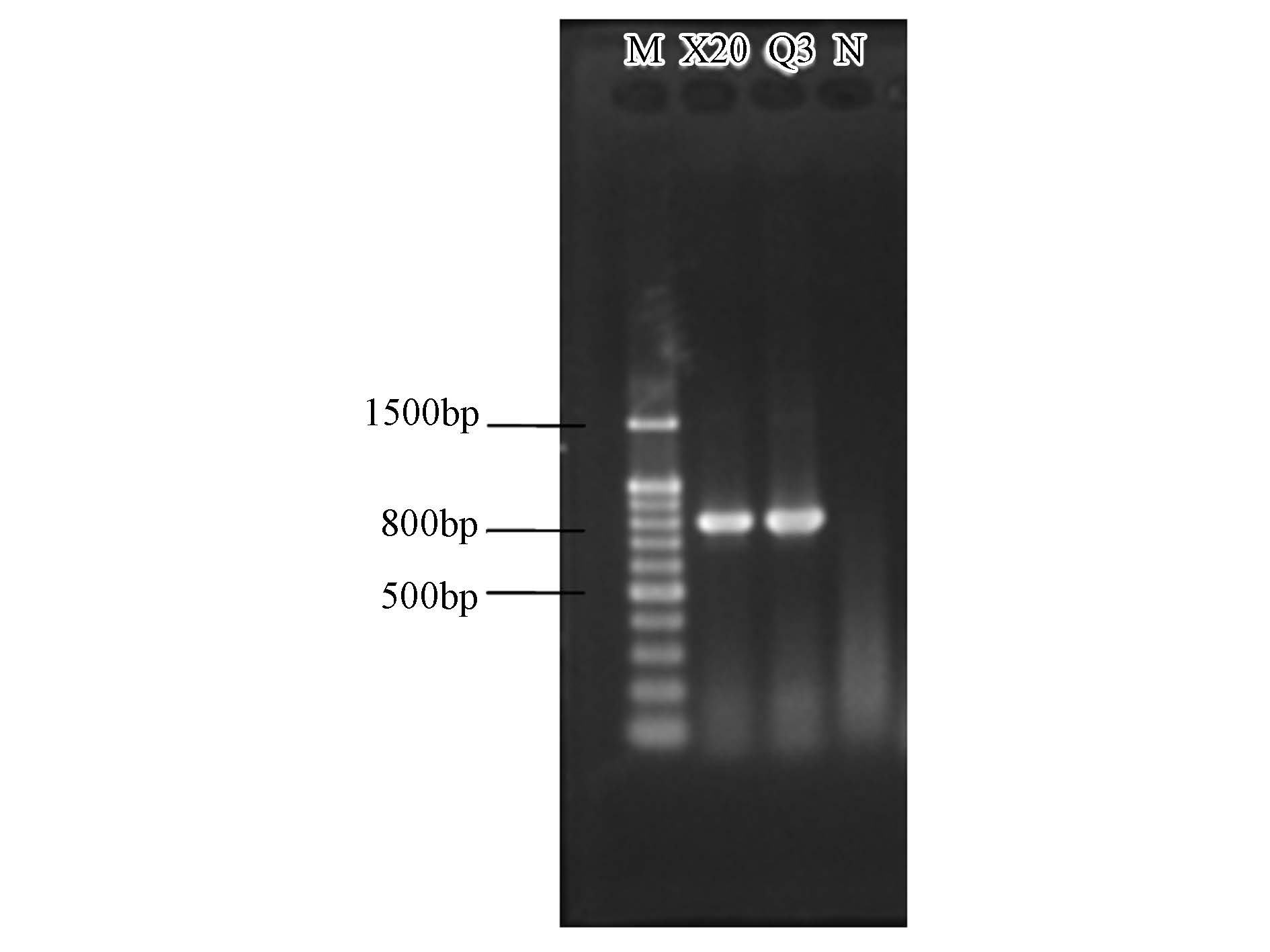 |
| 图 4 菌株Q3 mlrA基因扩增结果(M: Marker,X20: 阳性对照(武汉理工大学陈晓国教授赠送),N: 阴性对照) Fig. 4 PCR products of mlrA gene from stain Q3 |
1)本研究从太湖腐烂水华蓝藻中筛选出来一株缺陷短波单胞菌(Brevundimonas diminuta)Q3,GenBank接收号为KU685402.同时,对其降解MC-LR的能力进行了研究,发现在实验条件下Q3菌降解MC-LR无迟滞期,前2 d降解效率最高,分别达43.8%、40.7%,7 d内降解率可达61.5%,预示着在自然环境中可能有不同种类MCs降解菌的存在.
2)在缺陷短波单胞菌中成功扩增到了藻毒素降解基因mlrA,由于mlrA基因编码的MlrA酶是降解第一步开环过程中的关键酶,该酶的活性直接关系到藻毒素的降解程度,因此,推测Q3菌可能与已报道的Sphingomonas sp.ACM-3962菌具有相同的降解机制.
| [${referVo.labelOrder}] | Bourne D G, Jones G J, Blakeley R L, et al. 1996. Enzymatic pathway for the bacterial degradation of the cyanobacterial cyclic peptide toxin microcystin-LR[J]. Applied and Environmental Microbiology, 62(11) : 4086–4094. |
| [${referVo.labelOrder}] | Bourne D G, Riddles P, Jones G J, et al. 2001. Characterisation of a gene cluster involved in bacterial degradation of the cyanobacterial toxin microcystin-LR[J]. Environmental Toxicology, 16(6) : 523–534. DOI:10.1002/(ISSN)1522-7278 |
| [${referVo.labelOrder}] | Chen J, Hu L B, Zhou W, et al. 2010. Degradation of microcystin-LR and RR by a Stenotrophomonas sp[J]. strain EMS isolated from Lake Taihu China[J].International Journal of Molecular Sciences, 11(3) : 896–911. |
| [${referVo.labelOrder}] | 东秀珠, 蔡妙英. 2001. 常见细菌系统鉴定手册[M]. : 245–256. |
| [${referVo.labelOrder}] | 胡越.2012.X20菌的鉴定及其对MC-LR的酶学降解途径研究[D].武汉:武汉理工大学 |
| [${referVo.labelOrder}] | 韩志国, 武宝轩, 解生, 等. 2001. 淡水水体中的蓝藻毒素研究进展[J]. 暨南大学学报, 2001, 22(3) : 129–135. |
| [${referVo.labelOrder}] | Jones G J, Bourne D G, Robert L, et al. 1994. Degradation of the cyanobacterial hepatotoxin microcystin by aquatic bacteria[J]. Natural Toxins, 2(4) : 228–235. DOI:10.1002/(ISSN)1056-9014 |
| [${referVo.labelOrder}] | 金丽娜, 张维昊, 郑利, 等. 2002. 滇池水环境中微囊藻毒素的生物降解[J]. 中国环境科学, 2002, 22(2) : 189–192. |
| [${referVo.labelOrder}] | 刘海燕, 宦海琳, 汪育文, 等. 2007. 微囊藻毒素降解菌S3的分子鉴定及其降解毒素的研究[J]. 环境科学学报, 2007, 27(7) : 1145–1150. |
| [${referVo.labelOrder}] | 刘凯英, 薛罡, 程起跃, 等. 2012. 微囊藻毒素-RR高效降解菌的分离鉴定及降解特性[J]. 环境科学与技术, 2012, 35(4) : 22–26. |
| [${referVo.labelOrder}] | 李现尧, 刘晓文, 史全良. 2010. 一株微囊藻毒素降解辅助菌的分离和鉴定[J]. 微生物学通报, 2010, 37(3) : 473–478. |
| [${referVo.labelOrder}] | 刘晓文, 李现尧, 史全良. 2010. 一株微囊藻毒素降解菌的分离与鉴定[J]. 环境工程学报, 2010, 4(9) : 2023–2028. |
| [${referVo.labelOrder}] | Metcalf J S, Codd G. 2000. Microwave oven and boiling waterbath extraction of hepatotoxins from cyanobacterial cells[J]. FEMS Microbiol Lett, 184(2) : 241–246. DOI:10.1111/fml.2000.184.issue-2 |
| [${referVo.labelOrder}] | Manage P M, Edwards C, Singh B K, et al. 2009. Isolation and identification of novel microcystin-degrading bacteria[J]. Applied and Environmental Microbiology, 75(21) : 6924–6928. DOI:10.1128/AEM.01928-09 |
| [${referVo.labelOrder}] | Park H,Namikoshi M,Brittain S M,et al.2001.[d-Leu1] microcystin-LR,A new microcystin isolated from waterbloom in a Canadian Prairie lake[J].Toxicon,39(6):855-862 |
| [${referVo.labelOrder}] | Saito T, Okano K, Park H D, et al. 2003. Detection and sequencing of the microcystin LR-degrading gene, mlrA, from new bacteria isolated from Japanese lakes[J]. FEMS Microbiology Letters, 229(2) : 271–276. DOI:10.1016/S0378-1097(03)00847-4 |
| [${referVo.labelOrder}] | Takenaka S, Watanabe M F. 1997. Microcystin LR degradation by Pseudomonas aeruginosa alkaline protease[J]. Chemosphere, 34(4) : 749–757. DOI:10.1016/S0045-6535(97)00002-7 |
| [${referVo.labelOrder}] | Valeria A M, Ricardo E J, Stephan P, et al. 2006. Degradation of microcystin-RR by Sphingomonas sp.CBA4 isolated from San Roque reservoir (Córdoba-Argentina)[J]. Biodegradation, 17(5) : 447–455. DOI:10.1007/s10532-005-9015-9 |
| [${referVo.labelOrder}] | 王菲凤, 吴衍, 高滢, 等. 2014. 越南伯克霍尔德菌降解水中微囊藻毒素-LR[J]. 环境工程学报, 2014, 8(9) : 3837–3842. |
| [${referVo.labelOrder}] | 谢维, 吴涓, 李玉成, 等. 2012. 一株微囊藻毒素降解菌的筛选及鉴定[J]. 生物学杂志, 2012, 29(6) : 35–38. |
| [${referVo.labelOrder}] | Yang F, Zhou Y, Sun R, et al. 2014. Biodegradation of microcystin-LR and-RR by a novel microcystin-degrading bacterium isolated from Lake Taihu[J]. Biodegradation, 25(3) : 447–457. DOI:10.1007/s10532-013-9673-y |
| [${referVo.labelOrder}] | 游狄杰, 陈晓国, 等. 2014. 微囊藻毒素降解菌Paucibacter sp[J]. CH菌的分离鉴定及其降解特性[J].环境科学, 2014, 35(1) : 313–318. |
| [${referVo.labelOrder}] | 钟升, 吴涓, 王光云. 2010. 微囊藻毒素降解菌的筛选、鉴定及其降解活性研究[J]. 生物学杂志, 2010, 27(6) : 57–64. |
 2017, Vol. 37
2017, Vol. 37


