在经济和科技的高速发展下, 人们在享受富裕与便捷同时, 也承受着环境污染带来的危害, 大气污染已成为危害人类健康的主要因素(安爱萍等, 2005).山西省是我国以煤炭为主要能源的基地之一, 据统计, 山西省火电厂产生的氮氧化物排放量占山西省工业行业氮氧化物排放量的68%(山西省人民政府办公厅, 2015).氮氧化物(NOx)是大气中常见的污染物, 其主要种类为NO和NO2, NO在空气中易氧化成NO2.NO2主要来自煤、石油、天然气等燃料燃烧, 在高温燃烧的条件下, 燃料中含氮化合物与空气中的氧反应生成NO2.NO2对上呼吸道和眼结膜的刺激作用比较小, 主要是作用于深部呼吸道、细支气管以及肺泡.当NO2经由上呼吸道到达肺泡并溶于肺泡表面的液体中时, 会形成亚硝酸和硝酸及其盐类, 对肺组织产生强烈刺激作用和腐蚀作用, 从而引起肺部损伤(孟紫强, 2010).国内外一些流行病学研究提示NO2与肺癌发病率具有一定的相关性(Al-Ahmadi et al., 2013;Hystad et al., 2013;Masri et al., 2005;陆应昶等, 2003;冯丹等, 2001;贺琴等, 2007), 如Al-Ahmadi等在沙特阿拉伯调查发现, NO2与肺癌和乳腺癌的发病率有很高的相关系数, 冯丹等在乌鲁木齐市运用灰色关联度分析发现肺癌死亡率与NOx的关系密切.但到目前为止, NO2暴露肺癌风险的探讨多停留在“相关性”水平上, 对“暴露-效应”的研究仍不清楚, 尤其缺乏暴露标志水平的实验证据, 而对防护机制的研究更是鲜见报道.
上皮细胞间质转化(epithelial-mesenchymal transitions, EMT)存在于多种生理病理过程中, 指一些因素使得细胞逐渐失去其极性、细胞间紧密连接及黏附连接, 获得了侵袭性和游走迁移的能力, 并产生大量细胞外基质成分, 从而阻碍细胞凋亡, 变为形态和特性与间质细胞类似的细胞(张华东, 2011).文献报道, EMT在肿瘤起始、侵袭、转移和发展中扮演着重要的角色, 阐明调控肿瘤细胞发生EMT过程的分子机制, 已成为肿瘤学研究的热点问题之一(黄晓丹, 2010).单酰基甘油酯酶(MAGL)作为丝氨酸水解酶超家族成员之一, 有研究表示MAGL 在人侵袭性肿瘤细胞和原发性肿瘤细胞中高表达, 促进肿瘤的发生(Nomura et al., 2011).MAGL 抑制剂具有多重保护作用, 如神经保护、抗炎、镇痛、抗癌和抗药物依赖作用(Viso et al., 2008).为此, 本实验通过建立小鼠NO2动态吸入暴露模型, 考察EMT标志蛋白E-钙粘蛋白(E-cadherin)和α平滑肌肌动蛋白(α-SMA)表达水平的变化, 并在此基础上探讨MAGL抑制在此过程中的保护作用.
2 材料与方法(Materials and methods) 2.1 实验材料与仪器成年健康C57BL/6J小鼠, 雄性, 体重为20~25 g, 由北京维通利华公司提供;NO2标准气体:纯度为99.99%, 由北京北分瑞利分析仪器公司提供;MAGL抑制剂JZL-184(No.13158) 、前列腺素E2(PGE2) 酶联免疫试剂盒(Item Number 514010) 及硝酸盐/亚硝酸盐荧光检测试剂盒(Item Number 780051) 购自Cayman 公司;SDS-PAGE电泳及组织匀浆裂解液的相关试剂购自Amresco公司;牛血清蛋白(BSA)、考马斯亮蓝(G-250) 购自Sigma公司;一抗E-cadherin(bs-10009R), α-SMA(bs-10196R)购自北京博奥森公司;一抗β-actin购自Cell Signaling Technology公司;二抗IRDye 800CW Goat anti-Rabbit IgG(H+L)购自LI-COR公司;高速低温离心机(Sigma);低温冰箱(Thermo Scientific Forma);酶标仪(Bio-rad Model 550) ;FIX系列有毒有害气体检测报警仪(深圳万安迪科技有限公司).
2.2 实验动物分组与处理实验分为两部分, 第一部分将18只小鼠随机分为1个阴性对照组和2个NO2暴露组(NO2浓度分别为2.5、5.0 mg·m-3), 每组6只.2个暴露组每天在NO2动态熏气箱中暴露6 h, 连续4周.染毒期间, NO2暴露组及对照组均不饮水和进食, 其余时间自由饮水和进食.最后一次染毒24 h后断头处死小鼠, 取出肺组织, 迅速将其置于液氮中冷冻18 h, 再将其转移至-80 ℃冰箱保存.
第二部分将18只小鼠随机分为1个阴性对照组、1个NO2暴露组和1个JZL-184阻断组, 每组6只.暴露组和阻断组用浓度为5.0 mg·m-3的NO2对小鼠进行动态吸入染毒, 每天6 h, 连续4周.暴露期间阻断组小鼠每隔2d腹腔注射8.0 mg·kg-1的JZL-184, 同时对照组和暴露组小鼠注射8.0 mg·kg-1的溶剂对照(15% 二甲基亚砜、4.25% 吐温80、4.25% 聚乙二醇400、76.5% 生理盐水(Costola-de-Souza et al., 2013)).其余处理与第一部分相同.
2.3 硝酸盐/亚硝酸盐含量测定硝酸盐/亚硝酸盐荧光检测试剂盒购买自Cayman公司(Item Number 780051) .NO2进入体内的最终产物为硝酸盐(NO3-)、亚硝酸盐(NO2-), NO3-和NO2-的相对比例是变化的, 所以不能准确测量, 因此最好的测量指标是NO3-和NO2-的总和.试剂盒测定总NO3-/NO2-的步骤分为两步, 第一步利用硝酸还原酶将硝酸盐还原为亚硝酸盐, 第二步加入DAN, 在酸性条件下使亚硝酸盐转化为荧光性萘三唑(1(H)-naphthotriazole), 然后加入NaOH, 在碱性条件下提高荧光产物的检测强度, 该化合物的荧光强度决定了NO2-的浓度.具体操作如下:准备试剂, 将0.1 g小鼠肺组织加入800 mL PBS(pH=7.4) 进行匀浆, 将匀浆液倒入1.5 mL EP管, 在10000 g, 4 ℃条件下离心20 min.用注射器取上清, 使其通过0.2 μm的非硝酸纤维膜过滤至新EP管中, 取10 μL滤液测定NO3-和NO2-含量.按照步骤加入药品, 用标样做出硝酸盐和亚硝酸盐的标准曲线(硝酸盐的标准曲线用于测定NO3-和NO2-的总浓度, 亚硝酸盐的标准曲线只用于测定亚硝酸盐).根据公式分别计算出样品中NO3-和NO2-的含量.
2.4 Western blot方法测定目的蛋白的表达 2.4.1 蛋白提取制备裂解液(含1% Nonidet P40、2.5 μg·mL-1 aprotinin、50 μg·mL-1 leupeptin、5 μg·mL-1 pepstatin、1 mmol·L-1 EDTA、8 mmol·L-1 EGTA、25 μmol·L-1 PMSF、8 mmol·L-1 DDT以及25 μg·mL-1 Trypsin inhibitor), 取0.1 g肺组织放入800 μL裂解液中进行匀浆, 将匀浆液倒入EP管, 静置30 min后放入离心机, 在13000 r·min-1, 4 ℃条件下离心15 min, 取上清.用BSA做标准曲线, 考马斯亮蓝法检测样品蛋白含量.95 ℃金属浴煮样5 min, 使蛋白变性, 瞬离后进行分装, 置于-20 ℃保存.
2.4.2 蛋白检测配制浓度为10%的分离胶, 取20 μg蛋白样品进行SDS-PAGE电泳, 电泳完毕将胶上蛋白转移至硝酸纤维膜上, 对膜进行封闭1.5 h(封闭液为3%的BSA).加入稀释后的一抗(稀释比为1∶200) , 4 ℃摇床过夜.用PBST(0.1% Tween-20) 洗膜3次, 每次10 min, 加入稀释后的二抗(稀释比为1∶5000) 避光孵育1.5 h, PBST洗膜3次, 每次10 min, 最后PBS洗膜5 min.用双色红外激光成像系统odyssey(LI-COR, 美国)进行扫膜, 得到目的蛋白条带, 用专业图像分析软件(Image Pro Plus 6.0) 对其进行光密度分析.目的蛋白光密度与内参(β-actin)光密度比值即为最终结果.
2.5 前列腺素E2(PGE2) 表达测定PGE2酶联免疫试剂盒购买自Cayman公司(Item Number 514010) , 试剂盒将PGE2-乙酰胆碱酯酶(AChE)作为PGE2探针, 与样品中PGE2竞争PGE2单克隆抗体来测定小鼠样品中PGE2的表达量.向预先包被了羊抗小鼠IgG蛋白的酶标孔中加入PGE2一抗、PGE2探针、样品或标准品, 温育;清洗掉所有未结合的试剂后, 加入Ellman′s试剂(含AChE底物), 颜色的深浅与样品中PGE2的浓度呈负相关.具体操作如下:准备试剂、标准品、标液, 配制均质缓冲液(0.1 mol·L-1磷酸盐、1 mmol·L-1 EDTA、10 μmol·L-1 吲哚美辛、pH=7.4) , 取0.1 g小鼠肺组织, 加入1 mL均质缓冲液进行匀浆, 将匀浆液倒入EP管, 在8000 g、4 ℃条件下离心10 min, 取上清液.按说明书顺序加入EIA buffer、PGE2标液、样品、PGE2 AchE Tracer、PGE2一抗, 用塑料膜封板, 在4 ℃孵育18 h.准备Ellman′s试剂(现用现配), 拿出酶标板, 用wash buffer清洗5次, 加入Ellman′s试剂, 用塑料膜封板, 黑暗中摇动90 min.在405~420 nm的波长下检测其吸光度, 再进行计算, 得出样品中PGE2表达量.
2.6 数据分析方法用SPSS 11.5统计软件对实验数据进行统计分析, 用单因素方差分析检验处理间的差异显著性(*p<0.05, **p<0.01, ***p<0.001) , 最后用Origin 8作图.
3 结果(Results) 3.1 NO2吸入对肺组织硝酸盐和亚硝酸盐水平的影响图 1结果表明, NO2吸入暴露会造成使小鼠肺组织中NO3-和NO2-含量显著升高, 且这一作用呈现浓度依赖性变化.其中, NO2-的水平在NO2浓度为5.0 mg·m-3时出现统计学变化, NO3-的水平在NO2浓度为2.5和5.0 mg·m-3时均出现统计学变化(p<0.01) .
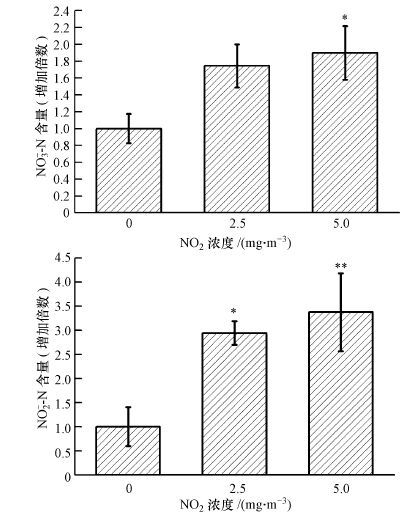 |
| 图 1 不同浓度NO2暴露对小鼠肺组织中NO3-和NO2-含量的影响(n=6) Fig. 1 Effects of NO2 exposure on NO3- and NO2- content in mouse lungs(n=6) |
如图 2所示, 随着NO2浓度的升高, 肺组织中α-SMA表达呈浓度依赖性升高.NO2浓度为2.5 mg·m-3时, α-SMA的表达较对照组出现统计学变化(p<0.01) .而随着NO2浓度的升高, 肺组织中E-cadherin表达量呈浓度依赖性降低, 并在NO2浓度为5.0 mg·m-3时, E-cadherin的表达量较对照组显著降低(p<0.05) .
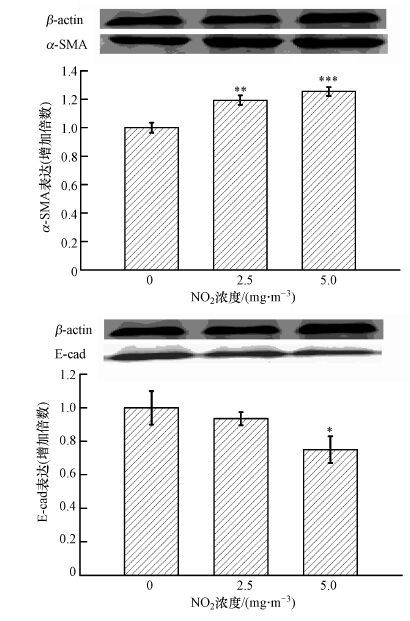 |
| 图 2 不同浓度NO2暴露对小鼠肺组织中α-SMA和E-cadherin表达的影响(n=6) Fig. 2 Effects of NO2 exposure on α-SMA and E-cadherin expression in mouse lungs(n=6) |
MAGL 在动物体内参与花生四烯酰甘油(2-AG)的水解过程, 2-AG在MAGL的作用下会水解为花生四烯酸(AA)和甘油, 而前列腺素E2(PGE2) 是AA的最终代谢产物(Mishra et al., 2014).MAGL 抑制剂具有多重保护作用, 如神经保护、抗炎、镇痛、抗癌和抗药物依赖作用(Viso et al., 2008).JZL-184是一种新合成的具有高效选择性的MAGL抑制剂, 该抑制剂可减少中枢神经系统和外周组织包括肺中2-AG的水解, 并且在一些啮齿动物炎症模型中也显示出高效的免疫抑制力和抗炎特性(Costola-de-Souza et al., 2013).为此, 我们考察了JZL-184预处理对NO2吸入暴露后小鼠肺组织中PGE2水平的影响.图 3结果显示, NO2暴露组肺组织PGE2含量较对照组显著上升(p<0.05) , 而JZL-184显著抑制NO2吸入诱导的PGE2含量增加(p<0.01) .
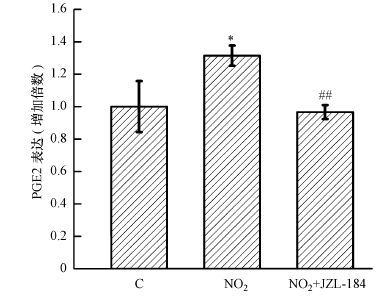 |
| 图 3 MAGL抑制对NO2吸入诱导小鼠肺组织PGE2水平变化的影响(n=6) Fig. 3 PGE2 contents in lungs of mice exposed to different treatment conditions(n=6) |
如图 4所示, NO2暴露组肺组织中α-SMA表达较对照组显著升高(p<0.01) , 而MAGL抑制显著降低吸入造成的α-SMA表达增加(p<0.05) .NO2暴露组肺组织中E-cadherin表达较对照组显著降低(p<0.05) , 而MAGL抑制显著增加吸入造成的E-cadherin表达较少.
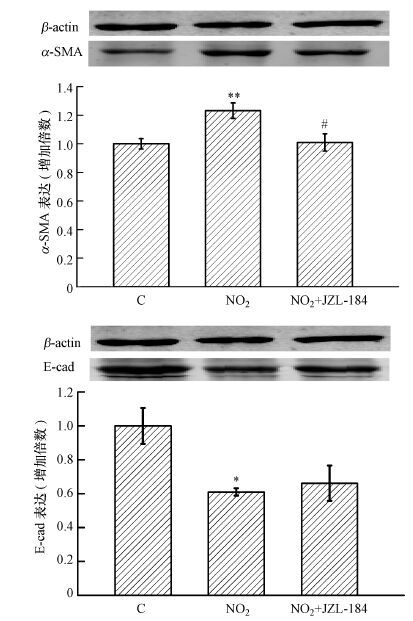 |
| 图 4 MAGL抑制对NO2吸入诱导小鼠肺组织α-SMA和E-cadherin表达变化的影响(n=6) (注:与对照组比较, *p<0.05, **p<0.01;与暴露组比较, #p<0.05) Fig. 4 Effects of MAGL inhibition on α-SMA and E-cadherin expression in lungs of mice exposed to NO2(n=6) |
国内外流行病学研究提示NO2吸入暴露与肺癌发生发展的相关性(Al-Ahmadi et al., 2013;Hystad et al., 2013;Masri et al., 2005;陆应昶等, 2003;冯丹等, 2001;贺琴等, 2007), 但“暴露-效应”关系的确定还是缺乏证据, 特别是分子标志物水平的实验证据.而文献报道, 在肿瘤的恶性病变过程中, EMT起着重要的作用.其中, E-cadherin和α-SMA是EMT的标志蛋白.E-cadherin是存在于人和动物上皮细胞中的一种粘附分子, 它在维持上皮细胞形态和结构的完整性中扮演着重要的作用.当E-cadherin的表达下调或缺失时, 就会导致上皮细胞之间的粘附力降低, 使细胞分散从而向外周组织浸润, 继而发生肿瘤的侵袭和转移(Miyoshi et al., 2004).α-SMA作为真核细胞的一种细胞骨架蛋白, 决定细胞骨架的形成, 影响细胞形态(Saito et al., 2012) .当NO2经由上呼吸道到达肺泡并溶于肺泡表面的液体中时, 会形成亚硝酸和硝酸及其盐类, 对肺组织产生强烈刺激作用和腐蚀作用, 从而引起肺部损伤(孟紫强, 2010).我们的研究发现, 小鼠吸入暴露后肺组织中NO3-和NO2-含量显著升高.同时, E-cadherin表达随NO2浓度的增加而显著降低, α-SMA表达随NO2浓度的增加而显著升高, 提示NO2吸入暴露可通过其体内衍生物诱导小鼠肺组织EMT过程.
MAGL是丝氨酸水解酶超家族成员之一, 不仅可协同激素敏感性脂解酶将储存的三酰甘油分解为脂肪酸和甘油, 也可将2-AG水解成AA和甘油, 调节内源性大麻素系统(成丽琴, 2014), 而PGE2是AA的最终代谢产物(Mishra et al., 2014).Nomura等研究显示, MAGL 是上皮间质转化和肿瘤干细胞的基因表达标记的一部分, MAGL 在人侵袭性肿瘤细胞和原发性肿瘤细胞中高表达, 促进肿瘤的发生(Nomura et al., 2011);Viso A等发现MAGL 抑制剂具有多重保护作用, 如神经保护、抗炎、镇痛、抗癌和抗药物依赖作用(Viso et al., 2008);Nomura等研究发现, MAGL在侵袭性人类肿瘤细胞和原发性肿瘤中高表达, 它可调节富含促癌信号脂质的脂肪酸网络, 促进肿瘤转移、侵袭、存活以及在体内生长, 且癌细胞可以操作MAGL产生一系列致癌脂质信号(Nomura et al., 2010);Daniel等研究发现MAGL可以通过分解2-AG来促进癌细胞的增殖和侵袭(Daniel et al., 2010);Hu等做了相关研究发现MAGL的表达与EMT的标志蛋白相关, 如E-cadherin、Vimentin和Snail, 且MAGL在强转移性的鼻咽癌细胞中高表达, 他们发现MAGL通过EMT途径促进了鼻炎癌细胞的转移(Hu et al., 2014).由此推断, MAGL抑制可维持2-AG水平, 减少其经MAGL催化的下游产物AA、PGE2等的产生, 因而对与之相关的EMT过程具有保护作用.我们的结果表明, NO2吸入暴露会使小鼠体内PGE2含量升高, 而加入MAGL抑制剂JZL-184后可降低体内PGE2的含量;同时, MAGL抑制可显著改变NO2吸入诱导的小鼠肺组织中α-SMA表达量升高和E-cadherin 表达降低.这一发现提示, MAGL抑制降低PGE2水平对NO2吸入诱导小鼠肺EMT的发生具有保护作用.
5 结论(Conclusions)NO2吸入暴露可造成小鼠肺组织硝酸盐和亚硝酸盐含量增加, 同时显著上调α-SMA、下调E-cadherin表达, 诱导EMT过程;而MAGL抑制可缓解吸入暴露造成的PGE2含量升高, 进而维持α-SMA和E-cadherin正常水平, 对NO2诱导的EMT过程具有保护作用.
| [1] | Al-Ahmadi K, Al-Zahrani A. 2013. NO2 and cancer incidence in Saudi Arabia[J]. Internation Journal Environmental Research and Public Health , 10 (11) : 5844–5862. DOI:10.3390/ijerph10115844 |
| [2] | 安爱萍, 郭琳芳, 董蕙青.2005. 我国大气污染及气象因素对人体健康影响的研究进展[J]. 环境与职业医学 , 2005, 22 (03) : 279–282. |
| [3] | Costola-De-Souza C, Ribeiro A, Ferraz-De-Paula V, et al. 2013. Monoacylglycerol lipase (MAGL) inhibition attenuates acute lung injury in mice[J]. PLoS One , 8 (10) : 1–15. |
| [4] | 成丽琴.2014. 单酰基甘油酯酶促肿瘤侵袭的研究进展[J]. 科技世界 , 2014 (20) : 5–5. |
| [5] | Daniel N, Long J Z, Niessen S, et al. 2010. Monoacylglycerol lipase regulates a fatty acid network that promotes cancer pathogenesis[J]. Cell , 140 (1) : 49–61. DOI:10.1016/j.cell.2009.11.027 |
| [6] | 冯丹, 徐桂永, 赵连伟, 等.2001. 肺癌死亡率与大气污染关系的灰色关联分析[J]. 数理医药学杂志 , 2001, 14 (4) : 364–365. |
| [7] | Hu W R, Lian Y F, Peng L X, et al. 2014. Monoacylglycerol lipase promotes metastases in nasopharyngeal carcinoma[J]. International Journal of Clinical and Experimental Pathology , 7 (7) : 3704–3713. |
| [8] | Hystad P, Demers P A, Johnson K C, et al. 2013. Long-term residential exposure to air pollution and lung cancer risk[J]. Epidemiology , 24 (5) : 762–772. DOI:10.1097/EDE.0b013e3182949ae7 |
| [9] | 贺琴, 吴森林, 许芬, 等.2007. 武汉市空气污染与肺癌潜在减寿年数的关系[J]. 中华流行病学杂志 , 2007, 28 (12) : 1175–1178. |
| [10] | 黄晓丹, 季国忠.2010. 上皮-间质转化在肿瘤侵袭转移中作用的研究进展[J]. 医学研究生学报 , 2010, 23 (3) : 319–322. |
| [11] | 陆应昶, 胡晓抒, 赵金扣, 等.2003. 江苏省肺癌死亡和大气污染情况地理信息系统的相关性[J]. 中国肿瘤 , 2003, 12 (7) : 374–377. |
| [12] | Masri F A, Comhair S A, Koeck T, et al. 2005. Abnormalities in nitric oxide and its derivatives in lung cancer[J]. American Journal of Respiratory and Critical Care Medicine , 172 (5) : 597–605. DOI:10.1164/rccm.200411-1523OC |
| [13] | Mishra N N, Ali S, Shukla P K. 2014. Arachidonic acid affects biofilm formation and PGE2 level in Candida albicans and non-albicans species in presence of subinhibitory concentration of fluconazole and terbinafine[J]. Brazilian Journal of Infectious Diseases , 18 (3) : 287–293. DOI:10.1016/j.bjid.2013.09.006 |
| [14] | Miyoshi A, Kitajima Y, Sumi K, et al. 2004. Snail and SIP1 increase cancer invasion by upregulating MMP family in hepatocellular carcinoma cells[J]. British Journal of Cancer , 90 (6) : 1265–1273. DOI:10.1038/sj.bjc.6601685 |
| [15] | 孟紫强. 2010. 环境毒理学基础[M]. 北京: 高等教育出版社: 160 -162. |
| [16] | Nomura D K, Lombardi D P, Chang J W, et al. 2011. Monoacylglycerol lipase exerts dual control over endocannabinoid and fatty acid pathways to support prostate cancer. [J]. Chem Biol, 18(7): 846-856 |
| [17] | Nomura D K, Long J Z, Niessen S, et al. 2010. Monoacylglycerol lipase regulates a fatty acid network that promotes cancer pathogenesis[J]. Cell , 140 (1) : 49–61. DOI:10.1016/j.cell.2009.11.027 |
| [18] | Saito O, Saito T, Asakura S, et al. 2012. The effects of tamoxifen on bone turnover markers and bone mineral density in women on maintenance hemodialysis[J]. Clinical and Experimental Nephrology , 15 (1) : 126–131. |
| [19] | 山西省人民政府办公厅. 2011. 山西省第一次全国污染源普查公报[OL]. 2011-01-24, http://www.shanxigov.cn/n16/n1116/n1458/n1518/n34105/14609089.html |
| [20] | Viso A, Cisneros J A, Ortega-Gutiérrez S. 2008. The medicinal chemistry of agents targeting monoacylglycerol lipase[J]. Current Topics in Medicinal Chemistry , 8 (3) : 231–246. DOI:10.2174/156802608783498032 |
| [21] | 张华东.2011. 上皮-间质转化研究进展[J]. 中国现代医学杂志 , 2011, 21 (31) : 3907–3911. |
 2016, Vol. 36
2016, Vol. 36


