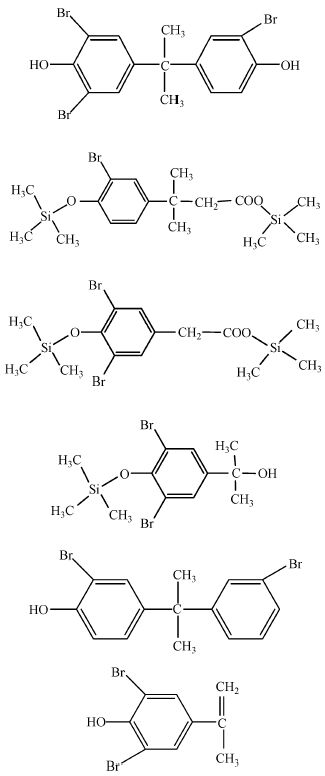
随着电子科技的发展,电子电器废弃物已经成为全球范围内亟待解决的环境问题.溴代阻燃剂(BFRs)作为广泛应用于电子产品中的高效阻燃化合物,其对环境的危害也日益加深(Morris et al.,2004;Stoker et al.,2005; Canton et al.,2005;曹洋等,2010).四溴双酚A(Tetrabromobisphenol A,CAS 79-94-7,TBBPA)是一种应用最广泛的溴代阻燃剂,其主要添加于环氧、聚碳酸酯、聚酯、酚醛等聚合高分子化合物中(http: www.bsef.com,2006).废弃电子产品中的四溴双酚A常通过挥发、浸出、光氧化、化学氧化、微生物降解和沉积物表面吸附等过程发生迁移和转化,散发在水体、沉积物、土壤和大气等环境体系中,甚至在生物体内已被检出(WHO,1995;Saint et al.,2004;Peterman et al.,2000;Sellstrom et al.,1995;Hayama et al.,2004;Hagmar et al.,2000).近年来研究发现,四溴双酚A是持久性、生物累积性和具潜在毒性的化合物,长期接触会危害大脑和骨骼发育,而且含四溴双酚A的废弃物在被焚化处理时,会释放出极易致癌化合物溴化二英和溴化呋喃.目前已经能分离筛选出以TBBPA为唯一碳源和能源生长的微生物.比如,钱艳园等从污染土壤、电子废弃物等中分离获得对四溴双酚A有良好降解性的假单胞菌属、红球菌属、苍白杆菌(Ochrobactrum sp)、鞘氨醇单胞菌(Sphingomonas sp)、丛毛单胞菌(钱艳园等,2012;Fan et al.,2014;An et al.,2011;Kim et al.,2007;Peng et al.,2012)等,这些菌株在好氧降解条件下,均可将四溴双酚A转化成低溴产物,或在异丙基处断开中间产物,使其毒性降低.实验室前期研究发现了铜绿假单胞菌NY3并构建了NY3菌alkB1基因和alkB2基因的单、双突变株,发现这2个基因在NY3菌代谢石油烃的过程有重要意义.万博等(2016)研究发现铜绿假单胞菌NY3也能降解四溴双酚A,为了了解这2个基因在铜绿假单胞菌NY3降解四溴双酚A中是否起特定作用,本论文研究了野生NY3菌株及其相应突变株NB1D(敲除alkB1基因)、NB2D(敲除alkB2基因),NB12DD(同时敲除alkB1和alkB2基因)等4株突变菌降解四溴双酚A的特性.
2 材料与方法(Materials and methods) 2.1 实验材料 2.1.1 菌种来源实验室保存的铜绿假单胞菌NY3(Nie et al.,2010)及陕西省研究所研究保存的NY3突变株NB1D、NB2D及NB12DD.
2.1.2 试剂和培养基① 四溴双酚A(TBBPA)储备液:8.00 g·L-1四溴双酚A氢氧化钠水溶液.
② 无机盐培养基:1.65 g(NH4)2SO4、2 mL微量元素(2.5 g FeSO4·7H2O、0.1 g ZnSO4·7H2O、0.2 g MnCl2·4H2O、0.024 g CoCl2·6H2O、0.024 g NiCl2·6H2O、0.017 g CuCl2·2H2O、0.109 g Na2MoO4·2H2O、0.062 g H3BO3、5 mL 12.1 mol·L-1 HCl,溶于1000 mL蒸馏水)、0.5 mL 1 mol·L-1 MgSO4·7H2O溶液、0.1 mL 1 mol·L-1 CaCl2·2H2O、15 mL磷酸盐缓冲液,调节pH至7.5,用蒸馏水定容至1000 mL,121 ℃高压水蒸气灭菌30 min,备用.
③ 牛肉膏液体培养基(g·L-1):牛肉膏3 g、蛋白胨10 g、Na2SO4 5 g、溶于1000 mL蒸馏水中,调节pH至7.5,121 ℃高压水蒸汽灭菌30 min,备用.
2.2 实验方法 2.2.1 NY3种子液的制备无菌操作条件下,将活化的NY3、NB1D、NB2D、NB12DD菌株分别用已灭菌的接种环勾划少许,接种于牛肉膏蛋白胨液体培养基中,30 ℃,150 r·min-1恒温,好氧振荡培养24 h,备用.
2.2.2 NY3及其突变菌株以不同质量浓度四溴双酚A为碳源生长特性无菌操作条件下,在已灭菌的无机盐培养基中,加入四溴双酚A的标准溶液,使无机盐培养基中四溴双酚A质量浓度分别为20和60 mg·L-1,将pH调至8,以10% 的接种量分别接入铜绿假单胞菌NY3及其突变菌株NB1D、NB2D、NB12DD,于(30±1)℃,150 r·min-1振荡培养,每4 h取样,测定待测样的OD600 nm,并用气相色谱测定不同时段四溴双酚A剩余量,计算其降解率.
2.2.3 不同共代谢碳源存在下铜绿假单胞菌NY3及其突变菌株代谢四溴双酚A的生长降解特性无菌操作条件下,分别加入1.8 g·L-1葡糖糖、1mL乳酸钠、0.75 mL乙醇,添入无机盐培养基中,并加入四溴双酚A,使其质量浓度为60 mg·L-1,将pH调至8,接种量10%,于(30±1)℃,150 r·min-1振荡培养,每4 h取样,测定待测样的OD600 nm,培养6 d后,测定培养基中Br-含量,并用气相色谱测定四溴双酚A剩余量,计算其降解率.
2.2.4 最佳共代谢碳源乳酸钠存在下NY3及其突变菌株代谢四溴双酚A中间产物的区别无菌条件下,分别加1mL乳酸钠溶液于100 mL无机盐中,并加入四溴双酚A使其质量浓度为60 mg·L-1,接种量10%,于(30±1)℃,150 r·min-1振荡培养,培养96 h,取发酵液100 mL,先在8000 r·min-1条件下离心10 min去除菌体,取其上清液,在上清液中加入25 mL三氯甲烷进行萃取,收集下层有机相,并对上清液运用相同方法进行萃取,共进行3次,将3次收集的有机相旋转蒸发浓缩为0.5 mL,得到待测样品.
2.2.5 菌株菌细胞生长量的测定取待测的菌悬液样品,以未接种的无机盐培养基作参比调零,在吸收波长为600 nm处测得的数值表示为菌细胞的生长量,用OD600 nm表示.
2.2.6 阴离子色谱法测定培养液中Br-含量20 mL降解液或生长液,离心,弃去菌体,三氯甲烷进行萃取上清液,重复3次,水相经过SPE-C18进行固相萃取后,用以测定Br-含量.有机相用以测定四溴双酚A剩余量.
2.2.7 气相色谱测定四溴双酚A含量的方法和色谱条件用安捷伦6890N气相色谱仪(FID检测器)测定TBBPA和降解后剩余TBBPA的组分.色谱条件:5% phenyl Methyl Siloxane HP-5毛细管气相色谱柱(30 m×320 μm×0.25 μm).载气:99.99%高纯氮气.进样口温度300 ℃,分流比30∶1(体积比).检测器温度:300 ℃,氢气流量40 mL·min-1,空气流量450 mL·min-1.程序升温,初始50 ℃,保留1 min,再以25 ℃·min-1升温至100 ℃,保留1 min,最后以5 ℃·min-1升温至300 ℃保留16 min.进样量为1 μL.根据以下公式计算四溴双酚A的浓度降解率.

|
(1) |
式中,R为四溴双酚A降解率,C0为四溴双酚A初始浓度(mg·L-1),Ct为四溴双酚A剩余浓度(mg·L-1).
2.2.8 最佳共代谢碳源存在下NY3菌及其突变菌株好氧降解四溴双酚A中间产物分析方法将得到的待测样品加入100 μL BSTFA(三甲基硅烷),60 ℃下加热30 min,并过0.22 μm有机滤膜装入进样瓶中,取1 μL,利用GC-QQQ测量该样品组分,测定条件如下:色谱条件:5% phenyl Methyl Siloxane HP-5 毛细管气相色谱柱(30 m×320 μm×0.25 μm).载气:99.99%高纯氮气.进样口温度300 ℃,分流比10∶1(体积比).检测器温度:300 ℃,氢气流量40 mL·min-1,空气流量450 mL·min-1.程序升温,初始100 ℃,保留1 min,再以15 ℃·min-1升温至280 ℃,保留20 min.进样量为1 μL.MS参数:轰击源为EI,电子能量为-70 eV,离子源温度为230 ℃,扫描方式为全扫描,扫描范围为30~6000 amu,扫描时间为3.5~33 min.
2.2.9 最佳共代谢碳源存在下NY3菌及其突变菌株好氧降解四溴双酚A不同时段上清液紫外曲线无菌条件下,分别加1 mL乳酸钠溶液于100 mL无机盐中,并加入四溴双酚A使其浓度为60 mg·L-1,接种量10%,于(30±1)℃,150 r·min-1振荡培养,分别在培养24和96 h时,取发酵液100 mL,先在8000 r·min-1条件下离心10 min去除菌体,取其上清液,利用DR5000紫外分光光度计测定其波长扫描.
3 结果(Results) 3.1 NY3及其突变菌株代谢四溴双酚A的特性按照2.2.2 节试验方法,NY3菌及其突变菌株均能以四溴双酚A为单一碳源生长,并对四溴双酚A进行一定程度上的降解,实验结果如图 1和图 2所示.从图 1看,在本实验接种量条件下,铜绿假单胞菌NY3及其突变菌株在20 mg·L-1四溴双酚A为唯一碳源的无机盐溶液中生长时,无延迟生长期,且均在36 h达到最大生长量,NY3菌株、NB1D、NB2D,NB12DD最大净生长量△OD600 nm值分别为0.577、0.493、0.437、0.386(图 1a).而四溴双酚A为60 mg·L-1时,最大净生长量则分别为0.461、0.391、0.359、0.291(图 1b).高浓度条件下,各菌株生长量明显较小,说明高浓度四溴双酚A对各菌株有一定的毒性.其中野生株NY3在高浓度和低浓度四溴双酚A中生长能力最强,而同时缺失alkB1基因和alkB2基因的突变株NB12D在高浓度和低浓度的四溴双酚A溶液中生长量都最小,说明alkB1基因和alkB2基因的缺失对NY3菌株在四溴双酚A中的生长有抑制作用.不论是高浓度还是低浓度,野生菌NY3对四溴双酚A降解能力都比突变株强,但双突变株NB12DD菌对四溴双酚A的降解也较高,说明alkB1基因和alkB2基因在NY3菌降解四溴双酚A中起一定的作用,但不完全,说明NY3菌中还存在其他影响四溴双酚A降解的基因.而缺失alkB2基因的突变株NB2D在含60 mg·L-1 的四溴双酚A溶液中降解转化率最少,如图 2b所示,说明alkB2基因的缺失,对NY3菌降解高浓度四溴双酚A碳源更重要.
 |
| 图 1 Y3菌及其突变株以不同浓度TBBPA为碳源的生长曲线 Fig. 1 Growth curve of NY3 strain and its mutants with different concentrations of TBBPA |
 |
| 图 2 NY3菌及其突变菌株对不同浓度TBBPA不同时段降解效率 Fig. 2 Degradation efficiency of NY3 and its mutant strains at different times with different concentrations of TBBPA |
为了提高TBBPA的降解转化及其脱溴效率,按2.2.3 节实验方法,投加乳酸钠、葡萄糖、和乙醇等小分子为共代谢碳源,测定生长曲线、TBBPA降解转化率及其脱溴率,结果如图 3所示.从图 3结果看出,因共存碳源不同,NY3菌株、NB1D、NB2D,NB12DD等菌株生长、降解及其脱溴等特性差别明显,除乙醇外乳酸钠和葡萄糖均能使各受试菌体生长量和对TBBPA的降解效率明显提高,但同一共存碳源存在下,4株菌生长、对四溴双酚A的降解及其脱溴等特性差别不明显.乳酸钠共存条件下,
NY3及其突变菌OD600 nm值均在2.2左右,葡萄糖共存条件,NY3及其突变菌OD600 nm值均在1.1左右. 生长初期,乙醇对NY3及其突变菌的生长由明显的抑制作用接种96 h后,各菌株仅有少量生长.如图 3a所示,乙醇共存时,96 h时各菌株对TBBPA降解转化率仅有约10%,脱溴率均为0.而乳酸钠和葡萄糖共存时,96 h各菌株对TBBPA降解率均可达到100%,脱溴率可分别平均达到19.75%和2.59%.与未投加共代谢碳源相比,乳酸钠使NY3菌及突变菌株96 h降解TBBPA转化率提高40%左右.上述结果表明,乳酸钠和葡萄糖作为四溴双酚A共存碳源能提高各受试菌株的生长量,且细胞生长量越高,对TBBPA降解转化率和脱溴率越高,但不同菌株之间的差别不明显.各受试菌株生长过程中,不仅利用了共存易降解碳源,同时快速降解转化了四溴双酚A.
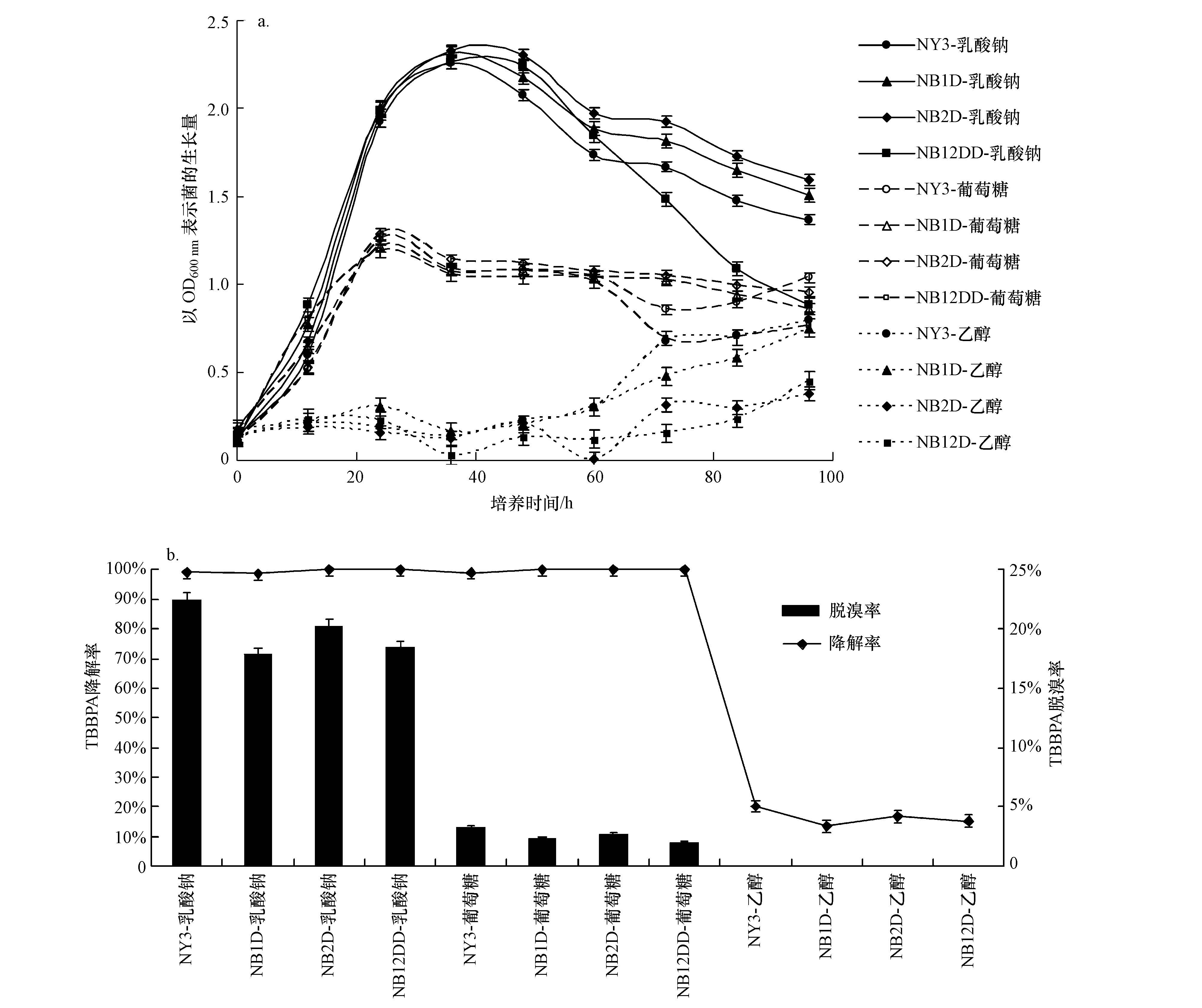 |
| 图 3 共代谢碳源和TBBPA存在下NY3及其突变株生长曲线(a)及对TBBPA降解率和脱溴效率(b) Fig. 3 The growth curves(a)and degradation and debromination rate(b)of TBBPA of NY3 and its mutant strains in the presence of cometabolic carbon source and TBBPA |
NY3菌及其突变株降解四溴双酚A后,如图 4a结果所示,24 h上清液紫外光谱图已经明显看出有TBBPA代谢中间产物出现,随着降解时间延长,降解上清液紫外吸收峰个数增加,且与TBBPA相比最大吸收峰均红移,结果如图 4b所示,说明四溴双酚A不断被代谢转化.表 1是积累明显的、主要的中间产物气质谱数据.由表 1结果看,NY3菌及其突变株代谢四溴双酚A的途径主要有2种,其一是直接还原脱溴,生成氢原子取代溴原子的产物(如表 1中分子量为464和370的化合物);其二是直接异丙基断裂(如表 1中分子量为382和454硅烷基化的化合物),然后脱水氧化,进一步脱溴直到被矿化.
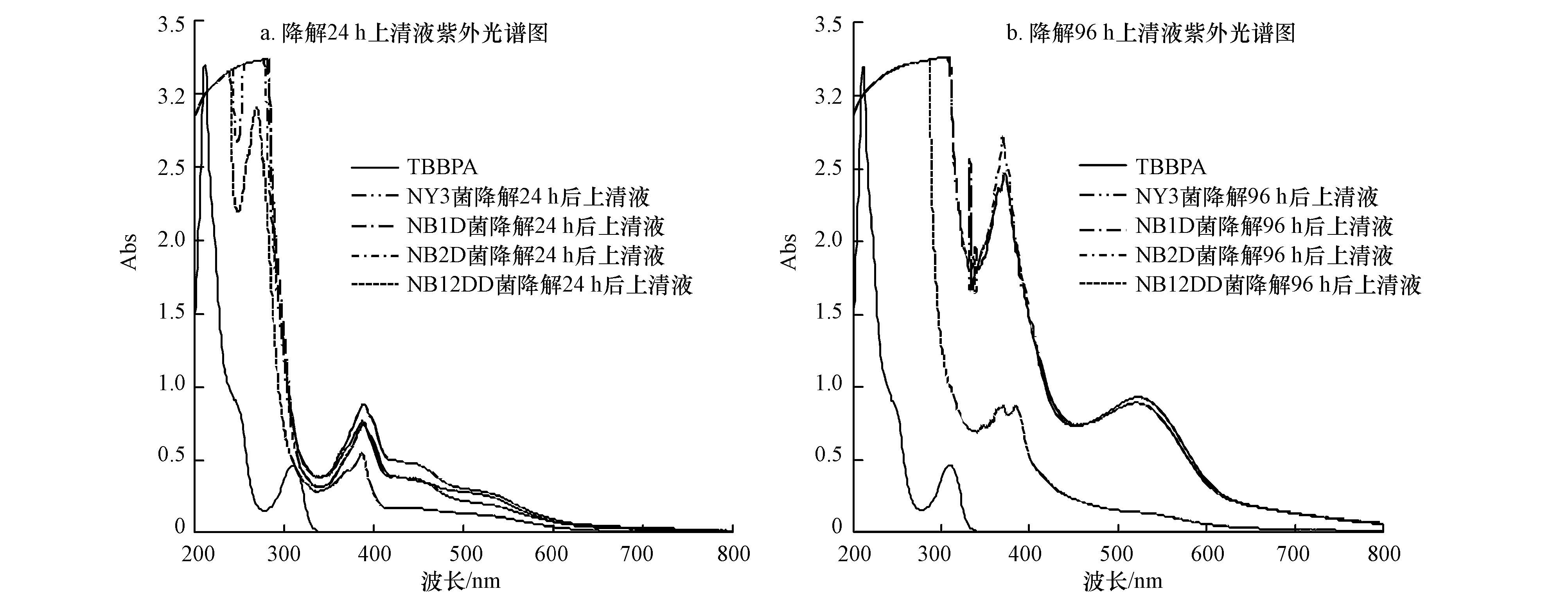 |
| 图 4 NY3菌及其突变株降解四溴双酚A后不同时间段上清液紫外光谱图 Fig. 4 Ultraviolet spectrum of the supernatant at different time period of NY3 and its mutant strains for the degradation of TBBPA |
| 表 1 NY3及突变菌株96 h好氧降解四溴双酚A中间产物质谱数据 Table 1 Mass spectrometry of TBBPA metabolites produced by NY3 and its mutant strain |
结合气质谱的色谱图(本文未示出)看,NY3、NB1D、NB2D 3菌株所积累的中间产物种类相同,但相对含量不同(表 1).而同时缺失alkB1和alkB2基因的NB12DD突变株脱溴能力明显降低,从气质谱的鉴定结果看,未发现NB12DD菌株能直接从四溴双酚A分子中脱溴(表 1).结合表 1、表 2结果看,敲除alkB2基因(保留alkB1基因)的突变株NB2D积累的直接脱溴产物较多,而敲除alkB1基因(即NB1D菌株)则通过直接脱溴所积累的中间产物较少,我们推测NY3菌株中alkB1基因可能为代谢四溴双酚A脱溴时的关键基因.
| 表 2 NY3及突变菌株96 h好氧降解四溴双酚A中间产物相对含量 Table 2 Relative content of the intermediate products of NY3 and the mutant strains aerobic degradation of TBBPA in 96 h |
1) NY3、NB1D、 NB2D及NB12DD菌株均能以四溴双酚A为单一碳源和能源进行生长,并对四溴双酚A进行一定程度上的降解.NY3菌中alkB1基因和alkB2基因的缺失对NY3菌株在四溴双酚A中的生长有抑制作用.alkB1基因和alkB2基因在NY3菌降解四溴双酚A中起一定的作用,但不完全,说明NY3菌中还存在其他影响四溴双酚A降解的基因.而缺失alkB2基因的突变株NB2D在高浓度的四溴双酚A溶液中降解转化率最少,说明alkB2基因的缺失,对NY3菌降解高浓度四溴双酚A碳源更重要.
2) 同一共代谢碳源的加入,NY3菌株、NB1D、NB2D,NB12DD等菌株生长特性差异不明显.而乳酸钠和葡萄糖能提高各受试菌株的生长量,且细胞生长量越高,对四溴双酚A降解转化率和脱溴率越高.
3) 加乳酸钠共代谢四溴双酚A过程中,主要累积了3,3′,5-三溴双酚A、2-溴-4(异戊酸)-苯酚、2,6-二溴-4(乙酸)-苯酚、4-(2-羟基-异丙醇基)-2,6-二溴-苯酚、2-溴-4(异丙基-溴苯)-苯酚、2,6-二溴-4-(2-丙烯基)-苯酚这几种中间产物,从这几种中间产物在不同菌株存在下的相对累积量可推测alkB1基因可能为NY3菌株代谢四溴双酚A脱溴时的关键基因.
| [${referVo.labelOrder}] | An T, Zu L, Li G, et al. 2011. One-step process for debromination and aerobic mineralization of tetrabromobisphenol-A by a novel Ochrobactrum sp[J]. T isolated from an e-waste recycling site[J].Bioresource Technology, 102(19) : 9148–9154. |
| [${referVo.labelOrder}] | Bromine Science and Environmental Forum[EB/OL].2006-08-16. http:www.bsef.com |
| [${referVo.labelOrder}] | Canton R F, Sanderson J T, Letcher R J, et al. 2005. Inhibition and induction of aromatase (CYP19)activity by brominated flame retardants in H295R human adrenocortical carcinoma cells[J]. Toxicological Sciences, 88(2) : 447–455. DOI:10.1093/toxsci/kfi325 |
| [${referVo.labelOrder}] | 曹洋, 李莉, 杨苏文, 等. 2010. 高效液相色谱法分析湖泊环境介质中的四溴双酌A[J]. 吉林广播电视大学学报, 2010(4) : 9–10. |
| [${referVo.labelOrder}] | Fan Z Z, Wang J, Liu S S, et al. 2014. Aerobic degradation characteristics of tetrabromobisphenol A by Pseudomonas[J]. Chinese Journal of Environmental Engineering, 8(6) : 2597–2604. |
| [${referVo.labelOrder}] | Hagmar L, Jakobsson K, Thuresson K, et al. 2000. Computer technicians areoccupationally exposed to polybrominated diphenyl ethers and tetrabromobisphenol A[J]. Organohalogen Compounds, 47 : 202–205. |
| [${referVo.labelOrder}] | Hayama Tadahi, Hideyuki Y, Suzuko O, et al. 2004. Deternination of tetrabromobisphenol A in human serum by liquid chromatography-electrospray ionization tandem mass spectrometry[J]. Journal of Chromatography B, 809(1) : 131–136. DOI:10.1016/j.jchromb.2004.06.013 |
| [${referVo.labelOrder}] | Kim Y M, Nam I H, Murugesan K, et al. 2007. Biodegradation of diphenyl ether and transformation of selected brominated congers by Sphingomonas sp. PH-07[J]. Applied Microbiology and Biotechnology, 77(1) : 187–194. DOI:10.1007/s00253-007-1129-z |
| [${referVo.labelOrder}] | Morris S, Allchin C R, Zegers B N, et al. 2004. Distribution and fate of HBCD and TBBPA brominated flame retardants in North Sea estuaries and aquatic food webs[J]. Environmental Science &Technology, 38(21) : 5497–5504. |
| [${referVo.labelOrder}] | Nie M Q, Yin X H, Ren C Y, et al. 2010. Novel rhamnolipid biosurfactants produced by a polycyclic aromatic hydrocarbon-degrading bacterium Pseudomonas aeruginosa strain NY3[J]. Biotechnology Advances, 28(5) : 635–643. DOI:10.1016/j.biotechadv.2010.05.013 |
| [${referVo.labelOrder}] | Peng X, Zhang Z, Luo W, et al. 2012. Biodegradation of tetrabromobisphenol A by a novel Comamonas sp.Strain, JXS-2-02, isolated from anaerobic sludge[J]. Bioresource Technology, 128 : 173–179. |
| [${referVo.labelOrder}] | Peterman P H, Orazio C E, Gale R W. 2000. Detection of tetrabromobisphenol A and formation of bromination of brominated 13C-bisphenol A's in commercial drinking water stored in reusable polycarbonate containers[J]. Division of Environmental Chemistry, 40(1) : 431–433. |
| [${referVo.labelOrder}] | 钱艳园, 刘莉莉, 于晓娟. 2012. 四溴双酚A好氧降解菌的筛选及其降解特性研究[J]. 环境科学, 2012, 33(11) : 3962–3966. |
| [${referVo.labelOrder}] | Saint L R, Pelletier E. 2004. LC-ESI-MS-MS method for the analysis of tetrabromobisphenol A in sediment and sewage sludge[J]. Analyst, 129 : 724–730. DOI:10.1039/b400743n |
| [${referVo.labelOrder}] | Sellstrom U, Jansson B. 1995. Analysis of tetrabromobisphenol A in a product and environmental samples[J]. Chemosphere, 31(4) : 3085–3092. DOI:10.1016/0045-6535(95)00167-7 |
| [${referVo.labelOrder}] | Stoker T E, Cooper R L, Lambright C S, et al. 2005. In vivo and in vitro anti-androgenic effects of DE-71,a commercial polybrominated diphenyl ether (PBDE) mixture[J]. Toxicology and Applied Pharmacology, 207(1) : 78–88. DOI:10.1016/j.taap.2005.05.010 |
| [${referVo.labelOrder}] | WHO.1995.Environmental Health Criteria 172:tetrabromobisphenol A and Derivatives[S].Geneva:Swilzerland.72 |
| [${referVo.labelOrder}] | 万博, 聂麦茜, 齐慧霞, 等. 2016. 铜绿假单胞菌NY3好氧降解四溴双酚A的特性研究[J]. 安全与环境学报, 2016(6) : 2597–2604. |
 2017, Vol. 37
2017, Vol. 37