甲醛是一种无色、易溶于水、具有强烈刺激性的气体, 是广泛存在于环境基质中的污染物, 常见于工业废气、机动车尾气和室内装潢.其中, 油漆及人造板材是引起室内甲醛污染的主要来源, 平均含量高达176~972 μg·m-3(汤波, 2006).在我国, 木材加工行业的职业人群暴露高达0.7~19.2 mg·m-3(范卫等, 2004).卷烟烟气中也含有一定量的甲醛, 约为12~106 μg/支烟, 是世界卫生组织《烟草控制框架公约》中烟气优先级管制污染物(Ashley et al., 2007).
研究表明, 甲醛可以通过生物体对DNA的保护屏障作用而产生多种遗传毒性效应, 如DNA氧化损伤、DNA链的断裂、DNA-蛋白质的交联(DPC)、DNA加合物、DNA-DNA的交联、姐妹染色单体互换(SCE)和微核的形成(MN)等(Ji et al., 2014; Kawanishi, 2014; Yu et al., 2015; 武阳等, 2009; 袭著革等, 2004), 目前甲醛造成DNA损伤最主要的形式为DNA-蛋白质的交联(武阳, 2010), 甲醛被国际癌症研究机构(IARC)列为了一类致癌物(IARC, 2012).Casanova(1991)等利用14C标记的甲醛暴露猕猴的鼻腔系统构建了甲醛的药代动力学模型研究了甲醛的吸收和代谢规律并外推至人类, 模型表明甲醛与DNA的结合量依赖于甲醛每分钟的输出剂量和DNA的含量水平.Huang(1993)等在体外实验中发现甲醛可以导致DNA链形成交联.Shaham(1996)等在甲醛暴露的白细胞中发现DPC显著的增多.Shaham(2002)等发现职业接触甲醛人群淋巴细胞中姐妹染色单体交换数量显著高于非接触人群(p < 0.01).Souza(2014)等发现甲醛可以引起外周淋巴细胞和红细胞中形成微核.
DNA加合物是DNA分子化学损伤的最普遍和最重要的形式, 如果在DNA复制时没有被及时正确的修复, 则可能使遗传信息发生改变, 最终引发癌症等相关疾病(Poirier, 2012; Grigoryeva et al., 2015).常见的DNA加合物是有害化学物质直接或经过机体代谢后的亲电活性产物与DNA分子形成的共价结合物, 是一种分子水平暴露的生物标志物.与苯并芘、NNK(烟草特有亚硝胺)相比, 甲醛中活泼的醛基不需要经过机体的代谢就可以直接进攻DNA上的亲核基团, 形成DNA加合物.以往研究发现N6-羟甲基腺嘌呤(N6-HOMe-dA)(图 1a)和N2-羟甲基鸟嘌呤(N2-HOMe-dG)(图 1c)是主要的甲醛-DNA加合物(Zhong et al., 2004a; 2004b).但是, 这两种结构形式在单核苷状态下不稳定, 需用还原剂转化为N6-甲基腺嘌呤(N6-Me-dA)(图 1b)和N2-甲基鸟嘌呤(N2-Me-dG)(图 1d)才能被检出(Moeller et al., 2011; Wang et al., 2009), 转化过程见图 1.
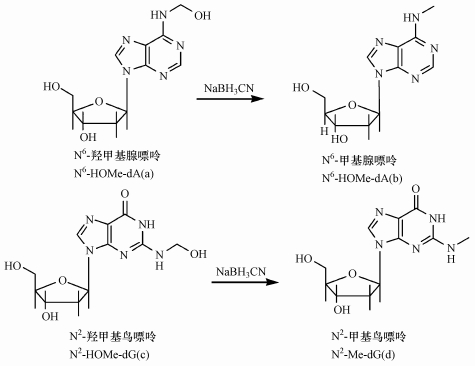 |
| 图 1 N6-羟甲基腺嘌呤、N2-羟甲基鸟嘌呤及其还原形态的结构式 Fig. 1 Chemical structures of N6-HOMe-dA, N2-HOMe-dG and their reducing state |
然而很多化学物质如甲醇、二甲基亚硝胺等可以被机体代谢为甲醛(Cheng et al., 2008; Lu et al., 2012a; Swenberg et al., 2013), 无法区分内源性及外源性的甲醛暴露, 使得甲醛-DNA加合物难以作为特异性暴露的生物标志物.Lu(2010; 2012b)等利用[13CD2]-甲醛暴露Fischer 344大鼠和Hela S3(宫颈癌)细胞, 结果显示在大鼠的鼻腔粘膜DNA中检测到了N2-HO-13CD2-dG(10 mg·L-1暴露5 d, 加合物含量为(2.43±0.78)加合物/107dG), 在Hela S3细胞中检测到了N2-HO-13CD2-dG和N6-HO-13CD2-dA, 且N2-HO-13CD2-dG是主要的甲醛-DNA加合物.同位素示踪结合细胞和动物实验虽然可以确定外源性甲醛暴露所致的DNA损伤, 但是实验设计较复杂, 不易重复.因此, 为了从DNA分子水平上研究外源性甲醛暴露所产生的DNA加合物, 验证甲醛对DNA的反应活性, 实验以小牛胸腺DNA为模型进行甲醛的暴露, 建立同时检测N6-HOMe-dA和N2-HOMe-dG的LC-MS/MS方法, 并对两种甲醛-DNA加合物的反应关系进行了研究.
文献报道过许多甲醛-DNA加合物检测方法, 如:紫外分光光度法, 该方法利用DNA形成加合物后最大吸收峰发生位移来定性分析, 利用吸光度值进行定量分析(李木兰, 2005), 但是该方法灵敏度和专一性较低, 不能给出加合物的结构信息;高效液相色谱-紫外检测技术(HPLC-UV), 通过样品与空白样的色谱图进行对比分析是否有加合物生成(Zhong et al., 2004), 虽然该方法在灵敏度方面有了一定提高, 但是同样不能准确给出加合物的结构信息, 专一性也没有得到改善;液相色谱串联质谱法(LC-MS/MS), 由于选择性好、灵敏度高且使用同位素作为内标可以对加合物进行准确定量和结构分析等优势, 成为了检测DNA加合物理想的技术(Chen, 2011).
因此, 本课题基于LC-MS/MS技术, 建立了一种同时检测N6-羟甲基腺嘌呤和N2-羟甲基鸟嘌呤的方法, 利用小牛胸腺DNA进行分子水平上的甲醛暴露, 检测不同浓度和不同时间甲醛暴露后DNA中N6-HOMe-dA和N2-HOMe-dG的含量.目前, 还未见利用LC-MS/MS检测方法分析甲醛在DNA分子水平暴露产生DNA加合物的相关研究.
2 材料和方法(Materialsandmethods) 2.1 仪器、试剂与材料AB SCIEX三重四极杆串联质谱仪(美国加州应用生物系统公司), Agilent 1200高效液相色谱(美国安捷伦公司), NanoDrop 2000超微量分光光度计(美国赛默飞科技公司), 恒温培养箱(美国赛默飞科技公司), 氮气浓缩干燥仪(瑞典拜泰齐公司), Milli-Q水纯化系统(德国默克集团), Analyst 1.5.1数据采集与处理软件.
脱氧核糖核酸酶Ⅰ、碱性磷酸酶(美国纽英伦生物技术公司), 磷酸二酯酶Ⅰ、乙酸铵、甲酸、甲醛溶液和小牛胸腺DNA(美国西格玛公司), NaBH3CN(上海阿拉丁试剂公司), 甲醇(韩国德山试剂公司), Strata-X聚合物小柱(33 μm, 30 mg·mL-1, 广东菲罗门科学仪器有限公司).N6-Me-dA和N2-Me-dG(美国Berry & Associates公司), 内标物[15N5]N6-Me-dA和[13C1015N5]N2-Me-dG(上海有机所合成, 纯度分别为99.9%和99.2%), 试剂均为色谱纯.
2.2 标准溶液配制准确称取2 mg的N6-Me-dA、N2-Me-dG、[15N5]N6-Me-dA和[13C1015N5]N2-Me-dG, 用甲醇溶液定容至10 mL的容量瓶中, 配制成0.2 mg·mL-1的标准储备液.然后用标准储备液稀释成不同浓度的标准工作液.
2.2 实验方法 2.2.1 甲醛水溶液暴露小牛胸腺DNA取200 μg小牛胸腺DNA, 加入1 mL不同浓度的甲醛溶液(0.001, 0.01, 0.05, 0.1, 0.5和1 mmol·L-1), 甲醛溶液用0.1 mol·L-1的PBS(磷酸盐缓冲溶液, pH=7.4)配制, 对照组加入同等体积的PBS溶液.将上述溶液放入37 ℃恒温培养箱中24 h(图 2a);使用2倍体积的冰乙醇沉淀DNA并终止反应, 12000 r·min-1离心5 min, 去掉上清(图 2b), 用70%的乙醇水清洗DNA样品, 得到的DNA团块晾干并加入100 μL超纯水复溶, 用NanoDrop 2000超微量分光光度计在260 nm处检测DNA的含量, 对于双链DNA一个吸收单位相当于50 μg·mL-1(王忠民等, 2002).不同时间梯度甲醛溶液暴露时选用100 μmol·L-1甲醛水溶液, 分别暴露0、2、4、8、12、16、24 h.
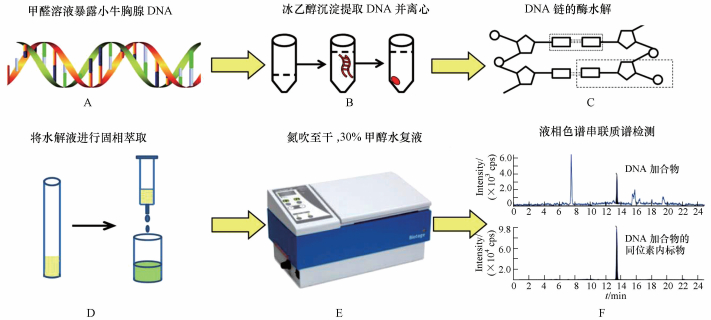 |
| 图 2 DNA样品中N6-羟甲基腺嘌呤, N2-羟甲基鸟嘌呤检测流程图 Fig. 2 Flowchart of simultaneous determination of N6-HOMe-dA, N2-HOMe-dG in DNA |
将提取的DNA((133.4±20.5) μg, 范围:106.1~165.6 μg)溶于500 μL的缓冲溶液中, 缓冲液的组成为10 mmol·L-1 PIPES、2.5 mmol·L-1 MgCl2和5 mmol·L-1 CaCl2(pH=7.0).向该缓冲溶液中投加30 mg的NaBH3CN和20 μL浓度为10 ng·mL-1的[15N5]N6-Me-dA和[13C1015N5]N2-Me-dG溶液.向上述溶液中加入100单位(U)脱氧核糖核酸酶Ⅰ(DNaseⅠ), 在37 ℃水浴中孵育3 h, 随后加入0.008单位磷酸二酯酶Ⅰ(PI)和50单位碱性磷酸酶(CIP), 在37 ℃水浴中继续孵育3 h, 将DNA水解为单核苷酸状态(图 2c).水解液首先用0.22 μm有机相尼龙滤膜过滤, 然后用Strata-X聚合物固相萃取(SPE)小柱进行脱盐和纯化(图 2d), 将过滤后的水解液样品加入由1 mL甲醇和1 mL水活化后的SPE小柱, 然后使用3 mL水和1 mL 10%的甲醇水溶液淋洗, 最后用1 mL 50%的甲醇水洗脱, 收集洗脱液, 在37 ℃条件下氮吹蒸干, 用100 μL 30%的甲醇水复溶(图 2E), 涡旋30 s, 在15000 g条件下离心5 min, 取上清液.
2.2.3 LC-MS/MS检测液相色谱:Thermo AcclaimTM Polar Advantage II C18色谱柱(4.6 mm×150 mm, 3 μm), 柱温30 ℃;流动相A:0.01%甲酸甲醇溶液, 流动相B:10 mmol·L-1乙酸铵水溶液;梯度洗脱条件:0~2 min:25% A, 2~5 min:25%~35% A, 5~17 min:35% A, 17~17.01 min:35%~25% A, 17.01~25 min:25% A;流速为0.38 mL·min-1, 进样量5 μL.
质谱条件:质谱配有电喷雾离子源, 多反应监测(Multiple reaction monitoring, MRM)正离子模式扫描;喷雾电压:5500 V, 离子源温度:600 ℃, 气帘气:138 kPa, 雾化气(Gas1):248 kPa, 干燥气(Gas2):317 kPa, 碰撞气:62 kPa(图 2F).
3 结果和讨论(Resultsanddiscussion) 3.1 前处理过程的优化 3.1.1 酶水解时间和用量的优化对DNA链进行酶水解时, 首先用DNaseⅠ将DNA消化成单脱氧核苷酸(5′-端为磷酸基团, 3′-端为羟基), 然后加入PI将具有3′-羟基末端的单链或双链DNA, 从3′-羟基末端开始游离出5′-核苷酸, 加入CIP可以催化核酸分子脱掉5′-磷酸基团, 从而使DNA片段的5′-磷酸基团末端变成5′-羟基末端.取200 μg相同甲醛染毒浓度(1 mmol·L-1)后的小牛胸腺DNA, 首先加入相同的酶用量(50 U DNaseⅠ, 0.004 U PI, 25 U CIP, 该酶量为方案A)在37 ℃条件下优化孵育时间, 设置酶解孵育的总时间分别为2、4、6、8、10 h.结果显示当孵育时间大于6 h后, N6-Me-dA和N2-Me-dG的含量变化不是很明显(图 3a), 固孵育时间选择6 h.然后固定孵育时间, 加入不同含量的水解酶(0.5、1、2、3、4A)在37 ℃条件下孵育6 h, 结果显示当酶用量大于等于2A(100 U DNaseⅠ, 0.008 U PI, 50 U CIP)时, N6-Me-dA和N2-Me-dG的含量基本不变(图 3b), 故选择的酶量为100 U DNaseⅠ, 0.008 U PI, 50 U CIP.
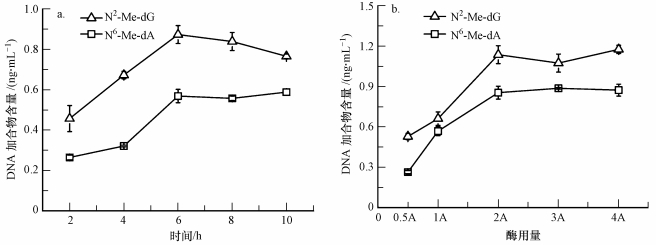 |
| 图 3 酶水解时间和用量的优化 Fig. 3 Optimization of time and dosage for enzymatic hydrolysis |
在固相萃取过程中, 实验考察了Water Sep-Pak® C18小柱和Strata-X聚合物小柱.结果表明两种小柱对两种目标物均有保留, 用不同比例的甲醇水(20%、30%、40%、50%、60%、70%、80%、90%、100%)进行洗脱, 结果显示当甲醇水的比例大于50%时, 分析物的回收率均已达到90%以上, 故选择1 mL 50%甲醇水洗脱.对两种小柱洗脱液进行分析, 发现Strata-X聚合物小柱对N6-Me-dA和N2-Me-dG的回收率较高, 均在97%以上, 可能由于Strata-X聚合物小柱含有表面修饰的苯乙烯二乙烯基苯聚合物, 增强了偏极性物质的保留, 故选择Strata-X聚合物小柱.
3.2 LC-MS/MS检测方法的建立 3.2.1 色谱条件的优化由于两种DNA加合物都具有极性, 因此选择了具有酰胺极性基团键合嵌入相Acclaim Polar Advantage ⅡC18(4.6 mm×150 mm, 3 μm)柱, 有机相为甲醇.为了降低噪音, 增加分析灵敏度, 改善峰形, 在有机相中添加了0.01%的甲酸、0.1%的甲酸和0.01%的乙酸, 在水相中加入了1、5和10 mmol·L-1的乙酸铵, 结果显示当流动相的组成为0.01%的甲酸甲醇和10 mmol·L-1的乙酸铵水溶液时, 分析物的灵敏度较高.(图 4).
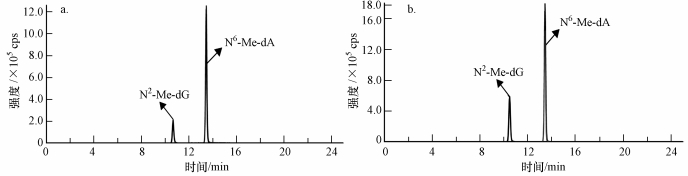 |
| 图 4 Acclaim PolarAdvantageⅡC18柱对N6-Me-dA和N2-Me-dG的分离色谱图;a图流动相为甲醇和水, b图流动相为含0.01%甲酸的甲醇和10 mmol·L-1乙酸铵水溶液(a和b均为10 ng·mL-1的标准工作液) Fig. 4 Chromatograms of N6-Me-dA and N2-Me-dG by Acclaim PolarAdvantageⅡC18 column; Mobile phase were methanol and ultrapure water (a), 0.01% formic acid in methanol and 10 mmol·L-1 ammonium acetate solution (b) (The concentration of standard solution of (a) and (b) were 10 ng·mL-1) |
用蠕动泵以10 μL·min-1的流速连续注射, 分别将500 ng·mL-1的N6-Me-dA、N2-Me-dG、[15N5]N6-Me-dA和[13C1015N5]N2-Me-dG标准溶液注入ESI离子源中, 首先在正离子模式下进行一级质谱扫描, 得到相应的准分子离子峰[M+H]+, 然后对该准分子离子峰进行子离子扫描得到碎片离子.选取丰度较高, 干扰较小的为定量离子对, N6-Me-dA优化的结果为定量离子对266.1/150.2, 定性离子对266.1/117.2, 内标离子对271.2/155.2;N2-Me-dG的定量离子对为282.2/166.2, 定性离子对为282.2/117.1, 内标离子对为297.2/176.2.为了达到更高的灵敏度, 对去簇电压和碰撞能量等参数进行了优化.
3.3 方法学考察 3.3.1 标准曲线和检出限将N6-Me-dA和N2-Me-dG配制成不同浓度的混合系列标准工作溶液, 浓度梯度为0.02、0.05、0.10、0.20、0.30、0.50、1.0和2.0 ng·mL-1, 两种内标[15N5]N6-Me-dA和[13C1015N5]N2-Me-dG浓度为2 ng·mL-1.各移取5 μL注入LC-MS/MS系统进行分离分析.N6-Me-dA和N2-Me-dG的线性回归方程分别为y=0.617x+0.0131和y=0.481x+0.0785, 相关系数r均大于0.999.以3倍信噪比对应的目标物浓度作为检出限(LOD), 该方法对应N6-Me-dA和N2-Me-dG的LOD分别0.014和0.0064 ng·mL-1, 定量限LOQ(S/N=10)为0.026和0.021 ng·mL-1.
3.3.2 精密度和稳定性选择3个质控(Quality control, QC)样本, 低(0.2 ng·mL-1)、中(1.0 ng·mL-1)、高浓度(2.0 ng·mL-1)在同一天内平行测6次得到日内精密度, 连续3 d分别检测得到日间精密度, 日内精密度和日间精密度的RSD小于5%(表 2).稳定性试验考察的内容包括短期稳定性、冻融稳定性及长期稳定性.短期稳定性考察低、中、高3组QC样品在48 h内的稳定性, 冻融稳定性包括3组样品分别在3次冻融循环后的稳定性.长期稳定性考察3组样品在30 d内(-80 ℃, n=6)的稳定性.结果显示RSD均小于等于9.3%(表 1).
| 表 1 N6-Me-dA和N2-Me-dG.的精密度和稳定性 Table 1 Precision and stability of N6-Me-dA and N2-Me-dG |
采用空白样品基质加标准品的方法测方法的回收率, 用小牛胸腺DNA作为样本, 在酶水解步骤, 选取3个添加水平(0.1、0.5、1.0 ng·mL-1)加入标准品, 每个实验平行做3次, 两种目标物的平均回收率在94.9%~111%之间, 证明该方法满足方法学要求(表 2).
| 表 2 N6-Me-dA和N2-Me-dG.的加标回收率 Table 2 The recovery rate of N6-Me-dA and N2-Me-dG |
对甲醛水溶液暴露的DNA中N6-羟甲基腺嘌呤和N2-羟甲基鸟嘌呤进行分析, 根据目标物与其稳定同位素内标物的保留时间基本保持一致的原理, 结合所选择的分析离子对对目标物进行定性分析;根据目标物与其内标物阴影面积的比值进行定量分析, 依据标准曲线计算获得各个样品中DNA加合物的浓度, 根据公式(1)计算获得各个样品中DNA加合物相对于核苷酸的含量:
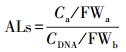
|
(1) |
式中, ALs(Adduct levels)为每108个核苷酸中, DNA加合物的个数, 无量纲;Ca为DNA加合物的浓度(ng·mL-1);FWa为DNA加合物的分子量;CDNA为DNA的浓度(ng·mL-1);FWb为碱基的平均分子量.
将不同甲醛暴露剂量和不同甲醛暴露时间下N6-Me-dA、N2-Me-dG的含量数据结果使用SPSS统计软件(19.0版本)进行统计分析, 结果显示N6-Me-dA和N2-Me-dG的量随着甲醛染毒剂量和甲醛染毒时间的增加而增加, 呈现剂量-反应和时间-反应关系(p < 0.004, 图 5), 且基本成线性增长关系, 在0.001~0.05 mol·L-1浓度范围内甲醛-DNA加合物的含量增长范围较小, 可能是由于染毒浓度偏小的原因.数据结果显示在体外小牛胸腺DNA染毒实验中, N2-HOMe-dG是主要的甲醛-DNA加合物, 这与之前的研究一致(Lu et al., 2010; Lu et al., 2012a; Yu et al., 2015), 本实验在DNA分子水平进行甲醛暴露进一步验证了甲醛不需要机体的代谢就能够直接与DNA进行反应, 且实验影响因素较少, 测定结果的稳定性较好.本文建立的LC-MS/MS方法具有灵敏度高, 重复性好, 选择性强等特点, 适用于含甲醛类污染物暴露的DNA损伤性研究.
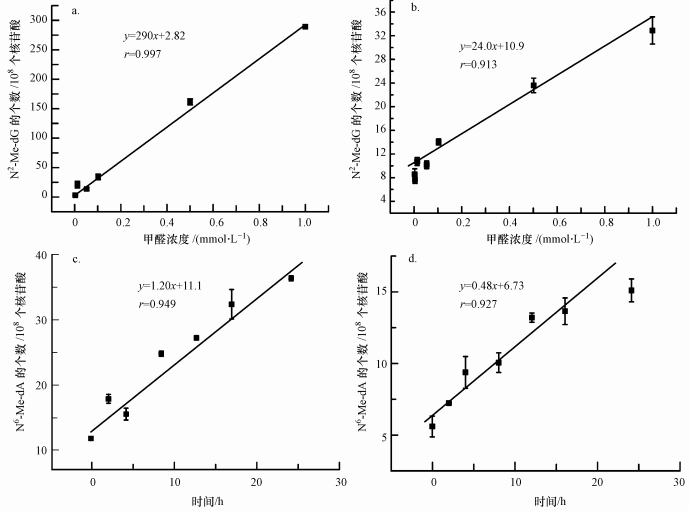 |
| 图 5 不同甲醛暴露剂量下(37 ℃, 24 h), 小牛胸腺DNA中(a)N6-Me-dA和(b)N2-Me-dG的含量;不同染毒时间下(37 ℃, 0.1 mmol·L-1)小牛胸腺DNA中(c)N6-Me-dA和(d) N2-Me-dG的含量 Fig. 5 Effects of the formaldehyde exposure dose on (a) N6-Me-dA and (b) N2-Me-dG formation in calf thymus DNA (Reaction condition: 37 ℃, 24 h); Effects of formaldehyde exposure time on (c) N6-Me-dA and (d) N2-Me-dG (Reaction condition: 37 ℃, 0.1 mmol·L-1) |
本文建立了一种灵敏度高、选择性好、稳定性强且可以同时检测DNA中的N6-羟甲基腺嘌呤和N2-羟甲基鸟嘌呤的LC-MS/MS方法.DNA样品经酶水解(NaBH3CN还原)、SPE纯化和浓缩复溶后进样分析, 该方法对目标物N6-Me-dA和N2-Me-dG的加标回收率范围是94.9%~111%, 检出限分别为0.014和0.0064 ng·mL-1.利用此方法从DNA分子水平上探讨了不同浓度甲醛和不同染毒时间条件下, 小牛胸腺DNA中N6-HOMe-dA和N2-HOMe-dG的含量, 显示N6-HOMe-dA和N2-HOMe-dG的量与甲醛暴露剂量成剂量-反应关系和暴露时间成时间-反应关系, 为接触人群的早期生物监测以及危险性评价提供了理论依据.
| [${referVo.labelOrder}] | Ashley D, Burns D, Djordjevic M, et al. 2007. The scientific basis of tobacco product regulation[J]. World Health Organization Technical Report Series , 951 : 78–84. |
| [${referVo.labelOrder}] | Casanova M, Morgan K T, Stemhagen W H, et al. 1991. Covalent binding of inhaled formaldehyde to DNA in the respiratory tract of rhesus monkeys: pharmacokinetics, rat-to-monkey interspecies scaling, and extrapolation to man[J]. Toxicological Sciences , 17 (2) : 409–428. DOI:10.1093/toxsci/17.2.409 |
| [${referVo.labelOrder}] | Chen H J. 2011. Analysis of DNA adducts in human samples: acrolein-derived exocyclic DNA adducts as an example[J]. Molecular Nutrition & Food Research , 55 (9) : 1391–1400. |
| [${referVo.labelOrder}] | Cheng G, Wang M, Upadhyaya P, et al. 2008. Formation of formaldehyde adducts in the reactions of DNA and deoxyribonucleosides with α-acetates of 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone (NNK), 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanol (NNAL), and N-nitrosodimethylamine (NDMA)[J]. Chemical Research In Toxicology , 21 (3) : 746–751. DOI:10.1021/tx7003823 |
| [${referVo.labelOrder}] | 范卫, 王法弟, 贾晓东, 等.2004. 近十年国内有关甲醛的环境与职业危害调查研究[J]. 劳动医学 , 2004, 21 (2) : 157–159. |
| [${referVo.labelOrder}] | Grigoryeva E S, Kokova D A, Gratchev A N, et al. 2015. Smoking-related DNA adducts as potential diagnostic markers of lung cancer: new perspectives[J]. Experimental Oncology , 37 (1) : 5–12. |
| [${referVo.labelOrder}] | Huang H, Hopkins P B. 1993. DNA interstrand cross-linking by formaldehyde: nucleotide sequence preference and covalent structure of the predominant cross-link formed in synthetic oligonucleotides[J]. Journal of the American Chemical Society , 115 (21) : 9402–9408. DOI:10.1021/ja00074a005 |
| [${referVo.labelOrder}] | |
| [${referVo.labelOrder}] | Ji Z, Li X, Fromowitz M, et al. 2014. Formaldehyde induces micronuclei in mouse erythropoietic cells and suppresses the expansion of human erythroid progenitor cells[J]. Toxicology Letters , 224 (2) : 233–239. DOI:10.1016/j.toxlet.2013.10.028 |
| [${referVo.labelOrder}] | Kawanishi M, Matsuda T, Yagi T. 2014. Genotoxicity of formaldehyde: molecular basis of DNA damage and mutation[J]. Frontiers in Environmental Science , 2 : 1–7. |
| [${referVo.labelOrder}] | Kreiger R, Garry V. 1983. Formaldehyde-induced cytotoxicity and sister-chromatid exchanges in human lymphocyte cultures[J]. Mutation Research Letters , 120 (1) : 51–55. DOI:10.1016/0165-7992(83)90073-8 |
| [${referVo.labelOrder}] | 李木兰. 2005.典型醛类污染物与DNA形成加合物的机制及检测方法[D].衡阳:南华大学 http://cdmd.cnki.com.cn/article/cdmd-10540-2005123732.htm |
| [${referVo.labelOrder}] | Lu K, Collins L B, Ru H, et al. 2010. Distribution of DNA adducts caused by inhaled formaldehyde is consistent with induction of nasal carcinoma but not leukemia[J]. Toxicological Sciences , 116 (2) : 441–451. DOI:10.1093/toxsci/kfq061 |
| [${referVo.labelOrder}] | Lu K, Craft S, Nakamura J, et al. 2012a. Use of LC-MS/MS and stable isotopes to differentiate hydroxymethyl and methyl DNA adducts from formaldehyde and nitrosodimethylamine[J]. Chemical Research in Toxicology , 25 (3) : 664–675. DOI:10.1021/tx200426b |
| [${referVo.labelOrder}] | Lu K, Gul H, Upton P B, et al. 2012b. Formation of hydroxymethyl DNA adducts in rats orally exposed to stable isotope labeled methanol[J]. Toxicological Sciences , 126 (1) : 28–38. DOI:10.1093/toxsci/kfr328 |
| [${referVo.labelOrder}] | Moeller B C, Lu K, Doyle Eisele M, et al. 2011. Determination of N2-hydroxymethyL-dG adducts in the nasal epithelium and bone marrow of nonhuman primates following 13 CD2-formaldehyde inhalation exposure[J]. Chemical Research in Toxicology , 24 (2) : 162–164. DOI:10.1021/tx1004166 |
| [${referVo.labelOrder}] | Poirier M C. 2012. ChemicaL-induced DNA damage and human cancer risk[J]. Discovery Medicine , 14 (77) : 283–288. |
| [${referVo.labelOrder}] | Shaham J, Bomstein Y, Meltzer A, et al. 1996. DNA-protein crosslinks, a biomarker of exposure to formaldehyde-in vitro and in vivo studies[J]. Carcinogenesis , 17 (1) : 121–126. DOI:10.1093/carcin/17.1.121 |
| [${referVo.labelOrder}] | Shaham J, Gurvich R, Kaufman Z. 2002. Sister chromatid exchange in pathology staff occupationally exposed to formaldehyde[J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis , 514 (1) : 115–123. |
| [${referVo.labelOrder}] | Souza A D, Devi R. 2014. Cytokinesis blocked micronucleus assay of peripheral lymphocytes revealing the genotoxic effect of formaldehyde exposure[J]. Clinical Anatomy , 27 (3) : 308–312. DOI:10.1002/ca.v27.3 |
| [${referVo.labelOrder}] | Swenberg J A, Moeller B C, Lu K, et al. 2013. Formaldehyde carcinogenicity research: 30 years and counting for mode of action, epidemiology, and cancer risk assessment[J]. Toxicologic Pathology , 41 (2) : 181–189. DOI:10.1177/0192623312466459 |
| [${referVo.labelOrder}] | 汤波.2006. 室内空气中的甲醛检测及控制[J]. 环境科学与管理 , 2006, 31 (5) : 168–170. |
| [${referVo.labelOrder}] | Wang M, Cheng G, Balbo S, et al. 2009. Clear differences in levels of a formaldehyde-DNA adduct in leukocytes of smokers and nonsmokers[J]. Cancer Research , 69 (18) : 7170–7174. DOI:10.1158/0008-5472.CAN-09-1571 |
| [${referVo.labelOrder}] | 王忠民, 常德安.2002. 上皮性卵巢癌中nm23-H1基因突变[J]. 肿瘤 , 2002, 22 (3) : 209–212. |
| [${referVo.labelOrder}] | 武阳, 常青, 杨旭.2009. 不同浓度甲醛致大鼠肝细胞DNA氧化损伤作用[J]. 环境科学学报 , 2009, 29 (11) : 2415–2419. |
| [${referVo.labelOrder}] | 武阳. 2010.甲醛遗传毒性与氧化损伤研究[D].武汉:华中师范大学 http://cdmd.cnki.com.cn/article/cdmd-10511-2010136972.htm |
| [${referVo.labelOrder}] | 袭著革, 晁福寰, 杨丹凤, 等.2004. 甲醛致核酸损伤作用的实验研究[J]. 环境科学学报 , 2004, 24 (4) : 719–722. |
| [${referVo.labelOrder}] | Yu R, Lai Y, Hartwell H J, et al. 2015. Formation, accumulation, and hydrolysis of endogenous and exogenous formaldehyde-induced DNA damage[J]. Toxicological Sciences , 146 (1) : 170–182. DOI:10.1093/toxsci/kfv079 |
| [${referVo.labelOrder}] | Zhong W, Que Hee S S. 2004a. Quantitation of normal and formaldehyde-modified deoxynucleosides by high-performance liquid chromatography/UV detection[J]. Biomedical Chromatography , 18 (7) : 462–469. DOI:10.1002/(ISSN)1099-0801 |
| [${referVo.labelOrder}] | Zhong W, Que Hee S S. 2004b. Formaldehyde-induced DNA adducts as biomarkers of in vitro human nasal epithelial cell exposure to formaldehyde[J]. Mutation Research , 563 (1) : 13–24. DOI:10.1016/j.mrgentox.2004.05.012 |
 2016, Vol. 36
2016, Vol. 36


