二氧化硫(SO2)是一种常见的大气污染物,主要来源于含硫化合物的燃烧、冶炼和加工等过程(Lu et al.,2010).环境中低浓度的SO2可为植物提供硫元素,促进植物生长发育;而高浓度的SO2会影响植物的光合作用和呼吸过程,导致植物生长缓慢,甚至诱发植物死亡(Randewig et al.,2012; Choi et al.,2014).
环境中的SO2经气孔进入植物体内,主要通过产生亚硫酸根(SO32-)和亚硫酸氢根(HSO3-)对组织和细胞产生毒性作用(Lewandowska et al.,2008).进入胞内的SO32-经氧化途径产生硫酸根(SO42-),或经还原途径生成半胱氨酸,进入细胞硫循环.SO32-氧化过程中会产生活性氧,使胞内活性氧水平升高(Lang et al.,2007; Brychkova et al.,2007).近期本课题组研究发现,SO2胁迫能引起拟南芥和蚕豆叶细胞内NO水平升高(赵均等,2014;李蕊等,2015).
NO和H2O2是植物体内的两种信号分子,在植物响应逆境胁迫的过程中发挥重要作用(Ma et al.,2010; Sun et al.,2010; Wang et al.,2013).课题组前期研究发现,NO参与SO2胁迫下拟南芥和蚕豆的气孔运动调节(赵均等,2014;李蕊等,2015);H2O2能够作为信号分子调控SO2诱导的蚕豆保卫细胞凋亡(Yi et al.,2012).此后,相继有学者在萱草和万寿菊中发现NO和H2O2在SO2诱导保卫细胞凋亡中的信号调节作用(Wei et al.,2013,2015),但这些报道均集中于草本植物的保卫细胞,且未对NO和H2O2的互作关系进行研究.迄今为止,关于SO2对木本植物的毒性效应,以及NO和H2O2两种信号分子在SO2诱导木本植物死亡过程中发挥的作用尚不清楚.
SO2气体易溶于水产生SO32-和HSO3-分子,两种分子摩尔比为3∶1(Shapiro,1977).有关SO2毒性研究常用SO2衍生物(Na2SO3和NaHSO3混合液,摩尔比3∶1)处理(尹晶晶等,2010; 付宝春等,2015; Yi et al.,2012; Wei et al.,2013; 2015).因此,本文选择生长在我国西北地区的高大乔木树种—胡杨的细胞为材料,采用SO2衍生物处理,研究SO2对胡杨细胞的毒性作用及NO和H2O2的调节作用,以期为揭示SO2对木本植物的毒害效应及相关机制提供理论依据.
2 材料与方法(Materials and methods) 2.1 植物材料取胡杨新鲜幼嫩叶片,在含0.5 mg·L-1 6-BA和0.5 mg·L-1 NAA的Murashige&Skoog(MS)固体培养基(pH 5.7)上诱导产生愈伤组织.将愈伤组织继代培养15 d后,选择颜色淡黄、生长旺盛的愈伤细胞进行处理和实验.
2.2 处理方法将生长15 d的胡杨愈伤细胞在MS液体培养基(pH 5.7)中平衡6 h后,分别按以下方法进行处理:①分别用0、1、2、5 mmol·L-1 SO2衍生物处理细胞0、3、6、9、12 h后,检测细胞死亡率;②用2 mmol·L-1 SO2衍生物处理细胞0、3、6、9、12 h后,检测胞内H2O2和NO水平,以0 mmol·L-1 SO2衍生物处理作为对照;③分别用2 mmol·L-1 SO2衍生物、2 mmol·L-1 SO2衍生物+0.5 mmol·L-1 H2O2、2 mmol·L-1 SO2衍生物+0.5 mmol·L-1 ASA、2 mmol·L-1 SO2衍生物+2 U·L-1 CAT处理细胞,6 h后检测细胞死亡率、硝酸还原酶活性和胞内NO水平;④分别用2 mmol·L-1 SO2衍生物、2 mmol·L-1 SO2衍生物+0.5 mmol·L-1 SNP、2 mmol·L-1 SO2衍生物+0.5 mmol·L-1cPTIO、2 mmol·L-1 SO2衍生物+0.5 mmol·L-1钨酸钠(Tungstate)处理细胞,6 h后检测细胞死亡率、抗氧化酶活性和胞内H2O2水平.
2.3 细胞死亡率检测利用Fluorescein Diacetate(FDA)荧光染料检测细胞活性.具体参见Sun等(2012)的方法,在1 mL细胞样品中加入20μg·mL-1 FDA溶液,室温下避光孵育10 min后,用荧光显微镜(BX51,Olympus,Japan)检测细胞荧光,每个重复观察5个视野,每个视野至少观察100个细胞.根据是否发绿色荧光统计细胞死亡率,发亮绿色荧光的为活细胞,不发绿色荧光或绿色较暗的为死细胞.细胞死亡率为死细胞数目与细胞总数之比.
2.4 H2O2水平检测利用2,7-dichlorodihydrofluorescein diacetate(H2DCFDA)荧光探针检测胡杨细胞内的H2O2水平.将胡杨细胞在50μmol·L-1 H2DCFDA中暗孵育5 min,然后在激光共聚焦显微镜(Leica SP5,Wetzlar,Germany)下观察细胞内的绿色荧光.激发波长为488 nm,接收波长为500~530 nm.利用Image-Pro Plus version 6.0软件来计算相对荧光强度,相对荧光强度越大,表示细胞内H2O2水平越高.
2.5 NO水平检测利用DAF-FM DA(4-Amino-5-Methylamino-2,7-Difluorofluorescein Diacetate)荧光探针检测胡杨细胞内的NO水平.将胡杨细胞在10μmol·L-1DAF-FM DA中暗孵育60 min后,利用激光共聚焦显微镜(Leica SP5,Wetzlar,Germany)下观察细胞内的绿色荧光.激发波长为488 nm,接收波长为515~535 nm.利用Image-Pro Plus version 6.0软件来计算相对荧光强度,相对荧光强度越大,表示细胞内NO水平越高.
2.6 硝酸还原酶(NR)活性测定利用磺胺比色法检测胡杨细胞的NR活性(刘洁等,2010),以单位时间内每克鲜重细胞产生的NO2-表示酶活性.
2.7 抗氧化酶活性测定将细胞样品在50 mmol·L-1磷酸钾缓冲液(pH 7.0,内含1 mmol·L-1 EDTA和1%(m/V,g·mL-1)PVP)中充分研磨成匀浆,4℃、12000 g离心20 min后,取上清备用.测定APX活性时,在提取液中加1 mmol·L-1 ASA;利用Pierce BCA Protein Assay Kit(Thermo,USA)测定细胞提取液的蛋白浓度;CAT和APX活性的测定方法参照文献(Sun et al.,2014).
2.8 数据统计分析利用SPSS17.0软件对数据进行方差分析,通过Duncan方法对不同处理组之间的数据进行多重比较,不同字母表示组间差异显著(p<0.05).
3 结果(Results) 3.1 SO2对胡杨细胞的致死效应用不同浓度的SO2衍生物(0、1、2、5 mmol·L-1)处理胡杨细胞,通过FDA染色检测胡杨细胞死亡率.结果表明,SO2衍生物诱导的胡杨细胞死亡具有浓度效应和时间效应.细胞死亡率随着SO2衍生物浓度的增加而增加,用5 mmol·L-1 SO2衍生物处理9 h后的死亡率是用1 mmol·L-1 SO2衍生物处理9 h后的死亡率的4.4倍(图 1).同一浓度下,处理时间越长,细胞死亡率越高.例如,用2 mmol·L-1 SO2衍生物处理0 h后,细胞死亡率仅为3.3%;处理9 h后,死亡率提高到45.7%(图 1).对照组(0 mmol·L-1 SO2衍生物)在处理12 h内的细胞死亡率均无明显变化(图 1).后续实验中,选取2 mmol·L-1作为SO2衍生物处理浓度.
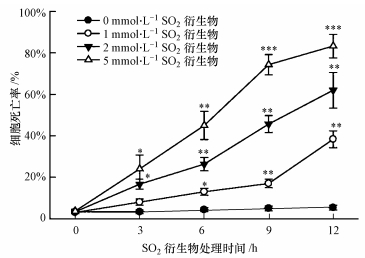 |
| 图 1 不同浓度SO2衍生物处理后胡杨细胞的死亡率(星号表示与处理起始时(0 h)相比差异显著;*p < 0.05, **p < 0.01, ***p < 0.001(Student′s t检验)) Fig. 1 Cell death rate of P. euphratica cells treated with different concentrations of SO2 derivatives |
用2 mmol·L-1 SO2衍生物处理胡杨细胞0、3、6、9、12 h后,分别通过H2DCFDA和DAF-FM DA特异性荧光探针检测细胞内的H2O2和NO荧光强度,以此反映胞内H2O2和NO的水平变化(图 2a).SO2衍生物处理3 h后,胞内H2O2水平明显升高,H2O2荧光强度是起始时(0 h)的1.5倍(图 2b);而NO水平和起始时相比并无明显差异(图 2c).此后随着处理时间的延长,胞内H2O2和NO水平均逐渐增加(图 2b、2c).在12 h时,H2O2和NO荧光强度分别达到起始时的3.6倍和2.9倍(图 2b、2c).此外,对照组(0 mmol·L-1 SO2衍生物)细胞的H2O2和NO水平在处理12 h内均无明显变化(图 2b、2c).这些结果表明,SO2衍生物诱导的胡杨细胞死亡可能与胞内H2O2和NO水平升高有关.
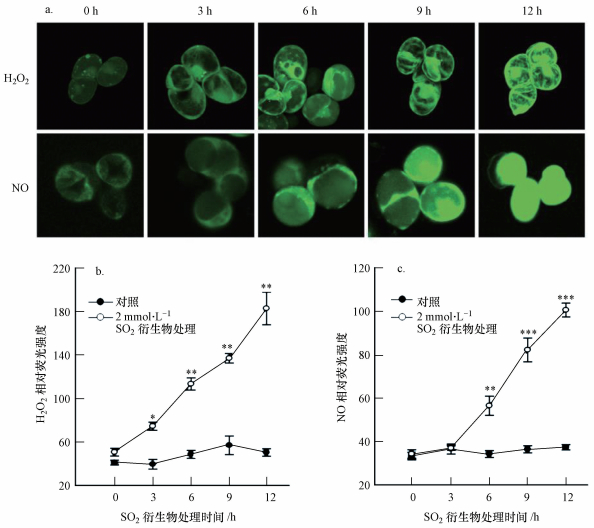 |
| 图 2 SO2衍生物(2 mmol·L-1)处理后胡杨细胞内H2O2和NO水平变化(a:代表性荧光图片;b、c:利用Image J软件计算的H2O2和NO相对荧光强度;星号表示与处理起始时(0 h)相比差异显著;*p < 0.05, **p < 0.01, ***p < 0.001(Student′s t检验)) Fig. 2 Changes of H2O2 and NO levels within P. euphratica cells after 2 mmol·L-1SO2 treatment |
为了进一步研究H2O2和NO在SO2诱导的胡杨细胞死亡中发挥的作用,分别使用外源H2O2(0.5 mmol·L-1)、H2O2清除剂ASA(0.5 mmol·L-1)和CAT(2 U·L-1)、NO供体SNP(0.5 mmol·L-1)、NO清除剂cPTIO(0.5 mmol·L-1)、NO合成抑制剂钨酸钠(Tungstate,0.5 mmol·L-1)和2 mmol·L-1 SO2衍生物共同处理细胞,6 h后通过FDA染色检测细胞死亡率.结果显示,SO2衍生物+H2O2处理组的细胞死亡率比SO2衍生物单独处理组高77.7%,而SO2衍生物+CAT和SO2衍生物+ASA处理组的细胞死亡率均明显低于SO2衍生物单独处理组,分别是SO2衍生物单独处理组的72.1%和66.2%(图 3a).由图 3b可以看出,与SO2衍生物单独处理相比,NO清除剂cPTIO和合成抑制剂钨酸钠的使用明显降低了细胞死亡率;而NO供体SNP和SO2衍生物共同处理后,细胞死亡率则明显提高.以上结果表明,H2O2和NO均参与调控SO2诱导的胡杨细胞死亡.
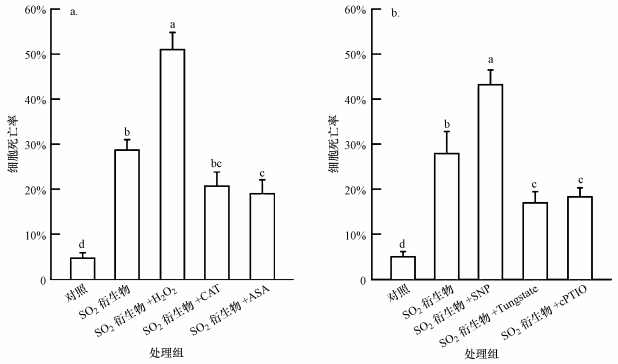 |
| 图 3 H2O2和NO干扰剂对SO2衍生物诱导胡杨细胞死亡的影响 Fig. 3 Effects of H2O2 and NO antagonists on the SO2 derivatives-induced P. euphratica cell death |
利用外源H2O2和H2O2清除剂CAT、ASA,分别与2 mmol·L-1 SO2衍生物共同处理细胞,6 h后通过DAF-FM DA特异性荧光探针检测胞内的NO水平(图 4a).与对照相比,SO2衍生物处理后的细胞内NO水平显著升高(图 4b).SO2衍生物+H2O2处理组的NO水平明显高于SO2衍生物单独处理组,而一定浓度的H2O2清除剂(2 U·L-1 CAT或0.5 mmol·L-1 ASA)则抑制了NO生成,SO2衍生物+CAT和SO2衍生物+ASA处理组的NO相对荧光强度分别是SO2衍生物单独处理组的57.0%和73.7%(图 4b).以上结果表明H2O2能够促进SO2诱导的胞内NO产生.
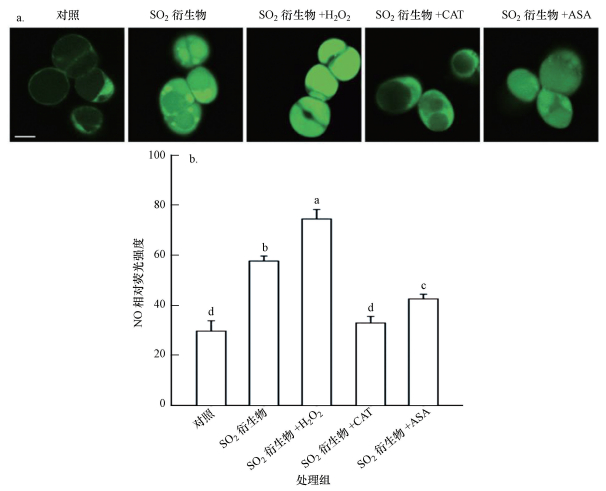 |
| 图 4 H2O2干扰剂对SO2衍生物诱导胡杨细胞产生NO的影响(a:代表性荧光图片;b:利用Image J软件计算的NO相对荧光强度) Fig. 4 Effects of H2O2 antagonists on the SO2 derivatives-induced NO production within P. euphratica cells |
硝酸还原酶(NR)介导的NO合成是植物细胞内产生NO的重要途径.SO2胁迫下,外源H2O2明显提高了胡杨细胞内的NR活性;而使用H2O2清除剂CAT、ASA后,SO2衍生物+CAT和SO2衍生物+ASA处理组细胞的NR活性受到明显抑制,分别是SO2衍生物单独处理组的70.4%和83.1%(图 5).以上结果表明,SO2胁迫下NR途径参与H2O2诱导的NO合成.
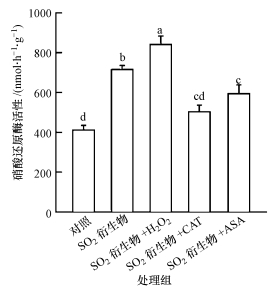 |
| 图 5 H2O2干扰剂对SO2胁迫下胡杨细胞硝酸还原酶活性的影响 Fig. 5 Effects of H2O2 antagonists on the nitrate reductase activities in SO2-stressed P. euphratica cells |
为了进一步探讨NO和H2O2在SO2诱导胡杨细胞死亡中的交叉互作关系,利用外源NO供体SNP(0.5 mmol·L-1)、NO合成抑制剂钨酸钠(Tungstate,0.5 mmol·L-1)、NO清除剂cPTIO(0.5 mmol·L-1),分别与2 mmol·L-1 SO2衍生物共同处理细胞,6 h后检测胡杨细胞的抗氧化酶(APX、CAT)活性和胞内H2O2水平.结果表明,SO2衍生物胁迫后细胞APX活性(以ASA计)和CAT活性(以H2O2计)均受到明显抑制(图 6).与SO2衍生物单独处理组相比,SO2衍生物+SNP处理组细胞的APX和CAT活性分别下降了47.1%和32.8%(图 6),H2O2水平增加了40.6%(图 7);SO2衍生物和钨酸钠共同处理后,细胞APX和CAT活性分别较SO2衍生物单独处理时提高了47.9%和44.7%(图 6),H2O2水平降低了47.1%(图 7);使用NO清除剂cPTIO后,与SO2单独处理组相比,细胞APX和CAT活性也均有不同程度的提高,而胞内H2O2水平明显下降(图 6、图 7).
 |
| 图 6 NO干扰剂对SO2胁迫下胡杨细胞抗氧化酶活性的影响 Fig. 6 Effects of NO antagonists on the antioxidant enzymes activities in SO2-stressed P. euphratica cells |
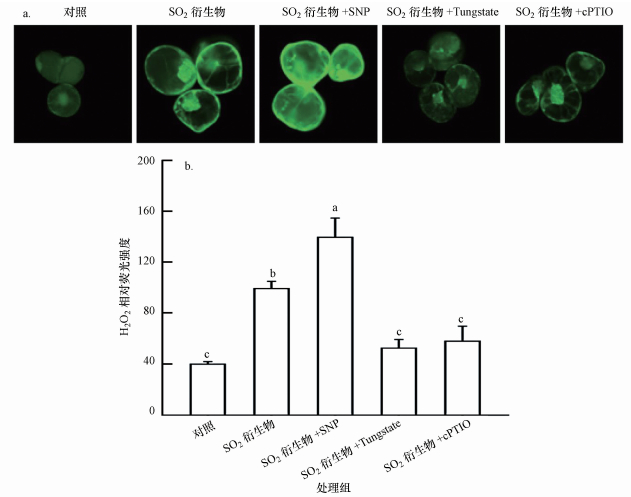 |
| 图 7 NO干扰剂对SO2胁迫下胡杨细胞H2O2水平的影响(a:代表性荧光图片;b:利用Image J软件计算的H2O2相对荧光强度) Fig. 7 Effects of NO antagonists on the H2O2 level in SO2-stressed P. euphratica cells |
较高浓度的SO2进入植物体后,以亚硫酸盐和亚硫酸氢盐的形式对植物组织、细胞和生物大分子产生毒性(Lewandowska et al.,2008).尹晶晶等(2010)报道2~4 mmol·L-1 SO2衍生物暴露3 h可使蚕豆表皮保卫细胞活性下降,细胞死亡率明显升高.本文利用1~5 mmol·L-1 SO2衍生物处理胡杨细胞3~12 h,发现SO2诱导的胡杨细胞死亡具有浓度效应和时间效应,SO2浓度越大,处理时间越长,胡杨细胞死亡率越高(图 1).
根据已有文献报道,SO2的毒性作用主要源于暴露引发的细胞活性氧水平升高.细胞内活性氧水平升高后,一方面可造成生物大分子(如DNA、蛋白质和膜脂)损伤,另一方面可使胞外Ca2+内流,并激活Caspase-like蛋白酶活性,最终导致细胞死亡(Li et al.,2012; Yi et al.,2012).H2O2和NO是在植物生长发育过程中起重要调节作用的信号分子,当植物受到逆境胁迫时,H2O2和NO迅速积累,激活下游信号,介导细胞死亡(De Michele et al.,2009; Sun et al.,2014).曾有学者在对萱草和万寿菊的叶表皮研究中发现,H2O2和NO参与调节SO2诱导的保卫细胞凋亡(Wei et al.,2013;2015).本实验用2 mmol·L-1 SO2衍生物处理胡杨细胞,随着处理时间的延长,细胞死亡率逐渐增加(图 1),同时胞内H2O2和NO水平也逐渐升高(图 2).本文进一步通过药理学实验,发现一定浓度的外源H2O2或NO供体SNP能够提高SO2胁迫下胡杨细胞的死亡率,而使用H2O2清除剂CAT和ASA、NO清除剂cPTIO、NO合成抑制剂钨酸钠后,SO2诱导的胡杨细胞死亡率明显降低(图 3),这些结果都表明,H2O2和NO参与调控SO2诱导的胡杨细胞死亡.
逆境胁迫下H2O2和NO在许多生理过程中都表现出相互协同性或依赖性(Bright et al.,2006; Qiao et al.,2014).De Michele等(2009)发现镉胁迫下NO诱导H2O2的产生,启动拟南芥悬浮细胞的程序性死亡.高温胁迫下,H2O2位于NO上游,通过增加热激蛋白积累来提高植物对高温的耐性(Wang et al.,2014).上述研究结果暗示,H2O2和NO信号分子在植物体内存在复杂的交叉互作关系.本研究显示,SO2胁迫后胡杨细胞内H2O2水平的升高先于NO(图 2),且快速产生的H2O2能够诱导NO水平升高(图 4).硝酸还原酶(NR)介导的NO合成是植物细胞内产生NO的重要途径.Desikan等(2002)在拟南芥保卫细胞中发现,H2O2通过提高NR活性来促进NO生成.与此类似,我们的研究也发现外源H2O2可以提高SO2胁迫下胡杨细胞的NR活性,促进胞内NO的产生,而利用抗氧化剂CAT和ASA清除H2O2后,NR活性和NO产生均受到明显抑制(图 4、图 5).这些结果表明,SO2胁迫下,胡杨细胞内快速产生的H2O2通过激活NR活性来促进NO产生.另一方面,胞内产生的NO也能够影响H2O2水平.本文结果显示,SO2胁迫下,外源NO供体SNP能够抑制抗氧化酶(CAT和APX)活性,增加胡杨细胞内的H2O2水平,而一定浓度的NO清除剂cPTIO和NO合成抑制剂钨酸钠均可提高CAT和APX活性,降低胞内H2O2水平(图 6、图 7),表明SO2胁迫下,胞内产生的NO能够通过抑制抗氧化酶活性来提高H2O2水平.这和Sun等(2014)报道的结果是相似的,他们也发现在植物细胞内,胁迫诱导产生的NO能够降低抗氧化酶活性,从而导致胞内H2O2大量积累.
综上,本文通过药理学实验初步证明了H2O2和NO在调控SO2诱导胡杨细胞死亡过程中的相互作用(图 8),对于二者在信号调节通路中的上下游关系并不明确,仍需进一步研究.
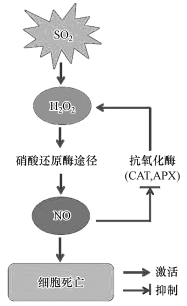 |
| 图 8 H2O2和NO在SO2诱导胡杨细胞死亡中的互作关系模式图 Fig. 8 A schematic model showing the crosstalk of H2O2 and NO in regulation of SO2-induced cell death of P. euphratica |
一定浓度的SO2衍生物可诱导胡杨细胞死亡,使细胞内H2O2和NO水平升高.H2O2与NO在胡杨细胞死亡过程中发挥信号调节作用,且存在相互作用关系.一方面,SO2胁迫下胡杨细胞快速产生的H2O2能够上调硝酸还原酶活性,促进NO生成;另一方面,NO可以通过抑制抗氧化酶活性(CAT和APX)来提高H2O2水平.H2O2与NO互作调控SO2诱导的胡杨细胞死亡.
| [${referVo.labelOrder}] | Brychkova G, Xia Z, Yang G, et al. 2007. Sulfite oxidase protects plants against sulfur dioxide toxicity[J]. The Plant Journal , 50 (4) : 696–709. DOI:10.1111/j.1365-313X.2007.03080.x |
| [${referVo.labelOrder}] | Bright J, Desikan R, Hancock J T, et al. 2006. ABA-induced NO generation and stomatal closure in Arabidopsis are dependent on H2O2 synthesis[J]. The Plant Journal , 45 (1) : 113–122. DOI:10.1111/tpj.2006.45.issue-1 |
| [${referVo.labelOrder}] | Choi D, Toda H, Kim Y, et al. 2014. Effect of sulfur dioxide (SO2) on growth and physiological activity in Alnus sieboldiana at Miyakejima Island in Japan[J]. Ecological Research , 29 (1) : 103–110. DOI:10.1007/s11284-013-1103-4 |
| [${referVo.labelOrder}] | De Michele R, Vurro E, Rigo C, et al. 2009. Nitric oxide is involved in cadmium-induced programmed cell death in Arabidopsis suspension cultures[J]. Plant Physiology , 150 (1) : 217–228. DOI:10.1104/pp.108.133397 |
| [${referVo.labelOrder}] | Disikan R, Griffiths R, Hancock J, et al. 2002. A new role for an old enzyme:Nitrate reductase-mediated nitric oxide generation is required for abscisic acid-induced stomatal closure in Arabidopsis thaliana[J]. Proceedings of the National Academy of Sciences , 99 (25) : 16314–16318. DOI:10.1073/pnas.252461999 |
| [${referVo.labelOrder}] | 付宝春, 魏爱丽, 翟晓燕, 等.2015. NO、ROS对诱导的万寿菊保卫细胞凋亡的调控[J]. 环境科学学报 , 2015, 35 (7) : 2289–2296. |
| [${referVo.labelOrder}] | Lang C, Popko J, Wirtz M, et al. 2007. Sulfite oxidase as key enzyme for protecting plants against sulfur dioxide[J]. Plant, Cell and Environment , 30 (4) : 447–455. DOI:10.1111/pce.2007.30.issue-4 |
| [${referVo.labelOrder}] | Lewandowska M, Sirko A. 2008. Recent advances in understanding plant response to sulfur-deficiency stress[J]. Acta Biochimica Polonica , 55 (3) : 457–471. |
| [${referVo.labelOrder}] | Li L, Yi H. 2012. Differential expression of Arabidopsis defense-related genes in response to sulfur dioxide[J]. Chemosphere , 87 (7) : 718–724. DOI:10.1016/j.chemosphere.2011.12.064 |
| [${referVo.labelOrder}] | 李蕊, 仪慧兰, 仪民.2015. 一氧化氮合酶途径参与SO2胁迫下蚕豆气孔运动调节[J]. 环境科学学报 , 2015, 35 (10) : 3406–3410. |
| [${referVo.labelOrder}] | 刘洁, 王省芬, 张桂寅, 等.2010. 棉花叶片硝酸还原酶活性的测定方法[J]. 河北农业大学学报 , 2010, 33 (4) : 1–4. |
| [${referVo.labelOrder}] | Lu Z, Streets D G, Zhang Q, et al. 2010. Sulfur dioxide emissions in China and sulfur trends in East Asia since 2000[J]. Atmospheric Chemistry and Physics , 10 (13) : 6311–6331. DOI:10.5194/acp-10-6311-2010 |
| [${referVo.labelOrder}] | Ma W, Xu W, Xu H, et al. 2010. Nitric oxide modulates cadmium influx during cadmium-induced programmed cell death in tobacco BY-2 cells[J]. Planta , 232 (2) : 325–335. DOI:10.1007/s00425-010-1177-y |
| [${referVo.labelOrder}] | Qiao W, Li C, Fan L. 2014. Cross-talk between nitric oxide and hydrogen peroxide in plant responses to abiotic stresses[J]. Environmental and Experimental Botany , 100 : 84–93. DOI:10.1016/j.envexpbot.2013.12.014 |
| [${referVo.labelOrder}] | Randewig D, Hamisch D, Herschbach C, et al. 2012. Sulfite oxidase controls sulfur metabolism under SO2 exposure in Arabidopsis thaliana[J]. Plant, Cell and Environment , 35 (1) : 100–115. DOI:10.1111/j.1365-3040.2011.02420.x |
| [${referVo.labelOrder}] | Shapiro R. 1977. Genetic effects of bisulfite[J]. Mutation Research , 39 : 149–176. DOI:10.1016/0165-1110(77)90020-3 |
| [${referVo.labelOrder}] | Sun J, Li L, Liu M, et al. 2010. Hydrogen peroxide and nitric oxide mediate K+/Na+ homeostasis and antioxidant defense in NaCl-stressed callus cells of two contrasting poplars[J]. Plant Cell, Tissue and Organ Culture , 103 (2) : 205–215. DOI:10.1007/s11240-010-9768-7 |
| [${referVo.labelOrder}] | Sun J, Zhan C, Deng S, et al. 2012. An ATP signalling pathway in plant cells:extracellular ATP triggers programmed cell death in Populus euphratica[J]. Plant, Cell and Environment , 35 (5) : 893–916. DOI:10.1111/pce.2012.35.issue-5 |
| [${referVo.labelOrder}] | Sun J, Yu Y, Li Z, et al. 2014. 1-Butanol triggers programmed cell death in Populus euphratica cell cultures[J]. Plant Growth Regulation , 74 (1) : 33–45. DOI:10.1007/s10725-014-9894-z |
| [${referVo.labelOrder}] | Wang Y, Loake GJ, Chu C. 2013. Cross-talk of nitric oxide and reactive oxygen species in plant programed cell death[J]. Frontiers in Plant Science , 4 : 314. |
| [${referVo.labelOrder}] | Wang L, Guo Y, Jia L, et al. 2014. Hydrogen peroxide acts upstream of nitric oxide in the heat shock pathway in Arabidopsis seedlings[J]. Plant Physiology , 164 (4) : 2184–2196. DOI:10.1104/pp.113.229369 |
| [${referVo.labelOrder}] | Wei A, Xin X, Wang Y, et al. 2013. Signal regulation involved in sulfur dioxide-induced guard cell apoptosis in Hemerocallis fulva[J]. Ecotoxicology and Environmental Safety , 98 (1) : 41–45. |
| [${referVo.labelOrder}] | Wei A, Fu B, Wang Y, et al. 2015. Involvement of NO and ROS in sulfur dioxide induced guard cells apoptosis in Tagetes erecta[J]. Ecotoxicology and Environmental Safety , 114 : 198–203. DOI:10.1016/j.ecoenv.2015.01.024 |
| [${referVo.labelOrder}] | Yi H, Yin J, Liu X, et al. 2012. Sulfur dioxide induced programmed cell death in Vicia guard cells[J]. Ecotoxicology and Environmental Safety , 78 (1) : 281–286. |
| [${referVo.labelOrder}] | 尹晶晶, 刘鑫, 仪慧兰, 等.2010. 二氧化硫诱导蚕豆气孔保卫细胞死亡效应研究[J]. 环境科学学报 , 2010, 30 (12) : 2512–2517. |
| [${referVo.labelOrder}] | 赵均, 薛美昭, 白鹤丽, 等.2014. 硝酸还原酶介导的NO合成参于SO2引发的拟南芥气孔运动的调节[J]. 环境科学学报 , 2014, 34 (3) : 796–800. |
 2016, Vol. 36
2016, Vol. 36


