硫是植物必需的大量营养元素之一, 主要源于根从土壤中吸收的SO42-.二氧化硫(SO2)作为常见的大气污染物, 可通过叶面气孔进入植物体, 尤其在土壤硫含量不足时, 由气孔进入的SO2可作为植物硫营养的补充.SO2进入植物细胞内溶于水产生SO32-和HSO3-, SO32-可经氧化途径转化为SO42-后储存, SO42-或SO32-经硫还原途径产生半胱氨酸(Cys), Cys是细胞内其他含硫氨基酸、肽和蛋白质的前体.当植株暴露于高浓度SO2后, 组织细胞中活性氧(ROS)水平提高(Li et al., 2012a), 引起植株氧化胁迫.谷胱甘肽(GSH)是植物细胞中普遍存在的抗氧化小分子物质, 具有多种生物学功能, 如维持胞内氧化还原平衡, 清除胞内过多的ROS, 调节相关防御酶活性等(Zechmann, 2014).GSH能通过抗坏血酸(AsA)-GSH循环清除胞内过多的H2O2, 也能直接清除胞内过多的ROS, 保护植物免受氧化损伤(Hasanuzzaman et al., 2010).谷胱甘肽过氧化物酶(GPX)和谷胱甘肽硫转移酶(GST)是细胞中以GSH为底物的重要解毒酶, 参与细胞氧化还原和代谢解毒过程, 在维持胞内氧化还原平衡中具有不可替代的作用, 对植物逆境适应具有重要意义(Haluskova et al., 2009).
植物中一氧化氮(NO)合成有两条主要的酶促途径, 即依赖于精氨酸的一氧化氮合酶(NOS)途径和依赖于NADPH的硝酸还原酶(NR)途径, 其中, NR能够利用NADPH作为电子供体, 催化硝酸盐转变为亚硝酸盐, 产生NO(Lozano et al., 2010).NO作为植物体内重要的内源性分子, 在植物应对干旱、低温、盐等非生物胁迫时, 能清除细胞内O2·-, 激活抗氧化酶(Arasimowicz et al., 2007; Felicitas et al., 2013; Hasanuzzaman et al., 2010).同时, 有研究表明, 拟南芥GSTU24为NO调控的靶基因(Parani et al., 2004).课题组前期的研究发现:拟南芥暴露于SO2后, 细胞内的含硫抗氧化物Cys、GSH含量与GPX、GST活性提高(李利红等, 2010);NR途径介导NO合成增加并参与SO2暴露期间气孔运动的调节(赵均等, 2014).但NR途径是否与SO2胁迫期间植物的含硫抗氧化物水平有关未见报道.拟南芥NR有两个编码基因NIA1和NIA2, nia1nia2突变体植株的NR活性仅为野生型的0.5%(Wilkinson et al., 1993).因此, 本文利用nia1nia2突变体NR途径缺失的特点, 研究SO2胁迫生理中NR途径对Cys和GSH含量、相关防御酶活性及基因转录的影响, 探讨NR途径在植物抗逆生理中的作用.
2 材料与方法(Materials and methods) 2.1 材料准备取拟南芥(Arabidpsis thaliana L.) Columbia野生型及NR缺失突变体nia1nia2种子(中科院植物研究所张文浩老师惠赠), 播种于营养土中.4 ℃春化2 d后置于培养间, 光照度≥3000 lx, 光/暗周期为16 h/8 h, 培养温度22 ℃, 相对湿度约60%.
2.2 SO2熏气处理取4周龄拟南芥植株, 设SO2熏气组和对照组, 分别置于体积0.45 m3的密闭箱内, 适应1 d后采用静态熏气方式进行SO2暴露.根据K2S2O5+2HCl→2KCl+H2O+2SO2的原理, 定量产生SO2气体, 同时采用甲醛吸收副玫瑰苯胺分光光度法测定SO2浓度, 使箱内浓度保持在30 mg·m-3.每天熏气16 h, 熏气期间保持光照度(Li et al., 2012a).取同期熏气组和对照组拟南芥叶片用于生理指标检测和RT-PCR分析.
2.3 Cys、GSH含量与GPX、GST活性的测定Cys含量测定采用Gaitonde(1967)的方法, 还原型GSH含量测定参照Anderson(1985)的方法, GPX活性测定采用Wendel(1981)的方法, GST活性测定采用Habig等(1974)的CDNB比色法.计算3个重复实验组的平均值和标准误, F检验后, 采用Duncan方法进行多重比较, 分析不同处理组与对照组之间的差异显著性.图中用相同字母表示差异不显著, 不同字母表示差异显著(p < 0.05).
2.4 RT-PCR分析RNA提取采用Trizol法.以总RNA为模板, 用EasyScript First-Strand cDNA Synthesis SuperMix (北京全式金生物技术有限公司)反转录合成cDNA, 采用特异性引物扩增目标基因序列.谷胱甘肽硫转移酶GSTU24基因的引物序列为5′-TGAGGACAA GAATTGCTCTGGC-3′和5′-TGACCTTCTCTGACTCA GGCAG-3′(Zhao et al., 2014).谷胱甘肽过氧化物酶GPX7基因的引物序列为5′-TTCGCTGCAAATC CGTCTCC-3′和5′-ACGTTAACGATCAACAAAGG-3′ (Li et al., 2012b).Actin2为内参基因, 引物序列为5′-TTCCTCATGCCATCCTCCGTCTT-3′和5′-CAGCG ATACCTGAGAACATAGTGG-3′.
RT-PCR体系20 μL包括:1~1.2 μL cDNA、2 μL dNTP混合物(2.5 mmol·L-1)、0.3 μL TransTaq HiFi DNA Polymerase、2.5 μL 10× BufferⅡ、正反向引物(10 μmol·L-1)各1.0 μL.GSTU24基因PCR条件为:94 ℃预变性5 min;94 ℃变性30 s, 56 ℃退火30 s, 72 ℃延伸1 min(30个循环);72 ℃延伸10 min.GPX7基因PCR条件为:95 ℃预变性5 min;94 ℃变性1 min, 62 ℃退火45 s, 72 ℃延伸1 min(30个循环);72 ℃延伸10 min.PCR产物用1%琼脂糖凝胶电泳检测.
3 结果(Results) 3.1 SO2熏气对拟南芥Cys和GSH含量的影响拟南芥野生型和突变体nia1nia2植株中Cys含量(以鲜重计)在非熏气组(对照组)间无明显差异, 在SO2暴露后均快速增加, 暴露6 h后显著高于非熏气组并在熏气期间维持较高水平(图 1), 其中, 野生型Cys含量增幅为340%~800%, 突变体Cys含量增幅为310%~430%, SO2暴露组野生型拟南芥Cys含量的增幅普遍略高于突变体.
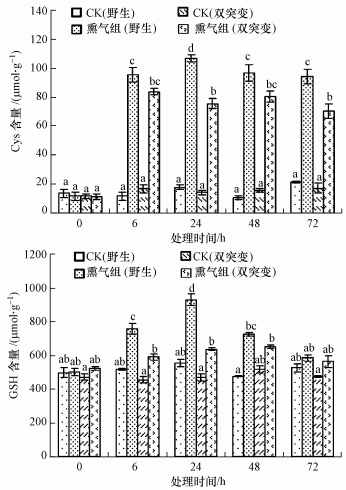 |
| 图 1 SO2熏气对拟南芥叶片Cys和GSH含量的影响 Fig. 1 Effect of SO2 fumigation on the contents of Cys and GSH in Arabidopsis leaves |
非熏气组拟南芥植株中GSH含量(以鲜重计)野生型略高于突变体, SO2暴露后GSH含量显著增加, 达到峰值后回落.SO2暴露组野生型GSH含量在熏气24 h时最高, 增幅为68%, 突变体GSH含量在熏气48 h时最高, 增幅为25%.熏气6~48 h期间野生型GSH含量增幅明显高于突变体(图 1).
上述结果说明, NR途径与植株GSH合成有关, NR途径参与了SO2暴露下Cys和GSH的合成增强过程.
3.2 SO2熏气对拟南芥GPX和GST活性的影响非熏气组拟南芥植株中GPX和GST的活性(均以protein计)野生型高于突变体, SO2暴露后野生型和突变体拟南芥中GPX和GST活性均迅速升高, 野生型GPX活性增幅为72%~200%, GST活性增幅为44%~94%;突变体GPX活性增幅为40%~120%, GST活性增幅为11%~48%, 野生型中酶活性增幅明显高于突变体(图 2).
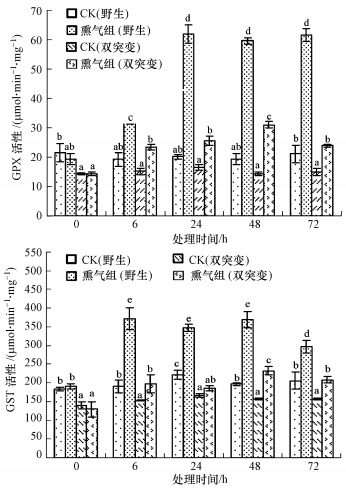 |
| 图 2 SO2熏气对拟南芥叶片GPX和GST活性的影响 Fig. 2 Effect of SO2 fumigation on GPX and GST activities in Arabidopsis leaves |
此外, SO2暴露组野生型拟南芥中GPX和GST活性提升速度快于突变体, 如GPX活性在SO2暴露24 h达到峰值, 而突变体GPX活性在48 h达到峰值.
上述结果说明, NR途径与植物细胞内的氧化还原酶GPX和重要解毒酶GST活性有直接关系, NR途径参与逆境生理中植物的氧化还原反应与细胞解毒过程.
3.3 SO2熏气对拟南芥GSTU24和GPX7基因转录水平的影响前期我们通过Affymetrix全基因组芯片检测野生型拟南芥SO2熏气72 h后基因表达谱特征, 发现拟南芥GST家族中最大的亚家族GSTU中GSTU1、GSTU3、GSUT4、GSTU24在SO2熏气组表达上调, R值分别为1.5、2.9、1.1和1.1(Li et al., 2012a);GPX2、GPX7在SO2熏气组表达上调, GPX7上调表达较为明显(Li et al., 2012b).因此, 本文选择GSTU24和GPX7基因, 检测SO2熏气6 h后基因表达的变化, 同时分析NO对基因GSTU24和GPX7的调控作用.
RT-PCR检测熏气6 h拟南芥GST和GPX编码基因的表达水平发现, 对照组野生型和突变体中GSTU24基因的转录水平明显不同, SO2暴露组野生型拟南芥中GSTU24上调表达, 但突变体中熏气组与对照组间无明显差异(图 3);对照组野生型和突变体间GPX7转录水平亦存在差异, SO2暴露组野生型和突变体中GPX7转录上调.研究结果表明, 拟南芥NR缺失突变体与野生型植株中GST和GPX编码基因的表达水平不同, 对SO2的响应过程亦不同.
 |
| 图 3 SO2熏气6 h拟南芥基因的差异表达 Fig. 3 Different gene expression in Arabidopsis after SO2 fumigation 6 hours |
环境中高浓度的SO2能引起植物的多种响应, 如抗氧化能力增强、抗氧化和防御相关基因表达上调等(Zhao et al., 2014; 李利红等, 2010).NR途径作为植物体合成NO的一种主要途径, 在植物应对生物和非生物胁迫中有重要作用(Clarke et al., 2000; Zhao et al., 2009).本研究发现, 拟南芥植株体内NR途径与SO2暴露期间植株体内含硫抗氧化物水平和基因转录调节有关, 说明NR途径参与了植物适应大气高浓度SO2的过程.
拟南芥植株暴露于较高浓度SO2时, 细胞内硫同化作用的底物增加, 植株硫同化作用增强, 促使Cys合成加速, GSH水平升高(李利红等, 2010), 本文发现NR突变体与野生型拟南芥对SO2具有相似的反应.GSH作为植物胞内普遍存在的小分子抗氧化物质, 一方面, 能作为GST和GPX的底物, 提高酶的反应效率;另一方面, 可通过AsA-GSH循环, 将H2O2还原成H2O, 降低氧化损伤.本研究发现, GSH含量在SO2暴露组野生型和突变体中均升高, 但野生型增幅显著高于突变体;因SO2暴露期间氧化还原反应消耗还原型GSH产生氧化型谷胱甘肽(GSSG), 导致GSH含量下降;野生型植株中高活性的GPX和GST, 促使酶作用底物GSH的消耗增多, 使野生型植株中GSH含量降幅高于突变体, 野生型与突变体内GSH含量差异缩小.
GPX和GST是植物细胞内重要的防御和解毒酶, GST能催化GSH与胞内亲电子有毒物质结合从而脱毒, GPX利用GSH将脂质过氧化物和H2O2还原成相应的醇和H2O, 缓解逆境对植物造成的损伤(Marshall et al., 2012).文中非熏气组野生型拟南芥GPX和GST活性均高于突变体, SO2暴露组野生型植株中GPX和GST活性增幅显著高于突变体, 即NR功能的缺失影响了逆境应答过程中AsA-GSH循环与相关抗氧化代谢和GST解毒过程, 说明植物NR途径能影响拟南芥植株正常生理下含硫抗氧化酶的活性, 以及SO2胁迫下植株的氧化还原反应和细胞解毒过程.
NR途径是植物细胞内NO合成的重要途径, 为验证NO的调节作用, 我们用NO供体硝普钠(SNP)喷淋NR突变体植株后检测发现, SNP可以提高NR突变体中GSH含量和GST活性, 且SO2熏气组增幅大于非熏气对照组, 说明由NR途径产生的NO参与调节植物细胞中的含硫抗氧化物水平, NO可促进SO2暴露组植株GSH水平和GST活性的提高(另文发表).由此认为, NR途径介导的NO合成参与调节了拟南芥植株SO2暴露期间氧化还原过程和代谢解毒过程.本结果不仅证实了逆境生理中NO介导的抗氧化能力提升, 与前人的研究结果一致(Boogar et al., 2014; Gill et al., 2013; Shi et al., 2014), 还为NO参与调节胞内含硫抗氧化物水平提供了直接证据.
植物应答环境胁迫的一个重要途径是基因转录改变, 课题组前期研究发现, SO2熏气72 h后野生型拟南芥中TRXh8、GSTU3、GSTU24、GPX7基因上调表达(李利红等, 2010;李利红, 2012;Zhao et al., 2014).本文检测SO2熏气6 h后野生型和突变体拟南芥组织中GSTU24和GPX7基因的转录水平, 进一步证实了SO2胁迫期间含硫抗氧化酶编码基因的差异转录, 并发现了由于NR基因功能缺失, 突变体与野生型中基因表达模式的不同, 为NR参与拟南芥含硫抗氧化酶编码基因的转录调节提供了依据.虽然因拟南芥中GST和GPX编码基因众多, 所检测的基因转录水平与酶活性变化趋势难以一一对应, 但文中结果清晰地表明, 拟南芥NR途径直接参与调控拟南芥植株含硫抗氧化酶编码基因的转录, 进而增强植株的逆境适应性.
5 结论(Conclusions)野生型拟南芥植株体内含硫抗氧化酶GST和GPX活性高于突变体, 一定浓度的SO2暴露后, 野生型与突变体植株体内Cys和GSH水平及GST和GPX活性提高, 且野生型中增幅高于突变体, 拟南芥GST和GPX编码基因GSTU24和GPX7在野生型和突变体中差异表达并对SO2响应程度不同, 表明NR途径参与了逆境生理中植物基因转录的调节, 通过提高含硫抗氧化物水平增强组织抗氧化能力, 缓解胁迫对拟南芥植株造成的损伤, 从而增强拟南芥植株对SO2胁迫的适应性.
| [${referVo.labelOrder}] | Anderson M E. 1985. Determination of glutathione and glutathione disulfide in biological samples[J]. Methods in Enzymology , 113 : 548–555. DOI:10.1016/S0076-6879(85)13073-9 |
| [${referVo.labelOrder}] | Arasimowicz M, Floryszak-Wieczorek J. 2007. Nitric oxide as a bioactive signalling molecule in plant stress responses[J]. Plant Science , 172 (5) : 876–887. DOI:10.1016/j.plantsci.2007.02.005 |
| [${referVo.labelOrder}] | Boogar A R, Salehi H, Jowkar A. 2014. Exogenous nitric oxide alleviates oxidative damage in turfgrasses under drought stress[J]. South African Journal of Botany , 92 : 78–82. DOI:10.1016/j.sajb.2014.02.005 |
| [${referVo.labelOrder}] | Clarke A, Desikan R, Hurst R D, et al. 2000. NO way back: Nitric oxide and programmed cell death in Arabidopsis thaliana suspension cultures[J]. The Plant Journal , 24 : 667–670. DOI:10.1046/j.1365-313x.2000.00911.x |
| [${referVo.labelOrder}] | Felicitas G, Jörg D, Frank G. 2013. Nitric oxide, antioxidants and prooxidants in plant defence response[J]. Frontiers in Plant Science , 4 : 419. |
| [${referVo.labelOrder}] | Gaitonde M K. 1967. A spectrophotometric method for the direct determination of cysteine in the presence of other naturally occurring amino acids[J]. Biochemical Journal , 104 (2) : 627–633. DOI:10.1042/bj1040627 |
| [${referVo.labelOrder}] | Gill S S, Hasanuzzaman M, Nahar K, et al. 2013. Importance of nitric oxide in cadmium stress tolerance in crop plants[J]. Plant Physiology and Biochemistry , 63 : 254–261. DOI:10.1016/j.plaphy.2012.12.001 |
| [${referVo.labelOrder}] | Habig W H, Pabst M J, Jakoby W B. 1974. Glutathione S-transferases the first enzymatic step in mereapturic acid formation[J]. The Journal of Biological Chemistry , 249 : 7130–7139. |
| [${referVo.labelOrder}] | Haluskova L, Valentovicova K, Huttova J, et al. 2009. Effect of abiotic stresses on glutathione peroxidase and glutathione S-transferase activity in barley root tips[J]. Plant Physiology and Biochemistry , 47 : 1069–1074. DOI:10.1016/j.plaphy.2009.08.003 |
| [${referVo.labelOrder}] | Hasanuzzaman M, Hossain M A, Fujita M. 2010. Physiological and biochemical mechanisms of nitric oxide induced abiotic stress tolerance in plants[J]. American Journal of Plant Physiology , 5 (6) : 295–324. DOI:10.3923/ajpp.2010.295.324 |
| [${referVo.labelOrder}] | Li L, Yi H. 2012a. Differential expression of Arabidopsis defense-related genes in response to sulfur dioxide[J]. Chemosphere , 87 (7) : 718–724. DOI:10.1016/j.chemosphere.2011.12.064 |
| [${referVo.labelOrder}] | Li L, Yi H. 2012b. Effect of sulfur dioxide on ROS production, gene expression and antioxidant enzyme activity in Arabidopsis plants[J]. Plant Physiology and Biochemistry , 58 : 46–53. DOI:10.1016/j.plaphy.2012.06.009 |
| [${referVo.labelOrder}] | Lozano J J, Leon J. 2010. Enhanced abscisic acid-mediated responses in nia1nia2noa1-2 triple mutant impaired in NIA/NR-and AtNOA1-dependent nitric oxide biosynthesis in Arabidopsis[J]. Plant Physiology , 152 : 891–903. DOI:10.1104/pp.109.148023 |
| [${referVo.labelOrder}] | 李利红, 仪慧兰, 武冬梅.2010. 二氧化硫胁迫诱发拟南芥植株含硫抗氧化物水平提高[J]. 应用与环境生物学报 , 2010, 16 (5) : 613–616. |
| [${referVo.labelOrder}] | 李利红.2012.二氧化硫胁迫下拟南芥防御基因的差异表达及表观遗传调控机制研究[D].太原:山西大学 http://cdmd.cnki.com.cn/article/cdmd-10108-1012484958.htm |
| [${referVo.labelOrder}] | Marshall K, Ashwil K, Ndiko L. 2012. Caspase-like enzymatic activity and the ascorbate-glutathione cycle participate in salt stress tolerance of maize conferred by exogenously applied nitric oxide[J]. Plant Signaling & Behavior , 7 (3) : 349–360. |
| [${referVo.labelOrder}] | Parani M, Rudrabhatla S, Myers R, et al. 2004. Microarray analysis of nitric oxide responsive transcripts in Arabidopsis[J]. Plant Biotechnology Journal , 2 : 359–366. DOI:10.1111/pbi.2004.2.issue-4 |
| [${referVo.labelOrder}] | Shi H T, Ye T T, Zhu J K, et al. 2014. Constitutive production of nitric oxide leads to enhanced drought stress resistance and extensive transcriptional reprogramming in Arabidopsis[J]. Journal of Experimental Botany , 65 (15) : 4119–4131. DOI:10.1093/jxb/eru184 |
| [${referVo.labelOrder}] | Wendel A. 1981. Glutathione peroxidase[J]. Methods in Enzymology , 77 : 325–333. DOI:10.1016/S0076-6879(81)77046-0 |
| [${referVo.labelOrder}] | Wilkinson J Q, Crawford N M. 1993. Identification and characterization of a chlorate-resistant mutant of Arabidopsis thaliana with mutations in both nitrate reductase structural genes NIA1 and NIA2[J]. Molecular Genetics and Genomics , 239 : 289–297. |
| [${referVo.labelOrder}] | Zechmann B. 2014. Compartment-specific importance of glutathione during abiotic and biotic stress[J]. Frontiers in Plant Science , 5 : 566. |
| [${referVo.labelOrder}] | Zhao M G, Chen L L, Zhang L, et al. 2009. Nitric reductase-dependent nitric oxide production is involved in cold acclimation and freezing tolerance in Arabidopsis[J]. Plant Physiology , 151 : 755–767. DOI:10.1104/pp.109.140996 |
| [${referVo.labelOrder}] | Zhao J, Yi H. 2014. Genome-wide transcriptome analysis of Arabidopsis response to sulfur dioxide fumigation[J]. Molecular Genetics and Genomics , 289 : 989–999. DOI:10.1007/s00438-014-0870-0 |
| [${referVo.labelOrder}] | 赵均, 薛美昭, 仪慧兰, 等.2014. 硝酸还原酶介导的NO合成参与SO2引发的拟南芥气孔运动的调节[J]. 环境科学学报 , 2014, 34 (3) : 796–800. |
 2016, Vol. 36
2016, Vol. 36


