2. 中国科学院武汉植物园, 武汉 430074
2. Wuhan Botanical Garden, Chinese Academy of Sciences, Wuhan 430074
孔雀石绿(Malachite Green, MG)是一种极易溶于水的三苯甲烷类染料, 可广泛应用于印染、食品加工、医药、水产养殖和工业等各个领域中, 尤其在水产养殖中, 孔雀石绿可作为驱虫剂、杀虫剂、防腐剂广泛用于预防与治疗水霉病、鳃霉病和小瓜虫病等(刘军等, 2006;Chaturvedi et al., 2013).但其广泛使用造成的负面效应, 如对哺乳动物细胞、水生生物和其他有机生命体的致癌致畸效应也逐渐凸现出来, 引起了科学界的广泛关注(Fessard et al., 1999;Zhang et al., 2009;Srivastava et al., 2013).因此, 美国、日本、英国等许多国家和地区立法严禁使用孔雀石绿, 且该染料已被美国食品和药物管理局(US Food and Drug Administration)列为致癌性测试的优先化学物质之一, 也被我国列入《食品动物禁用的兽药及其化合物清单》中, 禁止用于所有食品动物(刘军等, 2006;Srivastava et al., 2013).
吸附、化学沉淀、光降解、渗透和膜过滤等理化处理技术已被用于高残留、高毒性、高致畸致癌性的孔雀石绿污染处理(Rahman et al., 2005;Papinutti et al., 2006;Hameed et al., 2009;Han et al., 2010;Zhou et al., 2014), 然而, 理化处理方法往往费用昂贵且易产生二次污染.生物处理技术作为一种环境友好型且高效低耗的处理手段而受到青睐(Chen et al., 2009;Jing et al., 2009).本课题组针对生物处理技术实际应用中受温度、pH值、碳氮含量等环境因素影响较大的难题, 致力于筛选环境适应性更强的染料降解菌株, 已相继报道了多株可高效降解孔雀石绿和甲基橙等染料的菌株, 如Enterobacter sp. DH9、Aeromonas sp. DH6等(都林娜等, 2014;Du et al. 2014).但总体而言, 当前的研究工作多集中在降解行为的研究上, 而有关降解机制的研究则相对较为薄弱.因此, 本实验在前期研究工作的基础上研究菌株CV-v的降解行为, 同时对该菌株降解孔雀石绿的降解机制进行探讨, 以期为指导实际染料污染水体修复垫定理论基础.
2 材料与方法(Materials and methods) 2.1 菌种来源菌株CV-v来源于常年被皮革废水污染的污泥中, 保藏于中国典型培养物保藏中心(CCTCC M 2015177)(都林娜等, 2014).
2.2 培养基与试剂孔雀石绿(Malachite Green, λmax=620 nm)属于三苯甲烷类染料, 购自国药集团化学试剂有限公司;其它生化试剂均为国产分析纯.
碳源影响实验培养基母液(pH=7.0, g·L-1):Na2HPO4 15.13, KH2PO4 3.0, NaCl 0.5, NH4Cl 1.0, MgSO4·7H2O 0.491, CaCl2·2H2O 0.026.氮源影响实验培养基母液(pH=7.0, g·L-1):Na2HPO4 15.13, KH2PO4 3.0, NaCl 0.5, MgSO4·7H2O 0.491, CaCl2·2H2O 0.026.其他因子影响实验培养基母液(pH=7.0)为2.0 g·L-1的酵母粉溶液.LB培养基(pH=7.0~7.2, g·L-1):蛋白胨10, 酵母膏5, NaCl 10.
2.3 菌株CV-v对孔雀石绿的脱色特性研究 2.3.1 碳氮源对孔雀石绿脱色的影响将供试碳、氮源(碳源:葡萄糖、乳糖、半乳糖、蔗糖、麦芽糖、果糖、木糖和淀粉;氮源:氯化铵、硝酸钠、牛肉浸提物、酵母粉、蛋白胨、谷氨酸和甘氨酸)分别添加至培养基中, 使其终浓度为2.0 g·L-1.灭菌后, 添加已灭菌的终浓度为100 mg·L-1的孔雀石绿, 接种等量菌株CV-v过夜培养物(菌体干重为0.1~0.2 g·L-1), 并于30 ℃、180 r·min-1条件下振荡培养, 定时取样测定.
2.3.2 pH值对孔雀石绿脱色的影响用1.0 mol·L-1的HCl或NaOH将培养基初始pH值分别调为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0.灭菌后, 添加已灭菌的终浓度为100 mg·L-1的孔雀石绿, 接种等量菌株CV-v过夜培养物(菌体干重为0.1~0.2 g·L-1), 并于30 ℃、180 r·min-1条件下振荡培养, 定时取样测定.
2.3.3 温度对孔雀石绿脱色的影响设定温度梯度分别为10、20、30、40和50 ℃.培养基灭菌后, 添加已灭菌的终浓度为100 mg·L-1的孔雀石绿, 接种等量菌株CV-v过夜培养物(菌体干重为0.1~0.2 g·L-1), 并于180 r·min-1条件下振荡培养, 定时取样测定.
2.3.4 染料浓度对孔雀石绿脱色的影响分别调整初始染料浓度为100、200、300、400、500、600、700、800、900和1000 mg·L-1, 接种等量菌株CV-v过夜培养物(菌体干重为0.1~0.2 g·L-1), 并于30 ℃、180 r·min-1条件下振荡培养, 定时取样测定.
2.3.5 金属离子对孔雀石绿脱色的影响分别向培养基中添加终浓度为1.0、2.0和3.0 mmol·L-1的CuCl2、FeCl3、CaCl2、ZnCl2、MgCl2和MnCl2, 灭菌后, 添加已灭菌的终浓度为100 mg·L-1的孔雀石绿, 接种等量菌株CV-v过夜培养物(菌体干重为0.1~0.2 g·L-1), 并于30 ℃、180 r·min-1条件下振荡培养, 6 h后取样测定.
所有实验均重复3次, 并同时设置对照实验.
2.3.6 菌株CV-v对孔雀石绿的脱色动力学研究在酵母粉溶液(2.0 g·L-1)中添加100 mg·L-1的孔雀石绿, 接种后, 每隔一定时间收集4 mL样品, 于12000 r·min-1下离心10 min后, 上清液在620 nm处测定吸光度.所有实验重复3次并同时设置对照实验.
2.4 菌株CV-v降解孔雀石绿的酶分析孔雀石绿脱色过程中的相关酶分析方法参照文献(Du et al., 2013).配制含有和不含有100 mg·L-1孔雀石绿的酵母粉溶液(2.0 g·L-1), 分别接种等量菌株CV-v过夜培养物(菌体干重为0.1~0.2 g·L-1), 并于30 ℃、180 r·min-1条件下振荡培养, 12 h后取出并收集菌体.菌体沉淀用无菌磷酸盐缓冲液(100 mmol·L-1, pH=7.4)冲洗3次后, 重悬于5 mL磷酸盐缓冲液中, 在冰浴条件下(4 ℃)进行超声破碎, 破碎条件为:200 W, 破碎99次, 每次破碎7 s, 破碎间隔时间为3 s.离心后取上清液, 作为粗酶液进行分析.
酪氨酸酶、漆酶、木质素过氧化物酶、锰过氧化物酶、NADH-DCIP还原酶及孔雀石绿还原酶酶活测定方法具体参见文献(Du et al., 2013).酪氨酸酶、漆酶、锰过氧化物酶和木质素过氧化物酶的一个单位定义为一个吸光度值变化, 单位为unit·min-1·mg-1(以protein计);NADH-DCIP还原酶活性用DCIP的消光系数(90 L·mmol-1·cm-1)计算;孔雀石绿还原酶活性用孔雀石绿的消光系数(1.47×105 L·mmol-1·cm-1)计算.
2.5 菌株CV-v降解孔雀石绿产物的测定 2.5.1 紫外可见光分光光度法(UV-Visible analysis)分别收集降解前(未加菌)和降解后(培养24 h后)的混合培养物, 并在10000 r·min-1条件下离心10 min, 取上清, 用Evolution 300分光光度计进行全波长扫描分析.
2.5.2 红外扫描光谱法(Fourier Transform Infrared Spectroscopy, FTIR)分别收集降解前(未加菌)和降解后(培养24 h后)的混合培养物, 并在10000 r·min-1条件下离心10 min, 取上清, 用Bruker VERTEX 70红外光谱仪在可清洗的水溶液专用透射池中进行红外扫描分析, 扫描波长范围为1000~3000 cm-1, 检测器系统为DigiTect.
2.5.3 气相质谱分析(Gas Chromatography-Mass Spectrometry, GC-MS)分别收集接种前和接种后的混合培养物4 mL, 经三苯甲烷萃取后, 用于降解产物的分析.采用Trace GC Ultra和ISQ II MS对降解产物进行分析.GC-MS柱为TG-35ms的石英毛细管柱(30 m ×0.25 m id, 0.25 μm), 柱温设定为从100 ℃程序升温至280 ℃(8 ℃·min-1), 10 min内升至280 ℃.载气(氦气)流速为1 mL·min-1, 注射器和检测器温度为250 ℃.降解产物的质谱分析在EI模式、70 eV条件下进行满扫.
3 结果与讨论(Results and discussion) 3.1 菌株CV-v对孔雀石绿的脱色特性 3.1.1 碳氮源对孔雀石绿脱色的影响碳氮源对菌株CV-v脱色孔雀石绿的影响如图 1所示.培养6 h后, 多数供试碳源对脱色没有显著影响, 而当培养时间超过12 h后, 所测碳源均对脱色有显著的促进效应, 其中, 葡萄糖对脱色的促进效果最为显著(图 1a).任倩等(2007)在报道中指出, 葡萄糖作为菌体生长基质的碳源, 对脱色有显著影响, 本研究进一步印证了该结论.在供试氮源中, 无机氮源(氯化铵和硝酸钠)对脱色没有显著影响, 而多数有机氮源(牛肉浸提物、酵母粉、蛋白胨、谷氨酸和甘氨酸)则对脱色有显著的影响, 其中, 酵母粉对脱色促进效果最优, 而谷氨酸则对脱色有微弱的抑制效应.
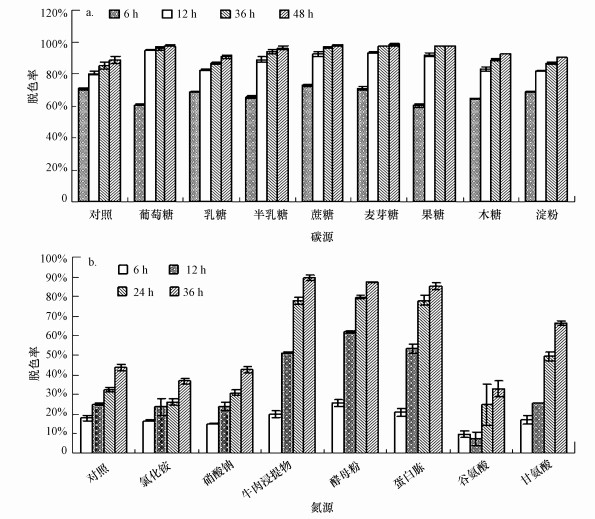 |
| 图 1 碳源(a)和氮源(b)对孔雀石绿脱色的影响 Fig. 1 Effect of carbon(a) and nitrogen(b) sources on decolorization of Malachite Green |
pH值和温度对孔雀石绿脱色的影响如图 2所示.当培养时间达到6 h后, 菌株CV-v在pH=3.0~10.0之间对孔雀石绿的脱色率均在80%以上, 而当培养时间达到12 h后, 该菌株对孔雀石绿的脱色率维持在90%以上.随着培养时间的延长, 当培养时间超过24 h后, 该菌株在pH=3.0~10.0之间可完全脱色孔雀石绿.安贤惠等(2013)的研究中分离了一株Aeromonas属的菌株, 该菌株对100 mg·L-1孔雀石绿的脱色率达到96.9%需要48 h以上的培养时间;Lv等(2013)的研究发现, 菌株Deinococcus radiodurans R1对孔雀石绿的脱色效果在pH 6.0~8.0之间时最优, 而当pH值低于6.0或高于8.0时, 该菌株对孔雀石绿的脱色率则急剧下降;本课题组以往的研究中分离的菌株Enterobater sp. DH9在pH=3.0~9.0之间时, 也需培养24 h以后, 对孔雀石绿的脱色率才能维持在90%以上.与以往已报道菌株相比, 本研究中的菌株CV-v在pH=3.0~10.0之间对孔雀石绿的12 h脱色率在90%以上, 脱色优势显著, 环境适应性强, 具有广阔的应用前景.
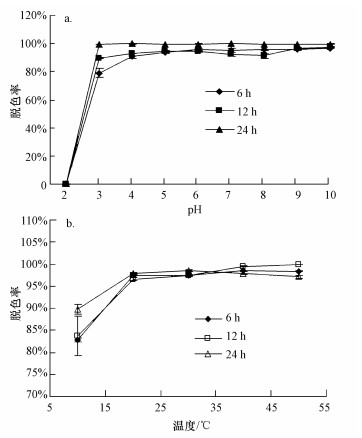 |
| 图 2 pH值(a)和温度(b)对孔雀石绿脱色的影响 Fig. 2 Effect of pH(a) and temperature(b) on decolorization of Malachite Green |
在温度为10~50 ℃的范围内, 菌株CV-v对孔雀石绿的6 h脱色率维持在80%以上;当培养时间超过24 h后, 该菌株在10~50 ℃内对孔雀石绿的脱色率在90%以上, 在20~50 ℃的条件下, 可完全脱色孔雀石绿, 温度适应性强, 进一步说明了该菌株具有较大的实际应用潜能.以往研究显示, 温度通过影响脱色菌株的生物量能够显著影响细菌对染料的脱色效率.一般而言, 在大多脱色体系中, 脱色率随着温度的升高而呈现上升趋势, 最大脱色率一般为菌体生长的最适温度, 只有某些嗜热菌株的最适脱色温度最高可达60 ℃左右(Pearce et al., 2003).相比较而言, 本研究中的菌株CV-v在50 ℃的条件下培养6 h后, 能够脱色95%以上的孔雀石绿(100 mg·L-1), 脱色优势显著, 适应性较强, 有望用于解决夏季温度过高, 污泥降解染料效率极低的实践难题.
3.1.3 染料浓度和金属离子对孔雀石绿脱色的影响染料浓度对孔雀石绿脱色的影响如图 3a所示.随着染料浓度的升高, 菌株CV-v对孔雀石绿的脱色率呈逐渐降低的趋势, 当孔雀石绿浓度低于500 mg·L-1时, 菌株CV-v在6 h内即可完全脱色孔雀石绿;当孔雀石绿浓度高于800 mg·L-1后, 脱色率降至80%以下, 而当孔雀石绿浓度为1000 mg·L-1时, 脱色率则降至40%左右.Pearce等(2003)的报道中指出, 染料作为目标污染物, 其浓度会显著影响脱色率, 当染料浓度过高时, 可能对降解菌株产生毒性效应.因此, 当孔雀石绿浓度超过500 mg·L-1后, 孔雀石绿对菌株CV-v的毒性效应开始显现出来, 进而导致脱色率的降低.
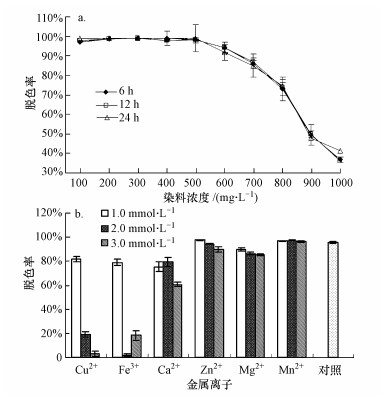 |
| 图 3 染料浓度(a)和金属离子(b)对孔雀石绿脱色的影响 Fig. 3 Effect of dye concentration(a) and metal ions(b) on decolorization of Malachite Green |
金属离子对孔雀石绿脱色的影响如图 3b所示.当供试金属离子浓度低于1 mmol·L-1时, 多数金属离子对脱色没有显著影响, 或有微弱促进或抑制作用;而当金属离子浓度升高至2 mmol·L-1时, 铜离子和铁离子已对脱色有显著的抑制效应;随着金属离子浓度的继续升高, 当其浓度达到3 mmol·L-1后, 钙离子和镁离子也开始对脱色有微弱的抑制效应.同时, 当体系中铁离子浓度达到3 mmol·L-1后, 孔雀石绿脱色率有所提升, 这可能是因为在该浓度下, 铁离子开始发挥絮凝作用, 进而导致孔雀石绿脱色率的升高.总体而言, 3 mmol·L-1以下浓度的锰离子对该菌株脱色孔雀石绿有较好的促进作用.
3.1.4 菌株CV-v对孔雀石绿的脱色动力学特征Das等(2010)的报道中指出, 微生物对染料的脱色动力学可以用零级(式(1))、一级(式(2))和二级模型(式(3))进行模拟.
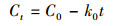
|
(1) |
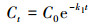
|
(2) |
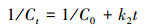
|
(3) |
式中, Ct表示染料在t时的浓度(mg·L-1), C0表示染料溶液的初始浓度(mg·L-1), t表示培养时间(min), k0、k1和k2分别指零级、一级和二级速率常数.基于以上公式, 将本研究中的动力学实验数据拟合后做图, 结果如图 4所示.实验结果表明, 菌株CV-v对孔雀石绿脱色的动力学实验数据与模型2拟合度最高(R2=0.9755), 而与模型1(R2=0.7745)和模型3(R2=0.677)的拟合度较低.因此, 菌株CV-v对孔雀石绿脱色的动力学特征可以用一级模型来进行解释.
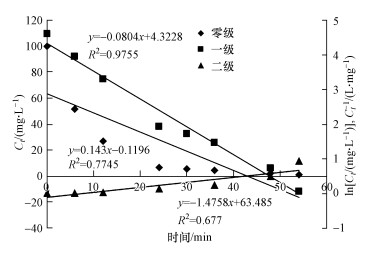 |
| 图 4 菌株CV-v对孔雀石绿的脱色动力学特征 Fig. 4 The kinetic characteristics of Malachite Green decolorization by strain CV-v |
已有报道显示, 染料的微生物降解主要由微生物体内的相关酶催化引起, 其中, 酪氨酸酶、漆酶、木质素过氧化物酶、锰过氧化物酶和NADH-DCIP还原酶等已被证实可能与染料的微生物降解相关(Shedbalkar et al., 2008).本研究中菌株CV-v降解孔雀石绿过程中相关酶活结果见表 1.如表 1所示, 孔雀石绿降解过程中, 酪氨酸酶、漆酶、木质素过氧化物酶和NADH-DCIP还原酶的酶活性在降解后都略有升高, 但这种变化趋势不显著(p>0.05), 说明这些酶与菌株CV-v降解孔雀石绿关系不大.而锰过氧化物酶和孔雀石绿还原酶的酶活性则在降解后有显著升高(p < 0.05), 说明这两种酶可能与菌株CV-v降解孔雀石绿相关.有研究显示, 锰过氧化物酶发挥催化作用需要锰离子的参与(李旭东等, 2008), 而本研究中锰过氧化物酶的酶活性在降解后升高与金属离子影响实验研究中发现的锰离子促进脱色的现象相互印证.
| 表 1 菌株CV-v降解孔雀石绿相关酶的酶活性 Table 1 The enzyme activities relative to degradation of Malachite Green by strain CV-v |
利用UV-visible全波长扫描(200~800 nm)对孔雀石绿脱色前后进行分析的实验结果如图 5所示.已有研究表明, 微生物对染料的脱色若由生物降解引起, 则染料的特征吸收峰在脱色后完全消失, 可产生新的产物吸收峰;若脱色由生物吸附引起, 则脱色前后的全波长扫描图谱中的吸收峰呈比例性降低, 且不产生新的吸收峰(Khataee et al., 2010;Parshetti et al., 2010).因此, 由图 5可知, 孔雀石绿的特征吸收峰(620 nm)在脱色后完全消失, 同时, 210 nm处的吸收峰略有升高, 且300~400 nm之间吸光度较脱色前也略有升高, 表明该菌株对孔雀石绿的脱色是由生物降解引起.
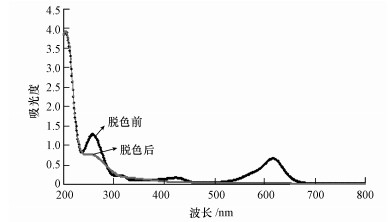 |
| 图 5 孔雀石绿脱色前后的全波长扫描图谱 Fig. 5 UV-visible spectrum of Malachite Green before and after decolorization |
进一步的FTIR扫描分析图谱(1000~3000 cm-1)如图 6所示.对比孔雀石绿降解前后的红外扫描图谱可以发现, 降解后产生的新吸收峰峰位主要位于2754、1976、1710、1641、1550、1530和1366 cm-1处.经检索可知, 波数为2754 cm-1处的吸收峰可能是由于—OH基团的伸缩振动引起的, 波数为1976 cm-1处的吸收峰可能是由苯环上的—CH基团的伸缩振动引起的, 波数为1710 cm-1处的吸收峰可能是由脂肪酮的—CO基团的伸缩振动引起的, 波数为1641 cm-1处的吸收峰可能是由二芳酮的—CO基团的伸缩振动引起的, 波数为1550、1530 cm-1处的吸收峰可能是由—NH2基团的伸缩振动引起的, 波数为1366 cm-1处的吸收峰可能是由芳胺的—NH2基团的伸缩振动引起的(吴瑾光1994).因此, 孔雀石绿降解后出现的新的产物基团主要包括—OH、—CO和—NH2.
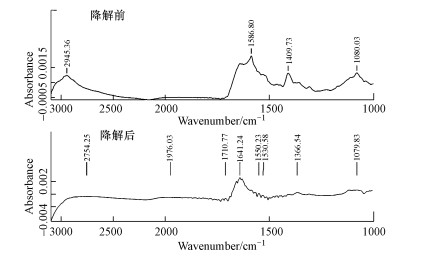 |
| 图 6 孔雀石绿脱色前后的FTIR图谱 Fig. 6 FTIR spectrum of Malachite Green before and after decolorization |
孔雀石绿降解前后的GC-MS分析结果表明, 孔雀石绿降解的主要检出产物为二甲氨基二苯甲酮(保留时间为14.07 min), 具体如图 7所示.该产物与GC-MS NIST数据库中的标准物比对的相似度为70.3%.从二甲氨基二苯甲酮质谱图上来看, 该产物的特征离子片段主要为:77(82)、105(28)、148(100)和225(36), 与GC-MS NIST数据库中的标准物基本一致, 可以推断二甲氨基二苯甲酮为孔雀石绿降解的中间产物之一.
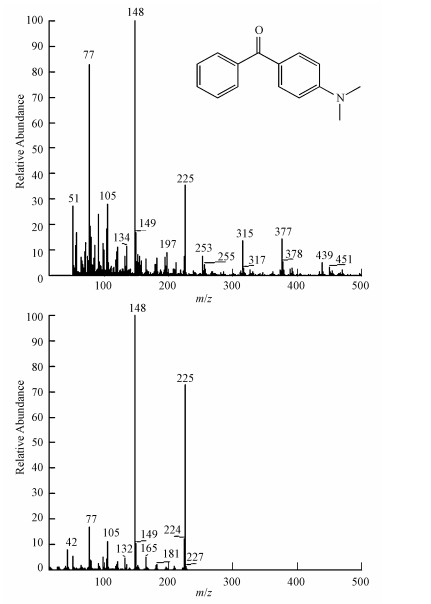 |
| 图 7 二甲氨基二苯甲酮与GC-MS NIST数据库中的标准物比对的质谱图 Fig. 7 Mass spectrum of (dimethyl amino-phenyl)-phenyl-methanone compared to the standard in GC-MS NIST database |
通过孔雀石绿降解中间产物的分析, 可以推测菌株CV-v降解孔雀石绿的主要降解途径为孔雀石绿经孔雀石绿还原酶、锰过氧化物酶等降解相关酶的催化, 降解生成二甲氨基二苯甲酮和4-羟基-N, N-二甲基苯铵, 二者可能通过进一步的脱甲基反应生成含—NH2基团的产物.
4 结论(Conclusions)1) 本研究通过单因素实验获知温度、pH值、碳氮源、金属离子和初始染料浓度等环境因素对菌株CV-v脱色孔雀石绿的影响, 结果表明, 该菌株的pH和温度适应能力较强, 应用前景广阔.此外, 菌株CV-v对孔雀石绿脱色的动力学符合一级动力学模型.
2) 酶分析实验结果表明, 锰过氧化物酶和孔雀石绿还原酶可能参与菌株CV-v降解孔雀石绿的反应过程.
3) 代谢产物分析结果表明, 菌株CV-v降解孔雀石绿的主要产物为二甲氨基二苯甲酮和4-羟基-N, N-二甲基苯铵, 二者可能通过进一步的脱甲基反应生成含—NH2基团的产物.
| [${referVo.labelOrder}] | 安贤惠, 张静, 王秀丽, 等.2013. 一株孔雀石绿降解菌的分离筛选及其初步鉴定[J]. 淮海工学院学报(自然科学版) , 2013, 22 (4) : 77–81. |
| [${referVo.labelOrder}] | Chaturvedi V, Bhange K, Bhatt R, et al. 2013. Biodetoxification of high amounts of malachite green by a multifunctional strain of Pseudomonas mendocina and its ability to metabolize dye adsorbed chicken feathers[J]. Journal of Environmental Chemical Engineering , 1 : 1205–1213. DOI:10.1016/j.jece.2013.09.009 |
| [${referVo.labelOrder}] | Chen C Y, Huang Y T, Ho I H, et al. 2009. Biological decolorization of dye solution containing malachite green by Pandoraea pulmonicola YC32 using a batch and continuous system[J]. Journal of Hazardous Materials , 172 : 1439–1445. DOI:10.1016/j.jhazmat.2009.08.009 |
| [${referVo.labelOrder}] | Das D, Charumathi D, Das N. 2010. Combined effects of sugarcane bagasse extract and synthetic dyes on the growth and bioaccumulation properties of Pichia fermentans MTCC 189[J]. Journal of Hazardous Materials , 183 : 497–505. DOI:10.1016/j.jhazmat.2010.07.051 |
| [${referVo.labelOrder}] | 都林娜, 泮琇, 李刚, 等.2014. 孔雀石绿高效脱色菌株的筛选、鉴定与脱色特性研究[J]. 环境科学学报 , 2014, 34 (1) : 143–151. |
| [${referVo.labelOrder}] | 都林娜, 李刚, 卢晓明, 等.2014. Enterobacter sp. CV-v对甲基橙的脱色特性与条件优化[J]. 中国环境科学 , 2014, 34 (12) : 3175–3181. |
| [${referVo.labelOrder}] | Du L N, Li G, Xu F C, et al. 2014. Rapid decolorization of Methyl Orange by a novel Aeromonas sp.strain DH-6[J]. Water Science & Technology , 69 : 2004–2013. |
| [${referVo.labelOrder}] | Du L N, Zhao M, Li G, et al. 2013. Biodegradation of Malachite Green by Micrococcus sp.strain BD15: Biodegradation pathway and enzyme analysis[J]. International Biodeterioration & Biodegradation , 78 : 108–116. |
| [${referVo.labelOrder}] | Fessard V T, Godard T, Huet S, et al. 1999. Mutagenicity of malachite green and leucomalachite green in vitro tests[J]. Journal of Applied Toxicology , 19 : 421–430. DOI:10.1002/(ISSN)1099-1263 |
| [${referVo.labelOrder}] | Hameed B H, Lee T W. 2009. Degradation of malachite green in aqueous solution by Fenton process[J]. Journal of Hazardous Materials , 164 : 468–472. DOI:10.1016/j.jhazmat.2008.08.018 |
| [${referVo.labelOrder}] | Han R, Wang Y, Sun Q, et al. 2010. Malachite green adsorption onto natural zeolite and reuse by microwave irradiation[J]. Journal of Hazardous Materials , 175 : 1056–1061. DOI:10.1016/j.jhazmat.2009.10.118 |
| [${referVo.labelOrder}] | Jing W, Gil J B, Kyoung-Sook K I M, et al. 2009. Isolation and characterization of Pseudomonas otitidis WL-13 and its capacity to decolorize triphenylmethane dyes[J]. Journal of Environmental Science , 21 : 960–964. DOI:10.1016/S1001-0742(08)62368-2 |
| [${referVo.labelOrder}] | Khataee A R, Dehghan G, Ebadi A, et al. 2010. Biological treatment of a dye solution by Macroalgae Chara sp.: Effect of operational parameters, intermediates identification and artificial neural network modeling[J]. Bioresource Technology , 101 : 2252–2258. DOI:10.1016/j.biortech.2009.11.079 |
| [${referVo.labelOrder}] | 刘军, 胡华军, 张明洲, 等.2006. 渔药孔雀石绿的毒性、危害和检测现状[J]. 浙江农业学报 , 2006, 18 (5) : 397–340. |
| [${referVo.labelOrder}] | 李旭东, 荚荣, 程晓滨, 等.2008. 锰过氧化物酶的固态发酵及其对染料的脱色作用[J]. 环境科学学报 , 2008, 28 (3) : 490–495. |
| [${referVo.labelOrder}] | Lv G Y, Cheng J H, Chen X Y, et al. 2013. Biological decolorization of malachite green by Deinococcus radiodurans R1[J]. Bioresource Technology , 144 : 275–280. DOI:10.1016/j.biortech.2013.07.003 |
| [${referVo.labelOrder}] | Parshetti G K, Telke A A, Kalyani D C, et al. 2010. Decolorization and detoxification of sulfonated azo dye methyl orange by Kocuria rosea MTCC 1532[J]. Journal of Hazardous Materials , 176 : 503–509. DOI:10.1016/j.jhazmat.2009.11.058 |
| [${referVo.labelOrder}] | Papinutti L, Mouso N, Forchiassin F. 2006. Removal and degradation of the fungicide dye malachite green from aqueous solution using the system wheat bran-Fomes sclerodermeus[J]. Enzyme and Microbial Technology , 39 : 848–853. DOI:10.1016/j.enzmictec.2006.01.013 |
| [${referVo.labelOrder}] | Pearce C I, Lloyd J R, Guthrie J T. 2003. The removal of colour from textile wastewater using whole bacterial cells: a review[J]. Dyes and Pigments , 58 : 179–196. DOI:10.1016/S0143-7208(03)00064-0 |
| [${referVo.labelOrder}] | 任倩, 蒋丽娟, 宋炜, 等.2007. 孔雀石绿降解茵M3的分离鉴定及降解特性研究[J]. 生态与农村环境学报 , 2007, 23 (3) : 65–69. |
| [${referVo.labelOrder}] | Rahman I A, Saad B, Shaidan S, et al. 2005. Adsorption characteristics of malachite green on activated carbon derived from rice husks produced by chemical-thermal process[J]. Bioresource Technology , 96 : 1578–1583. DOI:10.1016/j.biortech.2004.12.015 |
| [${referVo.labelOrder}] | Shedbalkar U, Dhanve R, Jadhav J. 2008. Biodegradation of triphenylmethane dye cotton blue by Penicillium ochrochloron MTCC 517[J]. Journal of Hazardous Materials , 157 : 472–479. DOI:10.1016/j.jhazmat.2008.01.023 |
| [${referVo.labelOrder}] | Srivastava S, Sinha R, Roy D. 2004. Toxicological effects of malachite green[J]. Aquatic Toxicology , 66 : 319–329. DOI:10.1016/j.aquatox.2003.09.008 |
| [${referVo.labelOrder}] | 吴瑾光. 1994. 近代傅立叶变换红外光谱技术及应用[M]. 北京: 科学技术文献出版社: 573 -648. |
| [${referVo.labelOrder}] | Zhang Y Z, Zhou B, Zhang X P, et al. 2009. Interaction of malachite green with bovine serum albumin: Determination of the binding mechanism and binding site by spectroscopic methods[J]. Journal of Hazardous Materials , 163 : 1345–1352. DOI:10.1016/j.jhazmat.2008.07.132 |
| [${referVo.labelOrder}] | Zhou Y M, Wang X H, Zhang M, et al. 2014. Removal of Pb(II) and malachite green from aqueous solution by modified cellulose[J]. Cellulose , 21 : 2797–2809. DOI:10.1007/s10570-014-0282-7 |
 2016, Vol. 36
2016, Vol. 36


