砷(As)是自然界中广泛分布的一种有毒致癌类物质,普遍存在于大气、水体、岩石和土壤中(刘英俊等,1984;Pontius et al.,1994).近年来,随着工业的发展和深层地下水的大量开采,多地出现了区域性砷中毒事件,由此砷污染逐渐受到人们的关注,砷污染修复技术的研究也已成为环境科学研究的热点之一(Hughes et al .,2002; Smedley et al .,2002; 赵凯等,2015).
吸附法是用于处理含砷污水的主要方法(韩彩芸等,2011; 高小娟等,2012),具有生产成本低、工艺简单、吸附材料来源广泛等优点.近年来,随着环境纳米技术的发展,利用纳米材料作为除砷吸附剂用以解决环境砷污染问题逐渐成为研究的热点,其中,以Fe3O4为代表的铁系纳米材料因表现出具有独特的理化性质和较高的砷吸附容量而成为研究的重点(Suvasis et al .,2003).纳米级Fe3O4粒子具有极大的砷吸附容量,其吸附性能与粒子的分散程度有关.然而,细小的纳米粒子因较高的表面能,容易发生团聚形成大粒径的粒子沉淀,使得除砷效果下降.林本兰等(2006)利用油酸对纳米Fe3O4进行表面改性,结果发现,表面改性能明显减小制备的纳米材料的粒径.He等(2007)发现,多糖稳定剂-淀粉可以通过静电稳定效应和空间位阻作用有效地阻止Fe3O4粒子发生团聚,形成具有高比表面积和良好稳定性的纳米粒子悬浮液.张峰等(2009)则采用聚乙二醇(PEG)作为活性剂制得了粒径小、分散性好的Fe3O4纳米粒子.由于淀粉的生产成本低,绿色环保,使用过程无二次污染,作为纳米材料稳定剂具有广阔的应用前景.因此,本研究拟采用淀粉稳定Fe3O4纳米粒子作为吸附材料进行砷的吸附动力学实验研究,并进一步对其在天然高砷地下水修复应用方面进行研究.张丽萍等(2014)的调查结果显示,大同盆地地下水中的砷主要以砷酸盐形式存在,因此,本文以淀粉稳定的Fe3O4纳米粒子悬浮液作为吸附剂,研究反应时间、pH值、初始浓度和腐殖酸对As(V)吸附的影响,并初步探讨稳定纳米Fe3O4粒子应用于天然富砷地下水修复中的效果.以期为运用淀粉稳定的Fe3O4纳米悬浮液原位修复地下水中的砷污染提供必要的理论基础和实践依据.
2 材料与方法(Materials and methods) 2.1 实验材料六水氯化铁(FeCl3·6H2O)、七水硫酸亚铁(FeSO4·7H2O)、可溶性淀粉((C6H10O5)n)、腐殖酸、氢氧化钠(NaOH)、盐酸(HCl)均为分析纯;As(V)标准溶液购自济南众标科技有限公司.
天然富砷地下水采自山西省朔州市山阴县大营村地下深度为25~28 m的含水层,As浓度为382 μg·L-1,pH为8.0.
2.2 实验仪器PHB-1精密pH计(上海三信仪表厂)、D8 ADVANCE X射线衍射仪(XRD,德国Bruker公司)、JSM-7001F热场发射扫描电镜(SEM,日本电子株式会社)、JEM-2010高分辨透射电子显微镜(TEM,日本电子株式会社)、novAA 400P原子吸收光谱仪(德国Analytik Jena公司)、HS55型氢化物发生器(德国Analytik Jena公司)、CF16RXII型高速离心机(日本日立公司);CPA225D型电子分析天平(德国Sartorius公司),感量为10-6 g.
2.3 四氧化三铁纳米粒子的制备淀粉稳定Fe3O4纳米粒子采用在An等(2011)方法基础上改良的方法制备.首先,将100 mL按FeCl3·6H2O与FeSO4·7H2O摩尔比2∶1比例配成的铁溶液转移到700 mL 0.172%的淀粉溶液中,搅拌10 min,使溶液充分混匀.然后,将浓度为2 mol·L-1的NaOH溶液逐滴滴入混合溶液中,pH计监测溶液pH变化,pH稳定达到11时停止滴入,继续搅拌5 min,整个过程一直在氮气保护下进行.最后,密封瓶口置于暗处晶化48 h,使用前用盐酸调节纳米悬浮液pH到8.0,得到待用稳定的Fe3O4纳米粒子悬浮液.最终悬浮液的Fe3O4纳米粒子质量浓度为776 mg·L-1,淀粉含量为0.15%.同时不加淀粉,其他步骤和制备方法同上,制备未加稳定剂的Fe3O4纳米粒子.
2.4 纳米粒子的表征用X射线衍射仪(XRD)对制备好的纳米粒子进行分析测定.未稳定的纳米粒子由于团聚作用产生沉淀,因此,可以直接用磁体进行沉淀收集,再冷冻干燥得到固体颗粒.淀粉稳定的纳米粒子由于粒径小、分散性好,所以对其进行直接冷冻干燥处理得到固体颗粒.
用扫描电镜(SEM)和透射电镜(TEM)对制备好的纳米粒子进行分析测定.对未稳定的纳米粒子进行搅拌,使其均匀分散于悬浮液中,再快速移取一定体积的悬浮液用定量的乙醇稀释均匀.稳定的纳米粒子则直接移取相同体积悬浮液用同样的操作步骤稀释在乙醇中.最后,吸取适量的稳定和未稳定纳米粒子稀释液滴加在铜片上,电热真空干燥处理后进行电镜测定.
2.5 吸附动力学测定配置100 mg·L-1的砷溶液,使用时逐级稀释至所需浓度.将合成好稳定的Fe3O4悬浮液和一定浓度的砷溶液分别加入到一系列60 mL的棕色试剂瓶中混匀,用0.1 mol·L-1 HCl或0.1 mol·L-1 NaOH调节溶液pH值,混合溶液总体积为30 mL,pH为8.0,砷浓度为375 μg·L-1,Fe3O4质量为2.33 mg.28 ℃条件下,将棕色试剂瓶置于恒温振荡器中以180 r·min-1的转速振荡,每隔一定时间取样后15000 r·min-1离心30 min,取上清液,用氢化物发生原子吸收光谱法测定溶液中砷的浓度.
2.6 吸附等温曲线测定60 mL的棕色试剂瓶分为4组,将合成好稳定的Fe3O4悬浮液和一系列浓度的砷溶液分别加入到各组试剂瓶中混匀,用0.1 mol·L-1HCl或0.1 mol·L-1 NaOH调节溶液pH值,混合溶液总体积为30 mL,Fe3O4质量为2.33 mg,各组pH分别为3.0、6.0、8.0、11.0,每组选取砷的浓度为2.5、5、10、20、30、40、50、75 mg·L-1.28 ℃条件下,将棕色试剂瓶置于恒温振荡器中以180 r·min-1的转速振荡60 h后15000 r·min-1离心30 min,取上清液,用氢化物发生原子吸收光谱法测定溶液中砷的浓度.砷的吸附量计算公式为:

|
(1) |
式中,qe为吸附量(mg·g-1),c0为砷的初始浓度(mg·L-1),ce为砷的平衡浓度(mg·L-1),V为混合溶液的总体积量(mL),m为Fe3O4的加入量(g).
2.7 初始浓度和腐殖酸(HA)对吸附的影响在温度为28 ℃的条件下,将合成好的稳定纳米Fe3O4悬浮液和一定浓度的砷溶液分别加入到3组棕色试剂瓶中混匀,溶液总体积为30 mL,pH为8.0,砷浓度分别为375、500和1000 μg·L-1,Fe3O4质量为2.33 mg,其余步骤同2.5 节.在同样28 ℃的条件下,取一定量的腐殖酸溶液与一定浓度的砷溶液于60 mL的棕色试剂瓶中混匀,溶液总体积为30 mL,pH为8.0,砷浓度为1000 μg·L-1,腐殖酸浓度为25 mg·L-1,其余步骤同2.6节.
2.8 纳米粒子对天然富砷地下水砷的吸附在温度为28 ℃的条件下,将合成好的稳定Fe3O4纳米粒子悬浮液和一定体积的天然高砷地下水分别加入到3组棕色试剂瓶中混匀,溶液总体积为30 mL,具体混合比例如表 1所示,其余步骤同2.6节.
| 表 1 稳定Fe3O4纳米粒子与天然地下水的混合比例 Table 1 The mixing proportion of starch-coated Fe3O4 and groundwater |
图 1为Fe3O4纳米粒子的XRD图谱.由图可知,未稳定和淀粉稳定的Fe3O4纳米粒子XRD图谱都出现了Fe3O4的特征峰,但由于悬浮溶液中存在NaCl,因此,淀粉稳定Fe3O4纳米粒子图谱出现了NaCl的特征峰.除此之外,图谱并无其他明显的杂质峰出现,且与Fe3O4标准图谱相一致,说明无论是稳定还是未稳定的条件下制备得到的都是纯度较高的Fe3O4纳米粒子(Zhou et al.,2001).稳定Fe3O4纳米粒子的衍射峰明显变宽,表明淀粉作为稳定剂使得Fe3O4纳米粒子的粒径减小(Si et al .,2004).
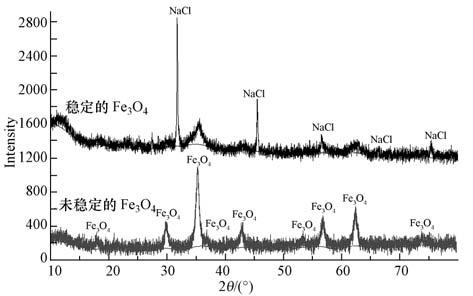 |
| 图 1 Fe3O4纳米粒子的XRD图谱 Fig. 1 X-ray diffraction pattern of Fe3O4 nanoparticles |
图 2是Fe3O4纳米粒子的SEM图像.由图 2a可知,经过48 h后,未稳定的Fe3O4纳米粒子绝大部分都团聚沉淀,淀粉稳定的Fe3O4纳米粒子则分散性良好,未出现沉淀现象.原因可能是作为稳定剂的淀粉包覆在Fe3O4纳米粒子表面,由于空间位阻和电荷排斥作用克服了能使粒子间发生团聚作用的范德华力和磁性吸力,从而使得纳米粒子能均匀地分散在水中.通过图 2a能清晰地看到未稳定Fe3O4纳米粒子的外貌特征,可知粒子间的团聚现象严重,大量粒径小于50 nm的纳米粒子发生团聚形成一个具大的粒子团.而稳定的Fe3O4纳米粒子由于表面有一层淀粉包覆,图 2b并不能很好地反映出稳定纳米粒子的外貌特征.因此,进一步运用透射电镜(TEM)对其进行表征,结果见图 3.由图 3可知,淀粉稳定的Fe3O4纳米粒子分散性良好,呈单一类球状,粒子粒径都小于30 nm,与An等(2011)制备的分散性良好的淀粉稳定Fe3O4纳米粒子粒径为10~30 nm的结论一致.
 |
| 图 2 Fe3O4纳米粒子的SEM图(a.未稳定Fe3O4,b.稳定Fe3O4) Fig. 2 SEM images of Fe3O4 nanoparticles |
 |
| 图 3 稳定Fe3O4纳米粒子的TEM图 Fig. 3 TEM images of starch-coated Fe3O4 nanoparticles |
图 4是Fe3O4纳米粒子对As(V)的吸附曲线.由图可知,无论是未稳定还是稳定的Fe3O4纳米粒子,对As(V)的去除率都随着吸附时间的延长而不断增加,吸附过程都包含3个阶段.初始阶段为As(V)的快速吸附过程,在吸附1 h后的去除率就分别达到了70%和80%以上,主要原因是该阶段纳米粒子的比表面积大,吸附活性点位多,吸附反应容易进行;随着吸附时间的增加,纳米粒子表面的吸附位点逐渐被占据,进入缓慢吸附阶段,此时的吸附作用主要依靠内扩散来进行;60 h后吸附就已经达到平衡,未稳定和稳定的Fe3O4粒子此时对As(V)的去除率分别为92%和99%,两者都表现出高效的除砷能力,与未稳定的Fe3O4纳米粒子相比,分散性较好的淀粉稳定的Fe3O4纳米粒子除As(V)效率更高.根据He等(2007)的研究,淀粉稳定的纳米铁粒子注入到地下水中进行原位修复,稳定的纳米铁颗粒因为良好的分散性能在注入到地下后具有较强的穿透性,能够实现与较大面积受污染地下水和土壤的接触,最终固定到土壤中达到去除污染物的效果.由此可见,采用淀粉作为稳定剂制备Fe3O4纳米粒子在进行地下水原位修复方面同样具有很大的应用潜力,在有效修复的同时,不会破坏土壤原本的结构和功能,符合原位修复的要求和理念(井柳新等,2010).
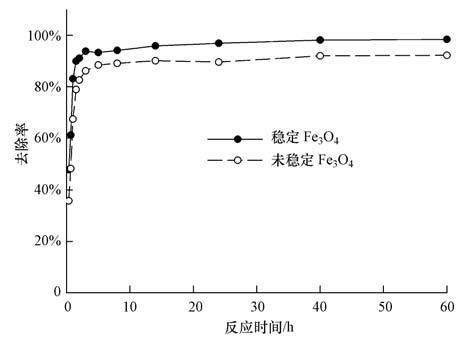 |
| 图 4 稳定和未稳定的Fe3O4对As(V)的吸附曲线 Fig. 4 As(V)adsorption time curve of starch-coated Fe3O4 and bare Fe3O4 |
为了进一步研究Fe3O4纳米粒子对As(V)的吸附动力学特征,采用吸附动力学模型方程对吸附过程进行模拟,包括Lagergren准一级动力学方程(式(2))和Ho准二级动力学方程(式(3))(Azizian et al.,2004; Ho et al.,2006).

|
(2) |

|
(3) |
式中,qe1、qe2分别为准一级、准二级动力学方程中的平衡吸附量(mg·g-1);k1(h-1)、k2(g·mg-1·h-1)分别为准一级和准二级吸附速率常数;qt是t时刻的吸附量(mg·g-1).以lg(qe1-qt)对t及t/qt对t作图,对数据进行线性拟合,拟合曲线见图 5,拟合具体参数见表 2.
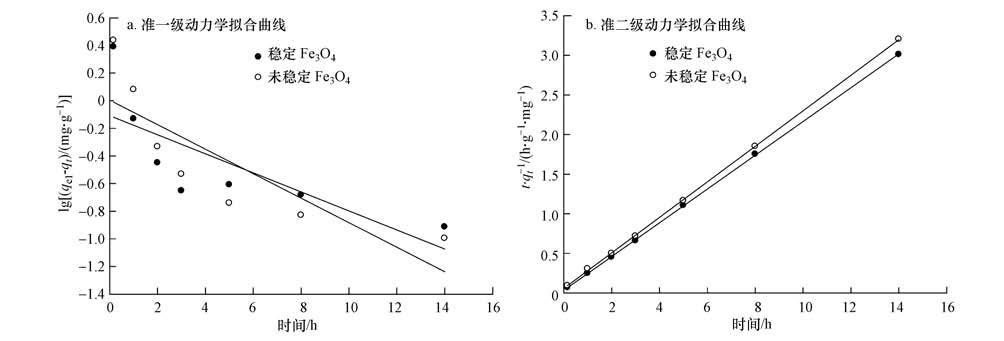 |
| 图 5 稳定和未稳定的Fe3O4吸附As(V)的吸附动力学拟合曲线 Fig. 5 As(V)adsorption kinetics curve fitting of starch-coated Fe3O4 and bare Fe3O4 |
| 表 2 稳定Fe3O4和未稳定的Fe3O4吸附砷的动力学拟合参数 Table 2 As(V)adsorption kinetic parameters fitting of starch-coated Fe3O4 and bare Fe3O4 |
由拟合结果可知,未稳定和稳定Fe3O4纳米粒子对As(V)的吸附过程符合准二级动力学方程,R2均达到了0.9999.此外,拟合得到的平衡吸附量与实际平衡吸附量相差不大,准二级动力学模型拟合得到未稳定和稳定Fe3O4纳米粒子对As(V)的平衡吸附量分别为4.46和4.69 mg·g-1,而实测值分别为4.45和4.75 mg·g-1,两者比较接近.准二级吸附动力学模型假设条件是吸附剂与吸附质之间存在电子的共用或转移,即吸附速率受到化学吸附机理的控制.因此,Fe3O4纳米粒子对水体中As(V)的吸附过程不仅包含物理吸附过程,还存在化学吸附的共同作用(Ho et al.,1999; Susmita et al.,2011).
3.3 不同pH条件下As(V)的吸附等温线由图 6可知,稳定的Fe3O4纳米粒子对As(V)的吸附容量随着初始浓度的增加而增大,随着pH的增大而逐渐减小.酸碱度影响Fe3O4纳米粒子吸附溶液中的As(V),可能是因为As(V)在溶液中主要是以砷酸根的形式存在,而随着pH的升高,溶液中的OH-逐渐增多,OH-与砷酸根离子竞争吸附点位,从而使纳米粒子对砷的吸附量减少(Jia et al.,2007).相反地,高pH有利于As(V)的解吸,为地下水中砷的富集创造条件,因此,高砷地下水一般呈弱碱性(Smedley et al.,2002; 郭华明等,2003).
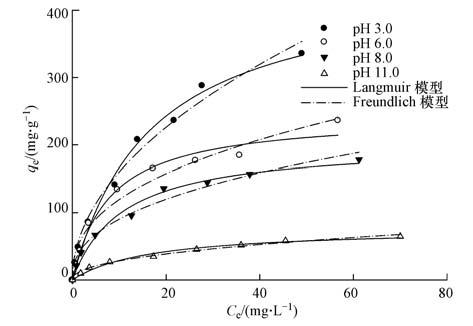 |
| 图 6 不同pH条件下As(V)的吸附等温拟合曲线 Fig. 6 As sorption isotherm curve fitting of starch-coated Fe3O4 with different pH |
为了进一步确定吸附剂和吸附质之间的相互作用和吸附机理,本研究采用了两种模型对吸附等温线进行拟合分析,分别是Langmuir单层吸附模型(式(4))和Freundlich经验模型(式(5))(张蕾等,2009).

|
(4) |
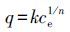
|
(5) |
式中,qe为吸附平衡时的吸附量(mg·g-1);b为等温方程的平衡常数(L·mg-1);ce为吸附达到平衡时砷的质量浓度(mg·L-1);qm为颗粒表面单层的饱和吸附量(mg·g-1);q为吸附量(mg·g-1);k为等温方程相关常数(L1/n·mg1-1/n·g-1);n为等温式中与吸附强度相关的常数.k越大,表明吸附效果越好;n越大,表明材料越容易吸附.以ce为横坐标,qe为纵坐标进行Langmuir和Freundlich模型拟合,得到各pH的非线性吸附等温线拟合曲线和具体拟合参数,结果如图 6及表 3所示.
| 表 3 不同pH条件下As(V)的吸附等温线拟合参数 Table 3 Fitting parameters of Langmuir and Freundlich isotherm models for As adsorption with different pH |
通过Langmuir拟合参数b可以计算得到判断吸附剂对吸附质亲和力的无量纲参数r.r的范围在0~1,表明有利吸附(Hu et al.,2011),计算公式如下:

|
(6) |
Langmuir假设的是吸附剂的表面存在大量的吸附活性中心点,吸附只在中心点上进行,每个点位吸附一个物质分子,点位数量和吸附物质的量是有限的,当吸附点位全部被占满时,吸附量就达到了饱和(Hu et al.,2011).由拟合结果可以看出,Langmuir单层吸附模型方程更准确地表达了稳定的Fe3O4纳米粒子吸附砷过程中吸附量与砷浓度的关系,这与谢亚巍(2012)的铁氧化物对砷的吸附特性研究的结论一致,也与前文得到的溶液中OH-能与砷酸根离子产生竞争吸附点位,随着pH的增大,吸附容量逐渐降低的结论一致.根据公式计算得到各pH条件下的最大吸附量依次为447.41、244.08、202.56、77.46 mg·L-1,说明稳定的Fe3O4纳米粒子对As(V)具有大的饱和吸附量,能有效地去除水体中的As(V).计算得到不同pH条件下各初始浓度的r都在0~1的范围内,说明纳米粒子对As的吸附为有利吸附,吸附反应易于进行.此外,Freundlich模型方程也能对吸附行为进行较好的拟合,不同pH拟合得到的k和n都比较大,也说明了纳米粒子对As(V)具有很强的吸附能力(宋娇艳等,2014).
| 表 4 不同pH条件下各初始质量浓度的r值 Table 4 r-values at different initial concentrations with different pH |
由图 7可知,随着溶液中As(V)浓度的增加,去除率逐渐降低.溶液初始As(V)浓度由375 μg·L-1增加到500 μg·L-1时,反应60 h后的去除率由99%下降到97%,增加单位浓度去除率下降的幅度比较小,说明淀粉稳定的Fe3O4纳米粒子表面的吸附点位还有大量空余,吸附还未达到完全饱和.当浓度增加到1000 μg·L-1时,去除率下降到了87%,单位浓度的去除率下降速率加快,说明此时溶液中As(V)浓度的继续增加会使得去除率下降速率加快.稳定的Fe3O4纳米粒子吸附溶液中的As(V)过程中,随着吸附时间的延长,pH会出现小幅度的下降.吸附60 h后溶液pH从初始的8.0变为7.8,60 h内的波动范围在7.5~8.0,波动幅度较小.因此,用稳定的Fe3O4纳米粒子吸附溶液中的As(V)可视为不会引起pH的改变.
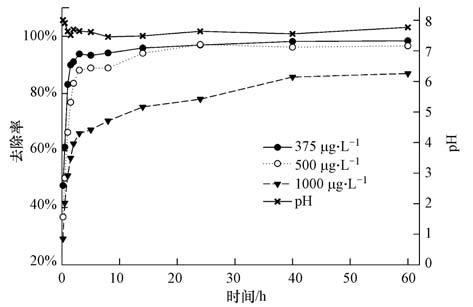 |
| 图 7 不同初始As(V)浓度的吸附时间曲线 Fig. 7 Adsorption curve of As(V)under different different initial As(V)concentrations |
本实验讨论的是溶于碱不溶于酸的腐殖酸对淀粉稳定的Fe3O4纳米粒子吸附水中As(V)的影响,腐殖酸中C元素的质量分数为56.95%.将0.1 g的腐殖酸溶于20 mL浓度为0.1 mol·L-1的NaOH溶液中,用蒸馏水定容到100 mL,得到质量浓度为1.0 g·L-1的备用腐殖酸溶液.
由表 5可知,溶液中只加入可溶性腐殖酸浓度为25 mg·L-1时不会对溶液的As(V)浓度产生影响,但腐殖酸的存在会极大地降低Fe3O4纳米粒子对As(V)的去除能力.浓度为1000 μg·L-1的As(V)溶液中加入的腐殖酸浓度为25 mg·L-1,Fe3O4纳米粒子对As(V)的去除率从未加有机质前的87%下降到71%,下降了16%.由此可见,可溶性腐殖酸的存在会抑制Fe3O4纳米粒子对溶液中As(V)的吸附作用.这可能一方面是因为加入腐殖酸之后,Fe3O4粒子表面的一部分吸附位点被腐殖酸占据,与砷酸根产生竞争吸附,抑制了对砷的吸附作用(陈锴等,2010);另一方面,腐殖酸能与溶液中的砷发生络合作用,产生As(V)-HA络合物,由于空间位阻和表面电荷等因素的影响,该络合物不易被Fe3O4纳米粒子吸附,从而抑制了对砷的吸附作用(Wang et al.,2006; 刘广良等,2011).陈锴等(2010)研究发现,当腐殖酸浓度为25 mg·L-1时,腐殖酸与砷酸根的竞争吸附作用是导致纳米粒子吸附砷能力下降的主要因素.但由表 5可知,溶液As(V)浓度为375 μg·L-1时,25 mg·L-1腐殖酸的加入并未对Fe3O4纳米粒子吸附作用产生明显的影响.可能是因为质量一定的纳米粒子对As(V)的吸附能力足以消除腐殖酸带来的阻碍作用,因此,去除率并没有引起大的变化.
| 表 5 腐殖酸对As(V)吸附的影响 Table 5 The effect of humic acid on the As(V)adsorption |
由表 6可知,淀粉稳定的Fe3O4纳米粒子对天然富砷地下水也具有较强的砷吸附能力,砷的去除率随着淀粉稳定的Fe3O4纳米粒子悬浮液投加量的增加而逐渐增大,当投加量与地下水体积比为1∶9时,去除率达到了95%.但与纳米粒子对标准As(V)溶液的吸附能力相比,吸附性能有所下降.这主要是由于天然富砷地下水成分复杂,不同离子之间产生了竞争吸附所致.同时,天然地下水中部分砷以活泼性更强的亚砷酸根形式存在,也降低了吸附材料对总砷的去除效率(郭华明等,2007).
| 表 6 稳定Fe3O4纳米粒子投加量对天然地下水砷吸附的影响 Table 6 The dosage effect of starch-coated Fe3O4 on the As adsorption in groundwater |
1) 利用共沉淀的方法以淀粉作为稳定剂制备的稳定Fe3O4纳米粒子与未加稳定剂制备的Fe3O4粒子相比,具有稳定性高、分散性好、在悬浮液中不易团聚沉降的特点.因此,从制备效果、环保和地下水原位修复应用的角度出发,以淀粉作为合成纳米粒子的稳定剂是较好的选择.
2) 研究表明,淀粉稳定的Fe3O4纳米粒子对溶液中的As(V)具有较强的吸附能力,吸附容量与溶液pH有关,随着pH增大,纳米粒子对As(V)的吸附容量逐渐减小.因此,运用Fe3O4粒子去除砷时还要考虑溶液的酸碱度,当碱性过大时吸附剂不宜用Fe3O4纳米粒子.Fe3O4对As(V)的吸附过程属于准二级动力学模型,吸附等温线更符合Langmuir单层吸附模型方程.
3) 在水溶液为弱碱性时,淀粉稳定的Fe3O4纳米粒子吸附溶液中As(V)的过程基本不会引起溶液酸碱度的变化.可溶性腐殖酸对纳米粒子吸附水体中As(V)具有较大的影响,其存在会降低纳米Fe3O4粒子的除砷能力.当溶液中腐殖酸的含量为25 mg·L-1时,纳米粒子对As(V)的去除率下降了16%.
4)淀粉稳定Fe3O4纳米粒子对天然富砷地下水也具有较强的吸附除砷能力,去除效率随着纳米粒子投加量的增加而增大.当纳米粒子投加量与地下水体积比为1∶9时,水体中总砷的去除率达到了95%.
| [1] | An B, Liang Q Q, Zhao D Y. 2011. Removal of arsenic(V) from spent ion exchange brine using a new class of starch-bridged magnetite nanoparticles[J]. Water Research , 45 (5) : 1961–1972. DOI:10.1016/j.watres.2011.01.004 |
| [2] | Azizian S. 2004. Kinetic models of sorption: Atheoretical analysis[J]. Journal of Colloid Interface Science , 276 : 47–52. DOI:10.1016/j.jcis.2004.03.048 |
| [3] | 陈锴, 李义连, 梁艳燕, 等.2010. 腐殖酸对As(V)在覆铁砂介质中吸附行为的影响[J]. 环境化学 , 2010, 29 (2) : 231–236. |
| [4] | 高小娟, 王璠, 汪启年.2012. 含砷废水处理研究进展[J]. 工业水处理 , 2012, 32 (2) : 10–15. |
| [5] | 郭华明, 王焰新, 李永敏.2003. 山阴水砷中毒区地下水砷的富集因素分析[J]. 环境科学 , 2003, 24 (4) : 60–67. |
| [6] | 郭华明, 杨素珍, 沈照理.2007. 富砷地下水研究进展[J]. 地球科学进展 , 2007, 22 (11) : 1109–1117. |
| [7] | 韩彩芸, 张六一, 罗永明, 等.2011. 吸附法处理含砷废水的研究进展[J]. 环境化学 , 2011, 30 (2) : 517–521. |
| [8] | He F, Zhao D Y. 2007. Manipulating the size and dispersibility of zerovalent iron nanoparticles by use of carboxymethyl cellulose stabilizers[J]. Environmental Science &Technology , 41 : 6216–6221. |
| [9] | He F.2007.Preparation,characterization,and applications of polysaccharide-stabilized metal nanoparticles for remediation of chlorinated solvents in soils and groundwater[D].Auburn:University of Auburn |
| [10] | Ho Y S. 2006. Review of secongd-order models for adsorption systems[J]. Journal of Hazardous Materials , 136 : 681–689. DOI:10.1016/j.jhazmat.2005.12.043 |
| [11] | Ho Y S, McKay G. 1999. Pseudo-second order model for sorption processes[J]. Process Biochem , 34 (5) : 451–465. DOI:10.1016/S0032-9592(98)00112-5 |
| [12] | Hughes M F. 2002. Arsenic toxicity and potential mechanisms of action[J]. Toxicology Letters , 133 (1) : 1–16. DOI:10.1016/S0378-4274(02)00084-X |
| [13] | Hu X J, Wang J S, Liu Y G, et al. 2011. Adsorption of chromium(VI) by ethylenediamine-modified cross-linked magnetic chitosan resin:Lsotherms,kinetics and thermodynamics[J]. Journal of Hazardous Mazardous Materials , 185 (1) : 306–314. DOI:10.1016/j.jhazmat.2010.09.034 |
| [14] | Jia Y F, Xu L Y, Wang X, et al. 2007. Infrared spectroscopic and X-ray diffraction characterization of the nature of adsorbed arsenate on ferrihydrite[J]. Geochim Cosmochim Acta , 71 (7) : 1643–1654. DOI:10.1016/j.gca.2006.12.021 |
| [15] | 井柳新, 程丽.2010. 地下水污染原位修复技术研究进展[J]. 水处理技术 , 2010, 36 (7) : 6–9. |
| [16] | 刘英俊, 曹励明, 李兆麟, 等. 1984. 元素地球化学[M]. 北京: 科学出版社 . |
| [17] | 刘广良, 蔡勇.2011. 环境中砷与溶解有机质的络合作用[J]. 环境化学 , 2011, 30 (1) : 50–55. |
| [18] | 林本兰, 沈晓冬, 崔升.2006. 纳米四氧化三铁磁性微粒的表面有机改性[J]. 无机盐工业 , 2006, 38 (3) : 19–21. |
| [19] | Pontius F W, Brown K G, Chen C J. 1994. Health implications of arsenic in drinking water[J]. Journal of the American Water Works Association , 86 (9) : 52–63. |
| [20] | Smedley P L, Kinniburgh D G. 2002. A review of the source,behavior and distribution of arsenic in natural waters[J]. Applied Geochemistry , 17 : 517–568. DOI:10.1016/S0883-2927(02)00018-5 |
| [21] | 宋娇艳, 袁林, 王强, 等.2014. 铁锰复合氧化物对铅离子的吸附特征及影响因素研究[J]. 西南大学学报 , 2014, 36 (7) : 135–142. |
| [22] | Susmita S G, Krishna G B. 2011. Kinetic of adsorption of metalions on inorgnic materials:Areview[J]. Advances in Colloid and Interface Science , 162 (12) : 39–58. |
| [23] | Suvasis D, Janet G H. 2003. Comparison of arsenic(V) and arsenic(III) sorption onto iron oxide minerals:implications for arsenic mobility[J]. Environmental Science &Technology , 37 : 4182–4189. |
| [24] | Si S, Kotal A, Mandal T K, et al. 2004. Size-controlled synthesis of magnetite nanoparticles in the presence of polyelectrolytes[J]. Journal of Materials Chemistry , 16 (18) : 3489–3496. DOI:10.1021/cm049205n |
| [25] | Smedley P L, Kinniburgh D G. 2002. A review of the source behavior and distribution of arsenic in natural waters[J]. Appllied Geochemistry , 17 : 517–568. DOI:10.1016/S0883-2927(02)00018-5 |
| [26] | Wang S, Mulligan C N. 2006. Effect of natural organic matter on arsenic release from soils and sedinents in to groundwater[J]. Environ Geochem Health , 28 : 197–214. DOI:10.1007/s10653-005-9032-y |
| [27] | 谢亚巍.2012.铁氧化物及其腐殖酸复合物对砷的吸附特性研究[D].重庆:西南大学 http://cdmd.cnki.com.cn/article/cdmd-10635-1012343981.htm |
| [28] | 赵凯, 郭华明, 高存荣.2015. 北方典型内陆盆地高砷地下水的水化学特征及处理技术[J]. 现代地质 , 2015, 29 (2) : 351–359. |
| [29] | 张丽萍, 谢先军, 李俊霞, 等.2014. 大同盆地地下水中砷的形态、分布及其富集过程研究[J]. 地质科技情报 , 2014, 33 (1) : 178–184. |
| [30] | 张蕾, 刘娜, 康平利, 等.2009. 纳米TiO2对去除水溶液中硒的吸附性能研究[J]. 化学通报 , 2009, 11 : 1013–1018. |
| [31] | 张峰, 朱宏.2009. 聚乙二醇包覆纳米Fe3O4颗粒的制备及特征[J]. 磁性材料及器件 , 2009, 40 (4) : 27–30. |
| [32] | Zhou Z H, Wang J, Liu X, et al. 2001. Synthesis of Fe3O4 nanoparticles from emulsions[J]. Journal of Materials Chemistry , 11 (6) : 1704–1709. DOI:10.1039/b100758k |
 2016, Vol. 36
2016, Vol. 36


