2. 湖州至美生物科技有限公司, 湖州 313000;
3. 浙江大学环境工程研究所, 杭州 310058
2. Huzhou Chimey Biological Technology Co. Ltd., Huzhou 313000;
3. Institute of Environmental Engineering, Zhejiang University, Hangzhou 310058
含酚废水主要来源于炼油、焦化、煤气和以苯酚或酚醛为原料的化工、造纸、冶炼、纺织印染等行业的生产过程中.此类废水来源广、水量大、组分复杂、毒性大,是我国水污染控制中被列为重点解决的有毒有害废水之一(聂玉冰,2011).在水体中,5 mg·L-1以上的苯酚即可对鱼类的生存构成威胁(Chung et al.,2003).苯酚被美国环保署列入优先控制污染物和65种有毒污染物名单,也是我国优先控制污染物之一(金相灿等,1990).我国污水综合排放标准(GB8978-1996)规定,挥发酚的一级标准、二级标准和三级标准分别为0.5、0.5、2.0 mg·L-1.
随着我国工业化程度的提高,各种含酚废水也相应增多,随之而来的酚类污染已经威胁着人类和动物,因此,必须寻找有效的方法治理含酚废水(李焱等,2008; Jeong et al.,2003).国内外关于含酚废水处理的研究很多,其中,物理、化学法具有操作简易、见效快的特点,但也存在能耗大、成本高且容易引起二次污染等不足;而生物强化法则利用微生物的新陈代谢作用将废水中的酚类物质代谢成二氧化碳、氨、二氧化硫等稳定的小分子,利用微生物体内的酶来分解酚以合成自身的有机质,使污水得到净化.这种方法不仅危害少,而且成本低廉,因此,在苯酚污染的治理中起到了越来越重要的作用(Chung et al.,2003).但目前生物处理技术只限于处理低浓度的含酚废水,而高浓度含酚废水具有污染物浓度高、可生化性差等特点,制约了这一技术在实际中的应用.
近年来,许多学者从酚类污染严重的环境中分离到许多降解苯酚的微生物菌种,主要包括Pseudmonas sp.(宋璟等,2010)、Bacillus sp.(张楠等,2010)、Candida tropicalis(周倩倩等,2011)、Brucella sp.(周集体等,2010),Bacillus cereus(温洪宇等,2009;姜立春等,2011)、产碱杆菌属(Alcaligenes sp.)(Baeket al.,2001 ;Essam et al.,2010)、微球菌属(Micrococcus sp.)(凌琪等,2007)、红球菌(Rhodococcus sp.)(沈锡辉等,2004)、不动杆菌(Acinetobacter)(Liu et al,2009)、醇单胞菌属(Sphingomonas sp.)、根瘤菌(Rhizobium sp.)(Wei et al.,2008)、苍白杆菌属(Ochrobactrum)等.这些菌种都能以苯酚为单一碳源进行生长,但由于不同的微生物菌种和不同的实验条件导致生物降解能力差异较大.Lee等(2001)曾筛选到一株降解苯酚的酵母菌(Yarrowia LipoLytica Y103),可以降解47 mg·L-1的苯酚;高振贤等(2005)研究发现,R.MetaLLidurans CH34菌株降解4 mmoL·L-1(相当于378 mg·L-1)的苯酚需要48 h;热带假丝酵母8953菌株在48 h内可完全降解约14.88 mmoL·L-1的苯酚(梁树才等,2007);Neis-seria Gonorrhoea BF-1菌株能在24 h内降解99.60%的5 mmoL·L-1的苯酚(刘亮等,2010).总之,虽然目前报道的去除苯酚的微生物种类较多,但这些菌株还存在耐酚浓度较低,降解酚需时较长,菌体生长及降解酚适应条件窄等不足,因此,有必要进一步开展苯酚降解微生物资源的发掘工作.
基于此,本研究从湖州污水处理厂的活性污泥中分离筛选到一株高效苯酚降解菌,结合形态学观察、生理生化实验和分子鉴定等方法确定其种属信息,鉴定为(Rhodococcus sp.)CM-HZX1;同时,研究pH、温度、转速、苯酚含量及盐度等对菌株CM-HZX1降解苯酚的影响,以期为含酚废水的处理提供一定的理论技术支持.
2 材料与方法(Material and methods) 2.1 菌株来源与试验仪器本实验分离得到的菌株CM-HZX1来自湖州污水处理厂的活性污泥中.实验仪器相关信息见表 1.
| 表 1 实验仪器 Table 1 Experimental apparatus |
胰蛋白胨 10 g·L-1,酵母粉5 g·L-1,NaCl 10 g·L-1,以无酚蒸馏水配制,调节pH值为7.0,121 ℃高温蒸汽灭菌20 min.LB琼脂平板培养基中需加入10~20 g·L-1的琼脂.
2.3.2 无机盐培养基(NH4)2SO4 1 g·L-1,CaCl2 0.1 g·L-1,K2HPO4 0.5 g·L-1,KH2PO4 0.5 g·L-1,MgSO4 0.5 g·L-1,NaCl 1.0 g·L-1,无酚水定容,调节pH为7.0~7.2,121 ℃高温蒸汽灭菌20 min.平板培养基中需加入10~20 g·L-1的琼脂.
2.3.3 苯酚无机盐培养基一定量的苯酚加入上述无机盐培养基中,pH调节至7.0~7.2,121℃高温蒸汽灭菌20 min.平板培养基中需加入10~20 g·L-1的琼脂.
2.4 实验指标细菌生长量的测定:以600 nm处的光吸收值(OD值)代表该菌体的生长状况.苯酚值的测定:根据《水和废水监测分析方法(第四版)》的4-氨基安替比林直接光度法测定挥发酚(以苯酚计).苯酚降解率:η=(1-Ct/C0)×100%,其中,η为苯酚降解率,Ct为反应后的苯酚浓度,C0为初始的苯酚浓度.
2.5 方法 2.5.1 分离与筛选取适量从湖州污水处理厂取回的活性污泥样品(约5 g)加到苯酚浓度为100 mg·L-1的LB培养基中,在30 ℃、150 r·min-1的摇床上振荡培养;待溶液由澄清变浑浊后,取上清液10 mL转接到苯酚浓度为200 mg·L-1的LB培养基中,在30 ℃、150 r·min-1的摇床上振荡培养;如此转接直至苯酚浓度提高至500 mg·L-1.然后取10 mL菌液到100 mL苯酚浓度为500 mg·L-1的无机盐培养基中,待培养液由澄清变浑浊后,收集保存.
取上述驯化培养的菌液1mL,配制成10-1、10-2、10-3、10-4、10-5、10-6梯度的稀释液,然后取100~200 μL稀释液平板涂布在苯酚无机盐固体培养基平板上,每个稀释度做3个重复,30 ℃恒温黑暗培养1周,观察平板上菌落的生长情况.挑选其中清晰可见的单菌落多次分离纯化,得到4株纯菌株.
挑取4株单菌接种至50 mL一定浓度苯酚的无机盐培养基中,30 ℃、150 r·min-1恒温摇床富集培养7~10 d,检测培养基中苯酚的含量,从而判断菌株降解苯酚的能力,筛选出一株以苯酚为唯一碳源生长且具有高效降解能力的菌株,命名为CM-HZX1.
2.5.2 菌株的鉴定形态学观察:主要针对菌落形态,包括菌株长在平板上的形态、光泽、大小等;细胞形态观察主要是对菌株进行电镜扫描.生理生化特征实验:按照北京陆桥公司购入的试剂盒进行实验.
分子鉴定:包括16S rDNA基因序列分析及系统发育树构建,用英潍捷基(上海)贸易有限公司合成的酶提取CM-HZX1菌株的DNA,扩增该菌株的16S rDNA,将获得的PCR产物纯化后委托上海立菲生物技术有限公司测序.引物为27F:5′to 3′:-AGA GTT TGA TCM TGG CTC AG-,1492R:5′to 3′:-GGY TAC CTT GTT ACG ACT T-(英潍捷基(上海)贸易有限公司合成).测序结果提交NCBI GenBank(National Center of Biotechnology Information),用BLAST进行相似性检索和同源性比较.利用MEGA5.0软件对这些细菌构建系统发育树,并进行同源性分析.
2.5.3 苯酚降解菌生长曲线的研究在500 mL锥形瓶中配制300 mL约500 mg·L-1的苯酚培养基,转接量约为15%,离心取菌泥加至苯酚培养基,pH=7.0,温度设定为30 ℃,转速设定为150 r·min-1,隔一定时间段取样检测挥发酚值,以不加菌株的培养基作为对照.以时间为横坐标,苯酚降解率为纵坐标,绘制图形.
2.5.4 苯酚降解菌最适条件的研究初始pH对降解苯酚的影响:在500 mL锥形瓶中配制300 mL约500 mg·L-1的苯酚培养基,转接量约为15%,离心取菌泥加至苯酚培养基,pH控制为3、4、5、6、6.5、7、7.5、8、8.5、9、10、11,在30 ℃、150 r·min-1条件下,隔一定时间段取样检测挥发酚值,以不加菌株的培养基作为对照.以时间为横坐标,苯酚降解率为纵坐标,绘制图形.
菌株最适生长温度测定:实验设计同pH影响实验,初始pH控制在7.0,温度依次设定为20、25、30、35、40 ℃.
转速对降解苯酚的影响:实验设计同pH影响实验,初始pH 控制在7.0,温度设定为30 ℃,转速依次设定为100、150、200、250 r·min-1.
初始浓度对降解苯酚的影响:实验设计同pH影响实验,初始pH控制在7.0,温度设定为30 ℃,转速设定为150 r·min-1,初始苯酚溶液浓度依次设定为10、20、50、100、200、300、400、500、600、700、800、900、1000、1500、2000、2500、3000 mg·L-1.
2.5.5 降解菌耐盐性研究实验设计同2.5.4 节中的pH影响实验,初始pH控制在7.0,温度设定为30 ℃,转速设定为150 r·min-1,利用NaCl调节盐度,NaCl质量分数依次设定为0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%、5.0%、6.0%.
3 结果与分析(Results and analysis) 3.1 菌株鉴定 3.1.1 形态学观察、生理生化特性CM-HZX1在LB培养基上培养1 d后,菌落形态呈现圆形、湿润、橘红色、不透明、易于挑起、边缘整齐,直径为0.8~1.12 nm,革兰氏染色反应呈阳性.由扫描电镜照片可知(图 1),菌体呈球状,无鞭毛,不产生芽孢.菌株CM-HZX1的部分生理生化特征研究结果显示:接触酶、硫化氢试验、硝酸盐还原、尿素酶呈阳性,葡萄糖发酵、吲哚、V.P、甲基红、明胶、甘油产酸、山梨醇、甘露醇、柠檬酸、水杨素、七叶苷、苯丙氨酸实验结果为阴性.该菌株的生理生化特性同《伯杰氏系统细菌学手册》中Rhodococcus sp.的结果一致.
 |
| 图 1 菌株CM-HZX1 的扫描电镜图片 Fig. 1 Scanning electron micrograph of strain CM-HZX1 |
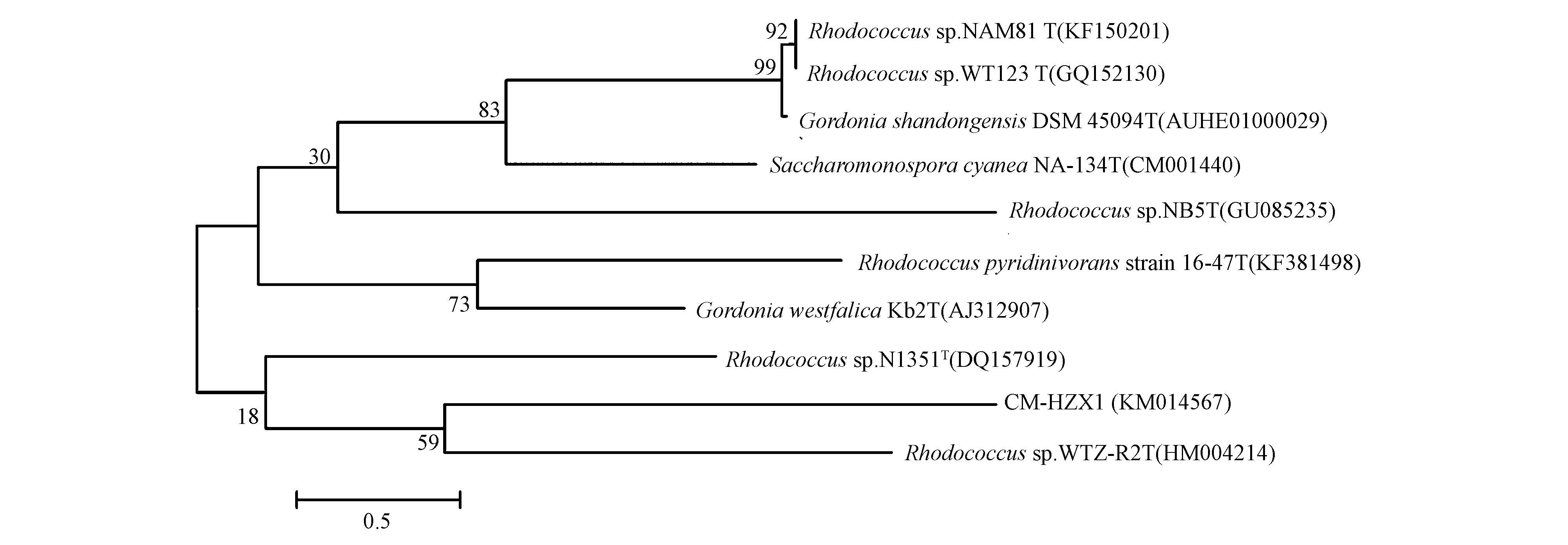
用英潍捷基(上海)贸易有限公司合成的酶提取CM-HZX1菌株的DNA,扩增该菌株的16S rDNA,将获得的PCR产物纯化后委托上海立菲生物技术有限公司测序.获得长度为1381 bp的16S rDNA片段,在GenBank中的注册登记号为KM014567.通过Blast比对发现,CM-HZX1菌株与已报道红球菌种属(Rhodococcus sp.)一些细菌的16S rDNA序列相似性达96%~99%.用MEGA5.0软件对这些细菌构建了系统发育树,并进行同源性分析.
如图 2所示,CM-HZX1菌株与红球菌(Rhodococcus sp.)的遗传距离最近,结合菌株的形态学特征,可初步确定CM-HZX1菌株为红球菌(Rhodococcus sp.),命名为红球菌(Rhodococcus sp.)CM-HZX1,并将该菌株送至位于武汉大学的中国典型培养物保藏中心(简称CCTCC)进行保藏,保藏编号为CCTCC NO:M 2014329,保藏日期为2014年7月9日.
 |
| 图 2 基于16Sr DNA 序列建立的CM-HZX1 菌株和相关菌的系统发育树 Fig. 2 Phylogenetic tree based on the partial 16S rDNA sequence of CM-HZX1 and the related strains |
微生物的生长曲线测定为菌株的培养及生长特性研究提供了参考.苯酚降解菌生长曲线的实验结果见图 3,结果表明,随着时间的延长,CM-HZX1对于苯酚的降解率也逐步增高,54 h的降解率达到92.5%.在6~12 h有一个延缓的增长期,而在这个时间段,该菌的生长曲线也处于延迟期;在24~54 h苯酚的降解率开始稳定增长,在12~24 h之间,该菌正处于对数生长期,此时的降解率增长至93.6%,说明CM-HZX1在这段时间内的降解效率最高.当CM-HZX1进入衰退期时,由于培养基中活菌数量减少,降解率虽然在增长,但增长幅度减小.
 |
| 图 3 CM?HZX1 生长曲线和苯酚降解曲线的关系 Fig. 3 Relations curve describing the growth of CM-HZX1 and phenol?degradation |
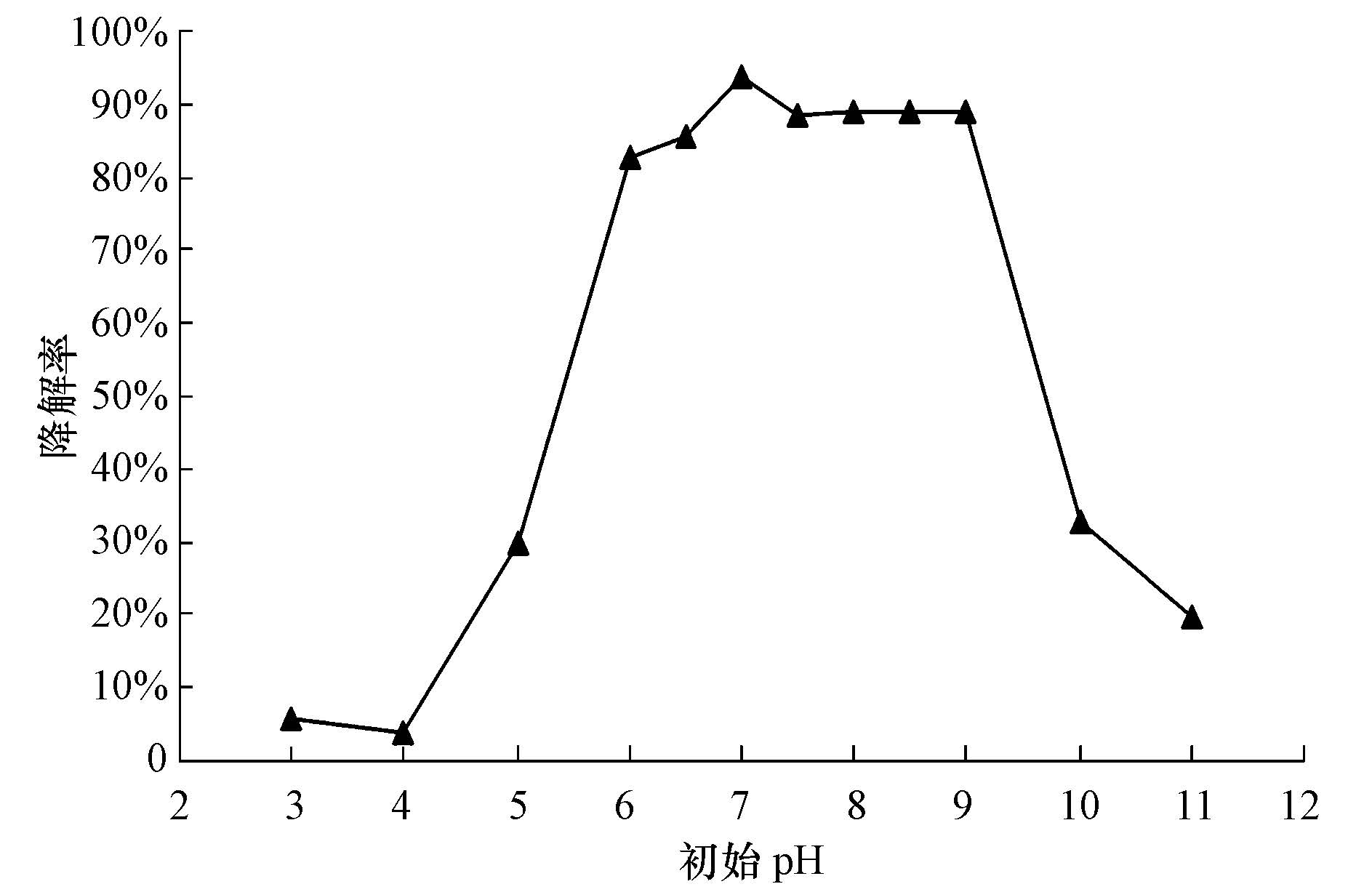
pH值在含酚废水的处理上是一个很关键的因素,因为它会直接影响到废水的物质组成及微生物的活力.本实验通过改变初始培养基中pH值,考察初始pH对CM-HZX1菌株降解苯酚的影响,结果见图 4.从图 4可以看出,该菌在初始pH为4.0以下的苯酚培养基中几乎没有降解能力,当pH由4.0增加至5.0时对苯酚的降解率有所增加;pH再增至6.0时,对苯酚的降解率迅速增大至82.6%;当pH升高至7.0时,苯酚降解率仍然增加,降解率为93.6%,再增大pH对苯酚的去除没有显著影响;当pH增加至10.0时,苯酚的降解率显著下降至32.5%.由此可知,苯酚微生物降解菌CM-HZX1在pH值为6.0~9.0时对苯酚的降解率达到80%以上,说明该苯酚降解菌在弱酸性至弱碱性范围内对苯酚有较好的降解效果,该微生物耐受环境范围广,初始pH在7.0时,苯酚降解率最高为93.6%.
 |
| 图 4 初始pH 对苯酚降解的影响 Fig. 4 Influence of pH on phenol degradation |
温度是影响微生物活力的重要因素之一,本实验通过改变培养温度,考察温度对CM-HZX1菌株降解苯酚能力的影响,结果见图 5.可以看出,CM-HZX1菌株在温度为30~35 ℃时对苯酚的降解率均超过90%;培养温度为40 ℃时,苯酚降解率急剧下降,这可能是高温抑制了细胞的生长,从而导致降解率下降.
 |
| 图 5 温度对苯酚降解的影响 Fig. 5 Temperature effect on phenol degradation |
随着摇床转速的提高,供氧量逐渐增加,本文通过设定不同摇床转速,得到溶解氧作用于微生物对苯酚降解率的影响,结果见图 6.可以看出,随着转速的增大,苯酚降解率也在变大,在150 r·min-1时降解率为93.6%;随后转速增大,降解率趋于平稳.
 |
| 图 6 转速对苯酚降解的影响 Fig. 6 Influence of rotating speed on phenol degradation |
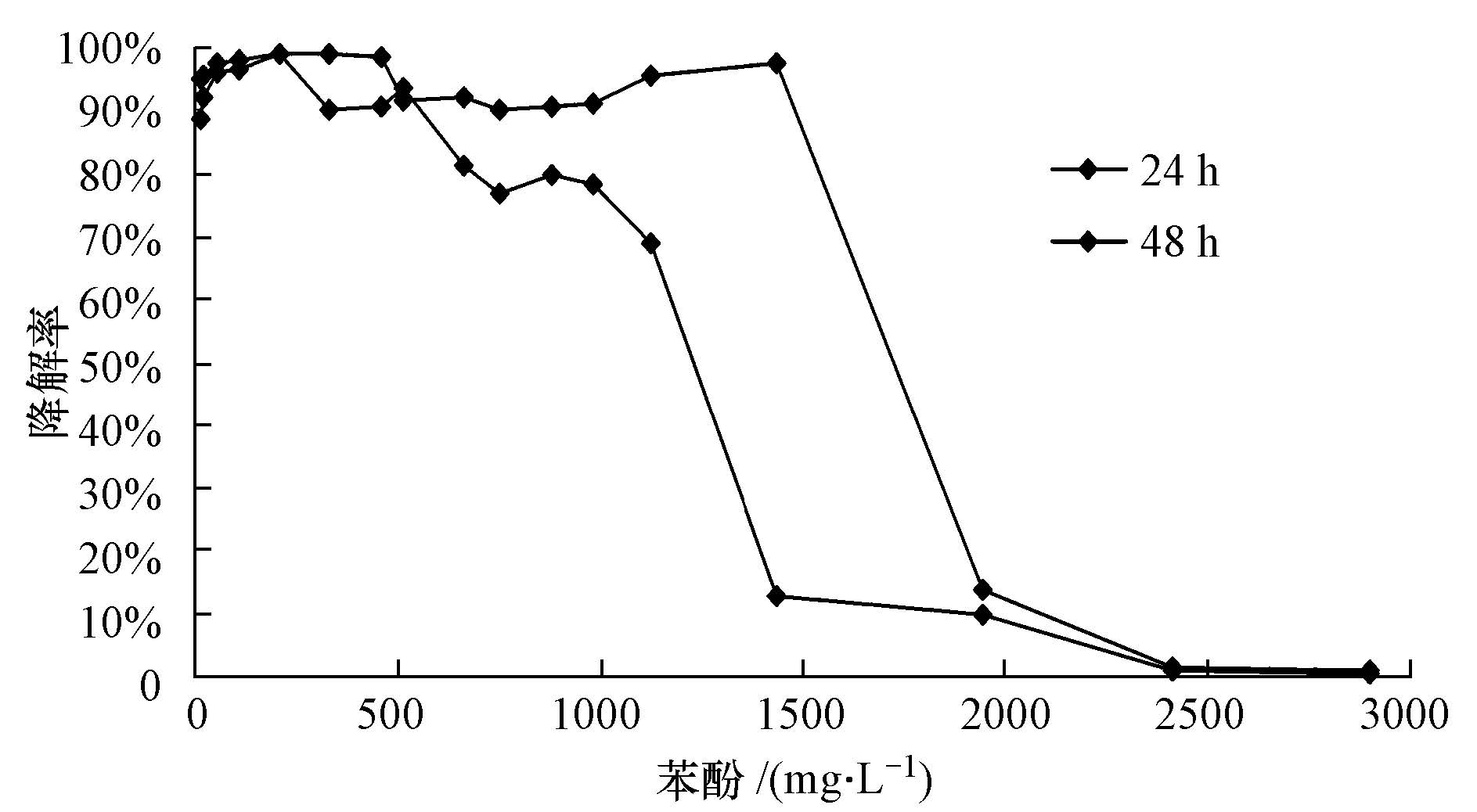
图 7结果表明,在24 h时,苯酚初始浓度为10~500 mg·L-1时,降解率在80%以上;初始浓度为500~1000 mg·L-1时,降解率在70%左右;初始浓度为500 mg·L-1时,降解率最高为93.6%.说明在这个浓度下菌株能够更好地将苯酚降解转化为自己能利用的营养物质.在48 h时,苯酚初始浓度在低于1500 mg·L-1时,降解率都在90%以上,高于1500 mg·L-1时降解率很低,可能是高浓度苯酚对细胞有一定的毒害作用从而抑制其生长,影响降解效果.苯酚的消耗并不是完全用来生成新的细胞,而是被用来克服强烈的底物抑制作用.另外,细胞各种代谢产物的积累也影响了细胞生物量的增加(Monteiroáet al.,2000).苯酚浓度越高,底物抑制作用越强,相对的细胞得率就越小,同时也导致细胞生长的延滞期越长(Hao et al.,2002).
 |
| 图 7 初始苯酚浓度对苯酚降解的影响 Fig. 7 Influence of initial phenol concentration on phenol degradation |
近年来,人们在苯酚降解研究中分离出大量的苯酚降解菌.例如,唐赟等(2006)分离出的嗜热菌BF80降解6 mmol·L-1(约为564 mg·L-1)的苯酚需要120 h;刘广金等(2007)分离出的一株假单胞菌(Pseudomonas sp.)降解500 mg·L-1的苯酚需要60 h;钱奕忠等(2001)发现的一株假单胞菌,在pH=6.79、温度为30~37 ℃之间时,降解472 mg·L-1的苯酚需要78 h;章杰等(2006)分离出的苯酚降解菌JF-2降解600 mg·L-1的苯酚需要13 d;Lee等(1996)分离出的醋酸钙不动杆菌PHEA-2降解苯酚的最佳质量浓度为300 mg·L-1.本研究分离出的菌株CM-HZX1降解苯酚的能力明显高于上述诸多已分离出的苯酚降解菌株.
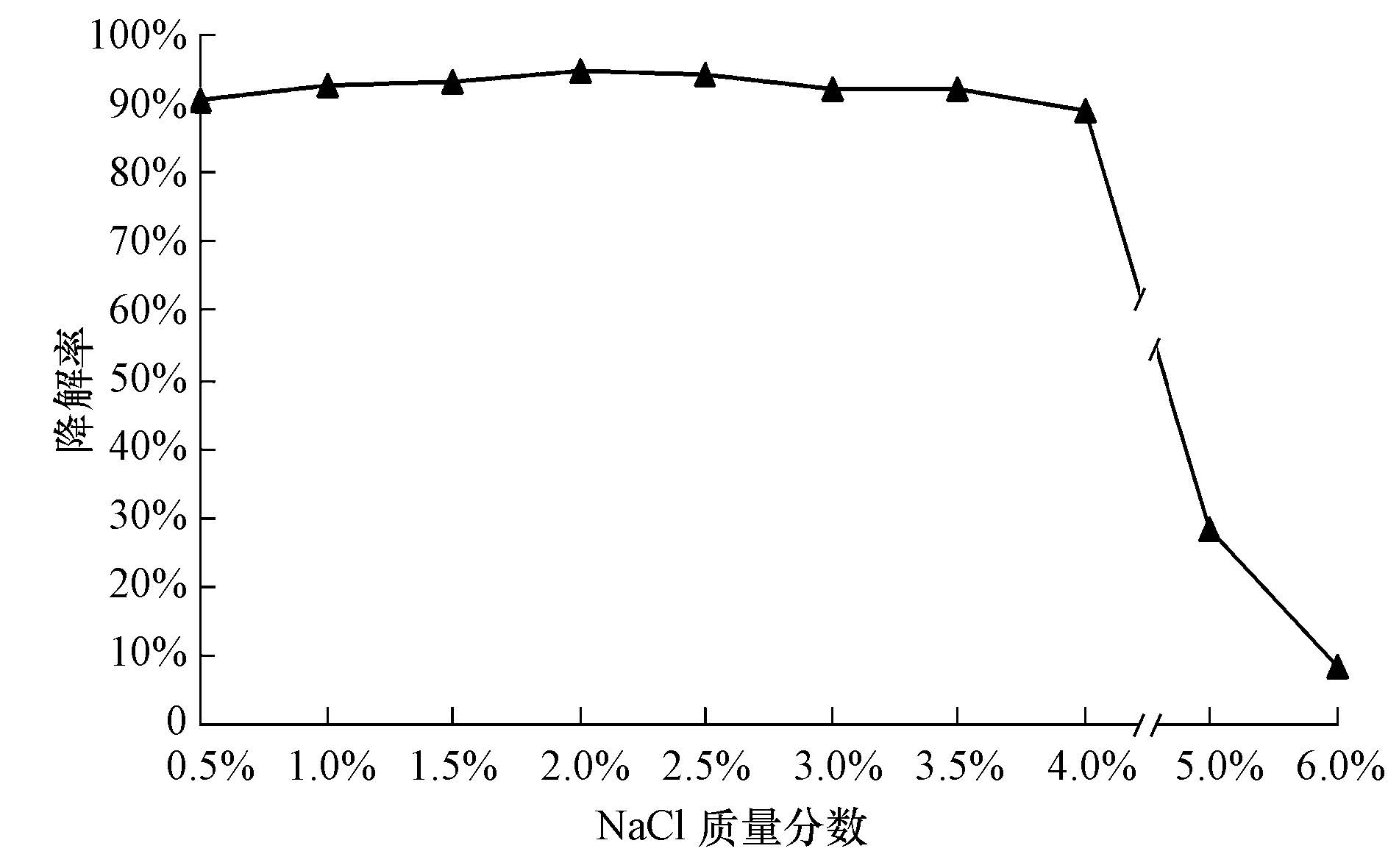
3.4 苯酚降解菌耐盐的研究工业废水水质复杂,特别是石化废水中含盐量较高,微生物难以发挥活性甚至于死亡.因此,需要考察盐度对苯酚降解菌的影响.从图 8可以看出,苯酚降解菌CM-HZX1在NaCl质量分数为0.5%~4.0%时,苯酚降解率都在85%以上,随着盐度的增大,苯酚降解率下降,说明CM-HZX1属于中度耐盐菌.
 |
| 图 8 盐浓度对降解苯酚的影响 Fig. 8 Influence of NaCl concentration on phenol degradation |
1) 从活性污泥中分离到一株能以苯酚为唯一碳源生长的菌株CM-HZX1,初步鉴定该菌株属于红球菌(Rhodococcus sp.).
2) 通过对菌株在不同pH、温度、转速及不同苯酚浓度下的降解率大小比较,初步认为该菌株能适应较广泛的环境条件,降解最适条件为pH=7.0、温度30 ℃、转速150 r·min-1,能耐受4%盐度的废水环境.
3) 在最适条件下,对0.5 g·L-1的苯酚在24 h时降解率可达93.6%,对1.5 g·L-1的苯酚在48 h时降解率在90%以上,降解效果远高于已报道的大部分苯酚降解菌株,可将其运用于工业含酚废水的生物处理,具有广阔的应用前景.
| [1] | Baek S H, Yin C R, Lee S T. 2001. Aerobic nitrate respiration by a newly isolated phenol-degrading bacterium,Alcaligenes strain P5[J]. Biotechnology Letters , 23 : 627–630. DOI:10.1023/A:1010354030216 |
| [2] | Chung T P, Tseng H Y, Juang R S, et al. 2003. Mass transfer effect and intermediate detection for phenol degra-dation in immobilized Pseudomonas putida systems[J]. Process Biochemistry , 38 (10) : 1497–1507. DOI:10.1016/S0032-9592(03)00038-4 |
| [3] | Essam T, Aminb M A, Tayeb O E. 2010. Kinetics and metabolic versatility of highly tolerant phenol degrading Alcaligenes strain TW1[J]. Journal of Hazardous Materials , 73 : 783–788. |
| [4] | 高振贤, 马宏, 贾振华.2005. Ralstonia metallidurans CH34苯酚降解特性的研究[J]. 微生物学通报 , 2005, 32 (1) : 44–47. |
| [5] | Hao O J, Kim M H, Seagren E A, et al. 2002. Kinetics of phenol and chlorophenol utilization by Acinetobacter species[J]. Chemosphere , 46 (6) : 797–807. DOI:10.1016/S0045-6535(01)00182-5 |
| [6] | Jeong J J, Kim J H, Kim C K, et al. 2003. 3-and4-alky lphenol degradation pathway in Pseudomonas sp.Strain KL28 genetic organization of the lap gene clusterand substrate specificities of phenol hydroxylase and catechol 2,3-dioxygen-ase[J]. Microbiology , 149 (11) : 3265–3277. DOI:10.1099/mic.0.26628-0 |
| [7] | 姜立春, 阮期平, 袁利娟, 等.2011. 高效降酚菌株JY03的筛选及其降解特性研究[J]. 环境工程学报 , 2011, 5 (8) : 1912–1916. |
| [8] | 金相灿, 程振华, 徐南妮. 1990. 有机化合物污染化学 有毒有机物污染化学[M]. 北京: 清华大学出版社 . |
| [9] | Lee J S, Kang E J, Kim M O, et al. 2001. Identification of Yarrowia lipolytica Y103 and its degradability of phenol and 4-chlorophenol[J]. Microbiol Biotechnol , 11 (1) : 112–117. |
| [10] | Lee S G, Hung S P. 1996. Removal and bioconversion of phenol in wasterwater by z-thermostable β-tryrosion[J]. Enzyme and Microbial Technology , 19 : 374–377. DOI:10.1016/S0141-0229(96)00001-4 |
| [11] | 梁树才, 杨宝玉, 刘海舟, 等.2007. 热带假丝酵母8953菌株对苯酚的降解特性研究[J]. 环境科学与技术 , 2007, 30 (3) : 27–29. |
| [12] | 李焱, 陈羽, 齐秀兰, 等.2008. 高效苯酚降解菌细胞固定化方法与条件的研究[J]. 微生物学杂志 , 2008, 28 (5) : 61–64. |
| [13] | 凌琪, 汤利华, 陶勇, 等.2007. 苯酚降解细菌的分离与选育研究[J]. 中国给水排水 , 2007, 23 (11) : 78–82. |
| [14] | 刘广金, 张袖丽.2007. 苯酚高效降解菌的筛选及其降解特性的研究[J]. 现代农业科技 , 2007 (11) : 202–203. |
| [15] | 刘亮, 唐赟, 杨峰晓, 等.2010. 一株苯酚降解菌BF-1的鉴定及降酚特性测定[J]. 西华师范大学学报(自然科学版) , 2010, 31 (3) : 239–243. |
| [16] | Liu Y J, Zhang A N, Wang X C. 2009. Biodegradation of phenol by using free and immobilized cells of Acinetobacte sp[J]. XA05 and Sphingomonas sp.FG03[J].Biochemical Engineering Journal , 44 : 187–192. |
| [17] | Monteiroá A M, G, Boaventura R A R, Rodirgues A. 2000. E Phenol biodegradation by Pseudomonas putida DSM 548 in a batch reactor[J]. Biochem Eng J , 6 (1) : 45–49. DOI:10.1016/S1369-703X(00)00072-3 |
| [18] | 聂玉冰.2011.高效苯酚降解菌剂复配及其对含酚废水处理系统的强化[D].哈尔滨:哈尔滨工业大学 http://cdmd.cnki.com.cn/article/cdmd-10213-1011261600.htm |
| [19] | 钱奕忠, 张鹏, 谭天伟.2001. 假单胞菌降解含苯酚废水[J]. 实验过程工程学报 , 2001, 1 (4) : 439–441. |
| [20] | Wei G H, Yu J F, Zhu Y H, et al. 2008. Characterization of phenol degradation by Rhizobium sp[J]. CNWTB 701 isolated from Astragalus chrysopteru in mining tailing region[J].Journal of Hazardous Materials , 151 : 111–117. |
| [21] | 沈锡辉, 刘志培, 王保军, 等.2004. 苯酚降解菌红球菌 PNAN5 菌株(Rhodococcus sp[J]. strain PNAN5)的分离鉴定、降解特性及其开环双加氧酶性质研究[J].环境科学学报 , 2004, 24 (3) : 482–486. |
| [22] | 宋璟, 王慧捷, 赵玮, 等.2010. 苯酚降解菌SZH3的分离及降解特性的初步研究[J]. 上海师范大学学报(自然科学版) , 2010, 39 (3) : 315–320. |
| [23] | 唐赟, 刘沐之, 梁凤来, 等.2006. 一株嗜热菌的分离鉴定及其苯酚降解特性[J]. 微生物学通报 , 2006, 33 (5) : 39–44. |
| [24] | 温洪宇.2009.苯酚降解嗜盐菌的筛选及分子生物学鉴定[D].中国矿业大学 http://cdmd.cnki.com.cn/article/cdmd-10290-2009222889.htm |
| [25] | 章杰, 何泽超, 梁川.2006. 一株降解苯酚微生物的研究[J]. 四川环境 , 2006, 25 (1) : 8–10. |
| [26] | 张楠, 陈波水, 杨致邦, 等.2010. 苯酚降解菌的分离、检定及降解特性[J]. 后勤工程学院学报 , 2010, 26 (1) : 22–26. |
| [27] | 周集体, 关晓燕, 曲媛媛, 等.2010. 苯酚降解菌株GXY-1分离鉴定、降解及其粗酶特性研究[J]. 大连理工大学学报 , 2010, 50 (3) : 340–345. |
| [28] | 周倩倩, 丁丛, 王志平, 等.2011. 苯酚降解菌的筛选及其降解特性初探[J]. 哈尔滨商业大学学报(自然科学版) , 2011, 27 (4) : 544–549. |
 2016, Vol. 36
2016, Vol. 36


