2. 湿润亚热带生态地理过程教育部重点实验室, 福州 350007;
3. 福建师范大学地理研究所, 福州 350007
2. Key Laboratory of Humid Subtropical Eco-geographical Process of the Ministry of Education, Fuzhou 350007;
3. School of Geographical Sciences, Fujian Normal University, Fuzhou 350007
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是一类广泛存在于土壤环境中的持久性有机污染物(Ghosh et al.,2014) ,可通过生物累积及食物链的传递,对生态环境和人体健康造成危害(张巧巧等,2010; Ping et al., 2011;宋立超等,2012;Moscoso et al., 2012) .与细菌相比,真菌对环境中PAHs污染的修复有其独特的作用(潘澄等,2011;吴宇澄和林先贵,2013;Rafin et al.,2013) .例如,细菌对PAHs降解主要集中于四环及以下的低分子量PAHs,而真菌通过共同代谢作用可以有效去除高达7环的高分子量PAHs(Thion et al.,2012) .部分PAHs降解真菌可以吸收PAHs并将其储存在细胞囊泡中(Verdin et al., 2005; Wu et al., 2009) ,虽然其吸收程度以及PAHs通过何种机制通过细胞壁进入细胞仍未可知,但此类真菌是PAHs潜在优势降解菌.Rafin等(2000) 通过14C同位素标记首次发现真菌Fusarium solani不仅能够代谢降解苯并[a]芘(BaP),而且还可以将其吸收储存在脂质囊泡中.
Fusarium solani能够降解包括菲、蒽、芘、苯并[a]蒽、苯并[a]芘等多种PAHs(Verdin et al., 2005; Wu et al., 2010) .有研究表明,PAHs能够被细胞色素P450氧化形成醌(Cavalieri and Rogan,1985; 1995),Veignie等(2002) 研究发现Fusarium solani降解苯并[a]芘过程中形成许多不同的产物,例如硫酸6-羟基苯并[a]芘(6-hydroxybenzo[a]pyrene sulfate),这是目前已知的苯并[a]芘在细胞内被细胞色素P450单加氧酶和芳基硫酸酯酶氧化的产物(Rafin et al., 2000;2006) .这些已经确定的代谢产物都说明Fusarium solani是在细胞内氧化PAHs,这个过程就需要经过3步:菌体吸收PAHs使其进入细胞——PAHs胞内运输至储存地点——PAHs的氧化降解(Fayeulle,2014).菌体吸收储存在囊泡中的PAHs以及菌体强烈吸附的PAHs在水溶液中不能被二氯甲烷萃取(Bine et al., 2000;Thion et al., 2012;Fayeulle et al., 2014) ,所以在本研究中用“消解”来表示芘总量的减少,它包括生物降解、菌体吸收储存和菌体强烈吸附3个部分.
目前关于Fusarium solani吸收储存PAHs能力的研究非常少,而这种吸收储存能力对PAHs降解率的贡献等方面的研究也鲜见报道.有关 Fusarium solani对PAHs降解的已有研究中,对于其吸收储存的PAHs有两种不同的做法:一部分研究忽略细胞囊泡中储存的PAHs,将实验中PAHs总消解量作为降解量进行分析(陈艳芳等,2008;Hong et al., 2009;Wu et al., 2010) ,但是PAHs在细胞囊泡中的储存不一定伴随着降解(Verdin et al., 2005) ,若细胞囊泡中储存PAHs占较大比例,此种做法所得降解率就存在较大误差;另一部分研究通过破坏Fusarium solani细胞结构使其细胞中储存的PAHs得以释放,从而得到PAHs的实际降解量,以此为准进行降解特性研究(Veignie et al., 2002;Verdin et al., 2005;Rafin et al., 2006) .Thion等(2012) 首次测定了Fusarium solani菌体中PAHs的吸收储存量,在高浓度菲(50 mg·L-1)、芘(50 mg·L-1)、和二苯并[a,h]蒽(50 mg·L-1)液体培养基培养28 d,菌株Fusarium solani MM1对PAHs的吸收储存量均为添加量的10%左右,但是文章对Fusarium solani吸收储存PAHs的特性未进行深入研究.
本文以芘为唯一碳源从公路旁污染土壤中筛选出1株真菌Fusarium solani PyF-1,研究了该菌株在液体培养条件下对芘的吸收储存能力以及降解特性,对于进一步了解PAHs降解真菌去除土壤中PAHs的机制具有一定的意义
2 材料与方法(Materials and methods) 2.1 土壤样品和化学试剂分离芘降解菌的土壤样品取自福州市公路旁的表层(0~10 cm)土壤,放入自封袋中,封口,4 ℃冰箱保存.芘(Pyrene,98%)购于Sigma Aldrich,丙酮、二氯甲烷均为分析纯,重蒸后使用;乙腈为色谱纯,购于Fisher Scientific
2.2 培养基无机盐培养基:NH4NO3 2 g,Na2HPO4 1 g,KH2PO4 0.5 g,(NH4)2SO4 0.5 g,MgSO4·7H2O 0.5 g,CaCl2·2H2O 0.05 g,FeSO4·7H2O 0.02 g,微量元素1 mL,去离子水1 L,pH 6.7~7.1,121 ℃蒸气灭菌20 min.微量元素溶液:H3BO3 0.3 g,CoCl2·6H2O 0.2 g,ZnSO4·7H2O 0.1 g,MnCl2·4H2O 0.03 g,Na2MoO4·H2O 0.03 g,NiCl2·6H2O 0.02 g,CuCl2·2H2O 0.01 g,去离子水1 L,pH 3.4.
真菌无机盐培养基:NH4NO3 2 g,Na2HPO4 1 g,KH2PO4 0.5 g,(NH4)2SO4 0.5 g,MgSO4·7H2O 0.5 g,CaCl2·2H2O 0.05 g,FeSO4·7H2O 0.02 g,孟加拉红0.05 g,微量元素1 mL,去离子水1 L,pH 6.7~7.1,121 ℃蒸气灭菌20 min;高温灭菌后加入氯霉素的乙醇溶液,使氯霉素最终浓度为0.1 g·L-1,固体培养基加入2%的琼脂.
沙氏葡萄糖培养基: 植物蛋白胨10 g,葡萄糖 20 g,去离子水1 L,调整pH 5.7,固体培养基加2%琼脂.芘用丙酮配成 10 g·L-1的母液,稀释成1 g·L-1的溶液,用 0.22 μm 的有机滤膜过滤灭菌备用
2.3 降解菌的分离与鉴定250mL灭菌锥形瓶中添加一定量1 g·L-1芘的丙酮溶液,待丙酮完全挥发后,加入50 mL无机盐液体培养基制备以芘为唯一碳源的液体培养基.称取供试土样1 g于150 mL锥形瓶中,加入10 mL 无菌水,置于摇床振荡30 min后,取土壤悬浊液按10%的体积比例接种到上述以芘为唯一碳源的无机盐液体培养基中;在28 ℃下,150 r·min-1振荡培养7 d,移取第1次培养液按10%的体积比例接入新鲜的以芘为唯一碳源的无机盐液体培养基中,进行第2次培养;按同样方法连续转接3次后培养得到以芘为唯一碳源的降解菌液.采用梯度稀释法,吸取定量降解菌液稀释成不同梯度涂布于以芘为唯一碳源的真菌固体培养基上,在28 ℃恒温箱中培养 7~10 d,挑取单菌落,接种到以芘为唯一碳源真菌无机盐液体培养基中.经过几个周期的分离纯化后得到单一菌落,将其命名为PyF-1.将菌株PyF-1接种到沙氏葡萄糖液体培养基中富集培养数天后进行菌种保存.以上操作均在无菌条件下进行.
真菌基因组DNA采用上海生工真菌基因组DNA快速提取试剂盒提取.采用ITS序列分析鉴定菌株.PCR扩增引物为: 正向引物 ITS5(GGAAGTAAAAGTCGTAACAAGG)和反向引物ITS4(TCCTCCGCTTATTGATATGC).PCR扩增程序为:95 ℃预变性 3 min;94 ℃变性 30 sec,59.6 ℃退火30 sec,72 ℃延伸90 sec,35 个循环;最后72 ℃延伸10 min.PCR产物用琼脂糖凝胶电泳检测.DNA 测序由上海生物工程技术有限公司完成,测序结果用Blast进行序列比对,并提交到GenBank(登录号KT347221)
2.4 降解实验 2.4.1 菌悬液的制备将分离纯化后的菌株PyF-1接种到沙氏葡萄糖琼脂培养基,28 ℃恒温培养箱培养7 d,用15 mL无菌水冲洗菌落,收集孢子于无菌离心管中.8000 r·min-1离心10 min,无菌水洗涤3次,制成相同浓度的若干菌悬液.以上操作均在无菌条件下进行.菌悬液中孢子的浓度用奥林巴斯光学显微镜来计数.所得菌悬液用于芘降解实验,最终实验培养液中孢子浓度为2×103·mL-1.
2.4.2 菌株 PyF-1对芘的降解实验向无菌试管中加入1 mL 1 g·L-1芘的丙酮溶液,待丙酮完全挥发后,加入20 mL真菌无机盐液体培养基,使初始芘的浓度是50 mg·L-1.接种一定量已制备的菌悬液,在28 ℃下150 r·min-1 避光振荡培养,分别在培养0、7、14、21、28、39 d时取样,测定其生物量和培养基中芘的残余量.以未接菌的含芘液体培养基为对照,每次测定均设3个重复.消解率计算利用公式:消解率(%)=(对照组提取芘-实验组提取芘)/对照组提取芘×100%
2.4.3 芘的提取和分组研究芘的提取:实验采用整瓶提取法,向待提取溶液中加10 mL二氯甲烷,在旋涡混合仪上旋混30 sec,将溶液倒入分液漏斗中萃取1次;另取10 mL二氯甲烷于试管中清洗瓶壁,并将洗液移入分液漏斗中再萃取1次,重复3次,将萃取后的二氯甲烷溶液经装有无水硫酸钠的玻璃柱去除残留水相,合并于50 mL容量瓶中定容.准确移取1 mL二氯甲烷萃取液于2 mL色谱瓶中,氮气吹干,再加2 mL乙腈定容,置于4 ℃冰箱保存待测.该方法的回收率在94%±2%.
菌体吸收储存芘:收集培养基中的菌体,冷冻干燥,索氏提取24 h,UPLC测定芘含量.提取的芘包括菌体吸收芘和菌体吸附的芘.
菌体表面吸附芘:取纯化菌株PyF-1接种到沙氏葡萄糖液体培养基中,在28 ℃下150 r·min-1 避光振荡培养7 d,收集菌体,121 ℃蒸气灭菌20 min,将高温杀死的菌体接种到20 mL浓度为50 mg·L-1芘的真菌无机盐培养基,再在28 ℃下150 r·min-1 避光振荡培养2 h.菌体吸附实验时间参照Binet等(2000) 植物根系吸附溶液中PAHs实验结果.溶液中芘和菌体吸附芘的提取过程同上.
生物降解芘:根据质量守恒定律,除了培养基中的芘和菌体吸收、吸附芘之外,培养过程中减少的芘应为生物降解的芘
2.5 生物量的测定分别收集培养0、7、14、21、28、39 d培养基中的菌体,冷冻干燥后称重,计算生物量
2.6 芘的测定芘的测定采用超高效液相色谱系统(Water ACOUITY UPLCTM),UPLC荧光检测器,色谱柱为Water PAHs专用柱(1.7 μm,2.1 mm×50 mm),柱温为40 ℃,进样量为5 μL,流动相为乙腈和水,流速为0.3 mL·min-1,激发和发射波长分别为270 nm和390 nm
2.7 显微镜观察收集在芘浓度为50 mg·L-1的无机盐培养基中培养的菌体进行观察.显微镜观察样品未进行染色,材料常规压片.普通光学显微镜观察采用Olympus CX31,荧光显微镜观察采用Olympus BX51,在DAPI标准滤光片下进行观察.其中DAPI标准滤光片激发波长340~380 nm,发射波长435~485 nm
2.8 数据分析采用origin8.0和SPSS19.0对数据进行统计和分析
3 结果(Results) 3.1 降解菌的分离与鉴定通过对福州公路旁污染土壤样品进行多次富集分离和纯化,得到1株以芘为唯一碳源生长的菌株,此菌落较大,呈白色、圆形、绒毛状(图 1),命名为PyF-1.以其 DNA 为模板,采用真菌ITS 特异引物 ITS5和ITS4进行PCR扩增并测序,结果见图 2.测序结果用NCBI在线Blast进行序列比对,发现菌株 PyF-1(登录号KT347221) 与Fusarium solani同源性为 100%.光学显微镜下观察,菌株产生的分生孢子是镰刀状孢子,孢子内有平行隔膜.根据形态和序列特征,菌株PyF-1鉴定为Fusarium solani.
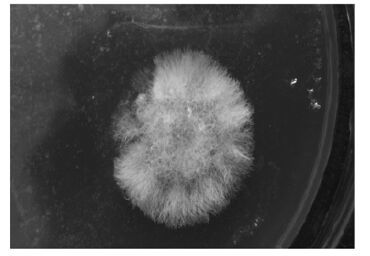 |
| 图 1 菌株PyF-1在含芘膜的固体培养基上的形态特征 Fig. 1 Morphology of strain PyF-1 grown on a solid culture medium coated with pyrene |
 |
| 图 2 菌株PyF-1的ITS基因序列 Fig. 2 ITS sequence of strain PyF-1 |
对实验中芘随时间的消解量进行单因素方差分析(One-Way ANOVA)得出,接种菌株的培养基中芘的消解呈显著差异,而未接种菌株的对照组中芘的消解无显著差异(p<0.05) .由图 3知,菌株PyF-1能够以芘为唯一碳源生长,第7 d时,菌体生物量达到最大值,此后直到28 d,随着培养时间的增加,生物量呈下降趋势,28~39 d基本保持稳定.培养基中残留芘在0~14 d内显著减少(p<0.05) ,14~21 d内进入稳定期,21~28 d再次显著减少(p<0.05) .第28 d时,培养基中芘的残留率最小,为添加量的66.6%,但到第39 d时培养基中芘的残留率回升到76.4%.
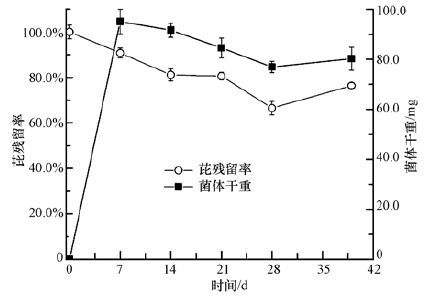 |
| 图 3 菌株PyF-1 在50 mg·L-1以芘为唯一碳源的培养基中的生长曲线及其对芘的降解曲线 Fig. 3 Growth curve of strain PyF-1 and degradation curve of pyrene by strain PyF-1 in mineral medium supplemented with 50 mg·L-1 of pyrene(mean±SD) |
普通光学显微镜(图 4a)和荧光显微镜(图 4b)对菌体的观察均发现菌丝中存在未降解的芘(图中箭头所指处),因此实验在培养7 d、14 d、21 d、28 d、39 d取样时,提取测定了菌体吸收储存芘的含量(图 5).高温灭菌杀死的菌体对芘的吸附实验结果表明,单位生物量吸附芘是(0.0478±0.0081) μg·mg-1,生物量表面吸附芘的总量不足添加芘量的0.5%.在培养前期,菌体吸收芘所占比重较小,不足芘添加量的3%,且变化不显著.培养后期菌体吸收芘变化显著,第28 d时,菌体吸收芘骤增,接近培养基中芘损耗总量的一半,占培养基中芘添加量的16.0%; 第39 d时,菌体吸收芘急剧减小为芘添加量的5.6%.
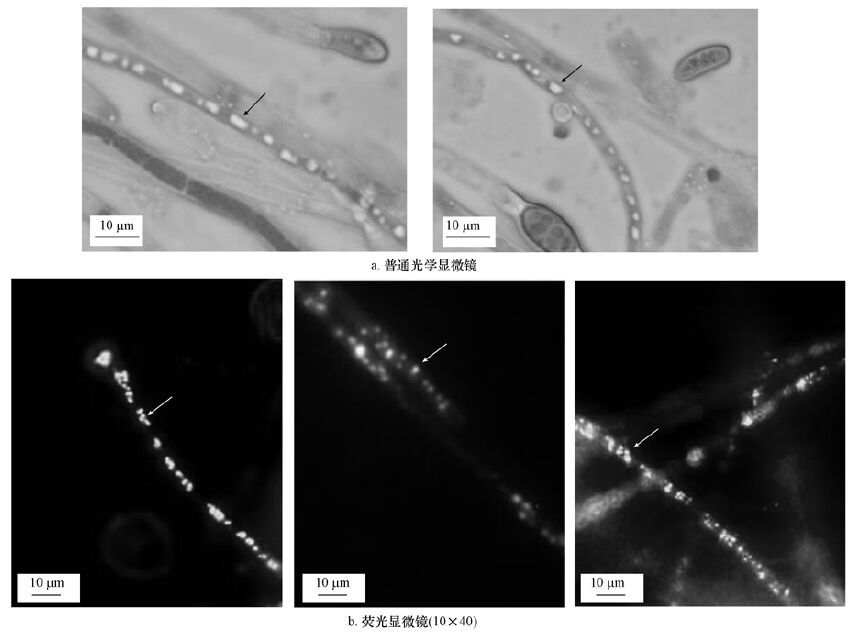 |
| 图 4 菌株PyF1在光学显微镜下菌丝中储存芘 Fig. 4 Light microscope observation of the intracellular elements in PyF-1 hyphae grown on mineral medium supplemented with 50 mg·L-1 of pyrene.(a)Bright field(10×100) ;(b)fluorescence using standard DAPI filter set(10×40) |
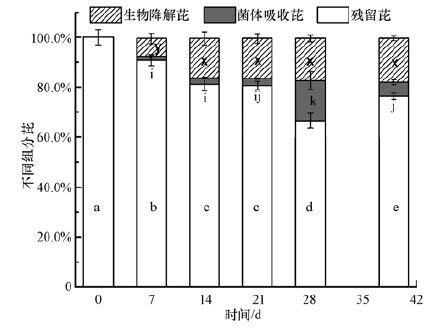 |
| 图 5 菌体吸收芘、生物降解芘和残留芘所占比例随时间变化 (注:各取样时间对照组平均值为100%,相同字母表示用LSD检验差异性不显著(p<0.05) ,不同字母表示差异显著(p<0.05) ,生物降解芘(y,z),菌体吸收芘(i,j,k),残留芘(a,b,c,d,e).) Fig. 5 Proportions of pyrene in biodegraded,absorbed,and residual fractions over 39 days of culturing |
根据质量守恒定律,除了培养基中残留芘、菌体吸收芘和菌体吸附的芘之外,培养过程中减少的芘应为生物降解的芘.由图 5知,生物降解芘在培养0~14 d内是逐渐增加的,且变化显著,14 d时生物降解芘占添加芘总量的15.9%,此后生物降解芘基本达到稳定,虽然略有增加,但是差异不显著.由表 1知,虽然单位生物量降解芘有逐渐增加的趋势,但是只有0~14 d单位生物量降解芘的变化是显著的(p<0.05) ,这与生物降解芘的变化趋势一致.
| 表 1 菌株PyF-1在不同取样时间的单位生物量降解芘 Table 1 Biodegraded pyrene per milligram of dried biomass of PyF-1 at different sampling times |
培养基中残留芘在各时间段变化显著(图 5),但是不同时间段菌体吸收芘、生物降解芘对芘总消解量的贡献率不同.在培养的0~21 d内,菌体吸收芘所占比重较小,而生物降解芘所占比重相对较大,培养基中芘的消解总量与生物降解芘量的变化趋势一致(图 6),这说明前期培养基中芘的消解以生物降解为主.培养后期生物降解芘基本达到稳定,菌体吸收芘变化显著,芘的消解总量随着菌体吸收芘量的变化产生显著波动(图 6),说明此时菌体吸收芘的变化是培养基中残留芘变化的主要原因.
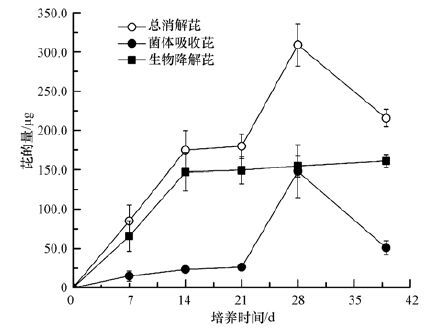 |
| 图 6 总消解芘、菌体吸收芘和生物降解芘动态变化曲线 Fig. 6 Kinetic curves of pyrene dissipated,absorbed and biodegraded by PyF-1 |
由图 3可以看出,在菌体生物量停止增加甚至减少的情况下,培养基中芘的消解继续增加,而且芘的消解量随时间呈先增大后减小的趋势.这是由于被菌体细胞吸附或者吸收的芘并没有被生物降解,随着培养时间延长,这部分芘可能重新被释放到培养基中,因而培养基中芘的残留率呈先减少后增大趋势.事实上进入Fusarium solani菌丝的PAHs储存在细胞囊泡中,这种脂肪性囊泡是细胞内PAHs储存和运输的重要载体(Rafin et al.,2000;Verdin et al.,2005;Wu et al.,2009;Thion et al.,2012;Fayeulle et al.,2014) .关于Fusarium solani菌丝对PAHs的吸收机制,不同学者有不同看法.Verdin等(2004) 推测PAHs是通过被动扩散经过脂质性的膜进入细胞,这个过程不依赖能量;而Fayeulle等(2014) 认为菌丝吸收PAHs是一个需要能量的主动过程,这个过程可能与真菌代谢脂质等天然疏水性分子的基本途径相同(Kamisaka and Noda,2001).目前进入囊泡的这部分PAHs的作用及去向仍未可知,这可能是微生物通过控制PAHs避免其对细胞产生毒性或者是微生物在氧化PAHs前暂时将其储存起来的一种方式.
在菌株PyF-1对芘的降解实验中,培养前期培养基中芘的消解以生物降解为主,主要是因为这段时间菌体干重增加,菌株PyF-1通过降解芘为自身生长和繁殖等提供碳源和能源.培养基中生物降解芘在14 d时基本达到稳定,Veignie等(2002) 和Rafin等(2006) 研究Fusarium solani对苯并[a]芘降解特性时发现Fusarium solani对苯并[a]芘的降解主要发生在菌株生长的延迟期和指数增长期,与本实验观察到的现象相一致.培养28 d时,单位生物量降解芘达到最大值,为2.07 μg·mg-1.Saraswathy和Hallberg(2005) 曾报道的Penicillium ochrochloron在28 d时单位生物量降解芘为3 μg·mg-1,这个数值也与本实验结果接近.
培养后期菌体吸收芘的变化是培养基中残留芘变化的主要原因.第28 d时,菌体吸收芘骤增,占培养基中芘添加量的16.0%,生物降解芘占培养基中芘添加量的为16.7%;39 d时,菌体吸收芘急剧减少为芘添加量的5.6%,而此时生物降解芘的量只是略有增加,为芘添加量的17.6%.菌体吸收芘的减少,可能是由于菌体囊泡中储存的芘重新释放到培养基中,这也是造成残留芘增加的原因.以上现象说明PAHs在细胞囊泡中的储存不一定伴随着降解(Verdin et al.,2005) .
Verdin等(2004;2005) 对从石油污染土壤中筛选出来的Fusarium solani F33进行研究,在浓度为0.4 mmol·L-1的PAHs液体培养基中培养30 d,蒽、芘和苯并芘的降解率分别为84%、70%和50%,单位生物量降解芘为19 μg·mg-1,实验添加10 g·L-1葡萄糖为菌体生长活动提供碳源,在无添加葡萄糖对照组,菌体几乎不生长,无PAHs降解.本实验从公路旁污染土壤中筛选出来的菌株PyF-1在50 mg·L-1在以芘为唯一碳源的液体无机盐培养基培养39 d,芘生物降解率为17.6%,说明菌株PyF-1在贫养环境下对PAHs也有一定的降解能力
5 结论(Conclusions)1) 通过富集培养,获得了1株能以芘为唯一碳源降解菌株PyF-1,根据形态特征和ITS序列分析等方法鉴定降解菌株为Fusarium solani.
2 ) 利用普通显微镜和荧光显微镜观察发现PyF-1菌丝能吸收储存芘.PyF-1对芘的消解主要是菌体吸收芘和生物降解芘两部分,菌体吸附芘不足添加芘总量的0.5%,可以忽略不计.
3) PyF-1对芘的吸收储存能力在不同生长阶段差异显著.在培养前期,菌体对芘的吸收储存所占比重较小,而生物降解芘所占比重相对较大且逐渐增加,因此前期培养基中芘的消解以生物降解为主.培养后期,生物降解芘趋于稳定,而菌体吸收芘变化显著,此时菌体吸收芘变化是培养基中残留芘变化的主要原因.
| [1] | Binet P, Portal J M, Leyval C. 2000.Fate of polycyclic aromatic hydrocarbons (PAH) in the rhizosphere and mycorrhizosphere of ryegrass[J]. Plant and Soil, 227 (1/2): 207–213. |
| [2] | Cavalieri E L, Rogan E G. 1985.Role of radical cations in aromatic hydrocarbon carconogenesis[J]. Environmental Health Perspectives, 64 : 69–84. |
| [3] | Cavalieri E L, Rogan E G. 1995.Central role of radical cations in metabolic activation of polycyclic aromatic hydrocarbons[J]. Xenobiotica, 25 : 677–688. |
| [4] | Fayeulle A, Veignie E, Slomianny C, et al. 2014. Energy-dependent uptake of benzo[a]pyrene and its cytoskeleton-dependent intracellular transport by the telluric fungus Fusarium solani [J]. Environmental Science and Pollution Research, 21:3515-3523 |
| [5] | Ghosh I, Jasmine J, Mukherji S. 2014.Biodegradation of pyrene by a Pseudomonas aeruginosa strain RS1isolated from refinery sludge[J]. Bioresource Technology, 166 : 548–558. |
| [6] | Ping L, Zhang C, Zhu Y, et al. 2011.Biodegrading of pyrene by a newly isolated Pseudomonas putida PL2[J]. Biotechnology and Bioprocess Engineering, 16 (5): 1000–1008. |
| [7] | Rafin C, Potin O, Veignie E, et al. 2000. Degradation of benzo[a]pyrene as sole carbon source by a non white-rot-fungus Fusarium solani [J]. Polycyclic Aromatic Compounds, 21:311-329 |
| [8] | Rafin C, Veignie E, Woisel P, et al. 2006. New potential of a deuteromycete fungus Fusarium solani in benzo[a]pyrene degradation: an eco-physiological hypothesis? [J]. In:New frontiers in environmental research, Glazer pp 165-179 |
| [9] | Rafin C, De Foucault B, Veignie E. 2013. Exploring micromycetesbiodiversity for screening benzo[a]pyrene degrading potential [J]. Environmental Science and Pollution Research, 20:3280-3289 |
| [10] | Saraswathy A, Hallberg R. 2005.Mycelial pellet formation by Penicillium ochrochloron species due to exposure to pyrene[J]. Microbiological Research, 160 (4): 375–383. |
| [11] | Thion C, Cébron A, Beguiristain T, et al. 2012.PAH biotransformation and sorption by Fusarium solani and Arthrobacter oxydans isolated from a polluted soil in axenic cultures and mixed co-cultures[J]. International Biodeterioration & Biodegradation, 68 : 28–35. |
| [12] | Veignie E, Rafin C, Woisel P, et al. 2002. Metabolization of the polycyclic aromatic hydrocarbon benzo[a]pyrene by a non-white rot fungus (Fusarium solani) in a batch reactor [J]. Polycyclic Aromatic Compounds, 22:87-97 |
| [13] | Veignie E, Rafin C, Woisel P, et al. 2004. Preliminary evidence of the role of hydrogen peroxide in the degradation of benzo[a]pyrene by a non-white rot fungus Fusarium solani [J]. Environmental Pollution (Barking, Essex: 1987), 129 (1): 1 -4 |
| [14] | Veignie E, Vinogradov E, Sadovskaya I, et al. 2012. Preliminary characterizations of a carbohydrate from the concentrated culture ciltrate from Fusarium solani and its role in benzo[a]pyrene solubilization [J]. Advances in Applied Microbiology, 2:375-381 |
| [15] | Verdin A, Lounës-Hadj Sahraoui A, Durand R. 2004. Degradation of benzo[a]pyrene by mitosporic fungi and extracellular oxidative enzymes [J]. International Biodeterioration and Biodegradation, 53:65-70 |
| [16] | Verdin A, Lounès-Hadj Sahraoui A, Newsam R, et al. 2005.Polycyclic aromatic hydrocarbons storage by Fusarium solani in intracellular lipid vesicles[J]. Environmental Pollution, 133 : 283–291. |
| [17] | Wu Y R, He T T, Lun J S, et al. 2009. Removal of benzo[a]pyrene by a fungus Aspergillus sp. BAP14 [J]. World Journal of Microbiology and Biotechnology, 25:1395-1401 |
| [18] | Wu Y R, Luo Z H, Vrijmoed L L P. 2010. Biodegradation of anthracene and benz[a]anthracene by two Fusarium solani strains isolated from mangrove sediments [J]. Bioresource Technology, 101:9666-9672 |
| [19] | 陈芳艳, 唐玉斌, 毛莉, 等.2008.一株茄镰孢菌对菲的降解特性研究[J].江苏科技大学学报, 22 (3):72–76. |
| [20] | 潘澄, 茆婷, 吴宇澄, 等.2011.产漆酶真菌筛选及其对 PAHs 污染土壤修复的初步研究[J].土壤学报, 48 (6):1253–1259. |
| [21] | 宋立超, 钮旭光, 李培军.2012.盐碱土壤 PAHs 降解真菌筛选及降解特性研究[J].土壤通报, 43 (6):1397–1400. |
| [22] | 吴宇澄, 林先贵.2013.多环芳烃污染土壤真菌修复进展[J].土壤学报, 50 (6):1191–1199. |
| [23] | 张巧巧, 赵叶君, 杨超光, 等.2010.一株芘降解菌的分离鉴定及其降解效果[J].应用生态学报, 21 (7):1851–1858. |
 2016, Vol. 36
2016, Vol. 36


