2. 生态系统保护与恢复杭州市重点实验室, 杭州师范大学, 杭州 310036
2. Key Laboratory of Hangzhou City for Ecosystem Protection and Restoration, Hangzhou Normal University, Hangzhou 310036
全氟及多氟有机物(PFCs)是一类人工合成化学品,由于具有难降解性、生物蓄积性和生物毒性等特征(王懿,2011),被认为是一种全球性新型持久性环境污染物(周启星等,2007).近年来,全世界范围内水体、土壤和生物体等多介质环境中都检测到了该类化合物的存在,主要包括全氟辛酸(PFOA)和全氟辛磺酸(PFOS)等.Post等(2009) 检测出新泽西州自来水PFOA浓度在2006—2008年间从5~39 ng·L-1升至18~84 ng·L-1;Boulanger等(2004) 检测出五大湖中PFOA浓度范围为7~50 ng·L-1;Saito等(2004) 于2003—2004年检测的日本大阪饮用水中PFOA浓度为(40.00±1.07) ng·L-1;Skutlarek(2006) 等研究表明,德国地表水中的鲁尔河和Moehne河水中PFOA最大浓度分别达到446和4385 ng·L-1;金一和等(2006) 2003年对长江三峡和武汉段水质进行调查,结果表明,该区域广泛存在PFOA污染,平均浓度为298 ng·L-1.PFOA的分布具有明显区域污染特征,东京湾PFOA的浓度高达192 ng·L-1,是PFOS浓度的3倍(Yamashita et al.,2005) ;对我国长江和珠江PFCs的分析发现,长江水系中PFCs主要以PFOS为主,而在珠江水系中主要以PFOA为主(So et al.,2007) .这些研究结果提示,对于PFCs的研究不但要关注生物体累积性较高污染较为普遍的PFOS,也需要加强对典型水域中PFOA的污染生态效应研究.
PFOA极易在鱼等水生生物中富集(Zhang et al., 2014) .张新等(2012) 研究表明,在大连沿海取样的鱼肉样品中,PFOA 的检出率为52.6%;Consoer等(2014) 研究证实,PFOA能够在鱼体肌肉、肾脏、肝脏等不同组织中富集.由于PFOA具有较好的水溶性,因此,PFOA对鱼等水生生物的潜在生态风险备受关注(Haug et al., 2010;Rylander et al., 2010) ,研究重点主要包括PFOA在鱼体不同组织中的富集规律研究(Ulhaq et al., 2015) ,不同鱼类对PFOA富集能力差异研究(Post et al., 2012) ,以及PFOA对鱼体肝脏等组织的毒效应研究(Hagenaars et al., 2013) 等.脾脏作为鱼类免疫应答主要组织(Murayama et al., 2006) ,其受PFOA的影响有待深入研究.
脾脏是鱼体重要的免疫组织,其对抵抗外来抗原至关重要,能够调控免疫反应(Fu et al., 2015) .白细胞介素是脾脏中白细胞等免疫细胞间相互作用的一类重要细胞因子,它们在传递信息,激活与调节免疫细胞,介导T、B细胞活化、增殖与分化及在炎症反应中起重要作用(Dinarello,2009).IL-lβ、IL-21及IL-4等都是白介素经典指标,其中,IL-lβ是鱼类脾脏中重要的炎症诱导因子(Dinarello,2011),IL-4和IL-21主要调节免疫球蛋白IgG和IgA的产生(Avery et al., 2008) ,而IL-4还能够激活斑马鱼IgZ的表达(Hu et al., 2010) .大量的毒理学研究表明,PFCs普遍对免疫系统能够产生毒性.Dong等(2012) 对8~10周雄性小鼠脾脏进行体内暴露,发现PFOS可以诱导IL-1β和IL-6上调表达;PFOA可以降低NK细胞活性和巨噬细胞活化能力,抑制Th1型细胞因子IL-2和IFN-γ的分泌水平,提高Th2型细胞因子IL-4和IL-10的表达(王玉,2011).因此,PFOA胁迫鱼类脾脏免疫反应调控过程中,白介素的表达极有可能受到影响.
本研究以典型水生动物斑马鱼为研究对象,采用体内暴露实验,应用透射电镜和RT-PCR(Reversetr Transcription Polylmerase Chain Reaction)等实验方法,研究PFOA对斑马鱼脾脏中白介素表达的影响,为白介素等细胞因子作为未来筛选全氟有机污染物水生态风险评价生物标志物提供重要实验依据
2 材料与方法(Materials and methods) 2.1 试剂全氟辛酸(Perfluorooctanoic Acid,PFOA)标准品购自美国Sigma 公司(CAS No.335-67-1,分子式:C8HF15O2,相对分子量414.06,纯度 96%);Power SYBR Master Mix购自Invitrogen;1st-Strand cDNA Synthesis Kit和TRIzol购自杭州浩基生物科技有限公司;RNase-Free DNase I购自Qiagen;其它试剂为分析纯
2.2 试验动物及处理试验所用斑马鱼(Daniorerio)购自浙江省杭州市花鸟鱼市场,试验前暂养2周.在室内盛有6 L曝气脱氯自来水(曝气3 d以上)的玻璃水族缸(试验前用10%的稀硝酸浸泡)中暂养7 d后,挑选健壮的斑马鱼进行试验.斑马鱼平均体重(1.0±0.2) g,试验水温为(20.0±0.2) ℃.试验期间,每天早晚喂食两次,采用半静止实验方法,试验过程中个体死亡率小于5%.将600条斑马鱼随机分成5组(设为对照组和PFOA浓度分别为0.05、0.1、0.5和1 mg·L-1的试验组),分别在7、14 d后取样,每个浓度组取30尾鱼.染毒结束后,将斑马鱼的脾脏组织取出,待测
2.3 透射电镜观察脾脏损伤将对照组和处理组斑马鱼的脾脏组织用0.1 mol·L-1、pH=7.0的磷酸缓冲液进行第1次漂洗,重复3次,每次15 min;之后将漂洗过的样品用1%的锇酸溶液固定2 h;再用0.1 mol·L-1、pH=7.0的磷酸缓冲溶液对样品进行第2次漂洗,重复3次,每次15 min;之后用乙醇溶液对样品进行脱水处理.乙醇浓度依次为50%、70%、80%、90%和95%,每种浓度15 min;最后再用100%的乙醇和丙酮各进行一次处理,每次20 min;接着将样品置于体积比为1∶1的丙酮与乙酸异戊酯混合液中处理1 h,再置于体积比为1∶3的丙酮与乙酸异戊酯混合液处理3 h;将取出后的样品浸入纯包埋剂过夜,进行渗透处理.将渗透处理过的样品分装到0.5 mL的离心管中,70 ℃加热过夜,并在零界点进行干燥、镀膜.使用荷兰Philips公司的TECNAL-10透射电镜观察样品
2.4 基因表达水平差异检测(Real-Time PCR)组织中总RNA提取根据杭州浩基生物科技有限公司动物组织总RNA提取试剂盒说明书进行.应用分光光度计测定RNA含量,采用Bio-Rad基因扩增仪进行逆转录实验.基因表达水平采用Primer Premier 6.0和Beacon Designer 7.8软件进行荧光引物的设计,然后由上海生物工程有限公司负责合成,引物序列见表 1.
| 表 1 白介素RT-PCR引物设计 Table 1 Real-time PCR primers of interleukins |
Real-Time PCR反应体系为(25 μL):10.5 μL ddH2O,12.5 μL SYBR Premix Ex TaqTM(2×),0.5 μL PCR-F(10 μmol·L-1),0.5 μL PCR-R(10 μmol·L-1),1.0 μL模板cDNA.Real-Time PCR反应条件:95 ℃预变性1 min;95 ℃变性10 s,62 ℃退火25 s(收集荧光),40个循环;熔点曲线分析55~95 ℃.所有测量重复3次,基因相对表达水平以2(Ct内参基因-Ct目的基因)进行分析,结果以实验组基因相对于对照组基因变化倍数表示
2.5 统计分析试验所有数据用Qriginal 8.0软件处理,每组数据处理结果用平均数±标准误差表示;处理与对照间的差异用One-way ANOVA分析.当p<0.05时,表示具有显著差异;当p<0.01时,表示具有极显著差异;并在图中分别用*和**表示
3 结果(Results) 3.1 PFOA对斑马鱼脾脏损伤的电镜观察结果采用透射电镜技术,对暴露于不同浓度PFOA 14 d后的斑马鱼脾脏进行了超微结构观察,结果如图 1所示.相对于对照组,很明显可以发现,0.05 mg·L-1较低浓度PFOA暴露后呈现出细胞膜皱缩的特征;而随着暴露浓度增加到0.1 mg·L-1,脾脏细胞呈现出空泡化特征;当暴露浓度增加到0.5和1 mg·L-1后,空泡化现象更为明显.透射电镜观察结果清晰地表明,PFOA低剂量体内暴露会导致斑马鱼脾脏损伤.
 |
| 图 1 斑马鱼暴露于PFOA(0.05、0.1、0.5和1 mg·L-1)14 d后脾脏电镜观察结果图(a.对照组正常细胞结构;b.0.05 mg·L-1暴露组,细胞呈现细胞膜皱缩特征;c.0.1 mg·L-1暴露组,细胞出现空泡化特征;d.0.5 mg·L-1暴露组,细胞同时呈现细胞膜皱缩及空泡化特征;e.1 mg·L-1暴露组,细胞呈现出大量空泡化特征) Fig. 1 Transmission electron microscope observations of the spleen of zebrafish(Daniorerio)after 14 days induced by PFOA in vivo(a. control group,normal cell structure; b. 0.05 mg·L-1 exposure group,shrinking of cell membrane; c. 0.1 mg·L-1 exposure group,vacuolization of cell; d.0.5 mg·L-1 exposure group,shrinking and vacuolization of cell; e. 1 mg·L-1 exposure group,significant vacuolization of cell) |
斑马鱼暴露于不同剂量PFOA(0.05、0.1、0.5和1 mg·L-1)7和14 d后,脾脏中IL-1β的mRNA相对表达量结果如图 2所示.对于7 d暴露组来说,IL-lβ mRNA表达量呈现明显的随暴露剂量的增加而不断上升的趋势,相对于对照组,0.1和0.5 mg·L-1 PFOA诱导组IL-lβ mRNA相对表达量分别增加0.2倍(p<0.05) 和0.4倍(p<0.01) .对于14 d暴露组来说,IL-lβ mRNA表达量同样呈现明显的剂量-效应特征,相对于对照组,0.05、0.1和0.5 mg·L-1 PFOA诱导组IL-lβ mRNA相对表达量分别增加1.7倍(p<0.01) 、3.9倍(p<0.01) 和7.1倍(p<0.01) .对于7和14 d暴露组,当PFOA暴露剂量增加到1 mg·L-1时,IL-lβ mRNA表达量均呈现出下降趋势,表达量都低于对照组,表明1 mg·L-1 PFOA暴露对斑马鱼肝脏具有严重的免疫损伤效应.
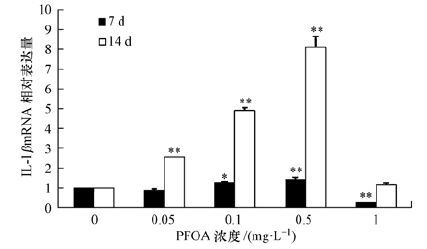 |
| 图 2 斑马鱼暴露于PFOA(0.05、0.1、0.5和1 mg·L-1)7和14天后脾脏中IL-1β的mRNA相对表达量 Fig. 2 mRNA levels of IL-1β in the spleen of zebrafish(Daniorerio)after 7 and 14 d of exposure to PFOA(0.05,0.1,0.5,and 1 mg·L-1) |
斑马鱼暴露于不同剂量PFOA(0. 05、0.1、0.5和1 mg·L-1)7和14 d后,脾脏中IL-4的mRNA相对表达量结果如图 3所示.对于7 d暴露组来说,IL-4 mRNA表达量呈现随诱导剂量增加先不断上升后下降的趋势,相对于对照组,0.05和0.1 mg·L-1 PFOA诱导组,IL-4 mRNA相对表达量分别增加0.5倍(p<0.01) 和1.4倍(p<0.01) ;当PFOA诱导剂量增加到0.5 mg·L-1后,IL-4的mRNA相对表达量下降,但仍然为对照组的1.7倍(p<0.01) .对于14 d暴露组来说,IL-4 mRNA表达量呈现不同的趋势,相对于对照组,仅仅1 mg·L-1暴露组IL-4的mRNA相对表达量有显著增加,为对照组的1.7倍(p<0.01) .
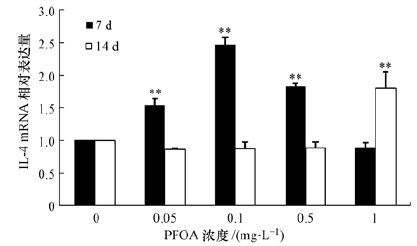 |
| 图 3 斑马鱼暴露于PFOA(0.05、0.1、0.5和1 mg·L-1)7和14 d后脾脏中IL-4的mRNA相对表达量 Fig. 3 mRNA levels of IL-4 in the spleen of zebrafish(Daniorerio)after 7 and 14 d of exposure to PFOA(0.05,0.1,0.5,and 1 mg·L-1) |
斑马鱼暴露于不同剂量PFOA(0. 05、0.1、0.5和1 mg·L-1)7和14 d后,脾脏中IL-21的mRNA相对表达量结果如图 4所示.对于7 d暴露组来说,IL-21 mRNA表达量呈现随诱导剂量增加而不断上升的趋势,相对于对照组,0.5和1 mg·L-1 PFOA诱导组的 IL-21mRNA相对表达量分别增加0.4倍(p<0.05) 和0.8倍(p<0.01) .对于14 d暴露组来说,IL-21mRNA表达量呈现明显的随暴露剂量的增加先上升后下降的趋势,相对于对照组,0.05、0.1和0.5 mg·L-1 PFOA诱导组的IL-21 mRNA相对表达量分别增加1.6倍(p<0.01) 、3.7倍(p<0.01) 和8.1倍(p<0.01) ,当PFOA诱导剂量增加到1 mg·L-1后,IL-21的mRNA相对表达量开始下降,但仍然为对照组的6.1倍(p<0.01) .
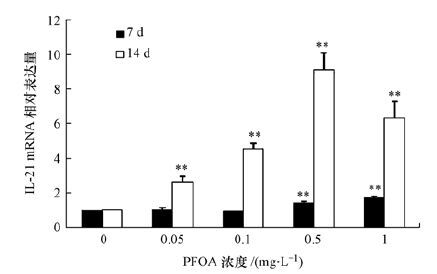 |
| 图 4 斑马鱼暴露于PFOA(0.05、0.1、0.5和1 mg·L-1)7和14天后脾脏中IL-21的mRNA相对表达量 Fig. 4 mRNA levels of IL-21 in the spleen of zebrafish(Daniorerio)after 7 and 14 d of exposure to PFOA(0.05,0.1,0.5,and 1 mg·L-1) |
为了进一步了解斑马鱼暴露于不同剂量PFOA(0. 05、0.1、0.5和1 mg·L-1)7和14 d后,脾脏中IL-1β、IL-4和IL-21表达之间的相互影响关系,采用多元拟合方法对于所有剂量诱导组各白介素(ILs)表达量进行了线性相关分析,结果如表 2所示.根据表 2的结果,IL-1β的表达量明显与IL-4和IL-21密切相关,当暴露时间为7 d时,IL-1β的表达量与IL-4表达量相关系数为0.53;当暴露时间为14 d时,IL-1β表达量与IL-21表达量的相关系数为0.50.这表明PFOA诱导不同时间段后,斑马鱼脾脏IL-1β的表达量分别受IL-4和IL-21的表达影响.
| 表 2 不同暴露时间下各ILs之间相对表达量的线性相关分析 Table 2 Linear correlation analysis of relative expression of ILs in different exposure times |
研究表明,全氟化合物(PFCs)会对哺乳动物的免疫系统造成危害.Corsini等(2011) 研究表明,PFCs 能影响人类免疫细胞活性和炎性细胞因子的释放;Brieger等(2011) 研究发现,PFOS 能导致自然杀伤细胞活性显著降低,引起脂多糖所诱导的炎性细胞因子 TNF-α释放的减少;Yang等(2002) 研究发现,PFOA能够降低小鼠血清中免疫球蛋白IgG和IgM水平,降低T细胞和B细胞免疫功能,并且PFOA能够作用于细胞周期中的S和G2/M期,间接导致胸腺细胞及CD+4和CD+8细胞的数量减少,从而危害动物的免疫系统.PFOA对哺乳动物毒效应研究较为成熟,而对于水生生物免疫系统的影响报道相对较少.本研究发现,PFOA能够诱导模式水生生物斑马鱼脾脏损伤并且导致白介素表达紊乱.
采用C14标记的PFOA示踪实验表明,体内暴露较短时间后,PFOA就能够在斑马鱼体内肝脏、肾脏、脾脏等多个组织中累积,从而产生毒效应(Ulhaq et al., 2015) .以斑马鱼为实验对象的研究表明,PFOA在细胞水平的致毒机理主要包括细胞膜通透性破坏及继发性线粒体功能紊乱,0.1 mg·L-1剂量的PFOA就能够诱导斑马鱼肝细胞膜通透性改变(Hagenaars et al., 2013) .本研究采用透射电镜技术,发现0.05 mg·L-1 PFOA暴露14 d后,能够诱导斑马鱼脾脏细胞出现细胞膜皱缩的现象,这一方面表明PFOA在低剂量暴露下可以导致斑马鱼脾脏损伤,另一方面也说明导致细胞膜通透性破坏是斑马鱼细胞水平毒效应的主要表现之一.
PFOA的免疫毒性主要表现为导致组织产生炎性反应,Singh等(2012) 研究表明,PFOA会引起促炎性因子的释放和表达,从而诱导血液中肥大细胞产生过敏性炎症反应.IL-1β是生物机体应对外来异生质反应最快、作用最强的炎性细胞因子(Dinarello,1997),IL-21也是典型的前炎细胞因子之一(Parrish-Novak et al., 2000) .实验结果表明,暴露时间为14 d后,IL-1β和IL-21的相对表达量最高分别为对照组的8.1倍(p<0.01) 和9.1倍(p<0.01) ,而IL-4的相对表达量最高为对照组的2.5倍(p<0.01) ,因此,白介素IL-1β和IL-21对PFOA胁迫的响应更为灵敏.主要原因在于IL-1β和IL-21为前炎性细胞因子,刺激炎性细胞黏附分子的表达(Guan et al., 2015; McLeod et al., 2015) ,而IL-4为典型的抗炎性细胞因子(McLeod et al., 2015) ,它们在免疫调控中的作用有明显区别.线性相关性分析表明,当暴露时间为7 d时,IL-1β表达量与IL-4表达量的相关系数为0.53;当暴露时间为14 d时,IL-1β表达量与IL-21表达量的相关系数为0.50.这说明PFOA诱导不同时间段后,斑马鱼脾脏IL-1β的表达量分别受IL-4和IL-21的表达影响.鱼体的免疫调控过程非常复杂,上述研究结果说明PFOA短期暴露下的免疫毒效应与抗炎性细胞因子IL-4的分泌有关,而PFOA长期暴露后由于机体无法修复炎性效应,因而其免疫毒效应受促炎性分子IL-21调控.
从图 2、图 3和图 4中的数据对比可以明显看出,PFOA诱导斑马鱼脾脏IL-1β、IL-4和IL-21的相对表达量均呈现明显的剂量-效应特征,但这种剂量-效应的变化并不是单一趋势,而是在低剂量下的诱导增加,而最高剂量诱导组(1 mg·L-1)往往导致IL-1β、IL-4和IL-21相对表达量的下降.对于7 d暴露组,IL-1β和IL-4在mRNA水平的相对表达量随着暴露剂量的增加呈现出明显的先上升后下降的趋势,而IL-21的相对表达量随着暴露剂量的增加不断上升.对于14 d暴露组,IL-1β和IL-21在mRNA水平的相对表达量随着暴露剂量的增加呈现出明显的先上升后下降的趋势,而IL-4的相对表达量随着暴露剂量的增加不断上升.这些结果充分证实了PFOA暴露后斑马鱼脾脏白细胞介素分泌的紊乱特征.白细胞介素IL-1β、IL-4和IL-21除了能够反映出相应组织的炎性水平,它们还能够调节下游的免疫球蛋白的表达(Paul,2015).DeWitt等(2008) 研究证实,PFOA可以导致小鼠血清中IgM的表达呈现明显下降趋势,IgG呈上升趋势.因此,PFOA诱导斑马鱼白介素表达紊乱有可能进一步对免疫球蛋白的分泌产生影响,相关研究有待进一步开展
5 结论(Conclusions)0.05、0.1、0.5和1 mg·L-1 PFOA能够诱导斑马鱼脾脏细胞损伤,出现细胞膜皱缩和空泡化等典型特征;PFOA能够明显干扰斑马鱼脾脏白介素的表达,导致白介素IL-1β、IL-4和IL-21水平紊乱,并且呈现明显的剂量-效应特征.
| [1] | Avery D T, Bryant V L, Ma C S. 2008.IL-21-induced Isotype switching to IgG and IgA by human naive B cells is defferentially regulated by IL-4[J]. Journal of Immunology, 181 (3): 1767–1779. |
| [2] | Boulanger B, Vargo J, Sclnoor J L, et al. 2004.Detection of perfluorooctane surfactants in great lakes water[J]. Environmental Science & Technology, 38 (15): 4064–4070. |
| [3] | Brieger A, Bienefeld N, Hasan R, et al. 2011.Impact of perfluorooctanesulfonate and perfluorooctanoic acid on human peripheral leukocytes[J]. Toxicol in Vitro, 25 (4): 960–968. |
| [4] | Consoer D M, Hoffman A D, Fitzsimmons P N, et al. 2014.Toxicokinetics of perfluorooctanoate (PFOA) in rainbow trout (Oncorhynchus mykiss)[J]. Aquatic Toxiclogy, 156 : 65–73. |
| [5] | Corsini E, Avogadro A, Galbiati V, et al. 2011.In vitro evaluation of the immunotoxic potential of perfluorinated compounds (PFCs)[J]. Toxicol and Applied Pharmacology, 250 (2): 108–116. |
| [6] | DeWitt J C, Copeland C B, Strynar M J, et al. 2008.Perfluorooctanoic acid induced immunomodulation in adult C57BL/6J or C57BL/6N female mice[J]. Environmental Health Perspectives, 116 (5): 644–650. |
| [7] | Dinarello C A. 1997.Interleukin-1[J]. Cytokine & Growth Factor Reviews, 8 (4): 253–265. |
| [8] | Dinarello C A. 2009.Immunological and inflammatory functions of the interleukin-1 family[J]. Annual Review of Immunology, 27 : 519–550. |
| [9] | Dinarello C A. 2011.Interleukin-1 in the pathogenesis and treatment of inflammatory diseases[J]. Blood, 117 : 3720–3732. |
| [10] | Dong G H, Zhang Y H, Zheng L, et al. 2012.Subchronic effects of perfluorooctanesulfonate exposure on inflammation in adult male C57BL/6 mice[J]. Environmental Toxicology, 27 (5): 285–296. |
| [11] | Fu X Z, Li N Q, Lin Q. 2015.Early protein ORF086 is an effective vaccine candidate for infectious spleen and kidney necrosis virus in mandarin fish Siniperca chuatsi[J]. Fish & Shellfish Immunogy, 46 (2): 200–205. |
| [12] | Guan L J, Wang X, Meng S. 2015.Increased IL-21/IL-21R expression and its proinflammatory effects in autoimmune thyroid disease[J]. Cytokine, 72 (2): 160–165. |
| [13] | Hagenaars A, Vergauwen L, Benoot D, et al. 2013.Mechanistic toxicity study of perfluorooctanoic acid in zebrafish suggests mitochondrial dysfunction to play a key role in PFOA toxicity[J]. Chemosphere, 91 (6): 844–856. |
| [14] | Hagenaars A, Vergauwen L, Benoot D, et al. 2013.Mechanistic toxicity study of perfluorooctanoic acid in zebrafish suggests mitochondrial dysfunction to play a key role in PFOA toxicity[J]. Chemosphere, 91 (6): 844–856. |
| [15] | Haug L S, Thomsen C, Brantster A L, et al. 2010.Diet and particularly seafood are major sources of perfluorinated compounds in humans[J]. Environment International, 36 (7): 772–778. |
| [16] | Hu Y L, Xiang L X, Shao J Z. 2010.Identification and characterization of a novel immunoglobulin Z isotype in zebrafish: implications for a distinct B cell receptor in lower vertebrates[J]. Molecular Immunology, 47 (4): 738–746. |
| [17] | 金一和, 丁梅, 翟成, 等.2006.长江三峡库区江水和武汉地区地面水中PFOS和PFOA污染现状调查[J].生态环境, 15 (3):486–489. |
| [18] | McLeod J J A, Baker B, Ryan J J. 2015.Mast cell production and response to IL-4 and IL-13[J]. Cytokine, 75 (1): 57–61. |
| [19] | Murayama E, Kissa K, Zapata A, et al. 2006.Tracing hematopoietic precursor migration to successive hematopoietic organs during zebrafish development[J]. Immunity, 25 (6): 963–975. |
| [20] | Parrish-Novak J, Dillon S R, Nelson A, et al. 2000.Interleukin 21 and its receptor are involved in NK cell expansion and regulation of lymphocyte function[J]. Nature, 408 : 57–63. |
| [21] | Paul W E. 2015.History of interleukin-4[J]. Cytokine, 75 (1): 3–7. |
| [22] | Post G B, Cohn P D, Cooper K R. 2012.Perfluorooctanoic acid (PFOA),an emerging drinking water contaminant: A critical review of recent literature[J]. Environmental Research, 116 : 93–117. |
| [23] | Post G B, Louis J B, Cooper K R, et al. 2009.Occurrence and potential significance of perfluorooctanoic acid (PFOA) detected in New Jersey public drinking water systems[J]. Environmental Science & Technology, 43 (12): 4547–4554. |
| [24] | Rylander C, Sandanger T M, Fryland L, et al. 2010.Dietay patterns and plasma concentrations of perfluorinated compounds in 315 Norwegian women: The NOMAC postgenome study[J]. Environment Science & Technology, 44 (13): 5225–5232. |
| [25] | Saito N, Harada K, Inoue K, et al. 2004.Perfluorooctane and perfluorooctane sulfonate concentrations in surface water in Japan[J]. Journal of Occupational Health, 46 (1): 49–59. |
| [26] | Singh T S K, Lee S, Kim H H, et al. 2012.Perfluorooctanoic acid induces mast cell-mediated allergic inflammation by the release of histamine and inflammatory mediators[J]. Toxicology Letters, 210 (1): 64–70. |
| [27] | Skutlarek D, Exner M, Farber H, et al. 2006.Perfluorinated surfactants in surface and drinking waters[J]. Environmental Science and Pollution Research, 13 (5): 299–307. |
| [28] | So M K, Miyake Y, Yeung W Y, et al. 2007.Perfluorinated compounds in the Pearl River and Yantze River of China[J]. Chemosphere, 68 (11): 2085–2095. |
| [29] | Ulhaq M, Sundström M, Larsson P, et al. 2015.Tissue uptake,distribution and elimination of 14C-PFOA in zebrafis (Danio rerio)[J]. Aquatic Toxicology, 163 : 148–157. |
| [30] | 王懿.2011.持久性全氟化合物典型污染源环境污染特性研究[D].南京:南京农业大学.1-73 |
| [31] | 王玉.2011.全氟辛烷磺酸(PFOS)和全氟辛酸(PFOA)对BALB/c小鼠免疫系统毒性效应研究[D].武汉:华中农业大学.1-74 |
| [32] | Yamashita N, Kannan K, Taniyasu S, et al. 2005.A global survey of perfluorinated acids in oceans[J]. Marine Pollution Bulletin, 51 (8/12): 658–668. |
| [33] | Yang Q, Abedi-Valugerdi M, Xie Y, et al. 2002.Potent suppression of the adaptive immune response in mice upon dietary exposure to the potent peroxisome proliferator,perfluorooctanoic acid[J]. International Immunopharmacol, 2 (2/3): 389–397. |
| [34] | Zhang L, Niu J F, Wang Y J, et al. 2014.Chronic effects of PFOA and PFOS on sexual reproduction of freshwater rotifer Brachionus calyciflorus[J]. Chemosphere, 114 : 114–120. |
| [35] | 张新, 刘薇, 金一和.2012.大连沿海常见海产品PFOS和PFOA的暴露水平调查[J].环境科学与技术, 35 (8):104–106. |
| [36] | 周启星, 胡献刚.2007.PFOS/PFOA环境污染行为与毒性效应及机理研究进展[J].环境科学, 28 (10):2153–2162. |
 2016, Vol. 36
2016, Vol. 36


