氧化亚氮(N2O)是大气中一种重要的温室气体,其单分子辐射能力是CO2的298倍,对全球总辐射强迫的贡献约为6.2%,对全球变暖和大气化学有重要作用(IPCC,2013).大气中N2O的生命周期大约为114年,它能从对流层混合进入平流层,并参与平流层臭氧的消耗(Prather,1998; Ravishankara et al., 2009).工业革命以来大气中N2O浓度急剧上升(Solomon et al., 2007),到2014年已经超过326×10-9(http://www.esrl.noaa.gov/gmd).随着氟氯代物的禁用,N2O将成为21世纪臭氧层的最大威胁(Ravishankara et al., 2009),对温室效应的贡献也会更加显著(Solomon et al., 2007).
尽管河流占全球面积不大,但是近年来由于使用化肥、排放污水等人为活动的增加导致向河流输送的无机氮大幅增加,因而河流也成为产生和释放N2O的活跃区域(Bouwman,1995; Seitzinger,1988),据估计河流和河口每年向大气释放的N2O约为1.5 Tg·N(Kroeze et al., 2005).河流中N2O的产生及转化途径主要有3种(Hooper,1997; Codispoti et al., 2005; Beaulieu et al., 2011):①硝化作用(NH4+ → NH2OH → NO2- → NO3-);②反硝化作用(NO3- → NO2- → NO → N2O → N2);③硝酸盐异化还原(DRNA)过程.其中硝化和反硝化作用是河流中N2O产生的主要过程,据Beaulieu(2011)估计,在河流系统中无机氮通过硝化、反硝化过程转变为N2O的量约为0.68 Tg·a-1,占河流总氮输入的0.75%,占全球人为输入无机氮的10%.水体中溶解氧的含量决定N2O产生和转化的主导过程(Codispoti et al., 2005).在有氧条件下,N2O主要通过硝化作用产生,而在低氧或者缺氧的环境中,N2O主要通过反硝化作用产生,但在极度缺氧的条件下,N2O会被反硝化作用消耗,其浓度迅速降低(Yoshinari et al., 1997; Patra et al., 1999).然而,目前对河流中N2O不同产生过程的相对贡献仍然不是很明确,因此对典型河流水体、沉积物中N2O的产生、转化和释放进行研究,对于深入认识河流中N2O的生物地球化学循环具有重要意义.
黄河是中国第二大河,干流全长5464 km,是典型的多沙少水的河流,流域面积79.5万m2,主要分布在上、中游地区,占到流域总面积的97%,下游几乎没有支流汇入,加上泥沙淤积逐渐成为地上悬河,下游流域面积只占总面积的2.9%(黄翠玲,2007;孙超,2007).受农业灌溉、化肥使用和水库大坝等人类活动影响,黄河年径流量变化大,每年6—9月为汛期,并且为了改善黄河下游河道淤积的现象,在此期间会进行调水调沙以改善黄河下游河道淤积的现象.调水调沙会人为改变黄河溶解无机氮(DIN)的月变化及向渤海的输入(Liu et al., 2012),进而影响河流中N2O的产生和释放.
目前,国内对于N2O的研究大多针对其在一些典型海区(如黄海、东海、南海等)、海湾(如胶州湾、大亚湾等)和河口(如长江口、黄河口、珠江口等)分布、释放的季节变化及其影响因素,但对于河流水体、沉积物中N2O的产生、释放和转化机制的研究相对较少.如杨晶(2011)于2008—2009年对大沽河口和娄山口进行了硝化速率及反硝化速率的测定.
本文在黄河下游垦利站进行了长期连续观测,对水体中溶解N2O浓度和释放的季节变化进行了研究,同时采集了表层水体和沉积物进行实验室受控培养,初步探讨了黄河下游段水体、沉积物中N2O的产生和转化,丰富了我国典型河口水体中溶解N2O的浓度变化、释放量以及河口水体、沉积物中N2O产生和转化机制的研究.
2 材料与方法(Materials and methods) 2.1 研究区域于2012年3月至2014年3月期间每月低潮期在黄河垦利站(如图 1所示)定点采集表层河水样品,研究黄河下游段溶解N2O浓度的月际变化,估算其水-气交换通量及其向河口及其邻近海域N2O的输送量.于2012年10月至2013年12月期间每月同时采集表层河水和表层沉积物(0~5 cm)样品,并在实验室进行受控培养实验,以测定黄河水体和沉积物中N2O的潜在硝化和反硝化速率.于2012年8月26日至9月1日黄河调流调沙后期在垦利每日8点采集黄河水,对河流中N2O浓度的日变化进行了连续监测.
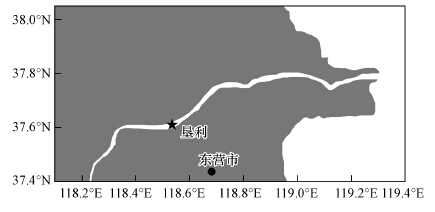 |
| 图 1 黄河下游垦利站采样站位 Fig. 1 Sampling location of Kenli station at the downstream Yellow River |
用10 L采水桶采集黄河表层水,用一头带有玻璃管的半透明橡胶管将水样分装到56.5 mL的玻璃样品瓶中.取样时,先用少量河水冲洗样品瓶2~3次,然后再将玻璃管插入瓶底将水样平稳且迅速的注入瓶中(避免产生漩涡和气泡),当水样溢出约瓶体积的1.5~2倍时,缓慢抽出玻璃管.迅速加入0.5 mL饱和氯化汞溶液以抑制微生物活动,然后用带聚四氟乙烯内衬的橡胶塞和铝盖将瓶口密封,并将样品瓶上下颠倒几次,使HgCl2均匀分散开,最后将样品置于低温避光条件下保存.每个站点平行取3份样品,带回实验室后尽快测定.现场的风速、气温、气压等气象数据由便携式风速仪(AZ 8909)同时测定,表层河水的温度、盐度、pH和溶解氧等参数由多参数水质仪(Multi 350i/SET,德国)同步现场测定.
河水中N2O浓度采用静态顶空-气相色谱法测定(Zhang et al., 2010).抽取5.0 mL高纯氮气(>99.999%)注入样品瓶内,同时排出等体积的水以形成瓶内顶空.在室温下将样品剧烈振荡3 min,静置3 h以上,直至气、液两相达到平衡,抽取顶空气体注入气相色谱仪(Agilent HP6890,配有ECD检测器)进行分离和测定.色谱测定条件为:
色谱柱:3 mm.i.d ×3 m的不锈钢填充柱(内填80/100目的Porapark-Q)
柱温:40 ℃;检测器温度:300 ℃;进样口温度:100 ℃
载气:Ar/CH4(95%/5%),30 mL·min-1;基电流:1.0 nA
测定样品前先用3种不同浓度的标准气体(0.291×10-6、0.617×10-6和4.980×10-6 N2O/N2,国家标准物质中心)对检测器信号进行校正,得出峰面积与标准气体浓度的关系曲线.测定过程中记录室温和气压,利用Weiss和Price(1980)提供的溶解度数据,计算出样品中溶解N2O的浓度.该方法测定水样中N2O的检测限为1.0 nmol·L-1,精密度约为2%.
2.3 实验室水体和沉积物受控培养实验采用添加抑制剂培养法测定表层河水和沉积物中N2O的潜在硝化速率和潜在反硝化速率(Barnes and Owens, 1999; Garcìa et al., 1998; Inwood et al., 2005),培养装置如图 2所示,培养瓶为体积约为1000 mL的棕色瓶,具体体积由称重法测定.将培养实验分为3组:第1组作为对照组,为不添加抑制剂的水体培养(600 g表层河水)和沉积物-水体培养(300 g表层河水+300 g表层沉积物),顶空保持空气氛围;第2组为添加硝化抑制剂烯丙基硫脲(ATU)的水体培养(540 g表层河水+60 g ATU溶液(1 g·L-1))和沉积物-水体培养(240 g表层河水+300 g表层沉积物+60 g ATU溶液(1 g·L-1)),ATU在间隙水和上覆水中的最终浓度为100 mg·L-1,顶空保持空气氛围;第3组为添加反硝化抑制剂(乙炔,抑制反硝化过程中N2O向N2的转化)的水体培养(600 g表层河水)和沉积物-水体培养(300 g表层河水+300 g表层沉积物),先用高纯氮气(>99.999%)吹扫培养瓶中的水体及沉积物0.5 h,制造缺氧环境,密封好后,向顶空中加入一定体积的洗涤过的乙炔气体(依次用1 mol·L-1硫酸铜溶液、98%浓硫酸、5 mol·L-1氢氧化钠溶液和1 mol·L-1硫酸铜溶液洗涤),使培养瓶内乙炔体积分数为20%(V/V)(Magalhaes et al., 2005).
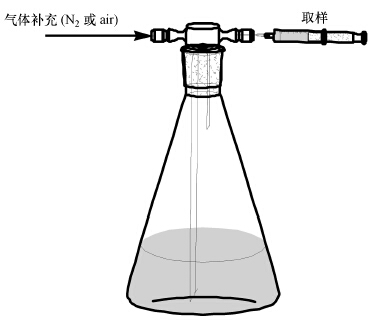 |
| 图 2 黄河垦利站N2O产生和转化培养实验装置(顾培培等,2011) Fig. 2 Incubation bottle for N2O production and transformation |
水体和沉积物培养期间,分别于4 h、8 h、14 h、22 h、30 h从以上培养瓶中抽取10 mL的顶空气体,利用气相色谱法测定N2O的浓度(参照本文2.2节).水体和沉积物中N2O净产生或净消耗速率可以通过对照组中N2O浓度随培养时间变化曲线的斜率得到.斜率为正代表净产生,斜率为负代表净消耗.N2O的潜在硝化速率用对照组(第1组)的N2O浓度随培养时间变化曲线的斜率减去添加ATU抑制剂组(第2组)的斜率得到.N2O的潜在反硝化速率由添加乙炔抑制剂组(第3组)的N2O浓度随培养时间变化曲线的斜率得到.具体计算公式如下:

|
(1) |
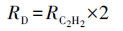
|
(2) |
其中,RN为硝化速率(nmol·L-1·h-1或nmol·kg-1·h-1),Rcontrol为N2O净产生或净消耗速率(nmol·L-1·h-1或nmol·kg-1·h-1),RATU为添加ATU抑制剂后N2O产生或消耗速率(nmol·L-1·h-1或nmol·kg-1·h-1),RD为反硝化速率(nmol·L-1·h-1或nmol·kg-1·h-1),RC2H2为添加乙炔抑制剂后N2O产生或消耗速率(nmol·L-1·h-1或nmol·kg-1·h-1).虽然该培养方法测定的速率并不具有环境真实性,但是能在一定程度上反映一种潜在可能性,因此在河流、河口等近岸海洋环境的氮循环研究中应用广泛(Magalhes et al., 2005; Inwood et al., 2005).
2.4 N2O饱和度及水-气交换通量的计算河水中溶解N2O的饱和度和水-气交换通量分别由下列公式计算:
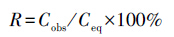
|
(3) |
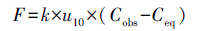
|
(4) |
其中,Cobs为表层水中溶解N2O的实测浓度;Ceq是表层水与大气达到平衡时的N2O浓度;k为气体交换速率,为风速(u10,水面上方10 m高度处的风速)与施密特数(Sc)的函数(Raymond and Cole, 2001).
目前文献中常用Liss和Meriivat 1986公式(Liss and Meriivat, 1986)和Wanninkhof l992公式(Wanninkhof,l992)(以下分别简称为LM86和W92公式)来估算k的较低值和较高值.然而,潮汐也可能影响水体湍流,特别是在水深较浅、底层摩擦力较高的河口内(Raymond and Cole, 2001; Zappa et al., 2003; Abril and Borges, 2004).Raymond and Cole认为在相同风速下,河口区的k值应该明显比外海的高,并提出了适用于大型河流和河口气体交换速率的估算公式(以下简称RC01公式).因为缺乏黄河口的实测气体交换速率,所以本文同时采用以上3个公式计算k值以便与已发表的数据进行对比.现场测得的风速根据Garratt公式校正到水面上方10 m高度处的风速.Sc根据以下公式计算(Wanninkhof,1992; Walter,2004):
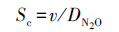
|
(5) |
式中,v为水体动力粘度,根据Siedler and Peters(1986)公式计算;DN2O(m2·s-1)为水体中N2O分子扩散系数,根据Rhee(2000)公式计算.
3 结果与讨论(Results and discussion) 3.1 黄河下游段溶解N2O浓度及饱和度的季节变化及其影响因素2012年3月—2014年3月黄河下游段表层河水温度和溶解N2O的浓度及饱和度如表 1所示.整体上而言,N2O浓度高值出现在冬季、初春以及2012年夏季,除此之外其他月际间浓度变化不大,另外2012年7月、8月由于受到调水调沙的影响,水体中溶解N2O浓度明显升高.饱和度在夏季最高,春季次之,秋季最低.2012年黄河表层水中N2O浓度变化范围为11.63~23.06 nmol·L-1,平均浓度为(16.14±4.17)nmol·L-1,2013年黄河表层水中N2O浓度变化范围为12.40~27.23 nmol·L-1,平均浓度为(16.20±4.77)nmol·L-1,均低于2010—2011年N2O的浓度(21.89 nmol·L-1,顾培培,2012)和2008—2009年N2O的浓度(17.80 nmol·L-1,李佩佩,2010),表明黄河下游段溶解N2O浓度有一定的年际变化.
| 表 1 2012—2014年间黄河下游段表层河水各参数的季节变化 Table 1 Temperature and N2O concentrations in the downstream Yellow River from 2012 to 2014 |
文献发表的世界上各大河流中溶解N2O的数据汇总如表 2所示,由此表可以看出,河流中N2O浓度有较大时空变化,范围为3.3~527.0 nmol·L-1,本文调查获得的黄河下游段N2O浓度在此范围内,但处于相对较低水平.
| 表 2 文献报道世界各大河流溶解N2O的浓度及饱和度汇总 Table 2 Summary of N2O concentrations and saturations in various rivers in the world |
2012年3月—2014年3月黄河垦利站河水中溶解N2O浓度及饱和度的季节变化如图 3所示.黄河下游段水体中溶解N2O浓度有明显的季节变化,具体表现为冬季和春季高于夏季和秋季,秋季最低,但全年变化幅度不大,这与李佩佩(2010)研究黄河口水体中N2O的季节变化结果相似.N2O饱和度同样存在明显的季节变化,具体表现为夏季最高,春季次之,秋季和冬季较低.从全年来看,枯水期(12月—5月)黄河溶解N2O浓度整体上高于丰水期(6月—11月),这与黄河下游溶解无机氮丰水期浓度低、枯水期浓度高的总体变化规律相一致(陈沛沛,2013;姚庆祯,2009),表明了黄河中N2O浓度受到水体中无机氮含量的影响.温度对河流中溶解N2O有双重影响,一方面,温度降低,其溶解度升高,因此冬季水体中溶解N2O浓度普遍较高.研究表明,水温每降低1 ℃,N2O在水中的溶解度会升高3%(Weiss,1980),而冬季温度最低,N2O的溶解度相对其他季节高.另一方面,温度升高,生物活动加强,有利于N2O的生物产生.N2O饱和度与温度呈明显正相关关系(图 4所示,R=5.49 T + 71.35,R2=0.49,n=19,p<8.13×10-4),表明N2O浓度及饱和度主要受到生物活动影响.此外,N2O饱和度与黄河的径流量也呈明显正相关关系(图 5所示,R=0.07 V + 126.09,R2=0.62,n=19,p<0.0001),径流量的增加一方面促进了营养盐输送量的增加,另一方面加速了N2O的释放.
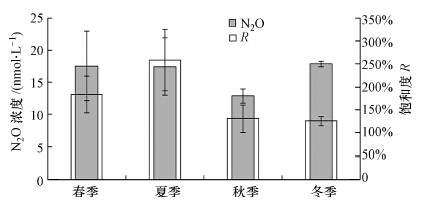 |
| 图 3 2012—2013年黄河下游段N2O浓度及饱和度的季节变化 Fig. 3 Seasonal variations of N2O concentrations and saturations in the downstream Yellow River from 2012 to 2013 |
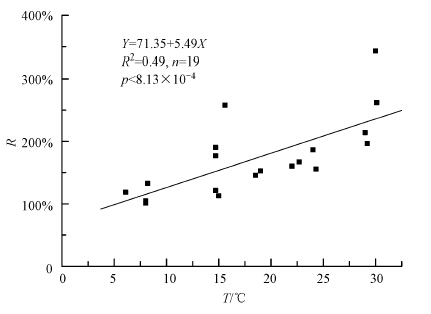 |
| 图 4 黄河下游段N2O饱和度(R)与温度(T)的关系 Fig. 4 Relationship between N2O saturations and temperature in the downstream Yellow River |
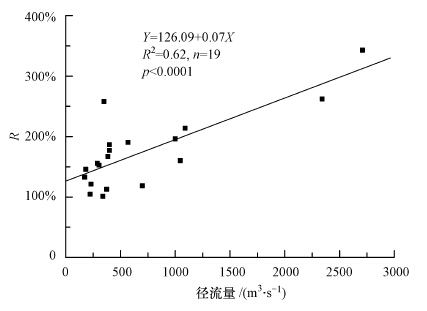 |
| 图 5 黄河下游段每月N2O饱和度与黄河径流量的关系 Fig. 5 Relationship between N2O saturations and the water discharge in the downstream Yellow River |
夏季水体中溶解N2O的浓度相对较高,可能与黄河进行调水调沙有关.2012年调水调沙后期黄河N2O浓度变化如图 6所示,8月1日~8月26日径流量增大(V>1500 m3·s-1),水体中溶解N2O浓度明显升高([N2O]:16~23 nmol·L-1);8月31日—9月1日径流量降低(V<1500 m3·s-1),N2O浓度明显降低([N2O] ≈ 10 nmol·L-1),调水调沙期间黄河水体溶解N2O浓度与径流量表现出较好的正相关关系([N2O]=0.01V-14.04,R2=0.87,n=6),这与顾培培(2012)和李佩佩(2010)的研究结果相同.调水调沙使大量河床泥沙被搅起,间隙水中高浓度氨释放到水体中,同时大量前期埋藏的有机物暴露于氧气中,加速了有机质再矿化(Ståhlberg et al., 2006),这都为硝化过程提供了有利条件,有利于N2O的产生和释放.姚庆祯等(2009)研究还表明,虽然调水调沙对黄河下游溶解态无机营养盐浓度在全年的变化规律并无明显影响,但对营养盐输送通量在年内的分配产生重大影响,使得黄河营养盐向河口的输送非常集中.2002年黄河首次调水调沙短短不到一个月的时间,所输送的营养盐通量便占到当年输送通量的一半左右.调水调沙使洪水漫滩导致下游滩地硝酸盐释放,硝酸盐浓度迅速升高(姚庆祯,2009).此外,8月温度较高,符合细菌生长的适宜温度(25~35 ℃)(Hansen,1981),微生物活动比较活跃,加上调水调沙前期引起的硝酸盐浓度升高,促进了硝化和反硝化作用的发生.但黄河口复杂的水体混合状况和影响N2O气体产生的诸多因素需要我们在今后的研究中更深入细致,关注季节变化和各个产生来源的不同贡献,以期能获得对黄河口溶解N2O更为清晰的认识.
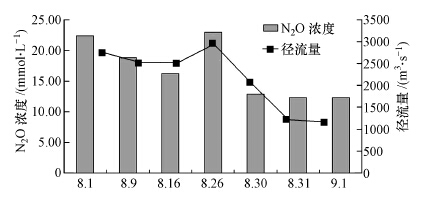 |
| 图 6 2012年8月—9月调水调沙期间黄河垦利站N2O浓度的变化 Fig. 6 Variations of N2O concentrations at Kenli station during the water-sediment regulation period in 2012 |
2012年10月至2013年12月黄河表层水和沉积物的潜在N2O净产生速率、潜在硝化速率及潜在反硝化速率如表 3所示,黄河下游段水体和沉积物整体表现为净产生N2O,其净产生速率(以N计)分别为(0.06±0.22)nmol·L-1·h-1和(0.15±1.19)nmol·kg-1·h-1.水体和沉积物中潜在反硝化速率均明显高于其硝化速率,表明反硝化作用在黄河下游水体N2O的产生过程中有重要作用,特别是在沉积物中N2O的产生主要通过反硝化过程产生或消耗.前人的研究也表明,河流中反硝化作用在N2O产生过程中起了很大作用(Laursen and Seitzinger, 2004;Beaulieu,2010).
| 表 3 黄河下游段水体和沉积物中潜在净产生速率、潜在硝化速率及潜在反硝化速率 Table 3 Potential rates of production, nitrification and denitrification in water and sediment in the downstream Yellow River |
2012年10月—2014年3月黄河下游段水体和沉积物中潜在反硝化速率均呈现出明显的季节变化.水体中,夏季最强,冬季次之,春季最低;沉积物中,夏季最强,春季次之,秋、冬季较低.水体和沉积物中潜在反硝化速率的最高值均出现在夏季,这可能是受温度的影响,硝化作用和反硝化作用都是受微生物活性影响的过程,其反应速率直接受水温变化的控制.另一方面,降雨也是不可忽略的一方面因素,Iriarte(1998)报道季节性降雨带入的硝化细菌对硝化速率季节性变化有着不可忽略的作用,硝化速率的提高为水体中反硝化过程提供了大量的NO3-,从而促进了水体中反硝化速率的提高.同时,水体中NO3-含量的增加会导致沉积物中NO3-含量的增加,进而促进了沉积物中反硝化速率的提高.有关研究表明,沉积物中N2O的产量与NO3-和还原剂(有机碳)的含量有关,当NO3-的含量远超过有机碳时,反硝化过程中N2O更容易作为最终的电子受体而被累积(Firestone,1989; Hutchinson,1993; Swerts,1996; Miller et al., 2008).此外,高NO3-含量会抑制N2O还原酶的活性,减少N2O向N2的转化(Firestone,1979),因而在水体和沉积物中N2O被累积,水体和沉积物中潜在硝化速率和潜在反硝化速率均增大,水体中溶解N2O饱和度的高值也出现在夏季.秋季水体和沉积物中潜在反硝化速率相对较低,可能是受呼吸作用的影响.当一些因素如不稳定碳、有机质等含量增加时,呼吸作用增强,耗氧量增大,为反硝化过程提供了适宜的低氧环境,但是环境中溶解氧的降低会抑制硝化作用,从而减低了NO3-的浓度,一定程度上也会抑制反硝化过程的进行,因而导致潜在硝化和潜在反硝化速率的降低(Beaulieu,2010),秋季水体中溶解N2O饱和度也表现为低值.但在沉积物中,在极度缺氧的条件下,N2O会被反硝化作用消耗,其浓度迅速降低(Yoshinari et al., 1997; Patra et al., 1999),2013年秋季沉积物中N2O表现为净损失,表明沉积物中N2O通过反硝化过程被进一步消耗.冬季虽然温度低,微生物活性低,但是水体中无机氮含量高(陈沛沛,2013;姚庆祯,2009),潜在反硝化速率反而不是很低.
世界上很多学者也已经对河流潜在反硝化速率进行了测定,其结果见表 4.黄河口潜在反硝化速率在世界上其他河流及河口中处于较低水平,这与黄河水体中溶解N2O浓度较世界其他河流偏低是一致的.这可能是由于反硝化作用受有机质等因素的影响较大,Hedin等(1998)报道在高硝酸盐沉积物环境中有机质的含量提高能促进反硝化作用的进行,Arango(2007)指出反硝化细菌是以溶解有机碳(DOC)为基底的异养微生物,水体中DOC和沉积物有机质含量低可能限制N2O产生和转化速率低.黄河是典型的高硝酸盐、低有机质水体,水体中DOC和沉积物有机质含量低可能限制了反硝化的发生及N2O的产生.另外,生物灌溉和生物扰动也会影响反硝化作用(Bertics and Ziebis, 2010; 2012).综合各种研究,N2O的产生是一个非常复杂的过程,是多种因素综合作用的结果,因此反硝化速率有较大的时空变化,即使在同一河口,所得到的潜在反硝化速率也是相差甚远.
| 表 4 文献报道世界河流的潜在反硝化速率 Table 4 Summary of potential denitrification rates in various rivers in the world |
2012年3月—2014年3月黄河垦利站每月表层河水中溶解N2O的浓度、饱和度和水-气交换通量如表 2所示.黄河下游段水体中溶解N2O全年处于过饱和状态,饱和度范围为101.1%~343.0%,平均值为190.8%±72.3%,夏季N2O饱和度最高,春季次之,冬季最低.利用LM86、W92和RC01公式计算水-气交换通量,2012年黄河溶解N2O的水-气交换通量分别为0.1~50.1(12.8±14.1)、0.1~77.6(21.5±21.3)、1.1~109.3(31.8±30.4)μmol·m-2·d-1,整体高于2013年的水-气交换通量0.1~15.9(6.1±7.1)、0.1~27.8(10.6±11.1)、2.5~37.4(16.0±14.3)μmol·m-2·d-1,是大气N2O的净源.2012年黄河溶解N2O的水-气交换通量在夏季最高,而2013年在春季最高.
根据2012年3月—2014年3月各月所测定的N2O浓度和垦利站的径流量(全国水雨情信息网,http://xxfb.hydroinfo.gov.cn/),估算出黄河向河口及其邻近海域输送的N2O总量约为5.8×105mol·a-1,与2010~2011年黄河向渤海输送的N2O量5.1×105 mol·a-1(顾培培,2012)基本一致,明显高于2008—2009年N2O的输送量(1.72×105)mol·a-1(李佩佩,2010),这主要是因为黄河的年径流量较之前有明显的增大.据《2012年黄河泥沙公报》报道,2012年汛期黄河上中游发生了多次暴雨,在黄河干流形成5次明显的洪水过程,中游部分支流出现近40~50年来最大洪峰流量,2012年黄河潼关站实测径流量351.4亿立方米,与1987—2010年均值比较偏大47%.调水调沙的一个月内N2O的输送量约为1.1×105 mol·a-1,占年输送总量的20.8%.
4 结论(Conclusions)1) 黄河下游水体中溶解N2O浓度有较为明显的季节变化,具体表现为冬季和春季高于夏季,秋季最低,但全年变化幅度不大.黄河下游水体中溶解N2O浓度主要受到温度、无机氮含量以及径流量等因素的影响.
2) 初步估算出黄河向渤海输送N2O的通量约为5.8×105 mol·a-1,调水调沙在一定程度上影响N2O入海通量的年内分配.
3) 黄河下游水体和沉积物整体表现出N2O的净产生,潜在反硝化速率均明显高于硝化速率,反硝化作用在N2O的产生过程中占主导地位.潜在反硝化速率均呈现出明显的季节变化,沉积物中潜在反硝化速率低于水体中的反硝化速率.
4) 黄河下游水体中溶解N2O全年处于过饱和状态,表现为大气N2O的净源.
| [1] | Abril G, Borges A V. 2004. Carbon dioxide and methane emissions from estuaries, in:Greenhouse gas emissions:fluxes and processes, hydroelectric reservoirs and natural environments[C]. New York, Springer, Berlin, Heidelburg, 187-207 |
| [2] | Arango C P, Tank J L, Schaller J L, et al. 2007.Benthic organic carbon in fluences denitrification in streams with high nitrate concentration[J]. Freshwater Biology, 52 : 1210–1222. |
| [3] | Barnes J, Owens N J P. 1999.Denitrification and nitrous oxide Concentrations in the Humber Estuary, UK, and Adjacent Coastal Zones[J]. Marine Pollution Bulletin, 37 (3-7): 247–260. |
| [4] | Beaulieu J J, Tank J L, Hamilton S K, et al. 2011.Nitrous oxide emission from denitrification in stream and river networks[J]. Proceedings of the National Academy of Sciences, 108 (1): 214–219. |
| [5] | Bertics V J, Sohm J A, Magnabosco C, Ziebis W. 2012.Denitrification and nitrogen fixation dynamics in the area surrounding an individual ghost shrimp (Neotrypaea californiensis) burrow system[J]. Applied and Environmental Microbiology, 78 (11): 3864–3872. |
| [6] | Bertics V J, Ziebis W. 2010.Bioturbation and the role of microniches for sulfate reduction in coastal marine sediments[J]. Environmental Microbiology, 12 (11): 3022–3034. |
| [7] | Bouwman A F.1995. Compilation of a global inventory of emissions of nitrous oxide[D]. Wageningen:Agricultural Univ Netherlands. 1995 |
| [8] | 陈沛沛, 刘素美, 张桂玲, 等.2013.黄河下游营养盐浓度、入海通量月变化及"人造洪峰"的影响[J].海洋学报, 35 (2):59–71. |
| [9] | Catarina T, Catarina M, Rui A R B, et al. 2010.Potential rates and environmental controls of denitrification and nitrous oxide production in a temperate urbanized estuary[J]. Marine Environmental Research, (70): 336–342. |
| [10] | Chen C T, Wang S L, Lu X X, et al. 2008.Hydrogeochemistry and greenhouse gases of the Pearl River, its estuary and beyond[J]. Quaternary International, 186 (1): 79–90. |
| [11] | Codispoti L A, Yoshinari T, Devol A H. 2005. Suboxic respiration in the oceanic water column. In:Del Giorgio, P A, Williams, P J le B. (Eds.), Respiration in Aquatic Ecosystems[D].Oxford:Oxford University Press, 225-247 |
| [12] | Cole J J, Caraco N F. 2001.Emissions of Nitrous Oxide (N2O) from a Tidal, Freshwater River, the Hudson River, New York[J]. Environ Sci Techno, 35 (6): 991–996. |
| [13] | De Angelis M A, Gordon L I. 1985.Upwelling and river runoff as sources of dissolved nitrous oxide to the Alsea estuary, Oregon, Estuar[J]. Coastal and Shelf Sci, 20 : 375–386. |
| [14] | Dennehy K F, McMahon P B. 2000. Concentrations of nitrous ox-ide in two western rivers[C]. Proceedings of the American Geophys-ical Union 2000 Spring Meeting, Washington DC, 30 May-3 June, 2000 |
| [15] | Dong L F, Nedwell D B, Colbeck I, et al. 2004.Nitrous oxide emission from some English and Welsh rivers and estuaries, Water Air Soil Poll[J]. Focus, 4 : 127–134. |
| [16] | 范成新, 王春霞. 2007. 长江中下游湖泊环境地球化学与富营养化[M]. 北京: 科学出版社: 274 -278. |
| [17] | Firestone M K, Davidson E A. 1989.Microbiological basis of NO and N2O production and consumption in soil[J]. Exchange of Trace Gases between Terrestrial Ecosystems and the Atmosphere, 1 : 7–21. |
| [18] | Firestone M K, Firestone R B, Tiedje J M. 1979.Nitric oxide as an intermediate in denitrification:Evidence from nitrogen-13 isotope exchange[J]. Biochemical and Biophysical Research Communications, 91 (1): 10–16. |
| [19] | 顾培培, 张桂玲, 李佩佩, 等.2011.调水调沙对黄河口及邻近海域溶存甲烷的影响[J].中国环境科学, 31 (11):1821–1828. |
| [20] | 顾培培. 2012. 典型河流、河口溶存甲烷和氧化亚氮的分布、释放及产生和转化[D]. 青岛:中国海洋大学 |
| [21] | García-Ruiz R, Pattinson S N, Whitton B A. 1998.Denitrification in river sediments:relationship between process rate and properties of water and sediment[J]. Freshwater Biology, 39 : 467–476. |
| [22] | Garratt J R. 1977.Review of the drag coefficients over oceans and continents[J]. Mon Weather Rev, 105 (7): 915–929. |
| [23] | 黄翠玲. 2007. 黄河入海过程中常量离子和有机碳输送规律的研究[D]. 青岛:中国海洋大学 |
| [24] | Hansen J I, Henriksen K, Blackburn T H. 1981.Seasonal distribution of nitrifying baeteria and rates of nitrification in coastal marine sediments[J]. Mierobial Ecology, 7 (4): 297–304. |
| [25] | Hedin L O, von Fischer J C, Ostrom N E, et al. 1998.Thermodynamic constraints on nitrogen transformations and other biogeochemical processes at soil-stream interfaces[J]. Ecology, 79 (2): 684–703. |
| [26] | Hooper A B, Vannelli T, Bergmann D J, et al. 1997.Enzymology of the oxidation of ammonia to nitrite by bacteria[J]. Antonie van Leeuwenhoek, 71 : 59–67. |
| [27] | Hutchinson G L, Davidson E A. 1993. Processes for production and consumption of gaseous nitrous oxide in soil. In:Harper, L A, Mosier, A R, Duxbury, J M, Rolston, D E (Eds.), Agricultural Ecosystem Effects on Trace Gases and Global Climate Change. American Society of Agronomy Special Publication 55. American Society of Agronomy, Madison, WI, 79-94 |
| [28] | Inwood S E, Tank J L, Bernot M J. 2005.Patterns of denitrification associated with land use in 9 midwestern headwater streams[J]. Journal of the North American Benthological Society, 24 : 227–245. |
| [29] | IPCC. 2013. Climate Change 2013:The Physical Science Basis[R]. UK:Cambridge University Press |
| [30] | Iriarte A, Alejandro dela S, Emma Orive. 1998.Seasonal variation of nitrification along a salinity gradient in an urban estuary[J]. Hydrobiologia, 362 : 115–126. |
| [31] | Kroeze C E, Dumont, Seitzinger S.2010. Future trends in emissions of N2O from rivers and estuaries, J. Integr[J]. Environ. Sci, 7:71-78 |
| [32] | 李佩佩. 2010. 黄河口及黄、渤海溶存甲烷和氧化亚氮的分布与通释放量[D]. 青岛:中国海洋大学 |
| [33] | Laursen A E, Seitzinger S P. 2004.Diurnal patterns of denitrifica-tion, oxygen consumption and nitrous oxide production in rivers measured at the whole-reach scale[J]. Freshwater Biol, 49 (11): 1448–1458. |
| [34] | Law C S, Rees A P, Owens N J P. 1992.Nitrous oxide:estuarine sources and atmospheric flux[J]. Estuar, Coastal and Shelf Sci, 35 : 301–314. |
| [35] | Liss P S, Merlivat L. 1986. Air-Sea Gas Exchange Rates:Introduction and Synthesis[C]. The role of air-sea exchange in geochemical cycling. 185:113-127 |
| [36] | Liu S M, Li L W, Zhang G L, et al. 2012.Impacts of human activities on nutrient transports in the Huang he (Yellow River) Estuary[J]. Journal of Hydrology, 430-431 : 103–110. |
| [37] | Magalhaes C M, Joye S B, Moreira R M, et al. 2005.Effect of salinity and inorganic nitrogen concentrations on Nitrification and denitrification rates in intertidal sediments and rocky biofilms of the Douro River estuary[J]. Portugal, Water Research, 39 : 1783–1794. |
| [38] | Marty D, Bonin P, Michotey V, et al. 2001.Bacterial biogas production in coastal systems affected by freshwater inputs[J]. Continental Shelf Research, 21 (18/19): 2105–2115. |
| [39] | McElroy M B, Elkins J W, Wofsy S C, et al. 1978.Production and release of N2O from thePotomac Estuary, Limnol[J]. Oceanogr, 23 : 1168–1182. |
| [40] | Miller M N, Zebarth B J, Dandie C E, et al. 2008.Crop residue influence on denitrification, N2O emissions and denitrifier community abundance in soil[J]. Soil Biology & Biochemistry, 40 : 2553–2562. |
| [41] | Patra P K, Lal S, Venkataramani S, et al. 1999.Seasonal and spatial variability in N2O distribution in the Arabian Sea[J]. Deep-sea Research, 46 : 529–543. |
| [42] | Prather M J. 1998.Time scales in atmospheric chemistry:Coupled perturbations to N2O, NOy, and O3[J]. Science, 279 : 1339–1341. |
| [43] | Ravishankara A R, Daniel J S, Portmann R W. 2009.Nitrous Oxide (N2O):The Dominant Ozone-Depleting Substance Emitted in the 21st Century[J]. Science, 326 : 123–125. |
| [44] | Raymond P A, Cole J J. 2001.Gas exchange in rivers and estuaries:choosing a gas transfer velocity[J]. Estuaries, 24 (2): 312–317. |
| [45] | Rhee T S. 2000. The process of air-water gas exchange and its application[D]. Texas A&M Univ, College Station |
| [46] | Richey J E, Devol A H, Wofsy S C, et al. 1988.Biogenic gases and the oxidation and reduction of car-bon in Amazon River and floodplain waters, Limnol[J]. Oceanogr, 33 : 551–561. |
| [47] | 孙超. 2007. 黄河调水调沙期间的碳输送特征及花园口站碳系统各分量的年变化[D]. 青岛:中国海洋大学 |
| [48] | Seitzinger S P. 1988.Denitrification in freshwater and coastal marine ecosystems:Ecological and geochemical significance, Limnol[J]. Oceanogr, 33 : 702–724. |
| [49] | Siedler G, Peters H. 1986. Properties of sea water, in:Oceanography, Landolt-B rnstein New Ser[C]. New York, Springer-Verlag, 233-264. |
| [50] | Solomon S, Qin D, Manning M, et al. 2007. Climate change 2007:The physical science basis[R]. New York, USA:Cambridge University Press |
| [51] | Ståhlberg C, Bastviken D, Svensson B H, et al. 2006.Mineralisation of organic matter in coastal sediments at different frequency and duration of resuspension[J]. Estuarine, Coastal and Shelf Science, 70 (1/2): 317–325. |
| [52] | Swerts M, Merckx R, Vlassak K. 1996.Denitrification, N2 fixation and fermentation during anaerobic incubation of soils amended with glucose and nitrate[J]. Biology & Fertility of Soils, 23 : 229–235. |
| [53] | Wall L G, Tank J L, Royer T V, et al. 2005.Spatial and temporal variability in sediment denitrification within an agriculturally influenced reservoir[J]. Biogeochemistry, 76 : 85–111. |
| [54] | Walter S, Bange H W, Wallace D W R. 2004.Nitrous oxide in the surface layer of the tropical North Atlantic Ocean along a west to east transect[J]. Geophysical Research Letters, 31 (23): 187–206. |
| [55] | Wanninkhof R. 1992.Relationship between wind speed and gas exchange over the ocean[J]. Journal of Geophysical Research, 97 (C5): 7373–7382. |
| [56] | Weiss R F, Priee B A. 1980.Nitrous oxide solubility in water and seawater[J]. Marine Chemistry, 8 : 347–350. |
| [57] | 徐继荣, 王友绍, 殷建平, 等.2007.大亚湾海域沉积物中的硝化与反硝化作用[J].海洋与湖沼, 38 (3):206–211. |
| [58] | Xu J, Wang Y S, Yin J P, et al. 2005.Transformation of dissolved inorganic nitrogen species and nitrification and denitrification processes in the near sea section of Zhujiang River[J]. Acta Scientiae Circumstantaie, 25 (5): 686–692. |
| [59] | 姚庆祯, 于志刚, 王婷, 等.2009.调水调沙对黄河下游营养盐变化规律的影响[J].环境科学, 30 (12):3534–3540. |
| [60] | 杨晶, 张桂玲, 赵玉川, 等.2011.胶州湾河口潮滩沉积物中N2O的产生和释放及其影响因素[J].环境科学学报, 31 (12):2723–2732. |
| [61] | Yan W, Laursen A E, Wang F, et al. 2004.Measurement of denitrification in the Changjiang River[J]. Environ. Chem, 1 : 95–98. |
| [62] | Yoshinari T, Altabet M A, Codispoti L, et al. 1997.Nitrogen and oxygen isotopic composition of N2O from suboxic waters of the eastern tropical North Pacific and the Arabian Sea-measurement by continuous-flow isotope-ratio monitoring[J]. Marine Chemistry, 56 : 253–264. |
| [63] | Zappa C J, Raymond P A, Terray E A, et al. 2003.Variation in surface turbulence and the gas transfer velocity over a tidal cycle in a macro-tidal estuary[J]. Estuaries, 26 (6): 1401–1415. |
| [64] | Zhang G L, Zhang J, Liu S M, et al. 2010.Nitrous oxide in the Changjiang (Yangtze River) Estuary and its adjacent marine area:Riverine input, sediment release and atmospheric fluxes[J]. Biogeosciences, 7 : 3505–3516. |
| [65] | 赵静, 张桂玲, 吴莹, 等.2009.长江溶存氧化亚氮的分布与释放[J].环境科学学报, 29 (9):1995–2002. |
 2016, Vol. 36
2016, Vol. 36


