2. 河海大学环境学院, 南京 210098
2. College of Environment, Hohai University, Nanjing 210098
大型底栖无脊椎动物(macroinvertebrate)是河流生态系统的重要成员,一般指生命周期的全部或大部分时间生活在水体底部淤泥内或石块、砾石的表面或其间隙中,以及附着在水生植物表面肉眼可见,且不能通过孔径为500 μm分样筛的水生动物类群(Chainho et al., 2007;段学花等,2010).主要包括扁形动物门涡虫纲、环节动物门寡毛纲和蛭纲、软体动物门腹足纲、节肢动物门昆虫纲和甲壳纲等(Tagliapietra et al., 2010).底栖动物群落结构组成及某一物种个体数变化对水生态环境的变化极为敏感,因此,其群落结构与多度值能准确指示水体受到污染的性质与程度(Lindenmayer et al., 2004)以及人类干扰对水生态系统的持久性或间断性.
在2000年,欧盟水框架协议(European Water Framework Directive,WFD)就提出水生态健康评价时除了要综合考虑水环境质量,耦合水生生物赋存结构与分布才是评价的关键(Touron-Poncet et al., 2014).而在反映水生态系统健康状况方面,底栖动物与其他水生生物相比具有不可替代的优势:它不仅种类多,生活周期长,活动场所比较固定,易于采集;而且具有不同种类对水生态环境的恶化或改善的敏感性差异显著,受外界干扰后群落结构的变化趋势可预测等优点(Gabriels et al., 2010; Griffith et al., 2005; Kröncke et al., 2010).同时,底栖动物是水生生态系统食物链中的关键环节(Strona et al., 2015),不仅能有效吞咽底泥促进有机碎屑分解,而且通过摄食排泄可加速污染物质的迁移转化,增强河流的自净能力;其次,它们又是其它生物类群的天然优质饵料(Rabeni et al., 2005),因此,其群落结构的变化不仅会引起食物网结构的改变,而且会影响淡水生态系统食物链上的能量流动、物质循环和信息传递(Alastair et al., 2006; 彭欣等,2011).此外,底栖动物群落组成与空间分布特性除受水环境因子及生物内部的多重作用外(Chen et al., 2013),经纬度、海拔高度、水文特征、土地利用类型、城市化、闸坝建设等因素同样对其群落结构的空间异质性具有较大贡献(章飞军等,2010).不同区域河流,受污染程度及生境条件不同,底栖动物群落结构差异亦明显.因此,水生态系统健康与否很大程度上取决于底栖动物群落结构的健康状况(Wang et al., 2008).
淮河是我国第三大河流,也是七大水系中污染较为严重的水域(吴焕忠,1999),其中大部分河段受有机物,营养盐及重金属污染尤为突出(Zhai et al., 2014; Wang et al., 2015);同时,从流域角度来看,主要表现出南北支流不对称,水灾害严重,闸坝众多等特点(蒋艳等,2014).闸坝建设虽然在流域防洪、航运、农业灌溉和供水等方面发挥了巨大的经济和社会效益,但因此引起的河道干涸断流,水动力变化,湖泊湿地萎缩,鱼类洄游通道阻断,生物多样性降低,流域水生态功能下降等生态环境问题已日益突出(吴焕忠,1999;Nilsson et al., 2005;Carlisle et al., 2011).因此,在淮河流域典型河流上开展基于底栖动物与水环境的生态调查,探索水利工程和入河污染负荷对水环境生态的干扰,明确底栖动物在季节尺度上的生态特征变化及其与水环境因子的关系,为淮河流域水生态系统管理和受损河流生态系统修复提供科学依据.
2 材料与方法(Materials and methods) 2.1 研究区域概况淮河流域(111°55′~121°25′E,30°55′~36°36′N)地处中国东部,介于长江和黄河两大流域之间,流域总面积约为27万km2,水资源量占全国的3.4%(Zhao et al., 2012).淮河干流发源于桐柏山太白顶北麓,全长由西向东约1000 km,总落差约200 m,依次流经河南,湖北,安徽,在江苏的三江营汇入长江.淮河两岸支流众多,南岸支流均发源于山区和丘陵区,源短流急,较大的支流有史灌河、淠河、东淝河、池河等,其中淠河是南岸主要支流,发源于大别山区;北岸主要支流有洪河、沙颍河、涡河、包浍河等,其中沙颍河是淮河最大的支流,发源于伏牛山区,全长约557 km,流域面积约3.6万km2.其次流域中湖泊众多,最大的为洪泽湖,蓄水面积约1576 km2,在防洪、航运、工业和生活用水等发挥着重要作用(Zhai et al., 2014;Wang et al., 2015).
同时,淮河流域位于我国南北气候过渡带,属暖温带半湿润季风气候区(Xia et al., 2011).淮河以北属暖温带区,以南属北亚热带区,气候温和.淮河流域冬春干旱少雨,夏秋闷热多雨,冷暖、旱涝急转;气温变化整体由北向南,由沿海向内陆递增,年平均气温为11~16 ℃;年平均水面蒸发量约为900~1500 mm,多年平均降水量约为920 mm.地表水地区分布总趋势是南多北小,同纬度地区山区多平原少,平原地区则是沿海多于内陆(Wang et al., 2015).
2.2 采样点设置2014年夏季(8月)和秋季(11月)在淮河流域典型河流(淮河干流、沙颍河、涡河、淠河)分别进行水样、沉积物和底栖动物样品采集.采样点位设置如图 1所示,两个季节共采集27个点位,共同点位22个;其中夏季采样点位22个,秋季采样点位27个.几乎所有点位底质类型均为淤泥,少部分点位是硬底泥,仅有个别点位是大石块、砾石或者砂石底质.
 |
| 图 1 淮河流域典型河流大型底栖动物调查点位图 Fig. 1 Sampling sites of macroinvertebrate in typical reaches of Huai River Basin |
现场使用便携式水质参数仪(型号:YSI 6600)测定水温(T)、pH值、电导率(EC)和溶解氧(DO).野外采集的水样应避光冷藏保存后运送至实验室进行水质化学分析,分析方法主要参照相关国家标准进行(水和废水分析检测方法 第4版).水质分析时,用重量法测定悬浮物(SS),碱性过硫酸钾消解-紫外分光光度法测定总氮(TN),纳氏试剂分光光度法测定氨氮(NH3-N),硫酸钾消解-钼酸铵分光光度法测定总磷(TP),重铬酸钾法测定化学需氧量(COD).所采集的沉积物样品去除砾石和碎叶等杂质后自然风干,取样研磨后再用100目尼龙筛筛分,取筛后样品约0.2000 g,用硝酸-盐酸-氢氟酸联合消解后用ICP-MS(型号:XSERIES 2)测定重金属指标,主要包括铜(Cu)、锌(Zn)、镍(Ni)、铬(Cr)、镉(Cd)、铅(Pb)、汞(Hg)、砷(As),每个样品平行3次实验,取3次测定值的平均值.
2.3.2 底栖动物采集与鉴定利用直径30 cm、40目孔径尼龙纱D型网(D-frame net)采集底栖动物样品.采集时,每个样点在100 m长河段内的可涉水深度,按照不同生境条件出现的比例进行样品采集,点位的采样样方均介于3~10个,则采样面积约为0.9~3 m2.被采集的底栖样品首先用孔径为500 μm的分样筛筛选洗净后放入封口袋,并加入75%的乙醇溶液固定带回实验室.在实验室体式镜下进行鉴定分类和计数,计算密度(ind·m-2).鉴定时,所有生物个体均被鉴定到最低分类单元,通常为属级;但其中软体动物可以鉴定至种,寡毛类鉴定至纲,甲壳纲鉴定到科或属(刘月英等,1979;Morse et al., 1994).最后用吸水纸吸干底栖动物表面的液体,使用精度为0.001 g天平称量底栖动物同一分类单元所有个体的湿重,计算生物量(g·m-2).
2.4 数据处理方法 2.4.1 生物指数计算应用优势度指数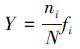
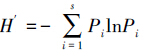
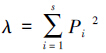
其中,S为各点位的底栖动物总分类单元数,ni为第i种的个体数,N为各点位底栖动物个体总数,fi为第i种的出现频率,Pi为第i种个体数占样本总个体数N的比例,即Pi=ni/N.以Y ≥ 2%作为优势种.
2.4.2 统计分析方法进行多元统计分析之前,应先对环境变量和生物变量进行log(X+1)转换,以满足数据正态分布要求或消除极值的影响(秦春燕等,2013).
采用非参数多维尺度分析(Non-metric Multidimensional Scaling,NMDS)检验不同季节底栖动物群落结构差异性(Field et al., 1982),采用聚类分析(Hierarchical Agglomerative Clustering)检验站点间物种相似性.采用典范对应分析(Canonical Correspondence Analysis,CCA)分析物种群落结构对水环境因子变化的响应关系(Ter Braak 1986; Ter Braak et al., 1995; Lopes et al., 2005).
底栖动物与环境因子的CCA分析按照以下步骤完成:首先对底栖动物多度数据进行去势对应分析(Detrended Correspondence Analysis,DCA),检验第一轴梯度长度,确定单峰分布还是线性分布,然后选择合适的排序分析方法,若第一轴梯度长度大于4,则进行CCA分析,若小于3,则进行RDA(Redundancy Analysis)分析,介于3、4之间二者皆可,优先选择CCA分析.然后采用向前筛选(forward selection)对环境变量进行逐步筛选,每一步都采用蒙特卡罗置换检验(Monte Carlo Permutation tests)在p<0.05水平上评估每个备选环境变量解释物种变异的贡献;最后,剔除环境变量中方差膨胀因子(variance inflation factor)大于20的变量,以达到减小环境变量之间共线性的问题.
基础数据统计在Excel中完成,采用Canoco for Windows 4.5软件进行CCA和DCA分析,采用多元统计软件PRIMER 5.0(Plymouth Routines In Multivariate Ecological Research)进行聚类分析,采用R软件进行NMDS分析和ANOSIM检验.
3 结果(Results) 3.1 底栖动物群落组成2014年夏季(8月)和秋季(11月)两次调查共获得62个分类单元,4297个底栖动物,主要以软体动物门(Mollusca)和昆虫纲(Insecta)分布为主,分别占总分类单元数的33.87%和53.23%,其中,昆虫纲主要为双翅目(Diptera)、蜉蝣目(Ephemeroptera)和蜻蜓目(Odonata),分别占昆虫纲分类单元数的33.33%、21.21%和18.18%.软体动物门占2纲12科13属21种,环节动物门(Annelida)占2纲3科4属,甲壳纲(Crustacea)占3目4科,昆虫纲占7目21科29属,具体为双翅目占5科11属,蜉蝣目占6科7属,半翅目(Hemiptera)占3科,毛翅目(Trichoptera)占1科2属4种,鞘翅目(Coleoptera)占1科,鳞翅目(Lepidoptera)占1科1属1种,蜻蜓目(Odonata)占4科6属(表 2).
| 表 2 底栖动物名录及优势种 Table 2 ist of benthic macroinvertebrates and dominant species in Summer and Autumn, 2014 |
夏季采集到45个分类单元,秋季采集到43个分类单元,其中存在25个共同分类单元(表 2).两季底栖动物群落组成均以软体动物门和昆虫纲为主(图 2),夏季软体动物门和昆虫纲分类单元数分别占总分类单元的35.56%和51.11%,秋季分别占36.36%和54.55%;但昆虫纲的组成存在季节性差异,夏季主要由双翅目、蜻蜓目和毛翅目组成,分类单元数分别占昆虫纲总分类单元数的30.43%、21.74%和17.39%;秋季主要为双翅目、蜉蝣目和蜻蜓目,分别占33.33%、29.17%和12.5%.此外,不同门类上底栖动物个体数也存在差异,夏季共采集到底栖动物3050个,平均密度为74.21 ind·m-2,平均生物量为7.89 g·m-2,其中甲壳纲个体数最多,占总个体数的47.12%,其次是毛翅目,占24.07%;然而秋季共采集到底栖动物1247个,平均密度为27.53 ind·m-2,平均生物量为1.13 g·m-2,其中双翅目最多,占总个体数的34.32%,其次是甲壳纲与蜉蝣目,个体数相当,分别占21.25%和22.53%.但t检验差异分析发现,夏秋两季生物密度无显著空间差异(p=0.135),而生物量空间分布则表现出极显著差异(p=0.002).
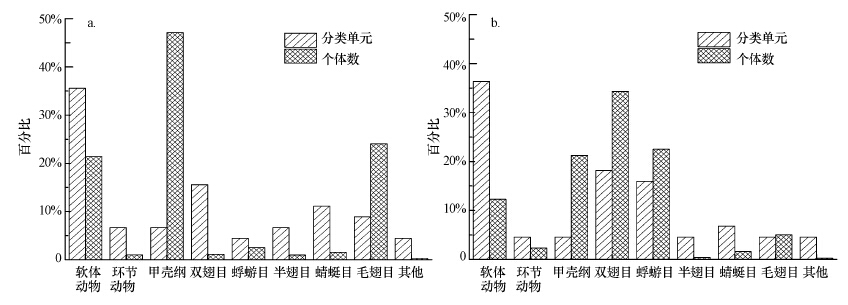 |
| 图 2 2014年夏季(a)和秋季(b)底栖生物群落结构组成 Fig. 2 Macroinvertebrate community structure in summer (a) and autumn (b) of 2014 |
不同季节出现的优势物种也不同,且同一优势物种在不同季节上的优势度也不同(表 2).夏季优势种为米虾属(Caridina,Y=40.35%)和铜锈环棱螺(Bellamya aeruginosa,Y=5.7%),优势度大于0.1%的物种共有13种;秋季优势种为米虾属(Y=15.48%)、直突摇蚊属(Orthocladius,Y=12.01%)、四节蜉属(Baetis,Y=4.37%)和环足摇蚊属(Cricotopus,Y=2.44%),优势度大于0.1%的物种共有15种.其中,米虾属为两个季节的共同优势种,但夏季优势度显著高于秋季.
3.2 底栖动物群落结构空间分布特征夏秋两季底栖动物的Margalef丰富度指数、Shannon-Wiener多样性指数、Pielou均匀度指数和Simpson优势度指数空间分布差异性较大.从图 3可以看出,在淮河干流的源头处(S1)和沙颍河的上游处(S8、S9)两季均表现出较高的生物指数值,而在息县(S2)与罗山县(S23)两处的底栖动物生物指数几乎都为0,其余各站点均因受干扰程度不同而表现出不同的生物特征值.
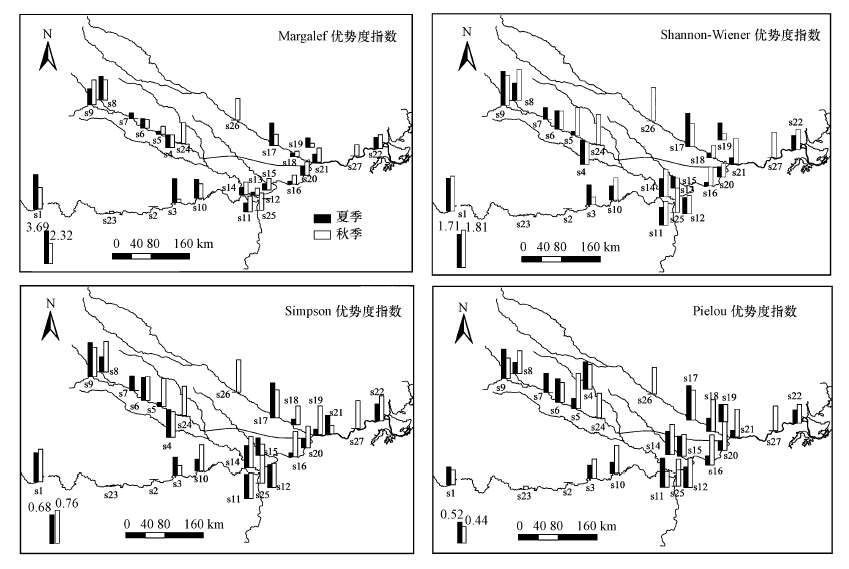 |
| 图 3 夏秋季底栖动物生态特征空间分布 Fig. 3 Spatial distribution of ecological characteristics on macroinvertebrate in summer and autumn |
夏季所有点位中,d值的分布范围为0~3.69,H′值的分布范围为0~1.76,J值的分布范围为0~1,λ值的分布范围为0~0.81,其中S1处d值最大,S9处H′值最大,S17处J和λ值最大.秋季所有站位中,d值的分布范围为0~2.64,H′值的分布范围为0~1.81,J值的分布范围为0~1.03,λ值的分布范围为0~0.76,其中最大d值位于S9,最大H′值位于S1,最大J值位于S5,λ最大值同时出现在S1和S25.
底栖动物栖息地在部分河段由于受采砂活动等人为干扰已被严重破坏,但由自然因子(如洪水冲蚀等)而引起的底质改变同样会对底栖动物群落结构的差异分布产生影响.例如在夏季,S13站点未采集到底栖动物,S2站点仅采集到一个物种,S5、S15、S16和S18站点均只采集到两个物种,表现出极差的生物多样性;在秋季,S2站点未采集到底栖动物,S7和S13站点均只采集到一个物种,S3、S18、S19、S20和S23站点均只出现2种底栖生物.这些站点底质均为淤泥,生境多样性单一,在水污染及底质污染的情况下,底栖动物的栖息就是受损.
基于底栖动物物种组成的各采样点的NMDS(stress value=0.22)排序分析(图 4)与ANOSIM分析,结果表明,淮河流域典型河流夏秋两季底栖动物群落结构组成存在极显著差异性(R=0.13,p=0.002).对不同季节底栖动物差异性贡献度较大的物种有铜锈环棱螺(Bellamya aeruginosa)、直突摇蚊属(Orthocladius)、寡毛纲(Oligochaeta)、四节蜉属(Baetis)、米虾属(Caridina)、尖萝卜螺(Radix acuminata)、椭圆萝卜螺(Radix swinhoei)、大脐圆扁螺(Hippeutis umbilicalis)、方格短沟蜷(Semisulcospira cancellata)、揺蚊属(Chironomus)、尖口圆扁螺(Hippeutis cantori)、环足摇蚊属(Cricotopus),它们一共解释了71.7%的两个季节底栖动物组成和结构的差异性.
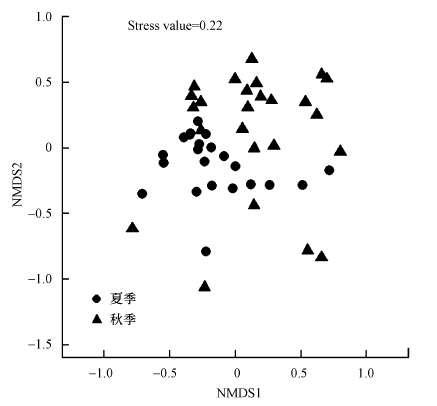 |
| 图 4 基于物种多度的夏秋季底栖动物非参数多维尺度(NMDS)采样点排序图 Fig. 4 Nonparametric multidimensional scaling (NMDS) ordination of sampling sites based on macroinvertebrates abundance in summer and autumn |
淮河流域受人为干扰严重,但不同空间位置受干扰程度不同,生境条件差异较大,各站点间所采集到的物种相似性较小.聚类分析结果表明:在底栖动物群落组成相似度为15%的条件下(马藏允等,1997),夏季22个采样点被分为5个聚类组(图 5a),其中聚类组A(S13)、C(S2)和D(S1)都仅有一个站点,S13未采集到底栖动物,S2仅有1个蟌科cercion属,S1点位的物种丰富度最高,因此被单独分为一组,聚类组B包含S14和S15,剩余点位组成聚类组E.秋季所有采样点在群落组成相似度为15%的条件下被分为7个聚类组(图 5b),其中聚类组A、B、C、D、E和F都各仅有一个站点,剩余站点组成聚类组G.
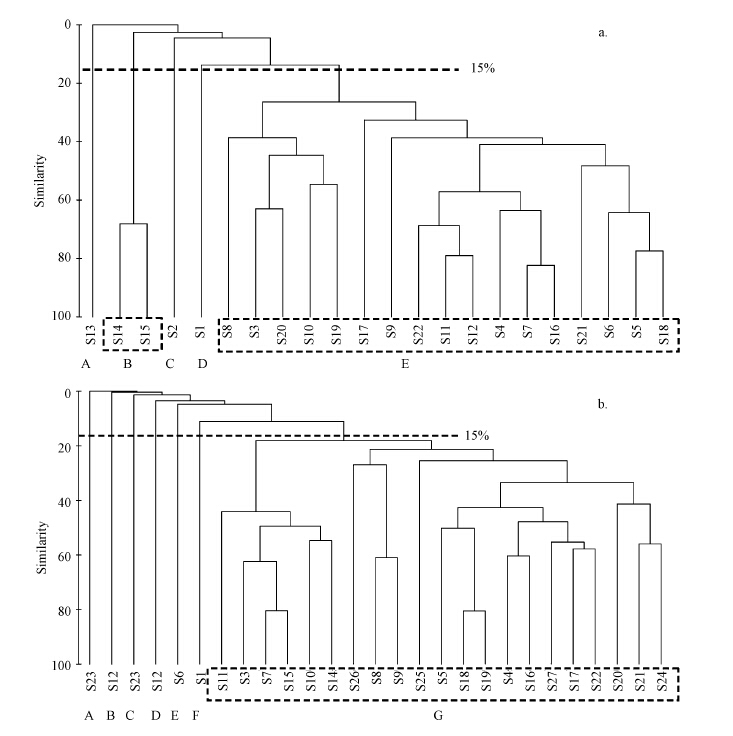 |
| 图 5 2014年夏季(a)和秋季(b)底栖生物调查站位的聚类分析 Fig. 5 Cluster analysis on macroinvertebrates in summer (a) and autumn (b) of 2014 |
物种DCA分析结果显示第一梯度长为2.848,所以采用RDA进行物种与环境因子的相关性分析(图 6),分析结果显示第一轴和第二轴的特征值分别为0.171和0.135,能够解释物种与环境因子累计方差的72.3%.从RDA分析图中可以看出,影响物种分布的主要环境因子为T、pH、TN、Cd、Pb和Hg,其中与轴1相关性较强的环境因子为pH 、TN和Pb,相关系数分别为0.5107、-0.5038和0.4302;而与轴2相关性较强的环境因子为T、Cd和Hg,相关系数分别为-0.5795、0.5953和0.7289.
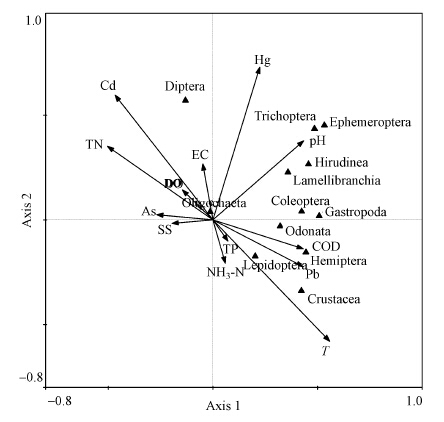 |
| 图 6 底栖动物与环境因子RDA排序图 Fig. 6 Ordination plot of RDA on macriinvertebrates and environmental factors |
腹足纲(Gastropoda)对污染非常敏感,主要分布在清澈透明、底质为砂或石的水体中,表现为和SS负相关;瓣鳃纲(Lamellibranchia)、蛭纲(Hirudinea)、蜉蝣目(Ephemeroptera)和毛翅目(Trichoptera)与pH正相关,甲壳纲(Crustacea)、鳞翅目(Lepidoptera)和半翅目(Hemiptera)与T、COD和Pb正相关;双翅目(Diptera)表现出较强的水环境适应性,但秋季生物量及丰度多于夏季.
4 讨论(Discussion) 4.1 底栖动物群落结构变化人类活动干扰已严重导致入河污染负荷提高和水生生物栖息地的破坏,这都是引起底栖动物群落结构分布变化的主要因素(冯剑丰等,2011).刘朔孺等(2012)研究中提到城镇化的发展将直接导致不透水地表面积的增加,降低了城镇土壤的保水能力和透水性,造成大部分污染物质不能随水下渗,而是直接携带地表污染物径流入河道,对河流生态环境造成明显的冲击作用.
水利工程建设在水资源优化配置方面虽取得了较大的效益,但也因此改变了河道水文情势(Nilsson et al., 2005;Lehner et al., 2011);闸坝不仅切断了河流的连通性,阻碍水生生物的自然迁移,而且改变了整条河流的水动力参数,造成污染物质的堆积,引起物种多样性锐减甚至部分生物灭亡(Pringle et al., 2000;Carlisle et al., 2011).其次,河流渠道化建设虽然有利于边坡稳定,但直接切断了水土交界面的连通性,严重阻碍了地球化学物质循环的基本通道,破坏了水生态系统物质循环和能量流动的功能(Dudgeon et al., 2006).
淮河干流源头处(S1)由于受人为干扰较轻,水质及生境条件较好,具有较好的栖息地多样性,因此,所采集的底栖动物呈现出较高的生物多样性及丰度值.但从上游向下游延伸,均受到不同程度的人为扰动,包括点源与面源污染物的排放,闸坝的水动力调控以及人为采砂活动,底栖动物表现出总个体数及物种多样性逐渐递减的趋势.例如S2、S23点位,大型采砂不仅严重破坏生物栖息地,更是对底栖动物造成瞬间性毁灭伤害,两处底栖动物群落不仅结构单一化,而且部分无底栖动物存在.此外,污染负荷提高对底栖动物群落结构变化的影响也不可忽视,例如,S6站点处,夏季TN、COD浓度严重超标,耐污种(水丝蚓)成为主导,其余物种几乎消亡,表现出较差的生态风险调控能力.
除此之外,大多数蜉蝣稚虫主要以腐屑、小型藻类、原生动物和腐烂的水草为食,一生大部分时间在水中度过,是未受干扰河流中底栖动物群落的重要组成部分,常见的主要包括四节蜉科、扁蜉科、细裳蜉科、小蜉科、蜉蝣科等,虽然它们有较强的耐受污染的能力,但总体表现出在污染的水体中常常最先消失.由于淮河流域部分水域2014年处于典型干旱缺水状态,在沙颍河段出现断流,污染物浓缩,水质严重恶化,因此蜉蝣目出现较少.例如,S8站点,河流干旱断流,河床裸露,污染物浓度升高,仅采集到一定数量的水丝蚓,而没有蜉蝣目类动物出现,这对物种群落结构健康状况仍具有一定的生态威胁.
4.2 水环境因子对底栖动物群落结构的影响底栖动物群落分布受多种环境因子的影响,通常因此而表现出较强的时空异质性,但不同区域环境,影响底栖动物群落分布的环境因子也不同(Yang et al., 2010).底栖动物主要栖息在河流水-土界面层或沉积物中,同时受到水环境和底质环境的双重影响,通常包括物理因子、化学因子、生物因子,其中物理因子主要包括底质类型、水温、沉积物粒径、水深及流速等(Copper et al., 2007);化学因子主要包括pH值、溶解氧、营养盐、有机物、重金属及有毒有害物质(Schneider et al., 2007; Wu et al., 2010);生物因子主要包括水生植物的分布和河流水环境中的竞争与捕食行为(闫云君等,2005).
底质类型是影响底栖动物群落结构变化的首要物理因子,它不仅是底栖动物的栖息地,也是穴居及建巢以躲避不利环境的场所.研究表明(Van Hoey et al., 2014):底质粒径、异质性、密实性、空隙及表面构造对底栖动物的组成均影响显著.在淮河干流的源头处,底质主要为砂砾石及大石块,比起淤泥底质的站位,底栖动物群落组成较丰富.此外,任何物种都有自己适宜的生活温度,温度变化将直接或间接的作用于河流底栖动物群落结构的组成.Cooper认为水温变化是影响水生昆虫的关键因子,不仅会导致昆虫密度的增减,也会影响昆虫的种群分布.在本研究中,夏季调查到的生物个体数及生物量都明显大于秋季,尤其是昆虫纲(蜉蝣目和毛翅目)存在显著的季节变化,说明水温变化是淮河流域主要河流底栖动物群落结构变化的重要驱动因子之一;RDA分析中,物种与水温也表现出较大的相关性.
随着社会经济的快速发展,大量有机污染物和营养盐的排入及酸碱度的变化对河流水生态环境已产生较大威胁,一些对污染敏感或不适应缺氧环境的生物会逐渐减少甚至消失.研究表明(闫云君等,2005),底栖动物的多样性与水体中营养盐含量均成负相关关系,尤其在温度较高的夏季,营养元素的流入将会加剧水体富营养化,直接导致某些底栖动物消失.本研究中RDA分析结果也具有类似的结果,如S6站点夏季TN与COD浓度分别高达14.88 mg·L-1和168.56 mg·L-1,严重超出地表水环境质量标准,该点所能采集到的底栖动物较少,仅出现水丝蚓耐污种.
大量工业废水不处理直接排放入河,大大提高了水体重金属污染水平,随后主要会粘附在SS的表面而沉积于河流底部,由于重金属具有不可降解性而具有明显的生态毒性,对栖息于河流底部,尤其对食底泥的底栖动物来说是一致命伤害;此外,由于重金属进入生物体内可通过食物链逐级传递并放大(Sakan et al., 2009; Wang et al., 2013),对整个水生态系统的健康稳定乃至人类健康具有潜在风险.研究表明(马陶武等,2010),较高浓度的Cd、Pb 单一污染沉积物均可在铜锈环棱螺体内富集且对肝胰脏 SOD 活性具有显著的促进作用,而铜锈环棱螺又是部分鱼类的饵料,这将会导致重金属污染物在各自食物链上逐级放大,造成更大的生态风险;其次,水生昆虫也对重金属毒性较为敏感,Cu、Zn、Pb是被公认为三大风险元素,其中Cu对水生昆虫的生物毒性要远远高于其他重金属,而且这些元素往往对水生昆虫产生协同毒性(Campana et al., 2013).例如,S13站点沉积物中Zn、Cr、Pb和As的浓度均显著高于其他站点,夏季该点未采集到任何物种,秋季仅采集到一个铜锈环棱螺.
大型水生植物不仅能作为底栖动物的重要食物来源,还能为其提供产卵及避难场所.此外,它还能有效拦截有机颗粒碎屑,增加滤食收集型底栖动物的食物来源;还可以稳定底质,抵抗水动力对底栖动物的冲击.不同底栖动物类群与水生植物的关系不同,通常腹足纲类底栖动物会随着水生植物生物量的增加而增加,本研究中S9站点处水质较好,沉水植物较多,夏秋两季均采集到较多米虾与腹足纲类物种.此外,岸边植被覆盖情况对底栖动物的分布也就有明显影响,植物落叶进入河流,枯萎腐烂沉入河底成为腐殖质类物质,是河底水生生物重要的食物来源,当然底栖生物也是其在自然河流中降解的重要分解者.
5 结论(Conclusions)1) 2014年夏季和秋季淮河流域典型河流底栖动物调查共获得62个分类单元,主要以软体动物门和昆虫纲分布为主,分别占总分类单元数的33.87%和53.23%,其中昆虫纲以双翅目、蜉蝣目和蜻蜓目为主,分别占昆虫纲分类单元数的33.33%、21.21%和18.18%.
2) 夏秋两季所采集底栖动物虽然在分类单元数上无明显差别,但丰度与生物量指标表现出夏季显著高于秋季.此外,不同季节同一河流优势物种及优势度差别较大,夏季优势种为米虾属和铜锈环棱螺,而秋季优势种为米虾属、环足摇蚊属、直突摇蚊属和四节蜉属.同时,夏季甲壳纲和毛翅目多度显著高于秋季,而秋季双翅目和蜉蝣目丰度显著高于夏季.
3) 群落结构NMDS与ANOSIM分析表明,淮河流域典型河流夏秋两季底栖动物群落结构组成存在极显著差异性(R=0.13,p=0.002).由于受干扰程度不同,各站点物种相似度较低;夏季淮干源头与沙颍河上游较其他河段均具有较高的丰富度、均匀度、多样性和优势度指数;秋季虽然各点位的均匀度指数与优势度指数值较均匀,但丰富度指数及多样性指数从上游到下游呈现递减趋势.
4) 通过RDA分析,水环境因子对河流底栖动物群落结构分布存在显著影响.淮河流域典型河流夏秋两季调查发现T、pH、TN、重金属(Cd、Pb、Hg)是群落结构差异化的主要影响因子.
| [1] | Alastair M S, Jowett I G. 2006.Effects of floods versus low flows on invertebrates in a New Zealand gravel-bed river[J]. Freshwater Biology, 51 (12): 2207–2227. |
| [2] | Chen Q W, Yang Q R, Li R N, et al. 2013.Spring micro-distribution of macroinvertebrate in relation to hydro-environmental factors in the Lijiang River, China[J]. Journal of Hydro-environment Research, 7 (2): 103–112. |
| [3] | Field J G, Clarke K R, Warwick R M. 1982.A practical strategy for analyzing multispecies distribution patterns[J]. Marine Ecology:Progress Series, 8 : 37–52. |
| [4] | Cooper M J, Uzarski D G, Burton T M. 2007.Macroinvertebrate community composition in relation to anthropogenic disturbance, vegetation, and organic sediment depth in four Lake Michigan drowned river-mouth wetlands[J]. Wetlands, 27 : 894–903. |
| [5] | Campana O, Rodríguez A, Blasco J. 2013.Evaluating the suitability of Hydrobiaulvae as a test species for sediment metal toxicity testing applying a tissue residue approach to metal mixtures in laboratory and field exposures[J]. Chemosphere, 91 (8): 1136–1145. |
| [6] | Carlisle D M, Wolock D M, Meador M R. 2011.Alteration of streamflow magnitudes and potential ecological consequences:a multiregional assessment[J]. Frontiers in Ecology and the Environment, 9 : 264–270. |
| [7] | 段学花, 王兆印, 徐梦珍. 2010. 底栖动物与河流生态评价(第1版)[M]. 北京: 清华大学出版社 . |
| [8] | Dudgeon D, Arthington A H, Gessner M O, et al. 2006.Freshwater biodiversity:importance, threats, status and conservation challenges[J]. Biological Reviews of the Cambridge Philosophical Society, 81 : 163–182. |
| [9] | 冯剑丰, 王秀明, 孟伟庆, 等.2011.天津近岸海域夏季大型底栖生物群落结构变化特征[J].生态学报, 31 (20):5875–5885. |
| [10] | Gabriels W, Lock K, Pauw N D, et al. 2010.Multimetric macroinvertebrate index flanders (MMIF) for biological assessment of rivers and lakes in Flanders (Belgium)[J]. Limnologica, 40 : 199–207. |
| [11] | Griffith M B, Hill B H, McCormick F H, et al. 2005.Comparative application of indices of biotic integrity based on periphyton, macroinvertebrates, and fish to southern Rocky Mountain streams[J]. Ecological Indicators, 5 (2): 117–136. |
| [12] | 国家环境保护总局. 2002. 水和废水监测分析方法(第4版)[M]. 北京: 中国环境科学出版社 . |
| [13] | 蒋艳, 栾震宇, 赵长森. 2014. 淮河流域闸坝运行对河流生态与环境影响研究[M]. 北京: 中国水利水电出版社 . |
| [14] | Kröncke I, Reiss H. 2010.Influence of macrofauna long-term natural variability on benthic indices used in ecological quality assessment[J]. Marine Pollution Bulletin, 60 (1): 58–68. |
| [15] | Lindenmayer D B, Margules C R, Botkin D B. 2004.Indicators of biodiversity for ecologically sustaninable forest management[J]. Conservation Biology, 14 (4): 941–950. |
| [16] | Lopes M R M, Bicudo C E M, Ferragut M C. 2005.Short term spatial and temporal variation of phytoplankton in a shallow tropical oligotrophic reservoir, southeast Brazil[J]. Hydrobiologia, 542 : 235–247. |
| [17] | 刘月英, 张文珍, 王跃龙. 1979. 中国经济动物志[M]. 北京: 科学出版社: 1 -126. |
| [18] | 刘朔孺, 邵卫伟, 刘东晓, 等.2012.浙江义乌市城镇化对溪流底栖硅藻群落的影响[J].南京农业大学学报, 35 (3):71–77. |
| [19] | Morse J C, Yang L F, Tian L X (Eds.). 1994. Aquatic Insects of China useful for Monitoring Water Quality[M]. Nanjing, China: Hohai University Press . |
| [20] | Lehner B, Reidy Liermann C, Revenga C, et al. 2011.High-resolution mapping of the world's reservoirs and dams for sustainable river-flow management[J]. Frontiers in Ecology and the Environment, 9 : 494–502. |
| [21] | Nilsson C, Reidy C A, Dynesius M, et al. 2005.Fragmentation and flowregulation of the world's large river systems[J]. Science, 308 : 405–408. |
| [22] | 马藏允, 刘海, 王惠卿, 等.1997.底栖生物群落结构变化多元变量统计分析[J].中国环境科学, 17 (4):297–300. |
| [23] | 马陶武, 朱程, 周科, 等.2010.Cd Pb 单一及复合污染沉积物对铜锈环棱螺肝胰脏 SOD 和 MT 的影响[J].农业环境科学学报, 29 (1):30–37. |
| [24] | 彭欣, 谢起浪, 陈少波, 等.2011.乐清湾潮间带大型底栖动物群落分布格局及其对人类活动的响应[J].生态学报, 31 (4):954–963. |
| [25] | Pielou E C. 1975. Ecological diversity[M]. New York: Wiley . |
| [26] | Pringle C M, Freeman M C, Freeman B J. 2000.Regional effects of hydrologicalterations on riverine macrobiota in the New World:tropical-temperate comparisons[J]. Bioscience, 50 : 807–823. |
| [27] | 秦春燕, 张勇, 于海燕, 等.2013.不同类群水生昆虫群落间的一致性以及空间和环境因子的相对作用[J].生物多样性, 21 (3):326–333. |
| [28] | Rabeni C F, Doisy K E, Zweig L D. 2005.Stream invertebrate community functional responses to deposited sediment[J]. Aquatic Sciences, 67 : 395–402. |
| [29] | Strona G, Fattorini S, Montano S, et al. 2015.ECo:A new measure evaluating the degree of consistency between environmental factors and spatial arrangement of species assemblages[J]. Ecological Indicators, 52 : 66–74. |
| [30] | 孙儒泳. 1992. 动物生态学原理 (第2版)[M]. 北京: 北京师范大学出版社 . |
| [31] | |
| [32] | Schneider P, Sager P E. 2007.Structure and ordination of epiphytic invertebrate communities of four coastal wetlands in Green Bay, Lake Michigan[J]. Journal of Great Lakes Research, 33 (2): 342–357. |
| [33] | Tagliapietra D, Sigovini M. 2010.Benthic fauna:collection and identification of macrobenthic invertebrates[J]. Terreet Environnement, 88 : 253–261. |
| [34] | Touron-Poncet H, Bernadet C, Compin A, et al. 2014.Implementing the Water Framework Directive in overseas Europe:A multimetric macroinvertebrate index for river bioassessment in Caribbean islands[J]. Limnologica, 47 : 34–43. |
| [35] | Ter Braak C J F. 1986.Canonical correspondence analysis:A new eigenvector technique for multivariate direct gradient analysis[J]. Ecology, 67 : 1167–1179. |
| [36] | Ter Braak C J F, Verdonschot P F M. 1995.Canonical correspondence analysis and related multivariate methods in aquatic ecology[J]. Aquatic Science, 57 : 255–289. |
| [37] | Van Hoey G, Birchenough, S N R, Hostens K. 2014.Estimating the biological value of soft-bottom sediments with sediment profile imaging and grab sampling[J]. Journal of Sea Research, 86 : 1–12. |
| [38] | Wang Z Y, Lee J H W, Cheng D S, et al. 2008.Benthic invertebrates investigation in the East River and habitat restoration strategies[J]. Journal of Hydro-environment Research, 2 (1): 19–27. |
| [39] | 吴焕忠.1999.淮河流域水污染防治与生态经济思考[J].生态与农村环境学报, 15 (4):1–4. |
| [40] | Wu D H, Yu H Y, Wu H Y, et al. 2010.Estimation of river nutrients thresholds based on benthic macroinvertebrate assemblages:A case study in the upper reaches of Xitiao St ream in Zhejiang, China[J]. Chinese Journal of Applied Ecology, 21 (2): 483–488. |
| [41] | Wang J, Liu G J, Lu L L, et al. 2015.Geochemical normalization and assessment of heavy metals (Cu, Pb, Zn, and Ni) in sediments from the Huaihe River, Anhui, China[J]. Catena, 129 : 30–38. |
| [42] | Xia J, Zhang Y Y, Zhan C S, et al. 2011.Water quality management in China:the case of the Huai River Basin[J]. International Journal of Water Resources Development, 27 (1): 167–80. |
| [43] | Yang Q R, Chen Q W. 2010.Relationship between macroinvertebrates and aquatic environment in Lijiang River[J]. Advances in Science and Technology of Water Resources, 30 (6): 8–10. |
| [44] | 闫云君, 李晓宇, 梁彦龄.2005.草型湖泊和藻型湖泊中大型底栖动物群落结构的比较[J].湖泊科学, 17 (2):176–182. |
| [45] | 章飞军, 童春富, 张衡, 等.2010.长江口潮下带春季大型底栖动物的群落结构[J].动物学研究, 29 (3):452–458. |
| [46] | Zhang L L, Liu J L. 2014.Relationships between ecological risk indices for metals and benthic communities metrics in a macrophyte-dominated lake[J]. Ecological Indicators, 40 : 162–174. |
| [47] | Zhao C S, Liu C M, Xia J, et al. 2012.Recognition of key regions for restoration of phytoplankton communities in the Huai River basin, China[J]. Journal of Hydrology, 420-421 : 292–300. |
| [48] | Zhai X Y, Xia J, Zhang Y Y. 2014.Water quality variation in the highly disturbed Huai River Basin, China from 1994 to 2005 by multi-statistical analyses[J]. Science of the Total Environment, 496 : 594–606. |
 2016, Vol. 36
2016, Vol. 36


