2. 沈阳铝镁设计研究院有限公司, 沈阳 110036
2. Shenyang Aluminum < Magnesium Engineering < Research Institute Co. Ltd, Shenyang 110036
溶解性有机物(Dissolved organic matter,DOM)在生物地化循环中扮演着重要角色,因此,考察其来源并且研究其迁移规律显得至关重要(Kraus et al.,2008).DOM组成复杂,可以通过同位素测量法(Bergamaschi et al.,1999; Clern et al.,2002; Hood et al.,2005)、CP/MAS 13C核磁共振法(Lu et al.,2003; Mash et al.,2004)、化学分级法(Bieroza et al.,2010; Leenheer et al.,2003)等方法判断其种类、分布和来源.近年来,国外学者采用的化学分级法,即利用树脂的吸附特性将DOM分成几种具有显著特征的组分,并辅助以化学分析仪器对各组分进行分析(Chen et al.,2003; Leenheer et al.,2003),得到了广泛的应用.
三维荧光光谱是一定范围内,激发-发射波长条件下荧光强度的集合,含有丰富的有机污染物荧光信息(Stedmon et al.,2011),可以定性或定量描述DOM的物理化学特性,并可对多组分复杂体系中荧光光谱重叠的对象进行光谱表征.Chen等(2003)提出的荧光区域积分(Fluorescence regional integration,FRI)法是将EEM图谱定量化,分为5个区域进行积分处理.与寻峰法相比,FRI法不仅能够充分利用有机物的荧光信息,而且克服了由于荧光团间相互叠加而导致的有些可能无法识别或识别不准确等不足(何小松等,2012).
与明水期相比,处于冰封期的河流在水文及其他影响污染物迁移转化的因素方面有许多相异之处,其污染物的迁移转化规律也与明水期有所不同.因此,研究冰封期河流中污染物的迁移转化对于水源的合理利用具有重要意义.在课题组的前期研究工作中,考察了水体冻结过程中冻结温度和DOM浓度对未分级的整体DOM在水-冰体系中迁移行为的影响,并利用三维荧光光谱寻峰法定性考察了冻结温度对水-冰体系中未分级的整体DOM荧光特性的影响(Xue et al.,2015).基于此,本文以沈阳市细河河水为研究对象,将DOM分级分离后采用自然冷冻法中的单向向下渐进冷冻法进行水体冻结模拟实验,并结合三维荧光光谱FRI法,定量研究水体冻结过程中DOM组分及荧光物质的迁移转化规律.
2 材料与方法(Materials and methods ) 2.1 试验水质分析本研究以沈阳市细河河水为研究对象,该河水的水质情况见表 1.
| 表 1 细河河水的水质情况 Table 1 Water quality data for the Xihe River waters |
将采集来的沈阳市细河河水用0.45 μm滤膜过滤,然后用蠕动泵使水样依次通过串联的XAD-7和XAD-4树脂柱.按照DOM在不同树脂上的吸附特性将其分为疏水性有机酸(HPO-A)、过渡亲水性有机酸(TPI -A)和亲水性有机物(HPI)3部分(Xue et al.,2007).
2.3 水体冻结试验将每种DOM组分水样装入6个圆柱形塑料瓶(直径10 cm、高30 cm,底部设有取样口)中,每瓶装入1.8 L.然后将这6个瓶子分别单独放入冰柜,在-25 ℃条件下进行水体冻结试验.塑料瓶体四周及底部包裹泡沫形成保温层(以阻止热量的传递、散失和对流),使得冰晶自上而下渐进生长,形成上层冰晶,下层浓缩液的两相体系.按预定时间取出塑料瓶,分离其中的水、冰两相,并使冰样在室温(约15 ℃)条件下自然融化,收集融化后的水样(融冰水样).测定未冻结水样和融冰水样的溶解性有机碳(Dissolved organic carbon,DOC)浓度和三维荧光光谱.水体冻结试验重复进行3次,取其平均值进行分析.水体冻结试验中的取样时间及其对应的未冻结水样、融冰水样和冻结率如表 2所示.
| 表 2 取样时间及其对应的未冻结水样、融冰水样和冻结率 Table 2 Sampling time and the corresponding unfrozen liquid and melted ice samples and freezing ratio |
DOC采用Shimadou TOC-5000型总有机碳分析仪测定,荧光光谱采用Eclipse EL0507-3920型分光荧光计测定.将水样用0.01 mol · L-1的KCl溶液稀释至DOC为0.3 mg · L-1,调节水样pH值为7,然后装入1 cm 石英荧光样品池中进行三维荧光光谱测定.激发和发射狭缝宽度均为5 nm,扫描速度为1200 nm · min-1,激发波长扫描范围为220~400 nm,发射波长扫描范围290~550 nm.
FRI法将EEM图谱分为5个区域,通过计算特定区域标准体积量化EEM图谱.这5个荧光区域分别为:Ⅰ区(λEx/λEm=220~250 nm/280~330 nm,类芳香族蛋白质荧光Ⅰ);II区(λEx/λEm=220~250 nm/330~380 nm,类芳香族蛋白质荧光Ⅱ);Ⅲ区(λEx/λEm=220~250 nm/380~480 nm,类富里酸物质荧光);Ⅳ区(λEx/λEm=250~280 nm/290~380 nm,类溶解性微生物代谢产物荧光);Ⅴ区(λEx/λEm=250 nm/380~480 nm,类腐殖酸物质荧光).在FRI法中,Φi,n表示具有相似性质的DOM的累计荧光强度,可反映出对应这一区域的特定结构的相对含量,ΦT,n表示整体积分区域的累计荧光强度.Φi,n、ΦT,n由以下公式进行计算:
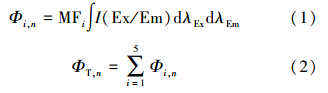
式中,I(Ex/Em)为激发-发射波长对应的荧光强度;MFi为区域系数,其值等于某一积分区域占整体积分区域面积比例的倒数.
为消除瑞利散射对水样DOM荧光的影响,将发射波长等于1倍和2倍激发波长处及其邻近(±20 nm)的区域,以及发射波长小于激发波长的区域和发射波长大于2倍激发波长的区域内的结果置零(肖雪等,2010),并在计算MFi时,将这些区域去除(Xue et al.,2013).
3 结果(Results) 3.1 水体冻结过程中DOM组分的迁移由图 1可知,水体冻结过程中,水相中HPO-A、TPI-A和HPI的DOC浓度随冷冻时间的增加而增加,分别由1.9、1.0、1.2 mg · L-1增加至6.1、2.6、3.0 mg · L-1.由于水分子与DOM中的有机物分子存在物理特异性的差异,一方面自上而下的冷冻过程,使得表层水分子在氢键的作用下缔结成冰晶,且冰晶的成长速度大于成核速度,并将有机物分子排除在外;另一方面,体系的温度下降,能量降低,使得溶液中的水分子对有机物分子的溶剂化作用减弱,将有机物分子挤出晶格之外,致使整个体系DOC浓度“下移”(张岩等,2011).因而,水相中DOC浓度不断上升.
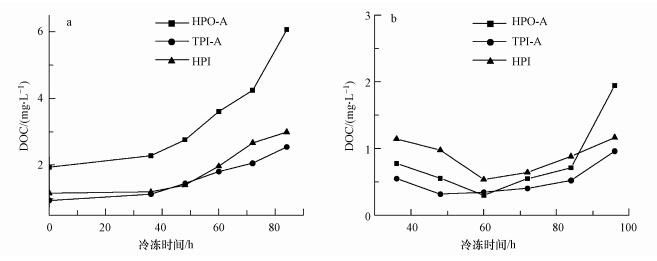 |
| 图 1 水体冻结过程中DOM组分在水相(a)和冰相(b)中的DOC浓度 Fig.1 DOC concentrations for DOM fractions in(a)liquid and (b)ice phase during water freezing |
如图 2所示,冰相中3种组分DOC浓度的实测值均随时间的增加先降低,然后升高.在60 h处,HPO-A和HPI的DOC浓度达到最低,分别为0.3 mg · L-1和0.5 mg · L-1,而TPI-A的DOC在48 h时最低,为0.3 mg · L-1.这是由于冷冻初期,表层溶液局部过冷,促使有机物分子异相成核,从而形成了一层有机物“浓缩层”.“浓缩层”的形成,保证了能量相对稳定的传递,使得水分子不断的缔结成冰晶,并且将有机物分子不断的排除至溶液中(陈佳俊等,2010).此时,冰晶中有机物浓度达到最低.随着冷冻时间的增加,溶液中有机物的浓度不断增加,固液界面处的有机物浓度增加的速度大于此时向低浓度水相中扩散的速度,有机物分子来不及向水相中扩散,被夹带或者包裹在冰晶之中,导致冰相中有机物浓度的不断升高,直至水体完全冻结,此时有机物完全迁移至冰相中.
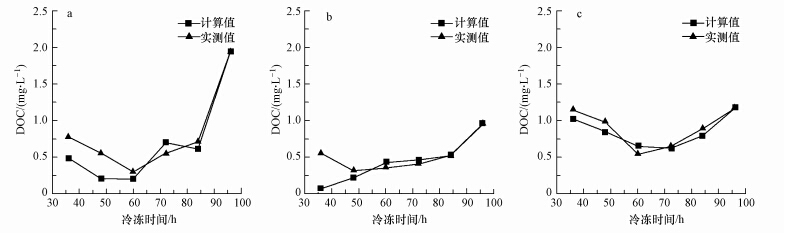 |
| 图 2 水体冻结过程中HPO-A(a)、TPI-A(b)和HPI(c)在冰相中的DOC浓度的计算值和实际值 Fig.2 Calculated and actual values of DOC concentrationsfor HPO-A(a),TPI-A(b) and HPI(c)in ice phase during water freezing |
图 2中DOM组分在冰相中DOC浓度的计算值为在水相中减少(由水相迁移至冰相)的那部分DOM在冰相中的浓度,该值的计算公式如下:
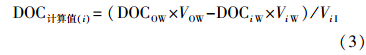
在本研究中,每一个融冰水样均经过了冻结和融化过程,因此,DOM组分在冰相中DOC浓度的计算值和实测值的差值反映了冻融作用对DOM组分的DOC浓度的影响.由图 2可知,与计算值相比,HPO-A,TPI-A和HPI在冰相中DOC浓度的实测值分别增加了-20.76%~169.09%、-17.02%~717.57%和-16.43%~15.01%,说明冻融作用对水体中DOM组分的DOC浓度有显著影响.
为考察水体冻结过程中DOM组分在冰-水体系中的分配规律,引入分配系数K,即为DOM组分在冰相中的DOC浓度与其在水相中的DOC浓度之比.由图 3可知,虽然3种DOM组分K值的变化趋势不同,然而在水体冻结过程中,DOM组分的K值排序为:HPI >TPI-A> HPO-A.这一结果表明,在水体冻结过程中,HPI更容易进入冰相,而HPO-A更倾向于停留在水相中浓缩.TPI-A 在冰、水两相间的分配介于HPI和HPO-A之间.Shafique等(2012)认为,冷冻过程中有机物的性质和浓度对其在冰、水两相之间的再分布有重要影响.本研究中DOM组分是根据其在XAD-8/XAD-4 树脂上的选择吸附性进行富集和分离的,这3种DOM组分的疏水性可排序为:HPO-A>TPI-A>HPI.在3种DOM组分中,HPI的极性最大,与水分子的亲和力最强,在冰晶形成过程中不易被排斥(陈佳俊等,2010),因此,K值较高,而HPO-A则相反.
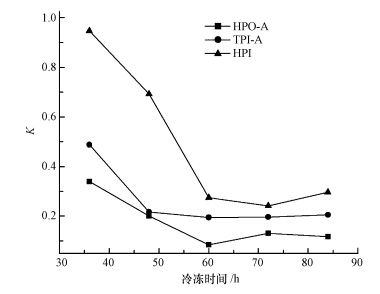 |
| 图 3 水体冻结过程中DOM组分的分配比 Fig.3 Partition coefficient for DOM fractions during water freezing |
由图 4可知,未冻结前(O水样),3种DOM组分均只显示2个明显的荧光峰,即类富里酸荧光峰和类腐殖酸荧光峰,说明这3种DOM组分中的荧光物质主要是类富里酸荧光物质和类腐殖酸荧光物质.在水体冻结过程中,水相中3种DOM组分的三维荧光光谱图的形状变化较小.虽然TPI-A的B和C水样,以及HPI的B水样显示出完整的类溶解性微生物代谢产物荧光峰,然而在3种DOM组分的所有水样的三维荧光光谱图上,类富里酸荧光峰和类腐殖酸荧光峰仍是主要的荧光峰.在水相中DOM组分的三维荧光光谱图上,等高线的密度会发生变化,这是由于各类荧光物质在冰-水体系中的迁移行为相异导致的.此外,水相中3种DOM组分的类腐殖酸荧光峰的中心位置向波长减小的方向发生了15~25 nm 的移动,即蓝移.有文献报道蓝移可能与羰基、羟基、胺基等官能团数量的减少有关(Uyguner et al.,2005;Spencer et al.,2007;高连敬等,2012).这一现象说明在水体冻结过程中,类腐殖酸荧光物质中那些带有羰基、羟基、胺基等官能团的有机物或是较易进入冰相中.
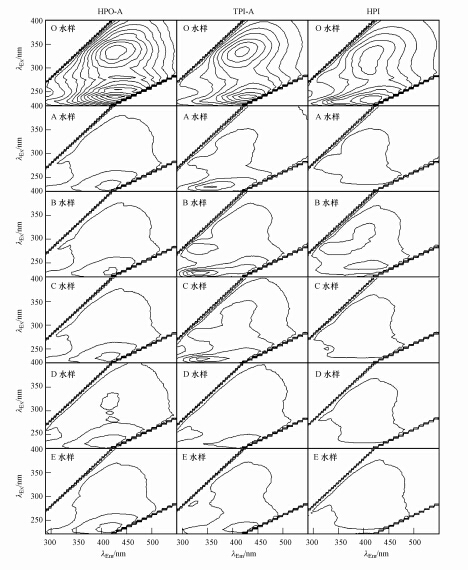 |
| 图 4 水体冻结过程中水相中的DOM组分的三维荧光光谱图 Fig.4 Three-dimensional excitation-emission matrix fluorescence spectra for DOM fractions in liquid phase during water freezing |
从图 4和图 5可以看出,冰相中DOM组分的三维荧光光谱图与水相差异较大,尤其是TPI-A和HPI.TPI-A和HPI的大多数冰样显示出显著的类溶解性微生物代谢产物荧光峰和类芳香蛋白荧光峰,说明由于冻融作用对TPI-A和HPI结构的改变,产生了类溶解性微生物代谢产物荧光物质和类芳香蛋白荧光物质.
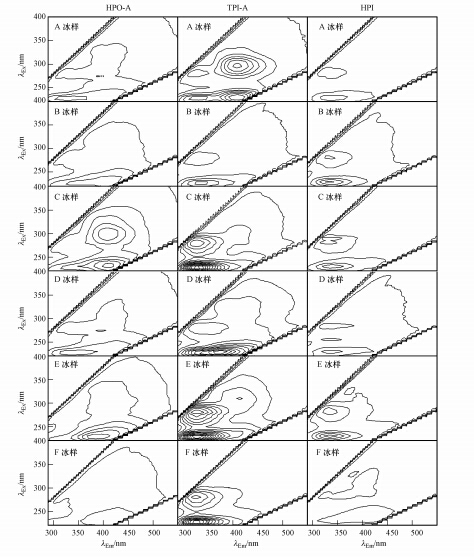 |
| 图 5 水体冻结过程中冰相中的DOM组分的三维荧光光谱图 Fig.5 Three-dimensional excitation-emission matrix fluorescence spectra for DOM fractions in ice phase during water freezing |
由于测定荧光光谱时,每个DOM组分水样均被稀释至DOC为0.3 mg · L-1,因此,图 6中的Φi,n值和ΦT,n值反映了与i区对应的荧光物质和总荧光物质在DOM组分中的相对含量.本研究中将ΦⅠ,n和ΦⅡ,n相加,统一表示类芳香族蛋白质荧光区域内的累计荧光强度,以ΦⅠ+Ⅱ,n表示.
由图 6可以看出,在冻结时间为0~36 h时,除了TPI-A的ΦⅠ+Ⅱ,n,3种DOM组分的Φi,n和ΦT,n均显著下降,说明在水体冻结的初始阶段,除TPI-A中的类芳香族蛋白质荧光物质外,3种DOM组分中的所有荧光物质比非荧光物质更易进入冰相,导致其在水相DOM组分中相对含量的降低.在随后的冻结过程中,水相中HPO-A的Φi,n和ΦT,n的变化曲线较平缓,反映HPO-A中的荧光物质和非荧光物质在冰-水体系中的分配规律相似.另一方面,在冻结时间为36~96 h时,水相中TPI-A的Φi,n和ΦT,n均先升后降,在冻结时间为60 h时达到最高值;而水相中HPI的Φi,n和ΦT,n随冻结时间的变化趋势是先升再降,最后略微升高.这说明在冻结时间为36~96 h时,TPI-A和HPI中的荧光物质和非荧光物质在冰-水体系中的分配行为不一致.
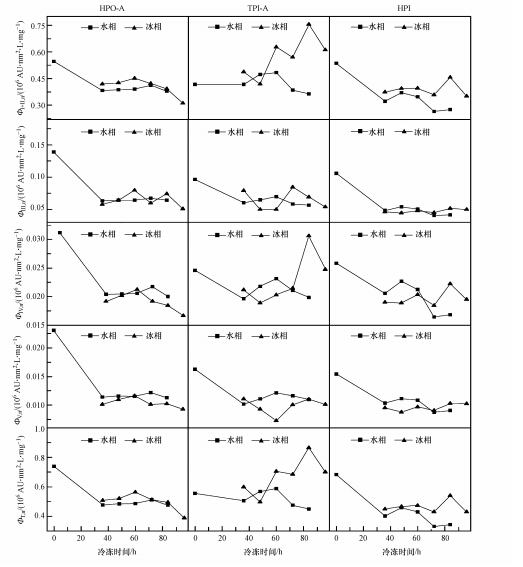 |
| 图 6 水体冻结过程中DOM组分在水相和冰相中的Φi,n和ΦT,n Fig.6 Φi,n and ΦT,n for DOM fractions in liquid and ice phase during water freezing |
图 6中Φi,n和ΦT,n的变化曲线反映了水体冻结过程中水相和冰相中荧光物质在DOM组分中的相对含量的变化.如果忽略冻融作用对DOM的改变,那么冰相中Φi,n和ΦT,n的变化趋势应该与水相恰好相反,然而,这一点在图 5的大部分图中未得到体现,说明冻融确实改变了这3种DOM组分的荧光性.由图 6可以看出,除了TPI-A的ΦⅠ+Ⅱ,n,3种DOM组分在A冰样和A水样中的Φi,n和ΦT,n均显著低于O水样,说明虽然荧光物质在水体冻结的初始阶段更易进入冰相,然而由于冻融作用,这些物质的荧光性降低,表现为其在冰相DOM组分中相对含量低于冻结前.在冻结时间为36~60 h时,相对于其在水相中平缓的变化曲线,冰相中HPO-A的ΦⅠ+Ⅱ,n、ΦⅣ,n和ΦⅤ,n值逐渐升高,说明冻融作用使在这一阶段进入冰相的荧光物质的荧光性增强,表现为其在冰相DOM组分中相对含量的升高.在随后的冻结过程中,冰相中HPO-A的ΦⅠ+Ⅱ,n、ΦⅣ,n和ΦⅤ,n值逐渐降低.对于TPI-A和HPI的ΦⅢ,n和ΦⅤ,n来说,其在冰相中的变化趋势与在水相中的相反并且变化幅度近似,说明类富里酸荧光物质和类腐殖酸荧光物质在冰相TPI-A和HPI中相对含量的变化主要是由于TPI-A和HPI中这两类荧光物质和其他物质在冰-水体系中的分配行为不一致所导致的.而对于HPO-A的ΦⅢ,n、TPI-A的ΦⅠ+Ⅱ,n及HPI的ΦⅠ+Ⅱ,n和ΦⅤ,n来说,其在冰相中的变化趋势较为复杂.在冻结时间为60~84 h时,其值在冰相中的变化趋势为先降低再升高,而其在水相中的变化趋势或与冰相相同(如HPI的ΦⅠ+Ⅱ,n和ΦⅤ,n),或虽然与冰相相反但变化幅度较小(HPO-A的ΦⅢ,n和TPI-A的ΦⅠ+Ⅱ,n),这说明这些荧光物质在DOM组分中相对含量的变化主要是由于冻融作用对其荧光性的改变所导致的:冻融作用使在60~72 h内进入冰相(D冰样)的HPO-A中的类富里酸荧光物质、TPI-A中的类芳香蛋白荧光物质,以及HPI中的类芳香蛋白荧光物质和类溶解性微生物代谢产物荧光物质的荧光性降低;冻融作用使在72~84 h内进入冰相(E冰样)的这些荧光物质的荧光性增强.另外,虽然HPO-A的ΦⅢ,n、TPI-A的ΦⅠ+Ⅱ,n及HPI的ΦⅠ+Ⅱ,n和ΦⅤ,n在F冰样中的值均低于E冰样,然而HPO-A的ΦⅢ,n在F冰样中的值低于E水样,而TPI-A的ΦⅠ+Ⅱ,n及HPI的ΦⅠ+Ⅱ,n和ΦⅤ,n在F冰样中的值则高于E水样,这说明冻融作用使在84~96 h内进入冰相(F冰样)的HPO-A中的类富里酸荧光物质的荧光性下降;而在该阶段(冻结时间为84~96 h)冰相中TPI-A的ΦⅠ+Ⅱ,n及HPI的ΦⅠ+Ⅱ,n和ΦⅤ,n的降低则主要是由于该阶段从水相(E水样)迁移至冰相(F冰样)的TPI-A中的类芳香蛋白荧光物质,以及HPI中的类芳香蛋白荧光物质和类溶解性微生物代谢产物荧光物质在DOM组分中相对含量较低导致的.由图 6可以看出,对于3种DOM组分来说,ΦT,n和ΦⅠ+Ⅱ,n的变化趋势非常相似,这是因为ΦⅠ+Ⅱ,n的值显著高于其他Φi,n,ΦⅠ+Ⅱ,n对ΦT,n的贡献最大,因此,主导了ΦT,n的变化.此外,由图 6还可知,HPO-A和HPI水样完全冻结后(F冰样)的Φi,n和ΦT,n均小于冻结前(O水样),说明冻融作用导致HPO-A和HPI的荧光性降低.与冻结前相比,TPI-A水样完全冻结后的ΦⅠ+Ⅱ,n上升,ΦⅢ,n和ΦⅤ,n降低,ΦⅣ,n几乎无变化,说明冻融作用引起TPI-A中类芳香族蛋白质荧光物质相对含量的升高,类富里酸荧光物质和类腐殖酸荧光物质相对含量的降低.
图 7和图 8中的总Φi,n和总ΦT,n均为将利用FRI法计算得出的Φi,n和ΦT,n值(图 5)乘以水样DOC后所得的数值,该数值可反映荧光物质数量的高低.如图 7所示,在水体冻结过程中,水相中HPO-A和HPI的总ΦT,n值变化趋势均是先降低、后升高.在水体冻结初始阶段(0~36 h处)总ΦT,n值的降低,可能是由于冷冻初期,表层溶液局部过冷,水分子迅速缔结成冰晶,并将荧光物质包裹于冰晶内.而随冷冻时间的增加,整个体系稳定后,HPO-A和HPI的总ΦT,n值均升高,说明荧光物质被水分子“排除”在外,浓缩于水相中.而TPI-A的总ΦT,n值随冻结时间增加整体呈上升趋势,但在72 h处降低.类芳香蛋白荧光物质是TPI-A中主要的荧光物质,由图 4可知,在此时,类芳香族蛋白质荧光峰消失,导致TPI-A的总ΦT,n值降低.水体冻结过程中,HPO-A在水相中的总ΦT,n值均显著高于TPI-A和HPI.
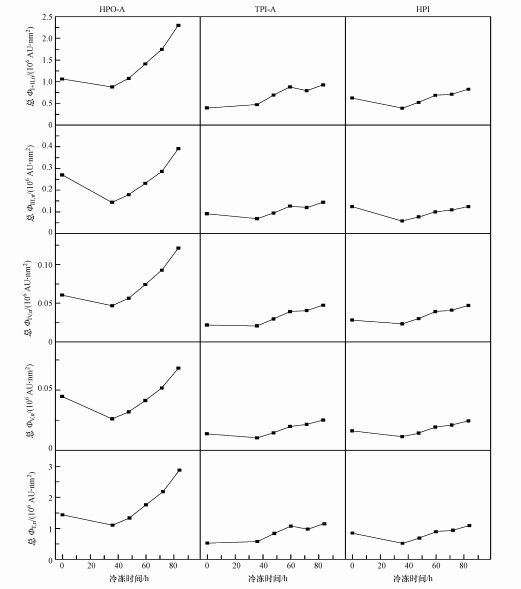 |
| 图 7 水体冻结过程中DOM组分在水相中的总Φi,n和总ΦT,n Fig.7 Total Φi,n and total ΦT,n for DOM fractions in liquid phase during water freezing |
HPO-A和HPI组分的总Φi,n值和总ΦT,n值,以及TPI-A的总ΦⅢ,n值、总ΦⅣ,n值和总ΦⅤ,n值随冷冻时间的增加呈现先降低后升高的趋势,均在冻结时间36 h时达到最低值(图 7).3种组分的总Φi,n值均可排序为:总ΦⅠ+Ⅱ,n>总ΦⅢ,n>总ΦⅣ,n>总ΦⅤ,n.总ΦⅠ+Ⅱ,n占ΦT,n值的80%左右,而总ΦⅤ,n值所占比例最低,为2%~3%左右.这表明类芳香族蛋白质荧光物质是这3种DOM组分中的主要荧光物质.Maie等(2007)的研究指出,类芳香族蛋白质荧光团中含有较高含量的多酚类物质,这些物质亦具有较高的芳香性.Baker和Inverarity(2004)认为,类芳香族蛋白质荧光的激发波长都处于UV范围内,光子产率较高,荧光强度值则相对较高,易于检测到,因此,类芳香族蛋白质荧光可以用来表征河流水质污染状况.对照图 4和图 5可知,在冷冻时间不断增加的过程中,类芳香族蛋白质荧光区域(Ⅰ区和Ⅱ区)的荧光中心没有发生蓝移或红移的现象,说明其结构较为稳定(钟润生等,2008),不易受到温度的影响.
如图 8所示,3种DOM组分在冰相中的总ΦT,n值随冻结时间的变化趋势均为先降低后升高. HPO-A和HPI在60 h处达到最低值,分别为170984.4×106 AU · nm2和256493.2×106 AU · nm2,TPI-A在48 h处达到最低值,为248497.8×106 AU · nm2.由图 8可知,在水体冻结过程中,冰相中HPO-A和HPI的总Φi,n计算值和总ΦT,n计算值均始终高于实测值(HPO-A的总Φi,n和总ΦT,n的计算值分别是实测值的3.2~9.1倍和3.6~7.8倍,HPI的总Φi,n和总ΦT,n的计算值分别是实测值的1.2~6.8倍和1.7~3.8倍),并且随着冻结时间的增长,差距逐渐减小.这说明冻融作用导致HPO-A和HPI的荧光性降低,并且在水体冻结初始阶段进入冰相中的那部分物质更容易受到冻融作用的影响.Spencer等(2007)认为冻融作用改变了水体中DOM分子的聚合状态,从而引起DOM光谱学特性的变化.与HPO-A和HPI相比,冰相中TPI-A的总Φi,n和总ΦT,n的计算值与实测值较为接近,说明TPI-A的荧光性受冻融作用的影响相对较小.对比3种DOM组分的总Φi,n值可知,总ΦⅢ,n的计算值与实测值相差最大,HPO-A、TPI-A和HPI的总ΦⅢ,n计算值分别是实测值的2.7~17.5倍、1.7~5.5倍和2.7~6.8倍;总ΦⅤ,n值次之,3种组分的计算值分别是实测值的2.4~9.1倍、1.5~5.5倍和1.5~3.4倍;3种组分的总ΦⅠ+Ⅱ,n计算值分别是实测值的2.3~6.8倍、0.1~1.0倍和1.5~2.5倍;3种组分的总ΦⅣ,n计算值分别是实测值的2.2~7.5倍、1.0~2.4倍和1.2~2.3倍.这说明冻融作用对DOM组分中的类富里酸荧光物质和类腐殖酸荧光物质的影响较显著.
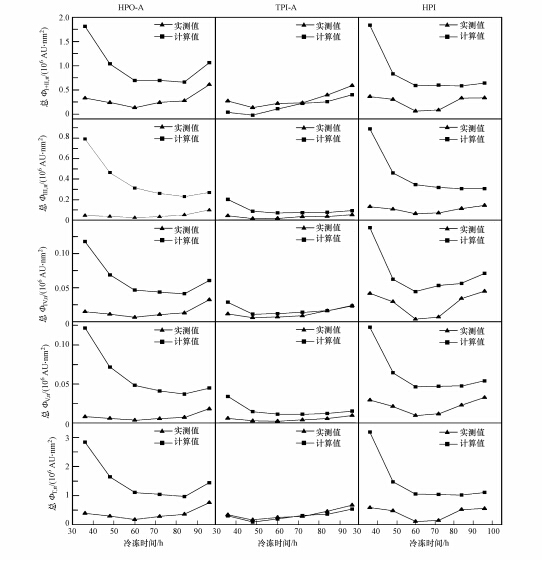 |
| 图 8 水体冻结过程中DOM组分在冰相中的总Φi,n和总ΦT,n的理论值和实际值 Fig.8 Calculated and actual values of total Φi,n and total ΦT,n for DOM fractions in ice phase during water freezing |
1)在水体冻结过程中,HPO-A、TPI-A和HPI的DOC浓度在水相中逐渐增加,而在冰相中先减少后增加,并且这3种DOM组分在冰、水两相间的分配系数排序为:HPI >TPI-A> HPO-A.
2)在水体冻结过程中,水相中HPO-A和HPI的总ΦT,n值,以及冰相中3种DOM组分的总ΦT,n值随冻结时间的变化趋势均为先降低后升高.
3)在水体冻结过程中,水相中3种DOM组分的类腐殖酸荧光峰发生蓝移.冻融作用导致HPO-A和HPI的荧光性降低,与HPO-A和HPI相比,TPI-A的荧光性受冻融作用的影响相对较小.此外,在4类荧光物质中,冻融作用对DOM组分中的类富里酸荧光物质和类腐殖酸荧光物质的影响较显著.
| [1] | Bake r A,Inverarity R. 2004. Protein-like fluorescence intensity as a possible tool for determining river water quality[J]. Hydrological Processes,18(15): 2927-2945 |
| [2] | Bergamaschi B A,Fram M S,Kendall C,et al. 1999. Carbon isotopic constraints on the contribution of plant material to the natural precursors of trihalomethanes[J]. Organic Geochemistry,30(8): 835-842 |
| [3] | Bieroza M Z,Baker A,Bridgeman J. 2010. Fluorescence spectroscopy as a tool for determination of organic matter removal efficiency at water treatment works [J]. Drinking Water Engineering and Science,3(1): 63-70 |
| [4] | 陈佳俊,费学宁,姜远光,等. 2010. 冷冻分离法去除水中污染物的对比研究[J]. 环境科学与管理,35(11): 96-98 |
| [5] | Chen W,Westerhoff P,Leenheer J A,et al. 2003. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter [J]. Environmental Science and Technology,37(24): 5701-5710 |
| [6] | Clern J E,Canuel E A,Harris D. 2002. Stable carbon and nitrogen isotope composition of aquatic and terrestrial plants of the San Francisco bay estuarine system [J]. Limnology and Oceanography,47(3): 713-729 |
| [7] | 高连敬,杜尔登,崔旭峰,等. 2012. 三维荧光结合荧光区域积分法评估净水厂有机物去除效果[J]. 给水排水,38(10): 51-56 |
| [8] | 何小松,于静,席北斗,等. 2012. 填埋垃圾渗滤液中水溶性有机物去除规律研究[J].光谱学与光谱分析,32(9): 2528-2533 |
| [9] | Hood E,Williams M W,McKnight D M. 2005. Sources of dissolved organic matter (DOM) in a Rocky Mountain stream using chemical fractionation and stable isotopes [J]. Biogeochemistry,74(2): 231-255 |
| [10] | Kraus T E C,Bergamaschi B A,Hernes P J,et al. 2008. Assessing the contribution of wetlands and subsided islands to dissolved organic matter and disinfection byproduct precursors in the Sacramento–San Joaquin River Delta: A geochemical approach [J]. Organic Geochemistry,39(9): 1302-1318 |
| [11] | Leenheer J A,Croué J P. 2003. Characterizing aquatic dissolved organic matter [J]. Environmental Science and Technology,37(1): 18A-26A |
| [12] | Lu X Q,Maie N,Hanna J V,et al. 2003. Molecular characterization of dissolved organic matter in freshwater wetlands of the Florida Everglades [J]. Water Research,37(11): 2599-2606 |
| [13] | Maie N,Scully N M,Pisani O,et al. 2007. Composition of a protein-like fluorophore of dissolved organic matter in coastal wetland and estuarine ecosystems [J]. Water Research,41(3): 563-570 |
| [14] | Mash H,Westerhoff P K,Baker L A,et al. 2004. Dissolved organic matter in Arizona reservoirs: assessment of carbonaceous sources [J]. Organic Geochemistry,35(7): 831-843 |
| [15] | Shafique U,Anwar J,Uz-Zaman W,et al. 2012. Forced migration of soluble and suspended materials by freezing front in aqueous systems [J]. Journal of Hydro-environment Research,6(3): 221-226 |
| [16] | Spencer R G M,Bolton L,Baker A. 2007. Freeze/thaw and pH effects on freshwater dissolved organic matter fluorescence and absorbance properties from a number of UK locations [J]. Water Research,41(13): 2941-2950 |
| [17] | Stedmon C A,Seredyńska-sobecka B,Boe-Hansen R,et al. 2011. A potential approach for monitoring drinking water quality from groundwater systems using organic matter fluorescence as an early warning for contamination events [J]. Water Research,45(18): 6030-6038 |
| [18] | Uyguner C S,Bekbolet M. 2005. Evaluation of humic acid photocatalytic degradation by UV–vis and fluorescence spectroscopy [J]. Catalysis Today,101(3/4): 267-274 |
| [19] | 肖雪,张玉钧,王志刚,等. 2010. 矿物油-乙醇溶液三维荧光光谱的实验研究[J]. 光谱学与光谱分析,30(6): 1549-1554 |
| [20] | Xue S,Zhao Q L,Wei L L,et al. 2007. Fate of secondary effluent dissolved organic matter during soil-aquifer treatment [J]. Chinese Science Bulletin,52(18): 2496-2505 |
| [21] | Xue S,Zhao Q L,Wei L L,et al. 2013. Fluorescence spectroscopic characterization of dissolved organic matter fractions in soils in soil aquifer treatment [J]. Environmental Monitoring and Assessment,185(6): 4591-4603 |
| [22] | Xue S,Wen Y,Hui X J,et al. 2015. The migration and transformation of dissolved organic matter during the freezing processes of water [J]. Journal of Environmental Sciences,27: 168-178 |
| [23] | 张岩,李畅游,张生,等. 2011. 呼伦湖冰封期污染特征分析及对水处理的意义[J]. 生态环境学报,20(8/9): 1289-1294 |
| [24] | 钟润生,张锡辉,管运涛,等. 2008. 三维荧光指纹光谱用于污染河流溶解性有机物来源示踪研究[J]. 光谱学与光谱分析,28(2): 347-351 |
 2015, Vol. 35
2015, Vol. 35


