2. 水土环境毒害性污染物防治与生物修复广东省高校重点实验室, 广州 510632
2. Key Laboratory of Water/Soil Toxic Pollutants Control and Bioremediation, Department of Education of Guangdong Province, Guangzhou 510632
据统计,全世界有各种类型盐碱地共9.5438亿hm2,而且仍以每年1.0×105~1.5×105 hm2的速度增长.在盐分、重金属污染等逆境胁迫下,植物细胞内会主动积累一些可溶性溶质来降低胞内渗透势,以保证水分的正常供应.甜菜碱作为植物主要的有机渗透调节物质,在逆境条件下,植物体内的甜菜碱醛脱氢酶活性升高,细胞内自然合成大量甜菜碱,对植物的渗透调节和亚细胞结构保护起到重要作用.然而,并不是所有的植物都能合成和积累甜菜碱,如拟南芥(Sakamoto et al., 2000)、烟草(McNeil et al., 1999)等.有的高等植物自然合成的甜菜碱亦不能正常分解被其利用,而是被储存作为一种副产物,如甜菜.因此,人工施用甜菜碱常常被作为一种抗不利环境和促进植物生长的方式.
已有研究表明,盐分胁迫下,外源甜菜碱能增强玉米(Yang et al., 2005)的光合能力和抗氧化酶活性,有效抑制水稻(Sobahan et al., 2009)对Na+的吸收,并引导Na+流向液泡(Ashraf et al., 2007),从而提高植物体内的K/Na比值,保持植物细胞的正常渗透调节进而增加其抗盐性;在干旱、高低温胁迫下,外源甜菜碱能有效促进高粱、玉米、小麦等(Agboma et al., 1997)的生长与增产,减轻低温对菠菜叶绿体类囊体的伤害(Coughlan et al., 1982),增加大麦的热耐受性(Oukarrouma et al., 2012).这主要是由于外源甜菜碱提高了植物的叶片水势、相对含水量和抗氧化酶活性,缓解了逆境胁迫引起的气孔和非气孔限制,从而增强了光合能力.然而,外源甜菜碱提高植物抗逆能力对不同植物及不同生长时期的施用剂量存在差异.有研究表明,在大豆的不同营养生长时期,叶面喷施3 kg · hm-2甜菜碱能最大化提高植物的光合效率与固N能力(Agboma et al., 1997);以垄播与叶面喷施甜菜碱的方式能最大限度促进向日葵的生长及提高其水分利用效率(Hussain et al., 2010);在番茄植株不同生长阶段,叶面喷施1 mmol · L-1的甜菜碱能有效提高其抗寒性(Park et al., 2006).这些研究对于探讨甜菜碱的抗性机制、农用机制和其他生理功能机制都起到了重要作用.
受灌溉水质和施肥等因素影响,许多盐渍化土壤同时也受到重金属的污染,尤其是沿海潮汐、滩涂围垦土地(Gabrijel et al., 2009).研究表明,重金属污染与盐分的双重胁迫直接影响了植物的生物量与水分利用效率、膜脂过氧化作用和抗氧化酶活性(Zhang et al., 2007),进而减弱了植物的生理活动.尽管不同领域的研究者对外源甜菜碱影响植物的生长适应和抗性机制做了大量研究.然而,在重金属污染的盐渍土上喷施甜菜碱来研究作物的抗盐性,以及对作物吸收累积重金属的特性研究尚未见报道.因此,本文通过探讨外源甜菜碱对苋菜品种的抗盐性,研究外源甜菜碱对苋菜吸收累积重金属的特性,分析盐分离子与重金属之间的相关性,以期进一步探究外源甜菜碱对苋菜吸收累积重金属的机制,亦可为重金属污染盐渍土苋菜的食用安全提出警示,并为植物修复重金属污染土壤提供理论参考.
2 材料与方法(Materials and methods) 2.1 植物种植、处理与收获本实验苋菜种植在暨南大学环境学院玻璃温室中,供试苋菜种子由河南驻马店金牡丹种业有限公司提供,无水甜菜碱来自Sigma公司,盆栽土壤来自广东省广州市棠东地区的赤红壤,供试土壤理化性质指标为:pH=6.348,TOC为35.4 g · kg-1,CEC为20.86 cmol · kg-1,Cd、Pb、Zn、Cr、Cu含量分别为1.81、94.48、338.55、44.80、50.62 mg · kg-1.根据GB15618—1995《土壤环境质量标准》中的二级标准,供试土壤Cd、Pb、Zn含量明显超标,属于重金属复合污染土壤.土壤晾晒、磨碎后,准确称取2.20 kg干土置于塑料花盆中,分别加入0.22 g · mL-1的NaCl 20、40 mL作为0.2%、0.4%轻重度盐分胁迫条件,并设置空白对照.塑料盆下放置塑料托盘,以防止水分和盐分流失,种植期间保持75%左右的田间持水量.为避免其他元素对实验结果造成干扰,盆栽过程中未喷施农药和追施化肥.
苋菜出苗10 d后,视幼苗情况,间苗至5株健康苗.在苋菜出苗25 d后(即营养生长旺盛时期),每天早上8:00—9:00在苋菜叶面喷施甜菜碱,甜菜碱喷施剂量分别为1、10、50 mmol · L-1,每2 d处理1次,共处理3次,并喷施去离子水作为空白对照(0 mmol · L-1).苋菜叶的正面和背面均要喷施,叶被浸润且无水滴落下,每个处理设3个重复.苋菜长至50 d左右时,选择在早晨6:00收获,根、茎叶分开放好,并尽量保证其完整性;选取一部分植物洗净、用滤纸吸干水分后,在液氮中速冻,置于0~4 ℃冰箱保存.剩余部分用去离子水洗净,用滤纸吸干水分并称鲜重后,分别用滤纸包装置于105 ℃烘箱中杀青15~20 min,然后保持温度在70~80 ℃,烘至恒重,并称干重.
2.2 测定方法与质控植物收获后,游离脯氨酸含量测定采用茚三酮显色法(Bates et al., 1973);可溶性糖含量测定采用蒽酮法(Dubois et al., 1956);总游离氨基酸含量测定采用茚三酮显色法(刘荣森等,2007).植物烘干磨碎后,采用干灰化法消解,在消解过程中加入植物标准样品(GSV-1国家标准参比物质),保证测定元素在允许的误差范围内才进行测试以达到质控的要求.Ca、Mg、Zn等元素采用ICP等离子发射体测定,Cu测定采用岛津原子吸收分光光度计(AA-7000F),Cd、Pb、Cr测定采用石墨炉原子吸收分光光度计(AA-7000F).
2.3 数据处理采用SPSS16.0软件进行单因素方差、Duncan多重比较和皮尔逊相关性分析,采用Origin 8.5完成作图.
3 结果分析(Results and analysis) 3.1 外源甜菜碱对苋菜茎叶可溶性糖、游离氨基酸和游离脯氨酸含量的影响可溶性糖、游离氨基酸与脯氨酸作为植物的有机渗透剂组分,与甜菜碱在植物的抗逆、生长和增产方面具有协同效应.由图 1可看出,0.2%轻度盐分条件下植物可溶性糖、游离脯氨酸含量(以鲜重计)均高于空白,而总游离氨基酸含量(以鲜重计)均显著低于空白对照,表明轻度盐分胁迫能促进苋菜自身大量合成游离脯氨酸和可溶性糖,消耗总游离氨基酸,以增加其有机渗透调节能力,抵抗盐分的毒害作用.苋菜叶面喷施50 mmol · L-1甜菜碱能显著提高0.4%重度盐分胁迫下植物的总游离氨基酸与脯氨酸含量,但未能提高0.2%轻度盐分胁迫下植物的总游离氨基酸与脯氨酸含量.这说明0.4%重度盐分胁迫下,喷施较高浓度的甜菜碱更能有效促进苋菜的生长代谢,从而提高相容性物质含量以增强渗透调节能力,盐分含量越高,较高浓度的甜菜碱提高兼容性物质的能力越强.
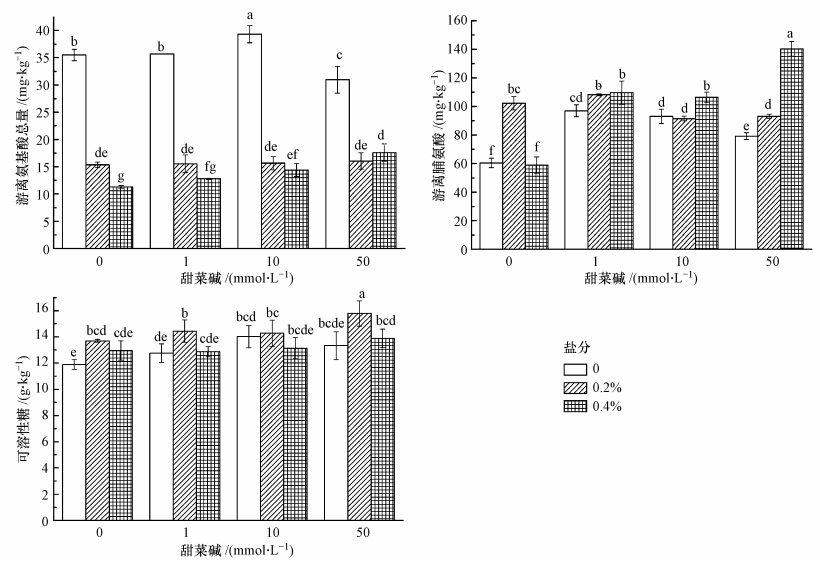 |
| 图 1 0.2%、0.4%盐分下外源甜菜碱对苋菜茎叶可溶性糖、游离氨基酸和脯氨酸含量的影响(平均值±SD,不同小写字母表示差异显著(p<0. 05),具有相同字母表示差异不显著,下同) Fig.1 Effect of exogenous glycinebetaine on the content of soluble sugar,free proline, and total free amino acid in the shoot of amaranth under 0.2% and 0.4% salt concentration(Mean ± SD,different small letters display significant differences,the same letter indicates no significant differences(p<0.05),the same below) |
盐分胁迫下,外源甜菜碱可以改善植物的多种生理活动以缓解盐分对植物的毒害.从表 1、表 2可以看出,盐分胁迫明显减少了苋菜对Ca、K、Mg的吸收量,抑制了Ca、K、Mg、Fe向苋菜茎叶部的转移,且随着盐分含量的增加,抑制效应更显著.在0.2%、0.4%轻重度盐分胁迫下,K/Na、Ca/Na比值随着盐分含量的增加而逐渐减小.说明盐分胁迫会显著抑制苋菜对K、Ca的吸收,使得体内的离子转移失衡,从而影响苋菜的正常生理活动.
| 表 1 盐分胁迫下外源甜菜碱对苋菜根系盐分离子含量的影响 Table 1 Effect of exogenous glycinebetaine on the content of saline ions in the root of amaranth under salt stress |
| 表 2 盐分胁迫下外源甜菜碱对苋菜茎叶中盐分离子含量的影响 Table 2 Effect of exogenous glycinebetaine on the content of saline ions in the shoot of amaranth under salt stress |
由表 1可知,在苋菜正常生长条件下,外源甜菜碱对K、Ca、Mg、Na的吸收效应并不明显,而在0.4%盐分胁迫下,苋菜叶面喷施10、50 mmol · L-1较高浓度的甜菜碱能调节苋菜体内的离子平衡,有效促进无机离子K、Na、Ca、Mg、Fe的吸收,尤其是Na离子.这可能是因为过量的Na毒害,使外源甜菜碱促进根系生成额外的液泡,并引导Na离子流向液泡.在0.4%盐分条件下,外源甜菜碱处理后苋菜茎叶部Ca、Na、K、Fe含量明显高于对照,说明外源甜菜碱能显著促进Ca、Na、K、Fe向苋菜茎叶部转移.另一方面,盐分处理后,苋菜根系K/Na、Ca/Na比值会随着叶面甜菜碱喷施剂量的增加而明显提高,且在0.2%、0.4%轻重度盐分下,喷施50 mmol · L-1甜菜碱促使苋菜根系K/Na比均值分别比0 mmol · L-1处理增加了31.1%、40.4%,Ca/Na比均值分别比0 mmol · L-1处理增加了6.7%、34.1%.在同一盐分处理下,外源甜菜碱促使茎叶部Ca/Na比值明显高于根系.因此,外源甜菜碱能显著改善苋菜对盐分离子的分布和向地上部转移,盐分含量越高,外源甜菜碱增加苋菜的抗盐效应越显著.
3.3 外源甜菜碱对苋菜吸收转运重金属的影响 3.3.1 外源甜菜碱对苋菜累积重金属的影响由表 3可知,盐分处理后根系重金属Cu、Zn含量明显低于空白对照,说明盐分胁迫能有效抑制苋菜根系对重金属Cu、Zn的吸收累积.喷施10、50 mmol · L-1甜菜碱促使0.2%、0.4%盐分下苋菜根系重金属Cd、Cu、Zn、Cr含量明显高于空白对照.尤其在0.4%盐分下,喷施50 mmol · L-1甜菜碱对各重金属的增幅效果最明显,其增幅分别为22.1%、127.1%、63.4%、61.1%、56.1%.而且外源甜菜碱调控下,0.4%盐分处理苋菜根部Cd、Cr、Pb、Cu的含量明显高于0.2%盐分处理,说明盐分含量越高,甜菜碱对苋菜吸收重金属的作用越明显.从表 4可看出,在0.2%盐分条件下,外源甜菜碱能明显增加苋菜对Cd、Cr、Pb、Cu、Zn向地上部的累积,而在0.4%盐分条件下,外源甜菜碱对Cd、Cr、Pb、Cu、Zn向地上部的累积效应并不明显,且Cr、Zn的累积效应受到了抑制.这也暗示随着盐分毒害的加重,大部分重金属吸附在根细胞壁或根液泡中,重金属离子往茎叶转运受到阻碍.
| 表 3 盐分胁迫下外源甜菜碱对苋菜根系吸收累积重金属的影响 Table 3 Effect of exogenous glycinebetaine on the absorption and accumulation of heavy metals in the root of amaranth under salt stress |
| 表 4 盐分胁迫下外源甜菜碱对苋菜茎叶吸收累积重金属的影响 Table 4 Effect of exogenous glycinebetaine on the absorption and accumulation of heavy metals in the shoot of amaranth under salt stress |
重金属在植物体内的转移情况可用转运系数(TF)来表征,其计算公式为:TF=茎叶部吸收量/根部吸收量,转移系数越大,表明重金属由土壤从植物根部向地上部转移的能力越强.从图 2可看出,苋菜叶面喷施50 mmol · L-1甜菜碱后,0.2%盐分处理的Cd、Cr、Zn转移系数均高于对照,0.4%盐分处理的Cd、Pb、Cu、Zn转移系数低于空白对照.表明在0.2%轻度盐分胁迫下,较高浓度的甜菜碱能有效缓解盐分对植物的渗透胁迫,且未能提高植物的总游离氨基酸与脯氨酸含量,从而促使苋菜对重金属Cd、Cr、Zn的向上转移;而在0.4%重度盐分胁迫下,由于总游离氨基酸与脯氨酸含量上升,对重金属产生络合,进而导致重金属Cd、Pb、Cu、Zn的向茎叶部转移系数减小.说明在轻度重金属污染的盐渍土中,较高浓度的甜菜碱增加苋菜转运重金属Cd、Cr、Zn的效果最显著.
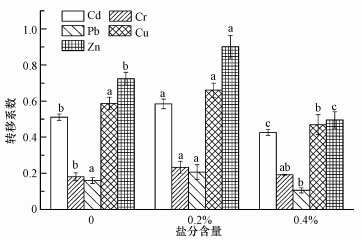 |
| 图 2 0.2%、0.4%盐分与喷施50 mmol · L-1甜菜碱处理下苋菜转运各重金属的能力(不同小写字母表示不同盐分处理下各个重金属的差异显著(p<0.05)) Fig.2 Ability of the transportation of heavy metals under the mediation of 50 mmol · L-1 glycinebetaine and 0.2% and 0.4% salt concentration |
重金属与盐分离子、重金属之间的相互作用关系十分复杂,可表现为协同作用、拮抗作用及加和作用,其作用类型因作用对象和外源介质的不同而不同.非必需的重金属只能伴随必需元素、通过它们的吸收通道进入植物体内.由表 5可看出,同一盐分处理后,苋菜叶面喷施甜菜碱对盐分离子与重金属吸收具有一定的相关性.特别是在0.4%较高盐分处理下,Na与K、Ca、Pb、Cr、Cu、Zn的吸收变化呈显著正相关(p<0.01),Pb、Cr、Cu、Zn与盐分离子、其他重金属的吸收变化呈现出显著正相关(p<0.01);而在0.2%盐分处理下,仅Na与Ca、Mg与Cd和Pb、Cr与Cd、Cu与Pb的吸收变化呈显著正相关(p<0.01).说明盐分含量越高,盐分毒害越严重,外源甜菜碱在缓解盐分胁迫、改善必需元素(包括重金属Cu和Zn)吸收的作用越突出,非必需重金属Cd、Pb、Cr也伴随必需元素被更多地被吸收.
| 表 5 同一盐分下苋菜根系盐分离子含量与重金属含量的相关系数 Table 5 Correlation coefficients between minerals and heavy metals in the root of amaranth under salinity treatment |
0.2%轻度盐分胁迫能有效增加植物茎叶部的可溶性糖、游离脯氨酸含量,减少总游离氨基酸含量,这与前人的研究结果一致(Joaquim et al., 2009).主要是由于盐分胁迫下,植物自身合成可溶性糖、游离脯氨酸来维持各器官较强的渗透能力,以提高对盐分胁迫的适应性.同时由于苋菜生理活动的失衡,加快了与植物生长有关的N消耗速率,从而导致蛋白质分解的游离氨基酸利用率下降.外源甜菜碱显著促进了0.4%盐分下苋菜可溶性糖、脯氨酸和游离氨基酸的合成,但未能显著促进0.2%盐分下苋菜可溶性糖、脯氨酸和游离氨基酸的合成.主要原因可能是甜菜碱与可溶性糖、脯氨酸与游离氨基酸同为有机渗透调节物质,甜菜碱与其它渗透有机渗透调节物质产生了协同作用(黄英运等,2012).这种协同作用在0.2%轻度盐分条件下表现不明显,因为轻度盐分胁迫下,植物主要是靠自身合成的游离脯氨酸、可溶性糖等物质来维持渗透平衡;而在0.4%重度盐分条件下,植物自身合成的有机渗透调节物质不足以抗衡盐分的渗透胁迫时,外源甜菜碱可急剧提高其它兼容性有机渗透调节物质的含量以缓解盐分的渗透胁迫.总之,由于茎叶部可溶性糖、总游离氨基酸与脯氨酸含量升高,对苋菜起到了更大的渗透调节作用,从而增强了盐胁迫下苋菜的保水能力,改善其生理活动,进一步增强了苋菜的抗盐能力.
4.2 外源甜菜碱对苋菜吸收盐分离子的影响盐分胁迫导致苋菜根和茎叶Na吸收量急剧增加,而K、Ca吸收量与K/Na比、Ca/Na比值明显下降(表 1、表 2).说明苋菜不能自主抑制Na的吸收,亦不是耐盐的植物.盐分胁迫下,叶面喷施不同浓度的甜菜碱能提高根系K/Na比、Ca/Na比值,基本保持K、Na、Ca的动态平衡,促进根系对K、Mg、Fe、Ca的吸收和累积(表 1、表 2),有利于盐分离子在植物中的吸收和重新分布,这与前人研究结果相符合(Cuin et al., 2005; Ali et al., 2011).
甜菜碱被称为是高效而价廉缓解盐分毒害的物质,它改善了植物的多种生理活动,提高光合色素活性,促进根系生成额外的液泡,并促使Na+流向液泡,这也是增强植物耐盐性的重要原因之一.而K/Na、Ca/Na比作为植物抗盐分胁迫能力强弱的重要标准,保持较高的K/Na、Ca/Na比值可以减轻盐分对植物的毒害.本研究结果也基本证实了外源甜菜碱能有效地增加K、Ca吸收转运、提高K/Na、Ca/Na比值,维持植物体内的离子平衡,从而增强苋菜的抗盐分胁迫能力.
K、Ca、Na等无机离子与甜菜碱分别作为植物体内主要的无机和有机渗透调节物质,它们两者之间存在着一个动态平衡.已有研究表明,外源Ca能促进植物细胞对甜菜碱的积累,这也暗示着Ca2+不可替代的渗透保护作用(Jaleel et al., 2007),而外源低浓度甜菜碱也能直接激活Ca-敏感型通道,促进植物吸收Ca,并增加细胞内自由Ca2+浓度(Li et al., 2014).与此同时,在盐分胁迫下,外源甜菜碱抑制Na、提高K/Na、Ca/Na比值的主要因素有:①与大分子蛋白、脂类物质相互结合,阻碍Na质外体流(Sobahan et al., 2009);②促使植物根系生长额外的液泡,并引导Na+流向液泡(Ashraf et al., 2007);③具有K/Na识别能力,可以部分地促使植物中阳离子输送动态平衡(刘燕燕等,2008).这也进一步证实了甜菜碱的重要有机渗透调节能力与抗盐胁迫能力.
4.3 外源甜菜碱对苋菜吸收累积重金属的影响盐分胁迫下,植物对重金属的耐受性倍受关注.研究表明,适量的盐分能刺激植物的木质化作用(Cheng et al., 2012),直接增加植物对重金属的耐受性.另一方面,盐分胁迫导致植物自身合成有机渗透调节物质来抵抗渗透胁迫,从而保护膜组织的耐受性,减少对重金属的吸收(Isabelle et al., 2009).在本研究中,盐分胁迫也明显降低了苋菜对重金属Cu、Zn的吸收和向地上部累积.
有研究报道,外源甜菜碱能显著抑制烟草细胞吸收重金属Cd(Islam et al., 2009),对水生植物浮萍吸收Cd的效果并不明显(Duman et al., 2011),能显著抑制浮萍对Pb的吸收(Duman,2011).但外源甜菜碱处理增加了玉米种子对重金属Cd、Cr、Zn的吸收(Ali et al., 2011).在本研究中,叶面喷施甜菜碱亦显著增强苋菜对重金属的吸收累积和地上部转运(表 3和图 2).主要原因可能是喷施甜菜碱后,随着Ca、Mg、K等盐分离子的大量转移和Ca通道被甜菜碱激活,增加了重金属Cd、Cr、Pb、Cu、Zn由Ca通道进入植物细胞的机会(表 5),这可能是因为Ca与Cd、Pb、Zn、Cu具有许多物理上的相似性,尤其是电荷和半径.此外,重金属Cd、Cr、Pb、Cu、Zn还共用根系吸收Fe、Zn的转运通道(Liu et al., 2003; Xin et al., 2010; Yang et al.,2004),因此,喷施甜菜碱通过促进Fe、Zn的吸收也可以增加对其它重金属的吸收.另外,甜菜碱作为两性分子,叶面喷施甜菜碱后,它能迅速地分布于植物的各个器官,有可能与重金属离子发生络合作用,从而提高其吸收累积,这还需作进一步的研究.
5 结论(Conclusions)1)叶面喷施较高浓度甜菜碱不仅增加了重度盐分胁迫下苋菜茎叶总游离氨基酸与游离脯氨酸的含量,而且增强了苋菜根系对Ca、Mg、K、Fe离子的吸收,提高了苋菜根部K/Na、Ca/Na比值.盐分含量越高,喷施高浓度甜菜碱对苋菜的抗盐作用越明显.
2)外源甜菜碱促进了苋菜根系对重金属Cd、Cr、Pb、Cu、Zn的吸收.在轻度盐分胁迫下,喷施较高浓度甜菜碱还显著增加了苋菜对重金属Cd、Zn、Cr向茎叶部转运.因此,在重金属污染的盐渍土施用甜菜碱虽然有助于作物的生长和耐盐效应,但需警惕作物吸收累积重金属增加的风险.
| [1] | Agbo ma P C, Sinclairb T R, Jokinen K, et al. 1997. An evaluation of the effect of exogenous glycinebetaine on the growth and yield of soybean: timing of application, watering regimes and cultivars[J]. Field Crops Research, 54(1): 51-64 |
| [2] | Agboma P C, Jones M G K, Peltonen-Sainio P, et al. 1997. Exogenous glycinebetaine enhances grain yield of maize, sorghum and wheat grown under two supplementary watering regimes[J]. Journal of Agronomy and Crop Science, 178(1): 29-37 |
| [3] | Ali Q, Ashraf M. 2011. Exogenously applied glycinebetaine enhances seed and seed oil quality of maize (Zea mays L.) under water deficit conditions[J]. Environmental and Experimental Botany, 71(2): 249-259 |
| [4] | Ashraf M, Foolad M R. 2007. Roles of glycine betaine and proline in improving plant abiotic stress resistance[J]. Environmental and Experimental Botany, 59(2): 206-216 |
| [5] | Bates L S, Waldren R P, Teare I D. 1973. Rapid determination of free proline for water-stress studies[J]. Plant and Soil, 39(1): 205-207 |
| [6] | Cheng H, Wang Y S, Ye Z H, et al. 2012. Influence of N deficiency and salinity on metal (Pb, Zn and Cu) accumulation and tolerance by Rhizophora stylosa in relation to root anatomy and permeability[J]. Environmental Pollution, 164: 110-117 |
| [7] | Coughlan S J, Heber U. 1982. The role of glycinebetaine in the protection of spinach thylakoids against freezing stress[J]. Planta, 156(1): 62-69 |
| [8] | Cuin T A, Shabala S. 2005. Exogenously supplied compatible solutes rapidly ameliorate NaCl-induced potassium efflux from barley roots[J]. Plant & Cell Physiology, 46(12): 1924-1933 |
| [9] | Dubois M, Gilles K A, Hamilton J K, et al. 1956. Colorimetric Method for Determination of Sugars[J]. Analytical Chemistry, 28(3): 350-356 |
| [10] | Duman F. 2011. Effects of exogenous glycinebetaine and trehalose on lead accumulation in an aquatic plant (Lemna gibba L.) [J]. International Journal of Phytoremediation, 13(5): 492-497 |
| [11] | Duman F, Aksoy A, Aydin Z, et al. 2011. Effects of exogenous glycinebetaine and trehalose on cadmium accumulation and biological responses of an aquatic plant (Lemna gibba L.)[J]. Water, Air and Soil Pollution, 217(1/4): 545-556 |
| [12] | Gabrijel O, Davor R, Zed R. 2009. Cadmium accumulation by muskmelon under salt stress in contaminated organic soil[J]. The Science of the Total Environment, 407(7): 2175-2182 |
| [13] | 黄英运, 朱丹华, 李虹章, 等. 2012. 外源甜菜碱对NaCl胁迫下大豆苗期生理指标的影响[J]. 浙江农业学报, 24(1): 12-16 |
| [14] | Hussain M, Farooq M, Jabran K, et al. 2010. Foliar application of glycinebetaine and salicylic acid improves growth, yield and water productivity of hybrid sunflower planted by different sowing methods[J]. Journal of Agronomy and Crop Science, 196(2): 136-145 |
| [15] | Isabelle L, Geoffrey M, Pierre M, et al. 2009. Chloride salinity reduces cadmium accumulation by the Mediterranean halophyte species Atriplex halimus L[J]. Environmental and Experimental Botany, 65(1): 142-152 |
| [16] | Islam M M, Hoque M A, Okuma E, et al. 2009. Exogenous proline and glycinebetaine increase antioxidant enzyme activities and confer tolerance to cadmium stress in cultured tobacco cells[J]. Journal of Plant Physiology, 166(15): 1587-1597 |
| [17] | Jaleel C A, Manivannan P, Sankar B, et al. 2007. Calcium chloride effects on salinity-induced oxidative stress, proline metabolism and indole alkaloid accumulation in Catharanthus roseus[J]. Comptes Rendus Biologies, 330(9): 674-683 |
| [18] | Joaquim A G S, Sandro A M A, Joo P M S L, et al. 2009. Roots and leaves display contrasting osmotic adjustment mechanisms in response to NaCl-salinity in Atriplex nummularia[J]. Environmental and Experimental Botany, 66(1): 1-8 |
| [19] | Li M F, Guo S J, Xu Y, et al. 2014. Glycine betaine-mediated potentiation of HSP gene expression involves calcium signaling pathways in tobacco exposed to NaCl stress[J]. Physiologia Plantarum, 150(1): 63-75 |
| [20] | Liu J G,Li K Q,Xu J K,et al.2003.Interaction of Cd and five mineral nutrients for uptake and accumulation in different rice cultivars and genotypes[J].Field Crops Research. 83(3):271-281 |
| [21] | 刘荣森, 杨虹琦, 黄郁维, 等. 2007. 植物中游离氨基酸的提取、纯化及分析方法[J]. 河南科技大学学报: 自然科学版, 28(3): 76-79 |
| [22] | 刘燕燕, 朱思明, 曾新安, 等. 2008. 甜菜碱提高植物抗性的研究进展[J]. 中国甜菜糖业, (3): 45-47 |
| [23] | McNeil S D, Nuccio M L, Hanson A D. 1999. Betaines and related osmoprotectants. Targets for metabolic engineering of stress resistance[J]. Plant Physiology, 120(4): 945-949 |
| [24] | Oukarrouma A, Madidib S E, Strasser R J. 2012. Exogenous glycine betaine and proline play a protective role in heat-stressed barley leaves (Hordeum vulgare L.): A chlorophyll a fluorescence study[J]. Plant Biosystems, 146(4): 1037-1043 |
| [25] | Park E J, Jeknic Z, Chen T H H, et al. 2006. Exogenous application of glycinebetaine increases chilling tolerance in tomato plants[J]. Plant & Cell Physiology, 47(6): 706-714 |
| [26] | Sakamoto A, Valverde R, Alia, et al. 2000. Transformation of Arabidopsis with the codA gene for choline oxidase enhances freezing tolerance of plants[J]. The Plant Journal, 22(5): 449-453 |
| [27] | Sobahan M A, Arias C R, Okuma E, et al. 2009. Exogenous proline and glycinebetaine suppress apoplastic flow to reduce Na+ uptake in rice seedlings[J]. Bioscience, Biotechnology, and Biochemistry, 73(9): 2037-2042 |
| [28] | Xin J L, Huang B F, Yang Z Y, et al. 2010. Responses of different water spinach cultivars and their hybrid to Cd, Pb andCd-Pb exposures[J]. Journal of Hazardous Materials, 175(1/3): 468-476 |
| [29] | Yang X E, Long X X, He H B, et al. 2004. Cadmium tolerance and hyperaccumulation in a new Zn-hyperaccumulating plant species (Sedum alfredii Hance) [J]. Plant and Soil, 259(1/2): 181-189 |
| [30] | Yang X H, Lu C M. 2005. Photosynthesis is improved by exogenous glycinebetaine in salt-stressed maize plants[J]. Physiologia Plantarum, 124(3): 343-352 |
| [31] | Zhang F Q, Wang Y S, Lou Z P, et al. 2007. Effect of heavy metal stress on antioxidative enzymes and lipid peroxidation in leaves and roots of two mangrove plant seedlings (Kandelia candel and Bruguiera gymnorrhiza) [J]. Chemosphere, 67(1): 44-50 |
 2015, Vol. 35
2015, Vol. 35


