2. 海军军医大学(第二军医大学)第二附属医院神经内科, 上海 200003
2. Department of Neurology, The Second Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200003, China
阿尔茨海默病(Alzheimer’s disease,AD)是一种病因复杂的神经退行性疾病,在临床上,AD主要表现为记忆障碍、认知功能障碍、人格改变和语言障碍等,给患者带来极大的困扰,严重影响了他们的社交和生活。目前全球有超过3 000万人受到AD的影响,预计到2050年AD患病人数将达到1.5亿[1]。AD在病理上主要有2个典型特征,即β淀粉样蛋白(β-amyloid protein,Aβ)沉积形成的老年斑和tau蛋白过度磷酸化形成的神经原纤维缠结(neurofibrillary tangle,NFT)。现阶段临床上AD的主要治疗药物包括乙酰胆碱酯酶抑制剂、N-甲基-D-天冬氨酸受体拮抗剂(如美金刚)、淀粉样蛋白结合剂和tau蛋白磷酸化抑制剂等[2],这些药物虽然能够清除或减少神经元周围病理性蛋白质,在改善症状和延缓病情进展方面有一定效果,但均无法完全治愈AD,因此急需更有效的替代疗法。
溶酶体系统是降解蛋白质、核酸等生物大分子的主要途径之一,内含多种水解酶,与细胞自噬息息相关,对维持细胞内稳态具有重要意义。溶酶体系统在正常情况下会确保蛋白质等大分子顺利降解,若溶酶体系统异常则会导致细胞内底物清除效率下降,引发一系列不良后果。目前已有通过恢复溶酶体功能治疗神经退行性疾病的药物出现,且这类药物在治疗上取得了较好的效果[3]。本文将围绕溶酶体功能异常与AD的关系,以及不同靶向溶酶体系统药物治疗AD的最新进展进行综述,以期为靶向溶酶体药物的研发提供依据。
1 溶酶体功能异常与AD的关系 1.1 溶酶体溶酶体是真核细胞中一种重要的细胞器,内含60多种水解酶,能分解蛋白质、核酸、多糖等内源和外源生物大分子,维持细胞内蛋白质稳定,是细胞的消化器官。证据表明,溶酶体是细胞中的一个主要信号枢纽,影响着能量代谢和炎症通路等过程[4]。自噬是介导细胞质中大分子降解的过程,该过程很大程度上依赖于溶酶体。细胞自噬有巨自噬、微自噬、分子伴侣介导的自噬3种方式,共同参与细胞的稳态调节。溶酶体中的任何缺陷都可能影响自噬过程,并导致病理性的蛋白质积累。在AD大脑中,溶酶体清除自噬液泡(autophagy vacuole)的过程被破坏,导致大量自噬液泡聚集在神经元中[5]。溶酶体缺陷由溶酶体酸化等多种因素引起,这些因素可影响自噬过程,促进病理性蛋白质聚集,且可能与神经退行性疾病的发病有关。
1.2 溶酶体酸化功能障碍溶酶体酸化主要由液泡型ATP酶(vacuolar ATPase,v-ATPase)、溶酶体膜上的多种离子通道、跨膜蛋白和氯离子-质子交换器等相互合作共同维持[6]。溶酶体pH值主要由v-ATPase维持,它是一种多聚酶复合物,可将质子从细胞质泵入溶酶体腔。研究表明,早老素(presenilin)1缺失、早老素2缺失或与家族性AD相关的早老素1突变会降低溶酶体v-ATPase的免疫活性,导致溶酶体pH值升高,从而抑制溶酶体蛋白酶的活化,延迟自噬蛋白的周转[7]。此外,溶酶体膜上的离子通道和跨膜蛋白受损也会影响溶酶体酸化。瞬时受体电位黏蛋白1(transient receptor potential mucolipin 1,TRPML1)是一种阳离子渗透通道蛋白,可维持溶酶体功能所需的低pH值和Ca2+水平[8]。TRPML1激活会导致溶酶体Ca2+释放,促进自噬体与溶酶体融合,且TRPML1还参与溶酶体的生物生成[9-10]。在AD小鼠中过表达TRPML1能改善其认知功能,减轻神经元凋亡[10]。溶酶体pH值需要维持在一个范围内,过度酸化也会影响溶酶体的功能。跨膜蛋白175是一种具有新型结构的溶酶体钾通道蛋白,在溶酶体膜电位和pH值稳定方面发挥着重要作用。跨膜蛋白175缺乏会使溶酶体过度酸化,导致组织蛋白酶活性受损和自噬体-溶酶体融合异常[11-12]。溶酶体酸化功能障碍会导致细胞自噬无法进行及有毒蛋白聚集体的积累,被认为是AD的重要驱动因素。
1.3 溶酶体与Aβ的产生Aβ沉积是AD的核心病理改变,Aβ蛋白是由淀粉样前体蛋白(amyloid precursor protein,APP)经过β-分泌酶、γ-分泌酶的连续裂解产生。APP生成Aβ经历了非淀粉样途径和淀粉样途径。在淀粉样途径中,APP在β位点由β前体蛋白裂解酶1进行初步加工,产生APPβ和β羧基末端片段(β C-terminal fragment,β-CTF)[13]。在AD患者中,神经元加速内吞会促进淀粉样蛋白的生成;同时,过量的β-CTF会导致Ras相关蛋白5病理激活,从而产生更多的Aβ并聚集在神经元内,进而加快神经退行性疾病的进程[14]。此外,sortilin相关受体1(sortilin-related receptor 1,SORL1)也与APP有关。SORL1在脑内高度表达,并作为APP的分选受体促进APP从内体转运到反式高尔基体网络,从而减少APP的淀粉样蛋白加工。SORL1缺失会导致溶酶体功能缺陷、Aβ水平升高及APP依赖性缺陷[15]。
1.4 溶酶体与tau蛋白的积累除了Aβ外,AD的另一个特征是tau蛋白的积累。tau蛋白的聚集形式通常在溶酶体内被降解,溶酶体功能受损会导致错误折叠或聚集的tau蛋白积累[16]。早老素1基因突变是早发性家族性AD最常见的病因,其功能改变会增加Ca2+释放,导致溶酶体功能受损、钙蛋白酶和激酶激活,从而加快tau蛋白过度磷酸化和NFT形成[17-18]。逆转运复合体对溶酶体系统功能的维持也很重要。逆转运复合体是一种内体膜结合蛋白复合物,由液泡蛋白分选成分VPS35、VPS26和VPS29组成,负责协调货物的分选。VPS35对正常细胞的自噬很重要,在VPS35基因敲除的细胞中溶酶体的蛋白质水解能力、靶向性和β-半乳糖苷酶活性均降低[19-20]。逆转运复合体功能障碍还会影响自噬-溶酶体轴的正常运转,导致微管相关蛋白tau蛋白聚集;此外,tau蛋白的清除会受到转录因子EB(transcription factor EB,TFEB)的调控,TFEB还通过与协调溶酶体表达和调控基序结合靶向v-ATPase亚基[20]。研究表明,过表达TFEB可减少AD患者NFT,并降低神经元中磷酸化tau蛋白含量[21]。APP的产生也可能与AD的tau蛋白病理变化相关。有研究提出,增加的APP可能会作为异常tau蛋白的受体发挥作用,从而促进细胞内tau蛋白的聚集,加速tau蛋白的积累[22]。这些研究结果强调了溶酶体系统在tau蛋白清除过程中的重要性,为研制AD的治疗药物提供了基础。
2 靶向溶酶体功能的策略目前靶向溶酶体的药物主要通过降低溶酶体pH值或恢复溶酶体酶活性,使其能发挥正常的生理功能(表 1)。但靶向溶酶体药物的临床应用较困难,需要继续探索。
|
|
表 1 靶向溶酶体的药物 |
2.1 重新酸化溶酶体
溶酶体是细胞中物质清除过程的最后一步,pH值维持在4.5~5.0,溶酶体酸化的程度和酶的活性对物质代谢至关重要。溶酶体酸化缺陷会影响底物的降解,增加病理性蛋白质的积聚。近年来,研究人员开发了针对溶酶体酸化缺陷的药物并取得了不小的成果。TFEB是调控溶酶体和自噬相关基因表达所必需的转录因子,可以促进溶酶体生物发生,并有望应用于AD的治疗。拟人参皂苷-F11(pseudoginsenoside-F11,PF11)是一种奥克替醇型人参皂苷,有研究表明PF11能够调节TFEB的核转位,从而增加溶酶体相关蛋白和酶的表达量,调节细胞内的pH值,是治疗AD的潜在药物[23]。
v-ATPase是维持溶酶体pH值的核心物质,因此其也是溶酶体酸化的重要靶点。EN6是一种自噬激活剂,以溶酶体v-ATPase为靶标。有研究提出EN6能够增加溶酶体酸化、抑制哺乳动物雷帕霉素靶蛋白复合体1信号转导及激活细胞自噬[24]。这表明EN6可以通过靶向v-ATPase来调节哺乳动物雷帕霉素靶蛋白复合体1信号转导,从而增强细胞的清除能力。然而,目前尚不清楚EN6能否穿透血脑屏障,这限制了其临床转化,且其安全性也需要进一步研究。
C381是另一种酸化溶酶体的小分子药物,文献报道C381靶向溶酶体后可刺激溶酶体酸化,增加溶酶体蛋白分解,并能减轻溶酶体膜损伤和渗透[25]。这表明C381是一种有前景的药物,可以用于治疗以溶酶体功能障碍为特征的神经退行性疾病。然而,研究人员也指出C381在实验设计上的不足。在该研究的模型中,研究人员证实C381在小胶质细胞中具有很强的作用,但并没有表明该药物具有细胞类型特异性作用,还需要进一步研究证明C381对各种细胞类型的影响。令人兴奋的是,与其他小分子药物相比,C381能穿透血脑屏障渗透到脑实质中,在治疗具有溶酶体病理学的神经退行性疾病方面前景广阔。
除小分子药物外,近些年来纳米药物被越来越多地应用到神经退行性疾病的靶向溶酶体治疗中。聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolic acid),PLGA)是美国FDA批准的一种生物可降解性聚合物,其在体内会分解成乳酸和羟基乙酸。Bourdenx等[3]提出PLGA酸性纳米颗粒(PLGA acidic nanoparticle,PLGA-aNP)能内化到溶酶体,且PLGA分解的2种酸可以将有缺陷的溶酶体重新酸化至基础水平,还可减弱帕金森病模型小鼠的病理改变。PLGA除了用于帕金森病外,也能对AD的治疗有一定作用。研究显示PLGA酸性纳米粒子可以使早老素1基因敲除(presenilin 1 knock-out,PS1KO)细胞的溶酶体pH值及蛋白质水解和自噬恢复到正常水平[7]。尽管PLGA已获美国FDA批准,但基于PLGA的纳米药物尚未进入临床应用,仍需要进一步推动PLGA的临床转化。
核脂纳米乳液(nucleolipid nanoemulsion,NL-NE)是基于DNA衍生物合成的纳米药物。Brouillard等[26]的研究表明NL-NE能有效穿透生物膜,并在细胞内断裂释放琥珀酸,能够使神经元溶酶体的pH值恢复到正常水平,且对细胞无明显毒性。尽管NL-NE能有效恢复溶酶体pH值,但所需的浓度较高,因此Brouillard等[27]开展了进一步研究。他们合成了一种基于多聚化方法的四聚体核脂,该药能释放4个有生物相容性的琥珀酸单位,提高了药物输送效率,有效降低了药物的总体浓度,还能恢复溶酶体的最佳pH值,且其活性成分的浓度比相应的单体低4倍。
2.2 恢复自噬-溶酶体功能溶酶体系统与自噬密不可分,一旦溶酶体损伤,自噬也无法进行。靶向溶酶体使细胞自噬恢复正常对治疗神经退行性疾病如AD等有至关重要的作用。Xue等[28]提出了一种功能化的单壁碳纳米管(single walled carbon nanotube,SWNT),其可以通过逆转哺乳动物雷帕霉素靶蛋白信号的异常激活和溶酶体蛋白水解缺陷来促进自噬底物的清除,从而促使细胞自噬恢复正常。此外,该研究使用了来自AD相关淀粉样变性转基因小鼠模型(transgenic mouse model of AD-related amyloidosis,CRND8)的原代神经胶质细胞,这种细胞表现出自噬诱导受损、溶酶体功能障碍、组织蛋白酶D活性显著降低;而经SWNT治疗后,细胞内的溶酶体大小和自噬恢复到正常水平,病理性蛋白质也可被有效清除。此外,SWNT也是重要的神经保护药物,能促进神经生长、分化和成熟,在临床转化方面很有潜力。
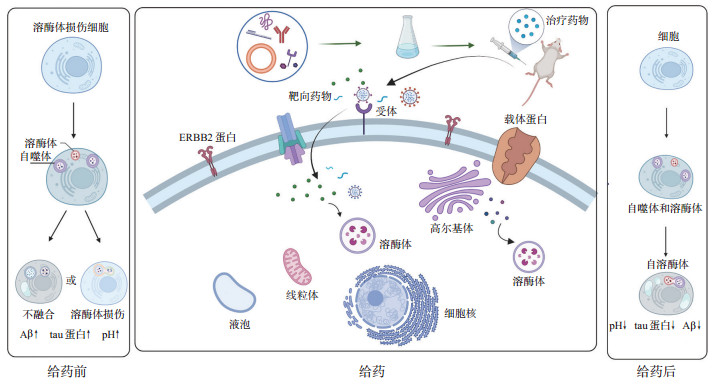
3 小结和展望溶酶体参与维持细胞内蛋白质稳态,被认为是一种参与细胞清除、信号转导和能量代谢的细胞器,其酶具有抵消蛋白质分解清除缺陷的潜力。功能正常的溶酶体对于维持细胞的生理活动至关重要。溶酶体功能障碍越来越被认为是帕金森病等神经退行性疾病的主要致病因素[3],也是潜在的治疗靶点。因此,针对溶酶体功能障碍开发包括AD在内的神经退行性疾病的治疗方法已成为临床上一个日益重要的目标,近年来靶向溶酶体治疗AD药物的研发也取得了令人振奋的成果(图 1)。然而,这些已开发的药物多用于恢复溶酶体功能,虽效果显著,但大多数仍处于细胞和动物研究层面,促进这些药物的临床转化必须克服以下几个问题:首先是穿透血脑屏障问题。血脑屏障阻碍了药物进入脑部病理区域,导致药物的治疗效果大打折扣,因此穿透血脑屏障是研发治疗神经退行性疾病药物的一大难点。其次是药物的稳定性问题。溶酶体是一个酸性细胞器,pH值较低,这可能会影响药物的稳定性。总之,虽然以溶酶体为靶点的药物在治疗AD上很有潜力,但是也面临很多问题。
|
图 1 靶向溶酶体药物治疗阿尔茨海默病的研发示意图 Aβ:β淀粉样蛋白;ERBB2:Erb-B2受体酪氨酸激酶2. |
| [1] |
RAJENDRAN K, KRISHNAN U M. Mechanistic insights and emerging therapeutic stratagems for Alzheimer's disease[J]. Ageing Res Rev, 2024, 97: 102309. DOI:10.1016/j.arr.2024.102309 |
| [2] |
KIM A Y, AL JERDI S, MACDONALD R, et al. Alzheimer's disease and its treatment-yesterday, today, and tomorrow[J]. Front Pharmacol, 2024, 15: 1399121. DOI:10.3389/fphar.2024.1399121 |
| [3] |
BOURDENX M, DANIEL J, GENIN E, et al. Nanoparticles restore lysosomal acidification defects: implications for Parkinson and other lysosomal-related diseases[J]. Autophagy, 2016, 12(3): 472-483. DOI:10.1080/15548627.2015.1136769 |
| [4] |
LAWRENCE R E, ZONCU R. The lysosome as a cellular centre for signalling, metabolism and quality control[J]. Nat Cell Biol, 2019, 21(2): 133-142. DOI:10.1038/s41556-018-0244-7 |
| [5] |
LAI S S M, NG K Y, KOH R Y, et al. Endosomal-lysosomal dysfunctions in Alzheimer's disease: pathogenesis and therapeutic interventions[J]. Metab Brain Dis, 2021, 36(6): 1087-1100. DOI:10.1007/s11011-021-00737-0 |
| [6] |
LO C H, ZENG J. Defective lysosomal acidification: a new prognostic marker and therapeutic target for neurodegenerative diseases[J]. Transl Neurodegener, 2023, 12(1): 29. DOI:10.1186/s40035-023-00362-0 |
| [7] |
LEE J H, MCBRAYER M K, WOLFE D M, et al. Presenilin 1 maintains lysosomal Ca2+homeostasis via TRPML1 by regulating vATPase-mediated lysosome acidification[J]. Cell Rep, 2015, 12(9): 1430-1444. DOI:10.1016/j.celrep.2015.07.050 |
| [8] |
FINE M, SCHMIEGE P, LI X. Structural basis for PtdInsP2-mediated human TRPML1 regulation[J]. Nat Commun, 2018, 9(1): 4192. DOI:10.1038/s41467-018-06493-7 |
| [9] |
TEDESCHI V, PETROZZIELLO T, SISALLI M J, et al. The activation of mucolipin TRP channel 1(TRPML1) protects motor neurons from L-BMAA neurotoxicity by promoting autophagic clearance[J]. Sci Rep, 2019, 9(1): 10743. DOI:10.1038/s41598-019-46708-5 |
| [10] |
ZHANG L, FANG Y, CHENG X, et al. Interaction between TRPML1 and p62 in regulating autophagosome-lysosome fusion and impeding neuroaxonal dystrophy in Alzheimer's disease[J]. Oxid Med Cell Longev, 2022, 2022: 8096009. DOI:10.1155/2022/8096009 |
| [11] |
FENG X, ZHAO Z, LI Q, et al. Lysosomal potassium channels: potential roles in lysosomal function and neurodegenerative diseases[J]. CNS Neurol Disord Drug Targets, 2018, 17(4): 261-266. DOI:10.2174/1871527317666180202110717 |
| [12] |
CANG C, ARANDA K, SEO Y J, et al. TMEM175 is an organelle K+channel regulating lysosomal function[J]. Cell, 2015, 162(5): 1101-1112. DOI:10.1016/j.cell.2015.08.002 |
| [13] |
SIRISI S, SÁNCHEZ-ACED É, BELBIN O, et al. APP dyshomeostasis in the pathogenesis of Alzheimer's disease: implications for current drug targets[J]. Alzheimers Res Ther, 2024, 16(1): 144. DOI:10.1186/s13195-024-01504-w |
| [14] |
XU W, FANG F, DING J, et al. Dysregulation of Rab5-mediated endocytic pathways in Alzheimer's disease[J]. Traffic, 2018, 19(4): 253-262. DOI:10.1111/tra.12547 |
| [15] |
HUNG C, TUCK E, STUBBS V, et al. SORL1 deficiency in human excitatory neurons causes APP-dependent defects in the endolysosome-autophagy network[J]. Cell Rep, 2021, 35(11): 109259. DOI:10.1016/j.celrep.2021.109259 |
| [16] |
XU Y, PROPSON N E, DU S, et al. Autophagy deficiency modulates microglial lipid homeostasis and aggravates tau pathology and spreading[J]. Proc Natl Acad Sci USA, 2021, 118(27): e2023418118. DOI:10.1073/pnas.2023418118 |
| [17] |
MUSTALY-KALIMI S, GALLEGOS W, MARR R A, et al. Protein mishandling and impaired lysosomal proteolysis generated through calcium dysregulation in Alzheimer's disease[J]. Proc Natl Acad Sci USA, 2022, 119(49): e2211999119. DOI:10.1073/pnas.2211999119 |
| [18] |
XUE W, ZHANG J, LI Y. Enhancement of lysosome biogenesis as a potential therapeutic approach for neurodegenerative diseases[J]. Neural Regen Res, 2023, 18(11): 2370-2376. DOI:10.4103/1673-5374.371346 |
| [19] |
CUI Y, CAROSI J M, YANG Z, et al. Retromer has a selective function in cargo sorting via endosome transport carriers[J]. J Cell Biol, 2019, 218(2): 615-631. DOI:10.1083/jcb.201806153 |
| [20] |
CAROSI J M, HEIN L K, VAN DEN HURK M, et al. Retromer regulates the lysosomal clearance of MAPT/tau[J]. Autophagy, 2021, 17(9): 2217-2237. DOI:10.1080/15548627.2020.1821545 |
| [21] |
ROOT J, MERINO P, NUCKOLS A, et al. Lysosome dysfunction as a cause of neurodegenerative diseases: lessons from frontotemporal dementia and amyotrophic lateral sclerosis[J]. Neurobiol Dis, 2021, 154: 105360. DOI:10.1016/j.nbd.2021.105360 |
| [22] |
KAMETANI F, HASEGAWA M. Reconsideration of amyloid hypothesis and tau hypothesis in Alzheimer's disease[J]. Front Neurosci, 2018, 12: 25. DOI:10.3389/fnins.2018.00025 |
| [23] |
YAO X C, XUE X, ZHANG H T, et al. Pseudoginsenoside-F11 alleviates oligomeric β-amyloid-induced endosome-lysosome defects in microglia[J]. Traffic, 2019, 20(1): 61-70. DOI:10.1111/tra.12620 |
| [24] |
CHUNG C Y S, SHIN H R, BERDAN C A, et al. Covalent targeting of the vacuolar H+-ATPase activates autophagy via mTORC1 inhibition[J]. Nat Chem Biol, 2019, 15(8): 776-785. DOI:10.1038/s41589-019-0308-4 |
| [25] |
VEST R T, CHOU C C, ZHANG H, et al. Small molecule C381 targets the lysosome to reduce inflammation and ameliorate disease in models of neurodegeneration[J]. Proc Natl Acad Sci USA, 2022, 119(11): e2121609119. DOI:10.1073/pnas.2121609119 |
| [26] |
BROUILLARD M, BARTHÉLÉMY P, DEHAY B, et al. Nucleolipid acid-based nanocarriers restore neuronal lysosomal acidification defects[J]. Front Chem, 2021, 9: 736554. DOI:10.3389/fchem.2021.736554 |
| [27] |
BROUILLARD M, KINET R, JOYEUX M, et al. Modulating lysosomal pH through innovative multimerized succinic acid-based nucleolipid derivatives[J]. Bioconjug Chem, 2023, 34(3): 572-580. DOI:10.1021/acs.bioconjchem.3c00041 |
| [28] |
XUE X, WANG L R, SATO Y, et al. Single-walled carbon nanotubes alleviate autophagic/lysosomal defects in primary glia from a mouse model of Alzheimer's disease[J]. Nano Lett, 2014, 14(9): 5110-5117. DOI:10.1021/nl501839q |
| [29] |
RAHMAN N, RAMOS-ESPIRITU L, MILNER T A, et al. Soluble adenylyl cyclase is essential for proper lysosomal acidification[J]. J Gen Physiol, 2016, 148(4): 325-339. DOI:10.1085/jgp.201611606 |
| [30] |
CHEN C C, KELLER M, HESS M, et al. A small molecule restores function to TRPML1 mutant isoforms responsible for mucolipidosis type Ⅳ[J]. Nat Commun, 2014, 5: 4681. DOI:10.1038/ncomms5681 |
 2025, Vol. 46
2025, Vol. 46


