2. 西南医科大学附属医院药学部, 泸州 646000;
3. 重庆市公共卫生医疗救治中心药学部, 重庆 400036
2. Department of Pharmacy, The Affiliated Hospital of Southwest Medical University, Luzhou 646000, Sichuan, China;
3. Department of Pharmacy, Chongqing Public Health Medical Center, Chongqing 400036, China
天冬酰胺酶(asparaginase,Aase)是一种用于治疗急性淋巴细胞白血病和其他血液系统恶性肿瘤的治疗性酶,可消耗血液中的天冬酰胺。天冬酰胺是一种生长必需氨基酸,肿瘤细胞不能合成天冬酰胺,这使天冬酰胺剥夺疗法(肿瘤因缺乏天冬酰胺而生长受到抑制)成为治疗肿瘤的有效策略[1]。此外,研究也已证明Aase是其他明显依赖细胞外天冬酰胺生长的肿瘤细胞的有效抑制剂,例如自然杀伤/T细胞淋巴瘤、乳腺癌、卵巢癌和小细胞肺癌[2]。同时,Aase对肿瘤细胞具有选择性,这可能会减少对正常细胞的损伤。然而,作为一种蛋白多肽类药物,Aase存在半衰期短、稳定性差、生物利用度低等固有缺陷,这极大地限制了Aase的临床应用。因此开发新的稳定、安全、高效的纳米递送系统具有重要意义[3]。
研究发现,经过聚乙二醇化聚磷腈纳米复合物包封的Aase稳定性提高[4];聚乳酸-羟基乙酸纳米粒包封的Aase活性提高[5],半衰期延长,免疫原性降低;麦芽糖功能化的核/壳型Fe3O4@Au纳米粒包封的Aase具有更好的稳定性[6]。目前关于Aase仿生脂质纳米递送系统的相关报道较少。环糊精脂质纳米粒是一类新型仿生纳米药物递送系统[7],但环糊精的差异会影响最终抗癌效果[2, 8]。已有文献报道,Aase被羟丙基环糊精包合后再制备成脂质纳米粒可以增加药物包封率,并提高其稳定性和生物利用度[9]。磺丁基-β-环糊精是一种具有磺丁基醚基团的聚阴离子β-环糊精衍生物,能通过非共价可逆相互作用与药物形成超分子复合物,增强纳米载体稳定性[10]。脂质纳米粒是一种具有模拟细胞膜特性、良好生物相容性的纳米载体[11],可消除生物降解等问题,已被用来递送过氧化氢酶[12]。依据上述思路,本研究制备了新型天冬酰胺酶磺丁基-β-环糊精超分子脂质纳米粒(asparaginase-loaded sulfobutyl ether-β-cyclodextrin supramolecule lipidic nanoparticle,ASLN),初步考察了ASLN的体内药代动力学行为及其对小细胞肺癌细胞株H446细胞增殖的抑制作用,为进一步研究ASLN对小细胞肺癌的治疗效果奠定基础。
1 材料和方法 1.1 材料和试剂Aase(以色列Prospec公司),磺丁基-β-环糊精(南京都莱生物技术有限公司),卵磷脂(德国Lipoid公司),胆固醇(美国Sigma公司),FBS(重庆赛米克生物科技有限公司),RPMI 1640培养基(美国Gibco公司),100×青霉素-链霉素溶液(上海碧云天生物技术有限公司),其他试剂均为分析纯。
1.2 仪器EYELAN-1300旋转蒸发仪(上海爱朗仪器有限公司),JEM-1400 Plus型透射电子显微镜(日本电子株式会社),Zetasizer Nano ZS型纳米粒度电位仪(英国Malvern公司),Varioskan LUX型多功能微孔板读数仪(中国赛默飞世尔科技有限公司)。
1.3 实验对象H446细胞购于美国模式培养物集存库,用RPMI 1640完全培养基(含10% FBS和1%青霉素-链霉素溶液)在37 ℃、5 % CO2条件下培养。体重为(200±20)g、1~2个月龄的雄性SD大鼠由重庆医科大学实验动物中心[动物生产许可证号:SCXK(渝)2018-0003]提供。
1.4 ASLN的制备采用逆相蒸发法,将适量卵磷脂、胆固醇(摩尔比1∶3)于二氯甲烷中溶解,37 ℃避光减压旋转蒸发至形成均匀薄膜。取适量乙醚溶解该薄膜后,加入含Aase的磺丁基-β-环糊精溶液超声处理至形成均匀分散体系,再次减压旋转蒸发得到均匀的乳白色混悬液,即为ASLN。
1.5 酶活性的测定Aase活性单位定义为在37 ℃、pH 7.3的特定条件下,1 min能转化1 μmol底物天冬酰胺的Aase量。采用奈斯勒试剂显色法[13]测定Aase的活性。
1.6 形态、粒径与zeta电位的测定取适量ASLN用双蒸水稀释至适当浓度后滴于铜网,采用1%磷钨酸染色,于透射电子显微镜下观察其形态。类似地,取适量ASLN用双蒸水稀释至适当浓度后使用Zetasizer Nano ZS型纳米粒度电位仪测定其粒径分布与zeta电位。
1.7 包封率的测定通过葡聚糖凝胶柱法测定ASLN的包封率[8]。取ASLN溶液加入葡聚糖凝胶G-200柱,用流速为1.0 mL/min的Tris-HCl缓冲液(pH 7.3)洗脱分离ASLN与Aase。分离的ASLN溶液加乙醚破乳后离心,其上清液加入考马斯亮蓝G-250溶液显色,测定595 nm波长处的光密度值,计算过柱后的ASLN包封Aase的含量(M1)。另取相同体积未过柱的ASLN溶液同法测定ASLN中Aase的含量(M0)。包封率(%)=M1/M0×100%。
1.8 药代动力学研究将12只雄性SD大鼠随机分为2组,每组6只,分别经尾静脉注射给予ASLN和Aase,剂量均为2.0 kU/kg。分别于给药后5 min、10 min、15 min、30 min、45 min、1 h、1.5 h、2 h、3 h、4 h、6 h、8 h、10 h、12 h、24 h、48 h时从眼眶下静脉丛取血0.3~0.5 mL,置于肝素化离心管中离心取上清液,测定ASLN和Aase活性。根据Aase活性测定结果,利用DAS 2.1.1软件计算ASLN与游离Aase的药代动力学参数。
1.9 生物等效性分析对ASLN和游离Aase的主要药代动力学参数活性-时间曲线AUC、峰浓度(Cmax)进行方差分析并计算90% CI,达峰时间(Tmax)采用Wilcoxon秩和检验,分析游离Aase与ASLN是否具有生物等效性。
1.10 细胞毒性实验通过MTT实验分析评估Aase和ASLN对小细胞肺癌细胞H446的细胞毒性。将H446细胞接种到96孔板孵育24 h。给予ASLN或Aase处理24 h后,添加MTT溶液37 ℃孵育4 h。弃去上清液,添加DMSO在摇床上低速振荡以充分溶解结晶物。用酶标仪测定490 nm波长处的光密度值,并计算H446细胞的相对细胞活力。
1.11 统计学处理采用SPSS 21.0软件进行数据分析。计量资料以x±s表示,采用独立样本t检验或Wilcoxon秩和检验进行组间比较。检验水准(α)为0.05。
2 结果 2.1 ASLN形态、粒径、zeta电位与包封率制备得到的ASLN呈球形或类球形,粒径分布和zeta电位如图 1所示,其粒径为(321.27±1.42)nm,zeta电位为(-9.31±0.42)mV。包封率为(66.46±1.57)%。
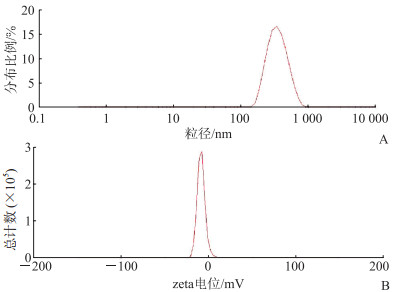
|
图 1 天冬酰胺酶磺丁基-β-环糊精超分子脂质纳米粒的粒径分布(A)和zeta电位(B) |
2.2 药代动力学评价 2.2.1 药代动力学参数
大鼠尾静脉注射游离Aase和ASLN后,其血浆Aase活性随时间变化曲线如图 2所示,ASLN组的活性-时间曲线AUC大于Aase组;静脉注射给药后,Aase组活性下降较ASLN组快,8 h后其活性几乎为0,而ASLN组活性消失较慢,24 h后其活性逐渐消失。结果表明,ASLN可延长Aase在大鼠体内的作用时间。
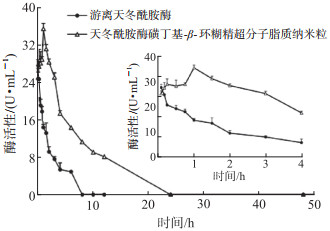
|
图 2 游离天冬酰胺酶与天冬酰胺酶磺丁基-β-环糊精超分子脂质纳米粒的活性-时间曲线 n=6, x±s. |
通过DAS 2.1.1软件计算发现Aase体内代谢过程更符合非房室模型。由ASLN和游离Aase的药代动力学参数(表 1)可知,ASLN的0~48 h活性-时间曲线AUC是游离Aase的3.46倍,表明血液循环中ASLN的保留量增加;ASLN的0~48 h平均滞留时间和峰浓度分别为游离Aase的2.11倍和1.29倍,同时游离Aase的血浆清除速率是ASLN的3.51倍,说明ASLN在血液循环中清除较慢。ASLN的相对生物利用度约为游离Aase的325.96 %。以上结果表明ASLN可延长Aase在大鼠体内的作用时间,提高Aase的生物利用度。
|
|
表 1 游离天冬酰胺酶和天冬酰胺酶磺丁基-β-环糊精超分子脂质纳米粒的主要药代动力学参数 |
2.2.2 生物等效性
ASLN的0~48 h活性-时间曲线AUC经对数转换后的90 % CI为131.4%~133.0%,超出规定范围(80%~125%),不在生物等效性标准区间范围内;另外,对ASLN和游离Aase的达峰时间进行Wilcoxon秩和检验,结果表明差异有统计学意义(P<0.05),参考生物等效性判定标准,ASLN与游离Aase生物不等效,ASLN的效果优于游离Aase。
2.3 细胞毒性评价MTT实验结果(图 3)显示,随着Aase浓度提高各组细胞存活率逐渐降低,表明Aase和ASLN可以抑制H446细胞增殖,其抑制率分别与Aase和ASLN的浓度呈正相关。与游离Aase相比,ASLN处理H446细胞后细胞存活率降低(P<0.05),表现出更强的杀伤能力和细胞毒性。
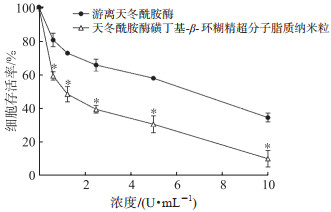
|
图 3 游离天冬酰胺酶和天冬酰胺酶磺丁基-β-环糊精超分子脂质纳米粒对H446细胞的毒性作用 *P<0.05与相同浓度游离天冬酰胺酶比较. n=3, x±s. |
3 讨论
Aase是天冬酰胺的专一水解酶,可通过降低血浆天冬酰胺水平使肿瘤微环境营养缺乏,诱发肿瘤细胞自噬,最终导致癌细胞死亡。天冬酰胺营养剥夺疗法可用于治疗多种天冬酰胺营养缺乏性肿瘤。目前已经有较多Aase纳米递送系统的相关研究,但在实际临床应用过程中其包封能力、稳定性、药代动力学、生物分布、治疗获益和安全性等问题均应充分考虑,还有大量的工作尚待进行。
本研究通过逆相蒸发法制备ASLN,其包封率(66.46%)高于Aase自组装纳米囊(55.75%)[14],表明ASLN可以提高Aase的包封率。在大鼠体内药代动力学研究中,尾静脉注射ASLN 1 h后血浆中Aase的活性最高,这与载天冬酰胺酶羟丙基-β-环糊精脂质体静脉注射1 h后出现最大活性[9]相似,说明磺丁基-β-环糊精与羟丙基-β-环糊精发挥的作用相似。ASLN的相对生物利用度约为Aase的3.26倍,而Wan等[13]制备的Aase自组装纳米囊相对生物利用度约为Aase的2.99倍,表明将Aase包载在磺丁基-β-环糊精脂质纳米粒中可提高其生物利用度。本研究发现各浓度ASLN对H446细胞均具有增殖抑制作用,其抑制效果与Gu等[2]制备的Aase仿生膜结构纳米微囊相当。ASLN提高Aase生物利用度和增强对H446细胞增殖抑制作用的可能原因如下:(1)Aase与磺丁基-β-环糊精通过非共价可逆相互作用自组装形成Aase-环糊精超分子两亲物,避免了Aase分子聚集,同时维持了Aase的有效构象,从而提高稳定性[15];(2)ASLN作为一种模拟细胞膜的纳米载体,能够将Aase-环糊精超分子两亲物固定限制在内部区域,小分子天冬酰胺和催化产物天冬氨酸很容易通过,这种微型生物反应器使Aase与底物天冬酰胺接触机会增大,从而提高了酶活性[16];(3)由于Aase被磺丁基-β-环糊精脂质纳米粒封装,与生理环境中多种代谢酶隔离,从而保持了优异的催化活性[8];(4)环糊精脂质纳米粒中Aase的递送依赖于增强的渗透性和保留效应,使Aase在靶部位有效积累[17],从而提高了肿瘤治疗效果。
综上所述,由于超分子复合物和脂质纳米粒对Aase的双重保护作用,ASLN中Aase的酶活性明显增强,生物利用度明显提高,并在肿瘤细胞中有效富集,提高了对小细胞肺癌细胞的增殖抑制效果,这为进一步研究ASLN对小细胞肺癌的治疗效果提供了理论基础。
| [1] |
时清华, 秦斌, 游松. 酶作为治疗性药物的研究进展[J]. 微生物学通报, 2020, 47(7): 2193-2206. DOI:10.13344/j.microbiol.china.200238 |
| [2] |
GU J, HUANG Y, YAN Z, et al. Biomimetic membrane-structured nanovesicles carrying a supramolecular enzyme to cure lung cancer[J]. ACS Appl Mater Interfaces, 2020, 12(28): 31112-31123. DOI:10.1021/acsami.0c06207 |
| [3] |
陈冉, 王婷婷, 李开铃, 等. 免疫调节抗病毒中药的特性与应用[J]. 中草药, 2020, 51(6): 1412-1426. DOI:10.7501/j.issn.0253-2670.2020.06.006 |
| [4] |
ANDRIANOV A K, MARIN A, MARTINEZ A P, et al. Hydrolytically degradable PEGylated polyelectrolyte nano complexes for protein delivery[J]. Biomacromolecules, 2018, 19(8): 3467-3478. DOI:10.1021/acs.biomac.8b00785 |
| [5] |
BRITO A E M, PESSOA A, CONVERTI A, et al. Poly (lactic-co-glycolic acid) nanospheres allow for high L-asparaginase encapsulation yield and activity[J]. Mater Sci Eng C Mater Biol Appl, 2019, 98: 524-534. DOI:10.1016/j.msec.2019.01.003 |
| [6] |
TARHAN T, ULU A, SARIÇAM M, et al. Maltose functionalized magnetic core/shell Fe3O4@Au nanoparticles for an efficient L-asparaginase immobilization[J]. Int J Biol Macromol, 2020, 142: 443-451. DOI:10.1016/j.ijbiomac.2019.09.116 |
| [7] |
黄永佳, 杨林, 李瑶, 等. 天冬酰胺酶-吴茱萸碱核壳型脂质纳米粒的药动学研究[J]. 中国药理学通报, 2019, 35(9): 1284-1289. DOI:10.3969/j.issn.1001-1978.2019.09.019 |
| [8] |
HUANG Y, GU J, YAN Z, et al. Cytomembrane-mimicking nanocarriers with a scaffold consisting of a CD44-targeted endogenous component for effective asparaginase supramolecule delivery[J]. Nanoscale, 2020, 12(22): 12083-12097. DOI:10.1039/d0nr02588g |
| [9] |
万胜利, 何丹, 晏子俊, 等. 载天冬酰胺酶羟丙基-β-环糊精脂质体的理化特性和药代动力学[J]. 第二军医大学学报, 2019, 40(6): 700-703. WAN S L, HE D, YAN Z J, et al. Physicochemical properties and pharmacokinetics of hydroxypropyl-β-cyclodextrin liposomes containing L-asparaginase[J]. Acad J Sec Mil Med Univ, 2019, 40(6): 700-703. DOI:10.16781/j.0258-879x.2019.06.0700 |
| [10] |
ZHANG X, MA X, WANG K, et al. Recent advances in cyclodextrin-based light-responsive supramolecular systems[J]. Macromol Rapid Commun, 2018, 39(11): e1800142. DOI:10.1002/marc.201800142 |
| [11] |
李嫄, 赵静, 余忠姝, 等. 壳聚糖包覆姜黄素脂质体体外释放和药代动力学研究[J]. 中国药理学通报, 2018, 34(6): 810-814. DOI:10.3969/j.issn.1001-1978.2018.06.014 |
| [12] |
SHI C, LI M, ZHANG Z, et al. Catalase-based liposomal for reversing immunosuppressive tumor microenvironment and enhanced cancer chemo-photodynamic therapy[J]. Biomaterials, 2020, 233: 119755. DOI:10.1016/j.biomaterials.2020.119755 |
| [13] |
WAN S, HE D, YUAN Y, et al. Chitosan-modified lipid nanovesicles for efficient systemic delivery of L-asparaginase[J]. Colloids Surf B Biointerfaces, 2016, 143: 278-284. DOI:10.1016/j.colsurfb.2016.03.046 |
| [14] |
谢江川, 胡雪原, 晏子俊, 等. 载天冬酰胺酶自组装纳米囊的药动学及生物等效性[J]. 第二军医大学学报, 2016, 37(6): 690-693. XIE J C, HU X Y, YAN Z J, et al. Pharmacokinetics and bioequivalence of self-assembly nanocapsules loaded with asparaginase[J]. Acad J Sec Mil Med Univ, 2016, 37(6): 690-693. DOI:10.16781/j.0258-879x.2016.06.0690 |
| [15] |
FAROOQ M A, HUANG X, JABEEN A, et al. Enhanced cellular uptake and cytotoxicity of vorinostat through encapsulation in TPGS-modified liposomes[J]. Colloids Surf B Biointerfaces, 2021, 199: 111523. DOI:10.1016/j.colsurfb.2020.111523 |
| [16] |
YANG L, ZHANG Y, XIE J, et al. Biomimetic polysaccharide-cloaked lipidic nanovesicles/microassemblies for improving the enzymatic activity and prolonging the action time for hyperuricemia treatment[J]. Nanoscale, 2020, 12(28): 15222-15235. DOI:10.1039/D0NR02651D |
| [17] |
PAN T, ZHOU Q, MIAO K, et al. Suppressing Sart1 to modulate macrophage polarization by siRNA-loaded liposomes: a promising therapeutic strategy for pulmonary fibrosis[J]. Theranostics, 2021, 11(3): 1192-1206. DOI:10.7150/thno.48152 |
 2024, Vol. 45
2024, Vol. 45


