2. 阿尔伯特爱因斯坦医学院糖尿病研究中心, 纽约 10461
2. Diabetes Research Center, Albert Einstein College of Medicine, New York 10461, USA
转运蛋白颗粒复合物亚基11(trafficking protein particle complex subunit 11,TRAPPC11)参与内质网到高尔基体间的囊泡转运,由TRAPPC11基因突变引起的疾病称为TRAPPC11相关病变。TRAPPC11相关病变是包含肌肉、眼、大脑和肝脏等多个组织器官的病变,其中由TRAPPC11突变引起的肌肉相关疾病已被确认是一种罕见性肢带型肌营养不良症,主要表现为近端肌肌无力[1-2]。在多种细胞系或斑马鱼中的研究发现,TRAPPC11基因敲降或突变通常与高尔基体结构完整性改变[3]、囊泡运输障碍[1]、蛋白质糖基化水平降低[4-6]、自噬抑制[7-8]等生理生化过程密切相关,但尚未见该基因在哺乳动物模型中具体功能的研究报道。
目前有关TRAPPC11在哺乳动物体内的功能研究尚缺乏有效的敲除鼠模型,不同组织中TRAPPC11的生理功能及病理生理学作用亦不清楚。本研究拟分步利用CRISPR/Cas9和Cre/loxP技术建立Trappc11诱导型全身性基因敲除小鼠模型,为探索Trappc11的体内功能及其与多系统疾病的关系奠定基础。
1 材料和方法 1.1 实验动物本实验所用动物均由上海南方模式生物科技股份有限公司[动物生产许可证号:SCXK(沪)2019-0002]提供,饲养于延安大学医学实验中心SPF级动物房。饲养期间小鼠自由饮水,饲喂普通维持饲料(江苏省协同医药生物工程有限责任公司)。饲养环境:昼夜各半循环照明,湿度恒定,温度22~25 ℃。所有操作均符合延安大学伦理学要求(审批号:YAU-G20230034)。
1.2 主要试剂与仪器Taq DNA聚合酶(货号:B532062)购自生工生物工程(上海)股份有限公司,鼠尾基因型鉴定试剂盒(货号:MF280-01)购自北京聚合美生物科技有限公司,他莫昔芬(货号:10540-29-1)购自美国Sigma公司,玉米油(货号:F2214830)购自上海阿拉丁生化科技股份有限公司。核酸凝胶电泳系统及成像系统为美国Bio-Rad公司产品,Nano-100微量分光光度计为杭州奥盛仪器有限公司产品。
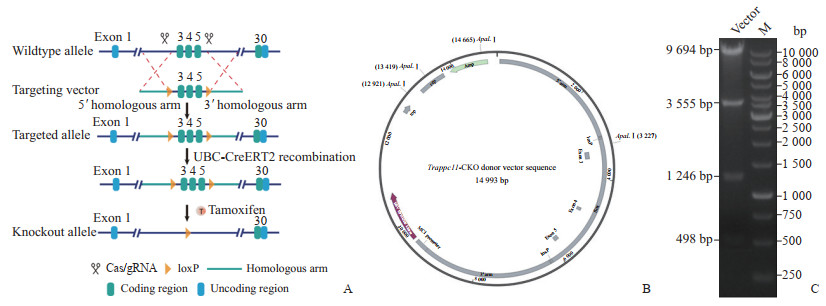
1.3 靶序列的选择及Trappc11同源重组载体的构建根据美国国家生物技术信息中心数据库上的序列信息,Trappc11转录本共包含30个外显子,选择Trappc11的外显子3~5为flox区域(图 1A),敲除该区域理论上会引起读码框移码突变,使翻译提前终止,从而导致蛋白质突变。通过无缝克隆(in-fusion cloning)的方法构建同源重组载体,该载体包含3.0 kb的5'同源臂、3.1 kb的flox区域和2.9 kb的3'同源臂(图 1B),用限制性内切酶进行酶切及DNA测序分析鉴定是否构建成功。
|
图 1 Trappc11 基因打靶路线图及同源重组载体的鉴定 A:Trappc11敲除过程示意图,Trappc11外显子3~5选为敲除区域;B:同源重组载体图谱,该载体包含3.0 kb的5'同源臂、3.1 kb的flox区域和2.9 kb的3'同源臂;C:载体ApaLⅠ酶切鉴定电泳结果,理论条带大小为9 694、3 555、1 246、498 bp. Trappc11:转运蛋白颗粒复合物亚基11;M:DNA梯状条带. |
1.4 Trappc11条件性敲除小鼠的构建与鉴定
通过体外转录获得Cas9 mRNA和gRNA,将Cas9 mRNA、gRNA和Trappc11同源重组载体显微注射到C57BL/6J小鼠的受精卵中,然后将注射后的受精卵移植到假孕母鼠中,母鼠分娩后获得F0代小鼠。通过PCR扩增及测序筛选得到F0代阳性小鼠,将F0代阳性小鼠与C57BL/6J野生型小鼠交配、繁殖,获得阳性F1代小鼠(Trappc11flox/+)。将同基因型的阳性F1代雌、雄小鼠进行交配、繁殖,得到Trappc11条件性敲除小鼠(Trappc11flox/flox)。
1.5 Trappc11诱导型全身性敲除小鼠的繁育与鉴定UBC-CreERT2小鼠(JAX Stock #007001)可在他莫昔芬诱导下全身性表达具有活性的Cre重组酶。将Trappc11flox/+小鼠与UBC-CreERT2小鼠进行交配获得Trappc11flox/+UBC-CreERT2+杂合子小鼠,然后将所获杂合子小鼠与Trappc11flox/flox小鼠交配,经过繁育可得到基因型为Trappc11flox/floxUBC-CreERT2+的Trappc11诱导型全身性基因敲除小鼠。
1.6 小鼠基因型鉴定取3周龄小鼠尾组织,提取基因组DNA进行PCR鉴定。针对Trappc11外显子3~5的上游loxP位点设计基因型鉴定引物,可从野生型、重组的等位基因中分别扩增出330 bp和394 bp的PCR产物。PCR反应条件:95 ℃ 3 min;95 ℃ 15 s、60 ℃ 15 s、72 ℃ 1 min,共35个循环;72 ℃ 5 min。UBC-CreERT2的基因型鉴定方法参见Jax lab网站( https://www.jax.org/strain/007001)。
2 结果 2.1 Trappc11同源重组载体的构建及鉴定通过无缝克隆的方法构建同源重组载体,经限制性内切酶的酶切鉴定(图 1C)及DNA测序分析证明Trappc11同源重组载体构建成功。
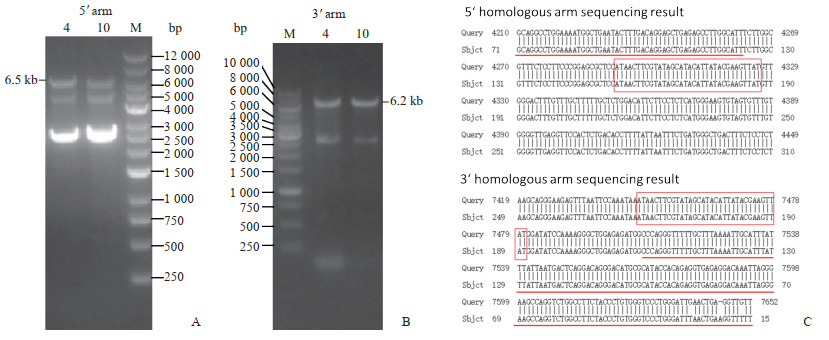
2.2 F0代阳性鼠鉴定将Cas9 mRNA、gRNA和Trappc11同源重组载体显微注射到C57BL/6J小鼠的受精卵中,然后将注射后的受精卵移植到假孕母鼠中,约21 d后获得F0代小鼠。设计PCR鉴定引物,理论上5'臂同源重组阳性基因组应扩增出6.5 kb片段,阴性基因组应扩增出9.4 kb片段;3'臂同源重组阳性基因组应扩增出6.2 kb片段,阴性基因组应扩增出9.6 kb片段。通过PCR扩增及测序对其进行鉴定筛选得到4号和10号F0代阳性小鼠(图 2)。
|
图 2 F0代阳性小鼠PCR鉴定及测序分析 A,B:阳性F0代小鼠PCR鉴定电泳图,4和10分别为对应编号F0代阳性小鼠的鼠尾基因组样品,5'臂同源重组阳性基因组应扩增出6.5 kb片段,3'臂同源重组阳性基因组应扩增出6.2 kb片段;C:阳性F0代小鼠测序鉴定结果,“Query”代表理论序列,“Sbjct”代表鼠尾基因测序结果,红框里为loxP序列,红线上面分别为5'同源臂序列和3'同源臂序列. PCR:聚合酶链反应;M:DNA梯状条带. |
2.3 Trappc11条件性敲除小鼠的获得与繁育
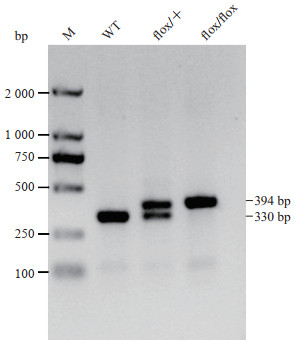
受精卵早期卵裂速度很快,因此得到的F0代阳性小鼠通常为嵌合体,不一定具备稳定遗传的能力,需要进行传代以获得可稳定遗传的F1代小鼠。PCR扩增及测序鉴定为阳性的F0代小鼠与C57BL/6J野生型小鼠交配获得阳性F1代小鼠(Trappc11flox/+)。同基因型的阳性F1代雌、雄小鼠繁育即可得到Trappc11条件性敲除小鼠(Trappc11flox/flox)。如图 3所示,loxP位点插入前,野生型基因型鉴定PCR产物为单一的330 bp条带,而在loxP位点插入后PCR产物大小为394 bp,因此在杂合子(flox/+)中会同时扩增出330 bp和394 bp两个条带,而纯合子(flox/flox)中只有394 bp一个条带,由此来区分不同的基因型。
|
图 3 Trappc11条件性敲除小鼠基因型鉴定 插入loxP位点后PCR的产物大小有330 bp和394 bp两种,只有一条330 bp条带的为野生型(WT),同时扩增出330 bp和394 bp的为杂合子(flox/+),只有一条394 bp条带的为纯合子(flox/flox). Trappc11:转运蛋白颗粒复合物亚基11;PCR:聚合酶链反应;M:DNA梯状条带. |
2.4 Trappc11诱导型全身性基因敲除小鼠的获得与鉴定
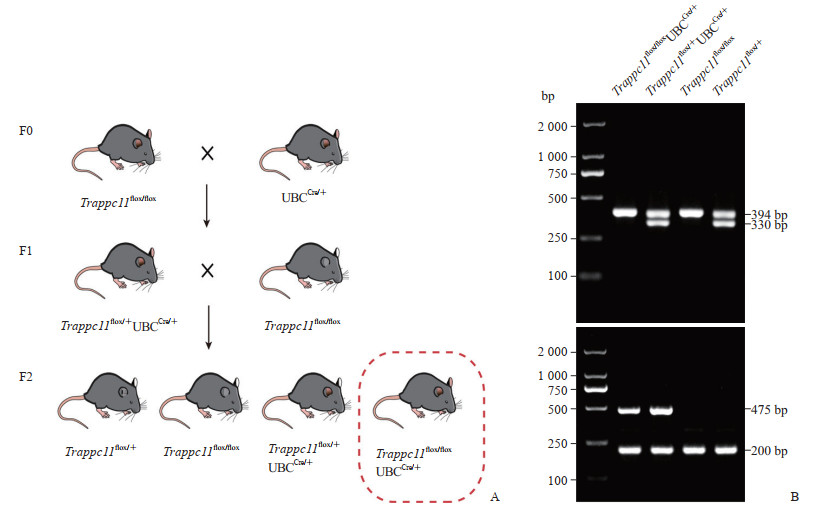
将Trappc11flox/+小鼠与UBC-CreERT2小鼠进行交配,获得Trappc11flox/+UBC-CreERT2+杂合子小鼠,然后将所获杂合子小鼠与Trappc11flox/flox小鼠交配获得Trappc11flox/floxUBC-CreERT2+纯合子小鼠,即为Trappc11诱导型全身性敲除小鼠。在雌激素诱导后,Cre蛋白会进入细胞核识别Trappc11外显子3~5两侧的loxP位点并发生重组,从而实现对Trappc11的时间特异性敲除。为便于快速批量分析基因型,本研究针对Trappc11外显子3~5上游的loxP位点设计了基因型鉴定引物,可分别从野生型和重组Trappc11等位基因中扩增出330 bp和394 bp的DNA条带(图 4),结合Cre的鉴定结果(对照:200 bp;Cre:475 bp)可快速判断小鼠的基因型。另外,他莫昔芬诱导后提取代表性组织骨骼肌基因组DNA,在Trappc11外显子3~5两侧设计引物进行PCR,结果显示Trappc11基因被敲除。经过初步的表型筛选发现基因敲除小鼠相比于野生型小鼠出现了体重下降和采食量减少的现象。
|
图 4 Trappc11诱导型全身性基因敲除小鼠繁育策略及基因型鉴定 A:Trappc11诱导型全身性基因敲除小鼠繁育策略,首先将得到的flox纯合子小鼠与UBC-CreERT2工具小鼠繁殖得到诱导型半敲除杂合子小鼠,然后再将其与flox纯合子小鼠繁殖一代即可得到Trappc11诱导型全身性敲除小鼠(基因型为Trappc11flox/flox UBC-CreERT2+);B:Trappc11诱导型全身性基因敲除小鼠基因型PCR鉴定结果. Trappc11:转运蛋白颗粒复合物亚基11;PCR:聚合酶链反应;M:DNA梯状条带带. |
3 讨论
TRAPPC11同源基因突变的斑马鱼表现出肝脏肿大、脂肪变性、肌营养不良等表型[9-10]。在人类中,TRAPPC11突变个体不同程度患有肢带型肌营养不良症、发育迟缓、脂肪肝、运动障碍、视觉发育缺陷和认知障碍等疾病[11-13]。由此可见,TRAPPC11基因与人类多种疾病的发生相关,然而目前尚未见有可用的小鼠模型,制约了对TRAPPC11基因在相关疾病发生、发展中的作用及机制的解析。国际基因敲除小鼠表型计划(Knockout Mouse Phenotyping Program,KOMP)对小鼠Trappc11基因进行全身性敲除后发现,纯合子敲除鼠会出现胚胎期(E9.5)致死或断奶前致死现象,杂合子敲除小鼠出现了听力受损、血液循环中肌酐水平升高等表型。最近的一项大规模人群全外显子组关联研究显示,TRAPPC11基因变异与重度抑郁症的发生密切相关,提示该基因在神经系统中具有潜在作用[14];在人成纤维细胞和宫颈癌细胞(HeLa细胞)中突变或敲除TRAPPC11基因会引起脂质在细胞中大量积累[15],这与在斑马鱼中的相关研究结果[9]一致。在动物科学领域的一项全基因组关联研究中发现,Trappc11基因位点单核苷酸多态性与牛胴体脂肪含量存在高度相关性,亦表明Trappc11在调节脂代谢中发挥重要作用[16]。另外一项在人群中进行的全外显子组测序研究显示,TRAPPC11与左心室肥厚和早发性缺血性脑卒中存在潜在相关性[17]。这些结果提示TRAPPC11在不同的组织细胞中对疾病的发生、发展有着不同的作用,在机体内具有复杂多样的功能。
本研究利用CRISPR/Cas9技术建立了Trappc11基因条件性敲除小鼠模型,之后基于Cre/loxP原理将Trappc11flox/+小鼠与UBC-CreERT2小鼠交配获得Trappc11诱导型全身性基因敲除小鼠模型。CreERT2是将人工改造的雌激素受体的配体结合区与Cre重组酶相融合形成的定位于细胞质中的融合蛋白,只有在雌激素诱导后融合蛋白上的Cre重组酶才会通过构象变化从锚定蛋白热激蛋白90上解离下来进入细胞核,识别loxP位点并发生重组反应,因此可以通过控制雌激素的注射时间实现对基因重组时间的特异性调控[18]。本研究首先通过体外转录获得Cas9 mRNA和gRNA,再通过无缝克隆的方法构建同源重组载体(包含3.0 kb的5'同源臂、3.1 kb的flox区域和2.9 kb的3'同源臂),将Cas9 mRNA、gRNA和同源重组载体显微注射到C57BL/6J小鼠的受精卵中,获得F0代小鼠;然后将经PCR扩增及测序鉴定为阳性的F0代嵌合小鼠与C57BL/6J小鼠交配,获得阳性F1代稳定遗传小鼠;最后再将其与UBC-CreERT2小鼠交配,成功构建了Trappc11诱导型全身性基因敲除小鼠模型。
综上所述,本研究利用CRISPR/Cas9和Cre/loxP技术成功建立了Trappc11诱导型基因敲除小鼠模型,克服了Trappc11全身性敲除小鼠致死的缺点,为揭示TRAPPC11的生理功能和病理生理学意义提供了重要工具。
| [1] |
SACHER M, SHAHRZAD N, KAMEL H, et al. TRAPPopathies: an emerging set of disorders linked to variations in the genes encoding transport protein particle (TRAPP)-associated proteins[J]. Traffic, 2019, 20(1): 5-26. DOI:10.1111/tra.12615 |
| [2] |
BOBADILLA E, JULIA N, JIMENEZ-MALLEBRERA C, et al. Limb girdle muscular dystrophies: P.167.TRAPPC11-opathies: an emerging phenotype of muscle-eye-brain-liver[J]. Neuromuscul Disord, 2019, 29(S1): S97. DOI:10.1016/j.nmd.2019.06.222 |
| [3] |
SCRIVENS P J, NOUEIHED B, SHAHRZAD N, et al. C4orf41 and TTC-15 are mammalian TRAPP components with a role at an early stage in ER-to-Golgi trafficking[J]. Mol Biol Cell, 2011, 22(12): 2083-2093. DOI:10.1091/mbc.E10-11-0873 |
| [4] |
MUNOT P, MCCREA N, TORELLI S, et al. TRAPPC11-related muscular dystrophy with hypoglycosylation of alpha-dystroglycan in skeletal muscle and brain[J]. Neuropathol Appl Neurobiol, 2022, 48(2): e12771. DOI:10.1111/nan.12771 |
| [5] |
MATALONGA L, BRAVO M, SERRA-PEINADO C, et al. Mutations in TRAPPC11 are associated with a congenital disorder of glycosylation[J]. Hum Mutat, 2017, 38(2): 148-151. DOI:10.1002/humu.23145 |
| [6] |
LARSON A A, BAKER 2nd P R, MILEV M P, et al. TRAPPC11 and GOSR2 mutations associate with hypoglycosylation of α-dystroglycan and muscular dystrophy[J]. Skelet Muscle, 2018, 8(1): 17. DOI:10.1186/s13395-018-0163-0 |
| [7] |
STANGA D, ZHAO Q, MILEV M P, et al. TRAPPC11 functions in autophagy by recruiting ATG2B-WIPI4/WDR45 to preautophagosomal membranes[J]. Traffic, 2019, 20(5): 325-345. DOI:10.1111/tra.12640 |
| [8] |
ZHAO Q. BioID indicates the involvement of the TRAPP protein TrappC11 in autophagy[D/OL]. Montreal: Concordia University, 2016[2023-05-12]. https://spectrum.library.concordia.ca/id/eprint/982017/.
|
| [9] |
SADLER K C, AMSTERDAM A, SOROKA C, et al. A genetic screen in zebrafish identifies the mutants vps18, nf2 and foie gras as models of liver disease[J]. Development, 2005, 132(15): 3561-3572. DOI:10.1242/dev.01918 |
| [10] |
ULHAQ Z S, OGINO Y, TSE W K F. FGF8 rescues motor deficits in zebrafish model of limb-girdle muscular dystrophy R18[J]. Biochem Biophys Res Commun, 2023, 652: 76-83. DOI:10.1016/j.bbrc.2023.02.046 |
| [11] |
LIANG W C, ZHU W, MITSUHASHI S, et al. Congenital muscular dystrophy with fatty liver and infantile-onset cataract caused by TRAPPC11 mutations: broadening of the phenotype[J]. Skelet Muscle, 2015, 5: 29. DOI:10.1186/s13395-015-0056-4 |
| [12] |
CHEN Q, ZHENG W, XU H, et al. Digenic variants in the TTN and TRAPPC11 genes co-segregating with a limb-girdle muscular dystrophy in a Han Chinese family[J]. Front Neurosci, 2021, 15: 601757. DOI:10.3389/fnins.2021.601757 |
| [13] |
JUSTEL M, JOU C, SARIEGO-JAMARDO A, et al. Expanding the phenotypic spectrum of TRAPPC11-related muscular dystrophy: 25 Roma individuals carrying a founder variant[J]. J Med Genet, 2023, 60(10): 965-973. DOI:10.1136/jmg-2022-109132 |
| [14] |
CHENG S, CHENG B, LIU L, et al. Exome-wide screening identifies novel rare risk variants for major depression disorder[J]. Mol Psychiatry, 2022, 27(7): 3069-3074. DOI:10.1038/s41380-022-01536-4 |
| [15] |
DEROSSI C, VACARU A, RAFIQ R, et al. Trappc11 is required for protein glycosylation in zebrafish and humans[J]. Mol Biol Cell, 2016, 27(8): 1220-1234. DOI:10.1091/mbc.E15-08-0557 |
| [16] |
MARTINS R, BRITO L F, MACHADO P C, et al. Genome-wide association study and pathway analysis for carcass fatness in Nellore cattle measured by ultrasound[J]. Anim Genet, 2021, 52(5): 730-733. DOI:10.1111/age.13129 |
| [17] |
JAWOREK T, RYAN K A, GAYNOR B J, et al. Exome array analysis of early-onset ischemic stroke[J]. Stroke, 2020, 51(11): 3356-3360. DOI:10.1161/STROKEAHA.120.031357 |
| [18] |
LÓPEZ I P, RODRIGUEZ-DE LA ROSA L, PAIS R S, et al. Differential organ phenotypes after postnatal Igf1r gene conditional deletion induced by tamoxifen in UBC-CreERT2; Igf1r fl/fl double transgenic mice[J]. Transgenic Res, 2015, 24(2): 279-294. DOI:10.1007/s11248-014-9837-5 |
 2024, Vol. 45
2024, Vol. 45


