2. 西交利物浦大学智能工程学院, 苏州 215123;
3. 利物浦大学计算机科学系, 利物浦 L693BX;
4. 首都医科大学附属北京朝阳医院超声医学科, 北京 100020;
5. 保定骨科医院普外科, 保定 071000;
6. 湖南师范大学工程与设计学院电子工程系, 长沙 410081
2. School of Advanced Technology, Xi'an Jiaotong-Liverpool University, Suzhou 215123, Jiangsu, China;
3. Department of Computer Science, University of Liverpool, Liverpool L693BX, England;
4. Department of Ultrasound, Beijing Chao-yang Hospital, Capital Medical University, Beijing 100020, China;
5. Department of General Surgery, Baoding Orthopaedics Hospital, Baoding 071000, Hebei, China;
6. Department of Electronic Engineering, School of Engineering and Design, Hunan Normal University, Changsha 410081, Hunan, China
下腔静脉(inferior vena cava,IVC)对容量变化敏感,下腔静脉塌陷指数(inferior vena cava collapsibility index,IVC-CI)可反映呼吸前后IVC直径变化,在血容量不足时IVC-CI显著增加,提示存在内出血的可能并预警休克[1]。与传统检查方式相比,超声检查具有快捷、无创等优点,临床上常用来快速检查患者状态[2]。IVC的超声测量方法是在IVC切面中测量距离肝静脉2 cm处的IVC直径,获得呼吸周期内IVC直径最值,并计算呼吸变异度[3]。IVC超声测量方法因其易获得性和可重复性被广泛作为容量评估方法使用,呼吸状态下超声测量的IVC直径、呼吸变异度和IVC-CI等均受到临床医师认可,测量结果还可以辅助危重通气患者的液体治疗及液体反应性的动态估计[4-5]。然而,IVC超声测量结果高度依赖于医师技术与经验,超声操作培训的不足与医师超声图像知识的缺乏会导致采集的超声图像质量较差,测量结果与实际偏差较大,这在经济不发达地区尤为明显[6]。目前IVC超声测量缺少统一标准,在临床中存在横向与纵向2种测量方式,不同测量方式会对指标结果和临床诊断产生影响[6-9]。此外,人工测量结果误差大,超声操作环节中人为误差引入过多,医师认知与操作存在差异性,导致IVC超声测量指标不通用且结果差别大[9]。
为解决上述问题,近年来发展出了计算机辅助IVC超声测量技术。基于图像处理的IVC测量实现了追踪IVC变化与测量IVC直径,但是需要操作者手动标记IVC区域[7-10]。在半自动测量算法中,有学者提出根据移动的IVC中线来确定IVC区域的方法,同样需要人工识别中线或输入2个标记以确定IVC中线,随后追踪IVC变化及测量直径[11-14]。一些算法已经利用IVC在超声影像中的结构特征实现识别,在识别基础上根据血管壁与血管灰度值变化明显的特点实现定位与测量[15-17]。上述算法虽然实现了IVC的自动测量,但是IVC识别依然需要手动输入参考,使IVC半自动化算法无法避免人为误差的影响,降低了算法识别的准确率与效率,因此,需要一种全自动化超声测量算法实现自动人体IVC超声识别与定位。本研究基于ICU患者IVC动态超声数据,提出了一种基于拓扑结构与自动跟踪算法的IVC识别与定位方法。
1 资料和方法 1.1 病例资料与超声图像采集收集首都医科大学附属北京朝阳医院2022年6月至2023年4月入院的18例ICU患者的IVC超声影像数据,其中男9例、女9例,年龄为16~66(45±10)岁。使用APL IO 500 TUS-A500型超声仪(日本TOSHIBA公司)进行影像采集,该仪器可将图像以AVI或DICOM格式输出,配有腹部超声探头,探头中心频率为1~5 MHz。由3位来自首都医科大学附属北京朝阳医院、拥有5年以上操作经验的超声医师进行数据采集,并使用RadiAnt DICOM Viewer 4.6.9软件进行IVC人工识别与定位测量。该软件可将视频分解为图片,且具备测距与标注功能,能够大幅度减小测量结果的人工误差。
超声影像采集流程:(1)患者取仰卧位,保持静息状态;(2)在整个数据采集过程中监测收缩压、舒张压、心率、平均动脉压和核心温度等生理信号;(3)医师将超声换能器置于患者腹部或肋下部,将超声耦合剂涂抹至体表以减少超声损耗,不断调整探头位置,最终在纵向视图中识别IVC;(4)确定IVC后,调整探头使IVC平行于水平面,且IVC与肝静脉汇合处位于图像左侧,并保持探头位置;(5)距离IVC与肝静脉汇合处2 cm为IVC观测点,通过B模式采集IVC在呼吸运动中的IVC最大扩张或收缩图像3帧及1段影像视频,该视频覆盖5~6个呼吸周期;(6)再次调整探头位置,并重复步骤(4)和(5)2次;(7)每次测量结束将DICOM格式数据存储在超声仪上,数据采集结束后下载到计算机存储。
本研究纳入患者的生理状态较差,且IVC病变呈现出不同特点,如IVC直径变化幅度不一、呼吸变异度差异较大甚至图像出现上下血管壁粘连,因此经医师筛选后排除部分图像。图像排除标准:(1)IVC与肝静脉汇合处不在图像内;(2)IVC随呼吸变化幅度较大或出现血管壁粘连;(3)图像噪声较大,人工识别IVC困难。
共采集18组超声数据集,每组数据集包括3帧影像(分别用于医师识别、定位并测量IVC数据)及1段超声影像视频,该片段包括5~6个呼吸周期,平均时长12 s。每组数据集均由同一位医师在相同的超声扫描环境中、使用相同仪器与探头采集获得并进行人工标注。
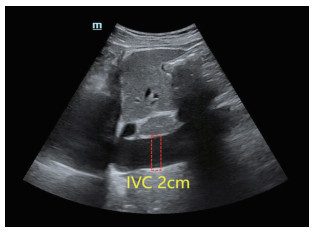
1.2 IVC人工标注与直径测量在每组数据集中的3帧超声图像上放置标记Pi(i=1, 2, 3)表示IVC定位。标记位于距离肝静脉汇合处2 cm(图 1),取3个标记的坐标平均值作为定位点μm(m为每组数据集序号)。在单帧超声图像上测量IVC直径时,首先放置参考线,该线与IVC上、下血管壁边界垂直,参考线位于先前定位点μm位置。沿参考线从IVC血管壁上边界到血管壁下边界的距离即为IVC直径。为减少人工测量误差,对每帧影像进行3次测量,取平均值为最终人工测量结果。
|
图 1 IVC超声影像 Fig 1 IVC ultrasound image The red dashed box indicates where the doctor measured the vessel diameter. "IVC 2cm" indicates the measurement distance of 2 cm from the hepatic vein. "m" is the serial number. IVC: Inferior vena cava. |
1.3 IVC自动识别与定位测量 1.3.1 图像处理
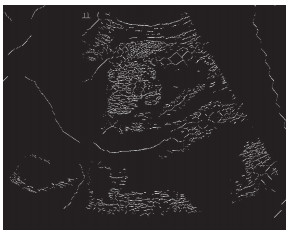
提前将超声数据集拆分为单帧,对单帧图像进行预处理,在保留重要信息的同时减小数据规模,确保在计算资源受限的便携式和手持式超声设备中使用。预处理主要有3个步骤:(1)将超声设备输出的原始非灰度图像转化为灰度图,由于同一超声片段的单帧图像具有相似的灰度分布特征,故采用单一阈值进行二值化处理(图 2)。阈值选择为数据采集后人为指定,以便算法中直接生成二值图。(2)数据增强,即对二值数据进行腐蚀膨胀,使用OpenCV库中腐蚀膨胀函数生成轮廓图像。(3)为了便于IVC识别,使用基于拓扑结构的细化算法将图像处理为骨架图像,记为In(图 3)。

|
图 2 图像二值化图 Fig 2 Binary image "m" is the serial number. |
|
图 3 输出骨架图 Fig 3 Skeleton image |
1.3.2 IVC自动识别
IVC自动识别原理如下:(1)在拓扑结构中,IVC血管壁为所有连续线段中最长的一段,满足IVC长度远大于宽度条件;(2)选定最长线段作为IVC上边界或下边界。
在骨架图中使用医师在单帧中确定的IVC起点,通过静态识别结合IVC生理特征方法进行IVC识别,方法为
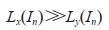
|
(1) |
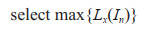
|
(2) |
其中Lx、Ly分别表示结构水平与竖直方向长度,In表示当前骨架图。
在骨架图中血管壁边界线是中心线上下的2条长线段,并且与中心线距离相同,首先选定骨架图中的最长线段认定为IVC的第1条边界。根据边界结合已知的起点与生理特征,将第1条边界与起点连线方向范围内的最长线段认定为IVC的第2条边界,通过算法计算2条边界到中心线起点的距离,若距离差值在2条边界距离人工计算的标准差(s)之内,则认定算法识别成功,并根据边界生成IVC中心线。
1.3.3 IVC自动定位与直径测量基于识别获得的中心线与血管边界,采用以下方法定位IVC:(1)根据单帧图像血管上、下边界生成跟踪框;(2)利用跟踪框跟踪数据集,输出每帧图像上IVC直径的测量值。
在第1帧图像中,IVC识别已经获取血管边界与中心线,算法从起点开始,沿中心线移动74个像素长度,标记该位置为2 cm位置,记为μn。IVC上、下边界上与μn水平坐标相同的点表示为接触点,记为Pu、Pl。以Pu和Pl为参考,生成2个分别包含接触点的矩形,分别记为wu、wl。wu或wl分别覆盖IVC部分区域(矩形高度的1/3)及上或下IVC血管壁(矩形高度的2/3)。基于覆盖尽可能多的IVC血管壁信息原则确定窗口覆盖的IVC区域和血管壁的比例,如图 4所示。
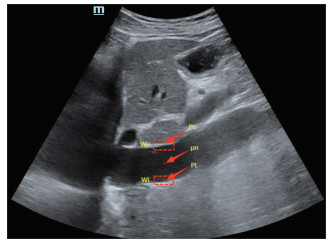
|
图 4 IVC超声影像生成2个跟踪框(红色虚线框) Fig 4 Two tracking rims (red dashed boxes) based on IVC ultrasound image "m" is the serial number. Wu: The rectangle contains contact points of the upper boundary; WL: The rectangle contains contact points of the lower boundary; Pu: The contact points of the upper boundary; μn: Midpoint of the 2 cm position; PL: The contact points of the lower boundary; IVC: Inferior vena cava. |
跟踪阶段使用核相关滤波(kernelized correlation filter,KCF)算法。相关是用于度量两个信号的相似程度,信号越相似相关性越高。算法在跟踪过程中设置一个滤波模型,使应用在跟踪目标时输出响应最大,目标位置即为响应最大位置。KCF算法在相关算法基础上使用核函数将样本映射到核空间,对所有位置进行同时计算,快速检测跟踪目标位置。
使用2个跟踪框遍历数据集所有图像。在一段超声数据集中,IVC随呼吸连续变化,2个跟踪框遍历输出IVC的坐标和直径变化量,且跟随每一帧变化自动更新坐标值。
定位目标为IVC 2 cm位置,算法采用直接计算方式获取定位结果,记为μm。
在直接计算方法中,使用数据集每一帧直接定位IVC。根据wu和wl在水平垂直方向上的位置动态变化确定2 cm参考点位置,即
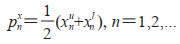
|
(3) |
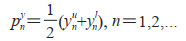
|
(4) |
其中,pnx和pny分别为第n帧图像上算法参考点在水平方向和竖直方向上的坐标,xnu和xnl分别是wu和wl的中心在第n帧图像上的水平方向坐标,ynu和ynl分别是wu和wl的中心在第n帧图像上的垂直方向坐标。
算法自动获取该帧的IVC定位坐标,坐标为第n帧图像上跟踪框之间的横坐标与纵坐标中值,即
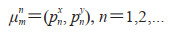
|
(5) |
每帧的IVC定位位置将被保存,其变化将显示在相对于帧的图像中,并在跟踪完成后显示。
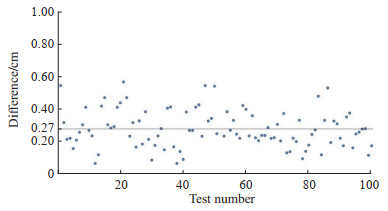
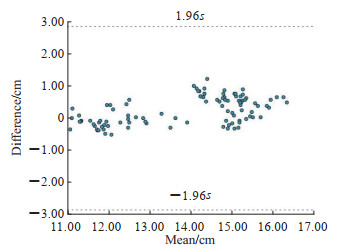
2 结果算法和人工识别IVC的数量分别为17、18个,算法识别准确率达到94.44%(17/18);Bland-Altman方法显示IVC直径自动测量结果的误差在±1.96s范围内,证明IVC直径自动测量方法可替代人工测量方法。使用定位坐标距离作为算法定位与人工定位指标,即‖μa-μm‖,选用100算法定位坐标μm的差值分析结果(图 5)及全部数据集算法定位与人工方法的对比结果(图 6)均表明算法定位可以代替人工定位方法。
|
图 5 自动方法定位IVC差值 Fig 5 Difference of IVC located by automated method IVC: Inferior vena cava. |
|
图 6 人工与自动方法定位IVC结果比较 Fig 6 Comparison of IVC location results between manual method and automated method "s" is the standard deviation. IVC: Inferior vena cava. |
3 讨论
本研究提出了一种基于拓扑结构与自动跟踪算法的IVC自动识别与定位方法。本研究工作是实现全自动IVC测量的基础,即以自动算法的方式识别和定位IVC以便后续测量。本研究共采集了18组超声数据,以超声医师识别结果作为金标准,自动算法成功识别出17组(成功率为94.44%)。
本研究采用的IVC测量部位为剑突下纵切面,超声探头从剑突下四腔心切面朝向患者头部移动,显示肝静脉汇入IVC后进行IVC识别,选取距离该点2 cm处测量IVC直径。数据采集自首都医科大学附属北京朝阳医院ICU患者,病例因素复杂,医师在识别内径时判断并排除了存在严重影响参数准确性因素(如心力衰竭、心脏显著扩大及腹腔压力过大等)的患者;IVC内径范围较大,经过医师筛选后排除了呼吸变化幅度过大、血管壁粘连及图像噪声过大的病例数据,18组数据总体IVC直径范围为12~30 mm。
由于数据来自于ICU患者,超声影像质量参差不一,对IVC识别造成困难。综合考虑上述问题,自动化算法在识别IVC方面,具有较高成功率,达到94.44%。分析原因为:(1)超声数据是由经验丰富的临床医师采集;(2)图像预处理完成降噪并显著提高了对比度;(3)阈值预先选择和细化算法生成骨架图使算法简单且稳定。重要的是,结合图像处理拓扑结构与IVC边界最长这一生理特点,采用静态识别方法显著提高了识别准确率。
超声探测易受噪声及探测角度影响,导致IVC静态识别容易引入部分误差。在B模式下,肋骨阴影是常见的IVC噪声,对算法自动识别产生干扰,采用腐蚀膨胀降噪平滑可以有效滤除肋骨阴影带来的噪声影响。后续研究将考虑使用动态识别方式,利用超声帧之间相关性进行识别,同时引入背景建模算法降噪。
本研究使用医师人工定位坐标对IVC自动定位结果进行检验。在算法测量之前,输出算法计算的2 cm参考点位置μmn,对比人工定位标记点μa,同一帧两点距离小于半个人工测量直径,表明该算法IVC定位结果准确[7]。
由算法输出的定位差值结果可见,自动定位的结果随呼吸运动不断变化,代表了数据集同一帧2个定位坐标的距离,即‖μa-μm‖。使用Bland-Altman图来表示算法定位与人工定位2种方法的可替代性,结果在±1.96s范围内,证明2种方法具有可替代性。在数据处理过程中存在结果超出范围的单帧,可能是由于人工定位和自动算法定位的性质不同导致,人工定位是医师根据临床经验定位IVC边界并结合参考点定位IVC 2 cm位置,而自动算法依赖于边界骨架图与跟踪框坐标的实时输出坐标,对实时输出坐标进行修正后使该数据位于范围内。
本研究具有以下局限性:(1)筛选了采集的超声数据,对于病情严重患者的图像,可能无法找到静脉汇合处或存在呼吸变异度不足等,需要对算法进行改进;(2)IVC是一个三维结构,本实验使用单个截面,未考虑IVC不同截面形状变化的问题。
综上所述,本研究使用临床医师从ICU患者采集的超声数据集,开发了一种IVC自动识别和定位算法,可自动输出IVC直径。对比IVC人工识别与定位结果,该自动识别与定位算法具有较高的成功率与准确性,与人工方法具有可替代性。在临床实践中,基于算法执行特点,研究人员可学习并调整采集方法,掌握适应算法的技巧。下一步研究中,将开发全自动跟踪和测量IVC的算法,以实现全自动IVC测量。
致谢 衷心感谢西交利物浦大学高圳栩及华东师范大学通信与电子工程学院杨晨逸、董海川、周润杰在数据采集、参考标准、界面设计、数据处理等方面给予的帮助!
| [1] |
黄家惠, 付廷飞, 梁璐. 超声监测下腔静脉直径在急危重症患者的应用[J]. 医学研究与教育, 2022, 39(3): 41-46. DOI:10.3969/j.issn.1674490X.2022.03.007 |
| [2] |
虞广. 超声动态监测下腔静脉内径指导肾衰合并急性心衰患者连续性肾脏替代治疗的应用[D]. 南昌: 南昌大学, 2022.
|
| [3] |
樊潇, 庄树昕, 邱舜敏, 等. 基于超声视频轮廓检测与光流的下腔静脉分割检测追踪[J]. 测试技术学报, 2022, 36(6): 530-536. DOI:10.3969/j.issn.1671-7449.2022.06.011 |
| [4] |
王金灿, 陈继, 吴海燕. 下腔静脉超声对容量状态评估的应用进展[J]. 湖北医药学院学报, 2023, 42(3): 344-348. DOI:10.13819/j.issn.2096-708X.2023.03.026 |
| [5] |
林益钦, 陈英勒, 吴黄辉, 等. 超声下腔静脉预测容量反应性和容量状态的临床应用[J]. 安徽医学, 2023, 44(5): 534-540. DOI:10.3969/j.issn.1000-0399.2023.05.009 |
| [6] |
SMILLIE R P, SHETTY M, BOYER A C, et al. Imaging evaluation of the inferior vena cava[J]. Radiographics, 2015, 35(2): 578-592. DOI:10.1148/rg.352140136 |
| [7] |
BLEHAR D J, RESOP D, CHIN B, et al. Inferior vena cava displacement during respirophasic ultrasound imaging[J]. Crit Ultrasound J, 2012, 4(1): 18. DOI:10.1186/2036-7902-4-18 |
| [8] |
SISÓ-ALMIRALL A, KOSTOV B, NAVARRO GONZÁLEZ M, et al. Abdominal aortic aneurysm screening program using hand-held ultrasound in primary healthcare[J]. PLoS One, 2017, 12(4): e0176877. DOI:10.1371/journal.pone.0176877 |
| [9] |
CINTHIO M, JANSSON T, ERIKSSON A, et al. Evaluation of an algorithm for arterial lumen diameter measurements by means of ultrasound[J]. Med Biol Eng Comput, 2010, 48(11): 1133-1140. DOI:10.1007/s11517-010-0660-8 |
| [10] |
EVANGELISTA A, GALUPPO V, MÉNDEZ J, et al. Hand-held cardiac ultrasound screening performed by family doctors with remote expert support interpretation[J]. Heart, 2016, 102(5): 376-382. DOI:10.1136/heartjnl-2015-308421 |
| [11] |
MESIN L, PASQUERO P, ALBANI S, et al. Semi-automated tracking and continuous monitoring of inferior vena cava diameter in simulated and experimental ultrasound imaging[J]. Ultrasound Med Biol, 2015, 41(3): 845-857. DOI:10.1016/j.ultrasmedbio.2014.09.031 |
| [12] |
CHEN J, LI J, DING X, et al. Automated identification and localization of the inferior vena cava using ultrasound: an animal study[J]. Ultrason Imaging, 2018, 40(4): 232-244. DOI:10.1177/0161734618777262 |
| [13] |
CHEN J, LI J, DING X, et al. Automated ultrasound measurement of the inferior vena cava: an animal study[J]. Ultrason Imaging, 2020, 42(3): 148-158. DOI:10.1177/0161734620912345 |
| [14] |
AU A K, MATTHEW FIELDS J. Ultrasound measurement of inferior vena cava collapse predicts propofol induced hypotension[J]. Am J Emerg Med, 2017, 35(3): 508-509. DOI:10.1016/j.ajem.2016.11.060 |
| [15] |
BELLOWS S, SMITH J, MCGUIRE P, et al. Validation of a computerized technique for automatically tracking and measuring the inferior vena cava in ultrasound imagery[J]. Stud Health Technol Inform, 2014, 207: 183-192. |
| [16] |
AKKAYA A, YESILARAS M, AKSAY E, et al. The interrater reliability of ultrasound imaging of the inferior vena cava performed by emergency residents[J]. Am J Emerg Med, 2013, 31(10): 1509-1511. DOI:10.1016/j.ajem.2013.07.006 |
| [17] |
WALLACE D J, ALLISON M, STONE M B. Inferior vena cava percentage collapse during respiration is affected by the sampling location: an ultrasound study in healthy volunteers[J]. Acad Emerg Med, 2010, 17(1): 96-99. DOI:10.1111/j.1553-2712.2009.00627.x |
 2024, Vol. 45
2024, Vol. 45


