子宫内膜异位症(endometriosis,EM)是子宫内膜腺体和间质种植在子宫腔被覆黏膜及子宫肌层以外的一种雌激素依赖性疾病,以痛经、盆腔包块、不孕症等为主要临床表现。EM在育龄期女性中的发病率约为10%~15%,近年来其发病率有逐渐上升趋势[1-2]。EM的治疗有药物治疗和手术治疗两种方式。由于EM患者多见于育龄期女性,故手术治疗多以保守性手术(如腹腔镜手术)方案为主,但保守性手术后复发率高[3]。治疗EM的药物有促性腺激素释放激素类似物、地诺孕素、孕三烯酮和口服避孕药等,存在低雌激素状态、肝功能损伤、阴道不规则出血等不良反应,长期应用受限[4]。因此,EM是妇科临床的一种难治性疾病[5]。
EM的病因目前并不明确,经血逆流学说、细胞化生学说、干细胞致病学说等均能解释一部分EM的发病机制[6-7]。目前多项研究表明,免疫系统功能障碍是导致EM进展的重要原因,多种免疫细胞(如中性粒细胞、巨噬细胞、自然杀伤细胞和树突状细胞等)参与EM的血管生成及病灶生长、侵袭、转移等多种病理学过程,同时免疫细胞还会分泌细胞因子和防御素,进一步影响EM环境[8-9]。其中巨噬细胞在EM中的作用最为引人关注。既往研究提示具有抗炎和促进组织修复功能的M2型巨噬细胞在EM的发生、发展过程中起重要作用,而具有促炎功能的M1型巨噬细胞能够拮抗M2型巨噬细胞作用,清除异位内膜组织,破坏病变结构[10-11]。
EM在中医学中属“癥瘕”“经行腹痛”“不孕”等范畴,其基本病机为血瘀。女子以血为本,冲脉为血海,冲脉盛则经调子嗣,冲脉不固,则易经血逆行,血行脉外则为瘀,因此,冲脉虚损是EM的内在原因,血瘀则为外在表现,又因“肾主生殖”“胞络者系于肾”“冲任之本在肾”“久病及肾”,故俞超芹教授认为EM的发生、发展与肾虚关系密切。阳气有助于血水之运化,子宫经血又依赖于冲任经络的输注,肾阳不足则任脉通畅乏力,经血易于积聚,瘀久化毒。在以上认知的基础上,结合长期临床治疗经验,俞教授提出对EM患者采用补肾活血、佐以清热解毒的治疗原则,组方补肾活血方,可改善患者临床症状,抑制子宫内膜异位病灶的生长,提高患者妊娠率,临床疗效满意[12]。但补肾活血方是否通过调控腹腔巨噬细胞功能影响腹腔免疫微环境发挥治疗EM的作用尚不清楚。本研究通过构建EM小鼠模型,观察补肾活血方对EM疾病进展的作用及补肾活血方干预下EM小鼠腹腔巨噬细胞分型和吞噬功能的变化,验证补肾活血方是否通过调控巨噬细胞治疗EM。
1 材料和方法 1.1 实验动物65只SPF级8周龄、体重18~20 g的性成熟BALB/c雌性小鼠购自北京维通利华实验动物技术有限公司[实验动物生产许可证号:SCXK(京)2021-0006],饲养于海军军医大学(第二军医大学)第一附属医院临床实验中心动物实验室[实验动物使用许可证号:SYXK(沪)2020-0033],实验前适应性饲养1周。本研究通过海军军医大学(第二军医大学)第一附属医院伦理审查委员会审批(CHEC2019-127),所有实验操作均严格遵照动物伦理相关规定执行。
1.2 实验药物补肾活血方中药液配制:仙灵脾12 g,鹿角片9 g,莪术9 g,桃仁9 g,牡丹皮9 g,赤芍15 g,红藤30 g,生蒲黄9 g,五灵脂9 g,水蛭9 g等,共18味药333 g,由海军军医大学(第二军医大学)第一附属医院中药房提供。按照《实验动物学》剂量换算表,成人每日中药液剂量150 mL(约168 g生药),取70 kg人和20 g小鼠间体表面积折算的等效剂量比值0.002 6进行换算,得到小鼠每日等效剂量为21.84 g/kg。应用旋蒸浓缩法将中药煎液浓缩至浓度为4.368 g/mL的中药原液,使用前用蒸馏水将原液稀释为2.184 g/mL的工作液。孕三烯酮混悬液配制:按上述剂量换算方法算得孕三烯酮每次剂量为0.325 mg/kg。将孕三烯酮胶囊(华润紫竹药业有限公司,国药准字H19980020,规格2.5 mg)去除胶囊外壳,然后将药物粉末溶于76.9 mL蒸馏水中,用振荡器震荡使粉末充分混匀,配制成浓度为0.032 5 mg/mL的孕三烯酮混悬溶液。
1.3 EM小鼠模型建立供体小鼠与受体小鼠数量比为1∶2。供体小鼠脱颈处死后,在无菌台上剖开腹腔,获得腹腔脂肪组织和子宫内膜,并剪碎至1 mm3大小,便于后续注射。受体小鼠腹部皮肤消毒后,以1 mL注射器针筒接20 mL注射器针头,以小鼠下腹部正中尿道口上方0.5 cm处为进针点,将子宫内膜碎片注射入受体小鼠腹腔建立EM模型,针孔处涂抹适量青霉素软膏预防感染。从取出供体小鼠子宫到将子宫内膜碎片注射入受体小鼠所有操作应在5 min内连续完成,全程保持无菌[13]。假手术小鼠腹腔注射等体积的供体小鼠腹腔脂肪组织,注射方法与EM模型小鼠相同。
1.4 实验分组和给药造模后将EM模型小鼠随机分为模型组、孕三烯酮组、补肾活血方组3组,每组8只;另设假手术组和空白对照组,每组8只小鼠。造模后次日开始给小鼠灌胃,各组均连续灌胃28 d。空白对照组、模型组和假手术组小鼠均每日灌胃0.2 mL生理盐水;孕三烯酮组小鼠每次灌胃0.2 mL孕三烯酮混悬液,每周2次,其余时间每日灌等体积的生理盐水;补肾活血方组小鼠每日灌胃0.2 mL补肾活血方中药液。
1.5 观察指标灌胃结束的次日,用颈椎脱臼法处死实验小鼠,放入75%乙醇浸泡30 s后,将小鼠仰卧位放在手术操作台上。用酒精棉球擦干小鼠腹部,将2 mL预冷的生理盐水注入小鼠腹腔,充分按摩腹部1 min后,用5 mL一次性注射器轻轻刺破腹腔最低点的腹膜,迅速抽吸腹腔灌洗液并转移至2 mL离心管中。观察和检测指标如下。
1.5.1 腹腔子宫内膜异位灶形态和纤维化观察小鼠腹腔子宫内膜异位灶生长部位、形态、颜色、大小等。异位灶取出后用直尺测量其长度、宽度与高度,按公式“体积=π/6×长×宽×高”计算异位灶体积。之后将异位灶放入4%多聚甲醛溶液中,室温固定24 h后常规石蜡包埋、切片,进行H-E染色,观察异位灶病理形态学特征。取子宫内膜异位灶石蜡切片,脱蜡后,用上皮型钙黏蛋白(E-cadherin)抗体(1∶400,美国CST公司)、Ⅰ型胶原抗体(1∶200,英国Abcam公司)、α肌动蛋白(α-smooth muscle actin,α-SMA)抗体(1∶200,英国Abcam公司)、平滑肌肌球蛋白重链Ⅱ(smooth muscle myosin heavy chain Ⅱ,SMMHC-Ⅱ)抗体(1∶300,英国Abcam公司)孵育,封片后在光学显微镜下观察表达情况,评估异位灶的纤维化程度。
1.5.2 腹腔粘连程度评分采用Blauer粘连评分系统[14]对小鼠腹腔粘连程度进行评分。评分标准:0分,无粘连;1分,盆腔轻微的膜状粘连;2分,粘连致密,通常宫角与肠管和膀胱均有粘连;3分,粘连更致密,范围更广,双侧宫角均与肠管和膀胱粘连,子宫尚有一定活动度;4分,严重的粘连,双侧子宫角均与肠管和膀胱粘连,子宫固定不动。由2位实验人员独立进行粘连评分,取2位实验人员所评分数的平均值作为最终的腹腔粘连评分。
1.5.3 腹腔灌洗液中炎症因子水平在4 ℃条件下,将收集的小鼠腹腔灌洗液以1 500 r/min离心15 min(离心半径150 mm),取上清液。采用ELISA法检测上清液中炎症因子干扰素γ(interferon γ,IFN-γ)、IL-12、TNF-α、TGF-β1、IL-10、IL-13水平(试剂盒购自武汉博士德生物工程有限公司)。
1.5.4 腹腔巨噬细胞极化状态在4 ℃条件下,将收集的腹腔灌洗液以1 000 r/min离心5 min(离心半径150 mm),弃上清,加入含10% FBS的RPMI 1640细胞培养基重悬细胞。取10 μL细胞悬液滴入血细胞计数板,在显微镜下(10×100倍)计数细胞。调整细胞密度,接种至直径为10 cm的细胞培养皿,放置于37 ℃细胞培养箱孵育4 h,待细胞充分贴壁后弃上清,用PBS漂洗2次除去未贴壁细胞,获得的贴壁细胞即为巨噬细胞。收集腹腔巨噬细胞,用PBS洗涤重悬,每1 mL细胞悬液(1∶1 000)加入1 μL活性染料FVS510原液,充分涡旋,避光孵育15 min。染完FVS510之后,洗涤2次,以1 200 r/min(离心半径150 mm)离心5 min,使游离的FVS510染料失效,便于后续染色。在此体系中加入2 μL Fc Block(美国BD公司),4 ℃下孵育5 min,以减少非特异性结合和背景信号。在Fc Block存在的情况下加入抗体(CD11b-PE/CY7、F4/80-BV421、CD86-APC、CD206-PE、CD16/32抗体,均购自美国BD公司),避光孵育15 min。用含有蛋白的染色缓冲液洗涤细胞并重悬,最后上机检测。
1.5.5 腹腔巨噬细胞吞噬功能按上述方法培养小鼠腹腔巨噬细胞。将巨噬细胞与预处理过的微球在37 ℃培养箱内避光孵育2 h后,用吸管将上清液轻轻吸弃,用预冷的PBS洗涤,用细胞刮将培养皿中贴壁的巨噬细胞刮下来,用培养基重悬。细胞悬液经孔径为70 μm的过滤器过滤后转移至流式检测管,用PBS缓冲液定容,上机检测。参照流式细胞术方法,根据CD11b-PE/CY7和F4/80-BV421荧光强度圈定所有的巨噬细胞,然后将FITC荧光表达阳性的巨噬细胞视为吞噬了微球的巨噬细胞,计算吞噬微球的巨噬细胞占总巨噬细胞的百分比,即为吞噬率。分析出每个样本吞噬率,计算每组样本吞噬率的平均值作为该组样本巨噬细胞的相对吞噬能力。同时分析每组样本吞噬微球的平均光密度。
1.6 统计学处理采用SPSS 22.0软件进行统计学分析,使用Graphpad Prism 7.0软件绘图。计量资料以x±s表示,组间比较采用单因素方差分析,两两比较采用Student-Newman-Keuls法。检验水准(α)为0.05。
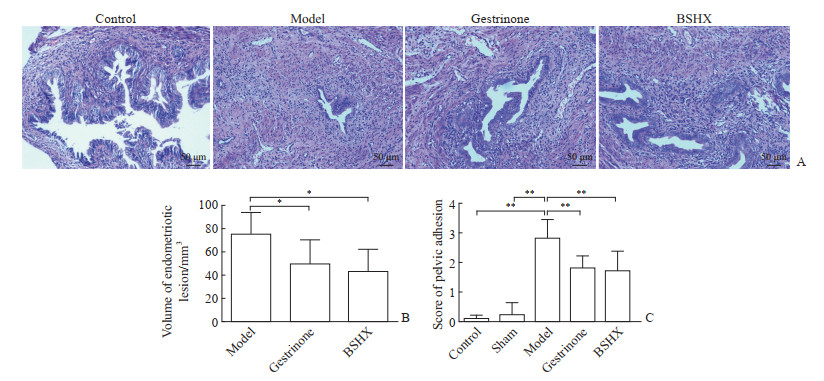
2 结果 2.1 补肾活血方抑制EM疾病进展空白对照组和假手术组小鼠腹腔均未见子宫内膜异位灶。EM模型小鼠腹腔子宫内膜异位灶大多数生长在肠系膜上,其次为脾下、腹壁、子宫附近,与周围组织轻中度粘连。异位灶为囊性不规则形态,呈半透明或暗红色,囊内含淡黄色或半透明液体,囊壁表面有细小血管形成,囊壁边缘有少量结缔组织,病灶直径1~10 mm不等。组织病理学观察可见生长良好的腺体和间质,腺体数目较正常在位子宫内膜明显减少,囊腔内可见炎症细胞。各组小鼠的子宫内膜异位灶组织形态学基本一致(图 1A)。孕三烯酮组和补肾活血方组小鼠腹腔异位灶体积与EM模型组相比均减小(均P<0.05),孕三烯酮组和补肾活血方组异位灶体积差异无统计学意义(P>0.05),见图 1B。空白对照组与假手术组小鼠腹腔粘连程度评分差异无统计学意义(P>0.05),EM模型组小鼠腹腔粘连评分较空白对照组和假手术组增高(均P<0.01),孕三烯酮组和补肾活血方组小鼠腹腔粘连评分与EM模型组相比均降低(均P<0.01),孕三烯酮组与补肾活血方组小鼠腹腔粘连评分差异无统计学意义(P>0.05),见图 1C。
|
图 1 各组小鼠腹腔子宫内膜异位灶H-E染色、病灶体积及粘连情况 Fig 1 H-E staining of peritoneal endometriotic lesions and differences in lesion volume and adhesion of mice in each group A: H-E staining of normal endometrium and endometriotic lesions; B: Comparison of endometriotic lesion volume in the peritoneal cavity among different groups; C: Scoring of peritoneal adhesion degree in different groups. *P < 0.05, **P < 0.01. n=8, x±s. H-E: Hematoxylin-eosin; BSHX: Bushen Huoxue prescription. |
2.2 补肾活血方改善EM病灶纤维化
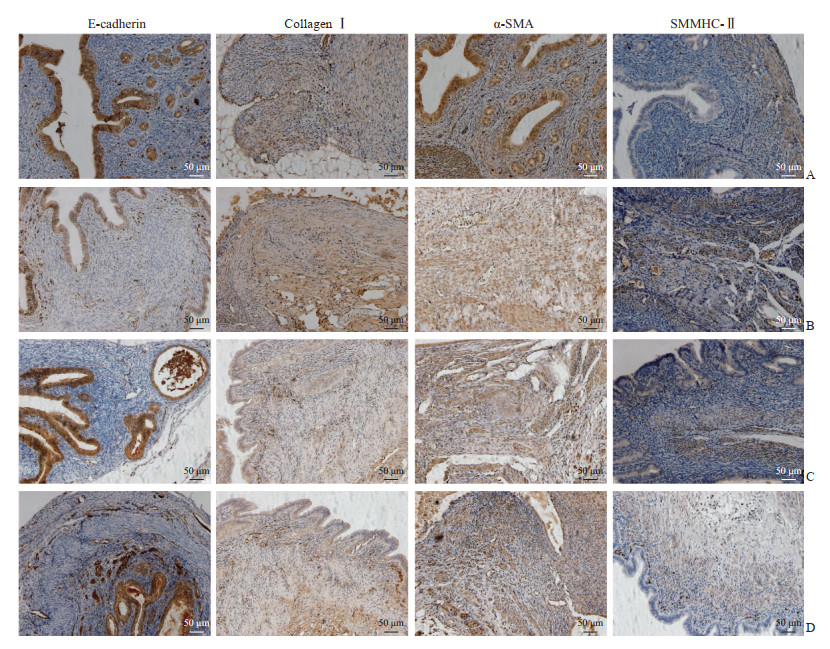
免疫组织化学染色结果(图 2)显示,正常在位子宫内膜和子宫内膜异位灶均有E-cadherin、Ⅰ型胶原蛋白、α-SMA、SMMHC-Ⅱ阳性表达。正常对照组E-cadherin主要表达于子宫腺上皮细胞的细胞膜,呈强阳性表达且分布均匀;模型组小鼠腹腔子宫内膜异位灶上皮细胞E-cadherin表达明显减弱;孕三烯酮组和补肾活血方组小鼠腹腔子宫内膜异位灶E-cadherin表达与模型组比较均有所增强。正常在位子宫内膜和子宫内膜异位灶Ⅰ型胶原蛋白主要位于间质细胞和肌成纤维细胞的细胞外基质,模型组小鼠腹腔子宫内膜异位灶Ⅰ型胶原蛋白表达与正常在位内膜相比显著增强,孕三烯酮组和补肾活血方组小鼠腹腔子宫内膜异位灶Ⅰ型胶原蛋白表达与模型组比较均有所减弱。α-SMA主要表达于正常在位子宫肌层的平滑肌细胞和成纤维细胞,子宫内膜间质部分几乎不表达;与正常对照组小鼠的在位子宫相比,模型组小鼠的腹腔子宫内膜异位灶α-SMA表达明显增强,且分布紊乱、无明显规律;与模型组比较,孕三烯酮组和补肾活血方组小鼠腹腔子宫内膜异位灶α-SMA表达均有所减弱。SMMHC-Ⅱ在正常对照组小鼠在位子宫主要表达于肌层的平滑肌细胞和少量成纤维细胞,分布规律;在模型组小鼠的腹腔子宫内膜异位灶表达紊乱,表达量明显增加;与模型组比较,孕三烯酮组和补肾活血方组小鼠腹腔子宫内膜异位灶SMMHC-Ⅱ表达均减弱。
|
图 2 各组小鼠腹腔子宫内膜异位灶免疫组织化学染色结果 Fig 2 Immunohistochemical staining of endometriotic lesions of mice in each group A: Immunohistochemical staining of normal endometrium in the control group; B: Immunohistochemical staining of endometriotic lesions in the model group; C: Immunohistochemical staining of endometriotic lesions in the gestrinone group; D: Immunohistochemical staining of endometriotic lesions in the Bushen Huoxue prescription group. α-SMA: α-smooth muscle actin; SMMHC-Ⅱ: Smooth muscle myosin heavy chain Ⅱ. |
2.3 补肾活血方改善
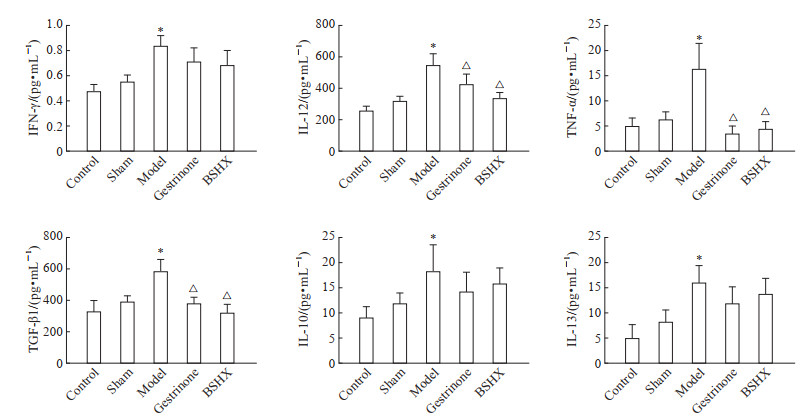
EM小鼠炎症状态ELISA检测结果(图 3)显示,空白对照组和假手术组小鼠腹腔灌洗液各炎症因子表达水平差异均无统计学意义(均P>0.05);与空白对照组比较,EM模型组小鼠腹腔灌洗液IFN-γ、IL-12、TNF-α、TGF-β1、IL-10、IL-13均升高(均P<0.05);与EM模型组相比,补肾活血方组和孕三烯酮组小鼠腹腔灌洗液IL-12、TNF-α、TGF-β1均降低(均P<0.05),IFN-γ、IL-10、IL-13差异无统计学意义(均P>0.05);补肾活血方组和孕三烯酮组小鼠腹腔灌洗液以上炎症因子表达水平差异均无统计学意义(均P>0.05)。
|
图 3 各组小鼠腹腔灌洗液炎症因子表达水平 Fig 3 Expression levels of inflammatory factors in peritoneal lavage fluid of mice in each group *P < 0.05 vs control group; △P < 0.05 vs model group. n=8, x±s. IFN-γ: Interferon-γ; IL: Interleukin; TNF-α: Tumor necrosis factor-α; TGF-β1: Transforming growth factor-β1; BSHX: Bushen Huoxue prescription. |
2.4 补肾活血方调控EM小鼠腹腔巨噬细胞功能
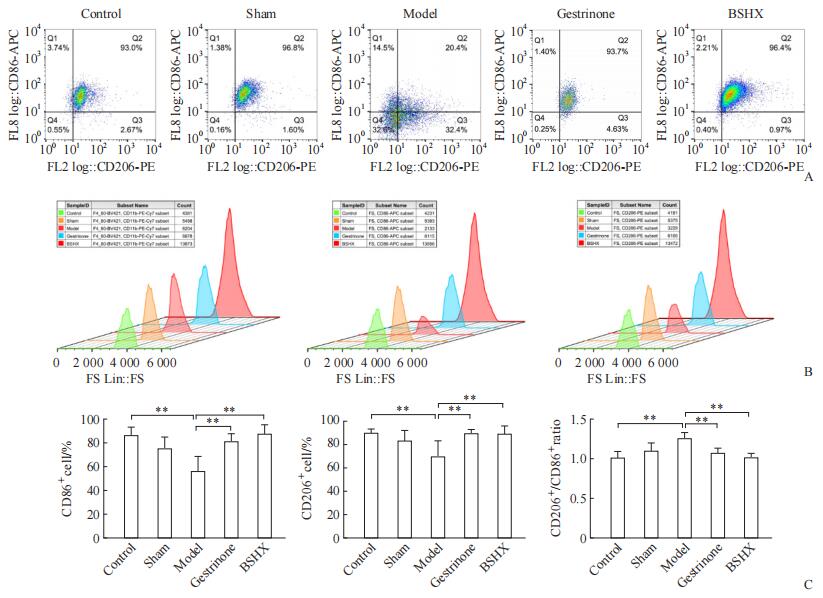
流式细胞术分析结果(图 4)显示,与正常对照组相比,假手术组小鼠腹腔M1型(CD86+)巨噬细胞百分比、M2型(CD206+)巨噬细胞百分比及M2/M1比值差异均无统计学意义(均P>0.05)。与正常对照组相比,EM模型组小鼠腹腔M1型巨噬细胞百分比、M2型巨噬细胞百分比均下降(均P<0.01),M2/M1比值升高(P<0.01)。与EM模型组相比,孕三烯酮组和补肾活血方组小鼠腹腔M1型巨噬细胞百分比、M2型巨噬细胞百分比均升高(均P<0.01),M2/M1比值均下降(均P<0.01),M1型、M2型巨噬细胞百分比相近。孕三烯酮组与补肾活血方组相比,小鼠腹腔M1型巨噬细胞百分比、M2型巨噬细胞百分比、M2/M1比值差异均无统计学意义(均P>0.05)。
|
图 4 各组小鼠腹腔M1型和M2型巨噬细胞流式细胞术分析结果 Fig 4 Flow cytometric analysis of M1 and M2 macrophages in the peritoneal cavity of mice in each group A: Flow cytometric density plots of peritoneal macrophages; B: Flow cytometric histograms of peritoneal macrophages; C: Proportions of M1 and M2 macrophages and M2/M1 ratio in the peritoneal cavity. **P < 0.01. n=8, x±s. PE: Phycoerythrin; APC: Allophycocyanin; FS: Forward scatter; Lin: Linage; BSHX: Bushen Huoxue prescription. |
应用流式细胞术检测巨噬细胞的吞噬能力,结果(图 5)显示,对照组与假手术组小鼠腹腔巨噬细胞的吞噬率差异无统计学意义(P>0.05);与对照组相比,EM模型组小鼠腹腔巨噬细胞的吞噬率升高(P<0.01);假手术组、孕三烯酮组和补肾活血方组小鼠腹腔巨噬细胞的吞噬率差异无统计学意义(均P>0.05)。各组小鼠腹腔巨噬细胞吞噬微球的平均光密度分析结果与吞噬率分析结果一致,即对照组与假手术组小鼠腹腔巨噬细胞吞噬微球的平均光密度差异无统计学意义(P>0.05),EM模型组小鼠腹腔巨噬细胞吞噬微球的平均光密度与对照组相比升高(P<0.01),而假手术组、孕三烯酮组和补肾活血方组小鼠腹腔巨噬细胞吞噬微球的平均光密度差异无统计学意义(均P>0.05)。
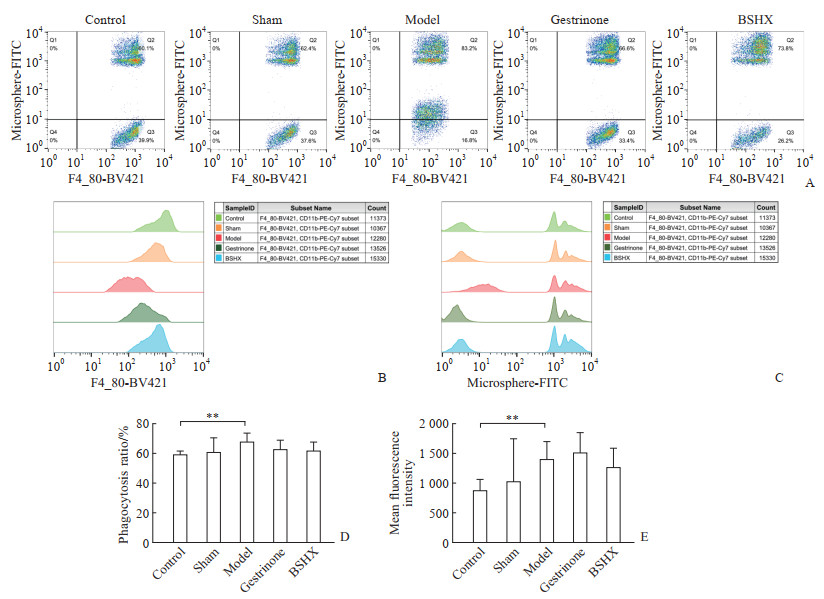
|
图 5 各组小鼠腹腔巨噬细胞吞噬功能流式细胞术分析结果 Fig 5 Flow cytometric analysis of phagocytosis function of peritoneal macrophages in each group of mice A: Density plots of phagocytosis rate of peritoneal macrophages; B: Histogram of relative quantity of peritoneal macrophages; C: Histogram of relative quantity of microspheres phagocytosed by peritoneal macrophages; D: Phagocytosis rate of peritoneal macrophages; E: Mean fluorescence intensity of microspheres phagocytosed by peritoneal macrophages. **P < 0.01. n=8, x±s. FITC: Fluorescein isothiocyanate; PE: Phycoerythrin; BSHX: Bushen Huoxue prescription. |
3 讨论
EM影响着全球大约2亿育龄妇女和女童,患者常伴有严重的痛经表现,且30%~50%的EM患者伴有不孕症,往往造成焦虑、抑郁等心理问题,给患者带来身心双重折磨[15-16]。EM是一种慢性疾病,现有治疗方法存在一定不良反应并且费用较高,寻找经济且长期安全的新型疗法势在必行。近年来,越来越多的学者关注中医药及天然化合物在EM治疗中的应用[17]。中医药常常表现出多效性作用特征,一方面抑制EM发病的基本病理过程,如增殖、炎症、氧化应激和血管生成;另一方面,中草药复方对治疗EM不孕症有效,可以有效提高EM患者妊娠率[18]。探究中医药治疗EM的具体机制有助于开发新的EM治疗药物。
巨噬细胞是调控EM的关键细胞,对于病变的生长、发育、血管形成、神经支配及疼痛症状的产生至关重要[19]。EM作为一种慢性炎症性疾病,巨噬细胞对其炎症功能的调控是研究的重点[20]。然而,巨噬细胞是一群极具异质性和可塑性的免疫细胞,目前已知的巨噬细胞有M1、M2a、M2b、M2c等多种活化状态,其在不同的条件下表现为不同的表型和功能,M1型和M2型是巨噬细胞一系列连续动态变化的两个极端。M1型以分泌IFN-γ、IL-12、TNF-α等促炎细胞因子为主,并发挥免疫激活和抗原提呈功能;M2型以分泌TGF-β1、IL-10、IL-13等抗炎细胞因子为主,并发挥损伤修复的功能。在机体稳态的情况,巨噬细胞不是绝对的M1或M2表型,基本是以混合表型的形式存在,在一个局部微环境中,M1或M2极化状态的偏移是巨噬细胞功能多样性和可塑性的表现,使其能够在不同环境状态下迅速做出反应[21]。在组织发生感染的早期,巨噬细胞会迅速到达炎症场所,激活免疫反应,清除病原体,这时主要依赖M1优势表型;在感染的后期,当病原体被清除或局部发生了免疫耐受,则表现M2优势表型,防止组织过度损伤[22]。
在EM疾病状态下,腹腔免疫微环境呈动态变化过程,M1型和M2型巨噬细胞比例的动态变化与EM模型小鼠腹腔粘连和异位灶纤维化程度关系密切[23-24]。有学者认为EM的发生可能是由于患者腹腔巨噬细胞吞噬能力减弱,导致进入腹腔的子宫内膜能够存活并种植、生长,但是目前尚无明确的证据证实患者腹腔巨噬细胞吞噬能力减弱[25]。有学者利用新型实时成像平台研究了不同亚型巨噬细胞的吞噬能力,结果显示,与脂多糖处理的巨噬细胞相比,经IL-4和IL-10处理的巨噬细胞表现出更高的生物颗粒吞噬率;与M1型巨噬细胞相比,M2型巨噬细胞可能有更强的吞噬能力[26]。TGF-β在巨噬细胞的活化和吞噬功能中挥发重要作用,有研究显示,TGF-β可诱导巨噬细胞向M2型转化,并且能够增强巨噬细胞的吞噬能力[27-28]。EM腹腔微环境中TGF-β水平显著升高,诱导巨噬细胞向M2型转化,理论上腹腔巨噬细胞的吞噬能力应该更强。本研究通过流式细胞术检测了各组小鼠腹腔巨噬细胞的相对吞噬能力,与对照组相比,EM模型小鼠腹腔巨噬细胞显示出更高的吞噬活性。本团队前期研究结果显示巨噬细胞在EM早期倾向于M1表型,在炎症后期向M2极化,且炎症后期腹腔中TGF-β1水平显著升高[29]。因此,我们认为在EM的早期,腹腔巨噬细胞的吞噬活性可能是减弱的,随着疾病进展,在中后期损伤修复阶段,由于TGF-β1介导的M2型巨噬细胞功能活跃,总体表现为巨噬细胞吞噬活性过度增强,导致腹腔病灶局部长期慢性损伤。而补肾活血方可以调控巨噬细胞活化,使M1型巨噬细胞及M2型巨噬细胞百分比均升高,且M2/M1比值下降,从而缓解损伤,发挥治疗EM的作用。
综上所述,本研究通过小鼠体内实验研究了补肾活血方治疗EM的疗效及其对EM模型小鼠腹腔巨噬细胞的调控作用,有助于进一步了解补肾活血方的治疗机制,推动中医药治疗EM的研究进展。中医药治疗可改善EM患者的临床症状和体征,但除了基础实验,中医药研究还需要大样本、多中心、前瞻性、随机对照研究来提供高级别的循证医学证据。此外,还需要对中医药核心成分进行科学化挖掘,找出最为核心的治疗机制,为新药开发提供抓手。
| [1] |
PEIRIS A N, CHALJUB E, MEDLOCK D. Endometriosis[J]. JAMA, 2018, 320(24): 2608. DOI:10.1001/jama.2018.17953 |
| [2] |
YEN C F, KIM M R, LEE C L. Epidemiologic factors associated with endometriosis in East Asia[J]. Gynecol Minim Invasive Ther, 2019, 8(1): 4-11. DOI:10.4103/GMIT.GMIT_83_18 |
| [3] |
LUNA RUSSO M A, CHALIF J N, FALCONE T. Clinical management of endometriosis[J]. Minerva Ginecol, 2020, 72(2): 106-118. DOI:10.23736/S0026-4784.20.04544-X |
| [4] |
VERCELLINI P, BUGGIO L, FRATTARUOLO M P, et al. Medical treatment of endometriosis-related pain[J]. Best Pract Res Clin Obstet Gynaecol, 2018, 51: 68-91. DOI:10.1016/j.bpobgyn.2018.01.015 |
| [5] |
俞超芹. 子宫内膜异位症诊治困局与思考[J]. 海军军医大学学报, 2023, 44(1): 1-6. YU C Q. Diagnosis and treatment of endometriosis: difficulties and thinking[J]. Acad J Naval Med Univ, 2023, 44(1): 1-6. DOI:10.16781/j.CN31-2187/R.20220197 |
| [6] |
VERCELLINI P, VIGANÒ P, SOMIGLIANA E, et al. Endometriosis: pathogenesis and treatment[J]. Nat Rev Endocrinol, 2014, 10(5): 261-275. DOI:10.1038/nrendo.2013.255 |
| [7] |
BULUN S E, YILMAZ B D, SISON C, et al. Endometriosis[J]. Endocr Rev, 2019, 40(4): 1048-1079. DOI:10.1210/er.2018-00242 |
| [8] |
ABRAMIUK M, GRYWALSKA E, MAŁKOWSKA P, et al. The role of the immune system in the development of endometriosis[J]. Cells, 2022, 11(13): 2028. DOI:10.3390/cells11132028 |
| [9] |
CRISPIM P C A, JAMMAL M P, MURTA E F C, et al. Endometriosis: what is the influence of immune cells?[J]. Immunol Invest, 2021, 50(4): 372-388. DOI:10.1080/08820139.2020.1764577 |
| [10] |
NIE M F, XIE Q, WU Y H, et al. Serum and ectopic endometrium from women with endometriosis modulate macrophage M1/M2 polarization via the Smad2/Smad3 pathway[J]. J Immunol Res, 2018, 2018: 6285813. DOI:10.1155/2018/6285813 |
| [11] |
DUAN J, LIU X, WANG H, et al. The M2a macrophage subset may be critically involved in the fibrogenesis of endometriosis in mice[J]. Reprod Biomed Online, 2018, 37(3): 254-268. DOI:10.1016/j.rbmo.2018.05.017 |
| [12] |
毕艳丽, 程雯, 倪喆鑫. 俞超芹治疗子宫内膜异位症经验探析[J]. 江苏中医药, 2019, 51(8): 24-26. |
| [13] |
DING J, MEI S, WANG K, et al. Curcumin modulates oxidative stress to inhibit pyroptosis and improve the inflammatory microenvironment to treat endometriosis[J]. Genes Dis, 2023, 11(3): 101053. DOI:10.1016/j.gendis.2023.06.022 |
| [14] |
DE IACO P A, STEFANETTI M, PRESSATO D, et al. A novel hyaluronan-based gel in laparoscopic adhesion prevention: preclinical evaluation in an animal model[J]. Fertil Steril, 1998, 69(2): 318-323. DOI:10.1016/s0015-0282(98)00496-8 |
| [15] |
CHAPRON C, MARCELLIN L, BORGHESE B, et al. Rethinking mechanisms, diagnosis and management of endometriosis[J]. Nat Rev Endocrinol, 2019, 15(11): 666-682. DOI:10.1038/s41574-019-0245-z |
| [16] |
MACER M L, TAYLOR H S. Endometriosis and infertility: a review of the pathogenesis and treatment of endometriosis-associated infertility[J]. Obstet Gynecol Clin North Am, 2012, 39(4): 535-549. DOI:10.1016/j.ogc.2012.10.002 |
| [17] |
MERESMAN G F, GÖTTE M, LASCHKE M W. Plants as source of new therapies for endometriosis: a review of preclinical and clinical studies[J]. Hum Reprod Update, 2021, 27(2): 367-392. DOI:10.1093/humupd/dmaa039 |
| [18] |
DONG P, LING L, HU L. Systematic review and meta-analysis of traditional Chinese medicine compound in treating infertility caused by endometriosis[J]. Ann Palliat Med, 2021, 10(12): 12631-12642. DOI:10.21037/apm-21-3425 |
| [19] |
HOGG C, HORNE A W, GREAVES E. Endometriosis-associated macrophages: origin, phenotype, and function[J]. Front Endocrinol (Lausanne), 2020, 11: 7. DOI:10.3389/fendo.2020.00007 |
| [20] |
TAYLOR H S, KOTLYAR A M, FLORES V A. Endometriosis is a chronic systemic disease: clinical challenges and novel innovations[J]. Lancet, 2021, 397(10276): 839-852. DOI:10.1016/S0140-6736(21)00389-5 |
| [21] |
KADOMOTO S, IZUMI K, MIZOKAMI A. Macrophage polarity and disease control[J]. Int J Mol Sci, 2021, 23(1): 144. DOI:10.3390/ijms23010144 |
| [22] |
SHAPOURI-MOGHADDAM A, MOHAMMADIAN S, VAZINI H, et al. Macrophage plasticity, polarization, and function in health and disease[J]. J Cell Physiol, 2018, 233(9): 6425-6440. DOI:10.1002/jcp.26429 |
| [23] |
RAMÍREZ-PAVEZ T N, MARTÍNEZ-ESPARZA M, RUIZ-ALCARAZ A J, et al. The role of peritoneal macrophages in endometriosis[J]. Int J Mol Sci, 2021, 22(19): 10792. DOI:10.3390/ijms221910792 |
| [24] |
WANG Y, FU Y, XUE S, et al. The M2 polarization of macrophage induced by fractalkine in the endometriotic milieu enhances invasiveness of endometrial stromal cells[J]. Int J Clin Exp Pathol, 2013, 7(1): 194-203. |
| [25] |
LIU Y Y, LIU Y K, HU W T, et al. Elevated heme impairs macrophage phagocytosis in endometriosis[J]. Reproduction, 2019, 158(3): 257-266. DOI:10.1530/REP-19-0028 |
| [26] |
KAPELLOS T S, TAYLOR L, LEE H, et al. A novel real time imaging platform to quantify macrophage phagocytosis[J]. Biochem Pharmacol, 2016, 116: 107-119. DOI:10.1016/j.bcp.2016.07.011 |
| [27] |
YANG J, YIN S, BI F, et al. TIMAP repression by TGFβ and HDAC3-associated Smad signaling regulates macrophage M2 phenotypic phagocytosis[J]. J Mol Med (Berl), 2017, 95(3): 273-285. DOI:10.1007/s00109-016-1479-z |
| [28] |
FUCHS A K, SYROVETS T, HAAS K A, et al. Carboxyl- and amino-functionalized polystyrene nanoparticles differentially affect the polarization profile of M1 and M2 macrophage subsets[J]. Biomaterials, 2016, 85: 78-87. DOI:10.1016/j.biomaterials.2016.01.064 |
| [29] |
毕艳丽. 补肾活血方调控腹腔免疫微环境抑制子宫内膜异位症进展的临床和实验研究[D]. 上海: 上海中医药大学, 2020.
|
 2024, Vol. 45
2024, Vol. 45


