2. 西南医科大学附属医院基建部, 泸州 646000;
3. 西南医科大学基础医学院, 泸州 646000;
4. 西南医科大学药学院, 泸州 646000
2. Department of Infrastructure, The Affiliated Hospital of Southwest Medical University, Luzhou 646000, Sichuan, China;
3. School of Basic Medical Sciences, Southwest Medical University, Luzhou 646000, Sichuan, China;
4. School of Pharmacy, Southwest Medical University, Luzhou 646000, Sichuan, China
放疗和化疗是治疗肿瘤的常规手段,但是放化疗的不良反应严重,治疗效果不佳。光热治疗(photothermal therapy,PTT)由于侵袭性小、毒性低、效率高等优点,在癌症治疗领域受到广泛关注[1]。PTT利用近红外光照射光热剂将光能转化为热能,诱导肿瘤发生不可逆损伤。吲哚菁绿(indocyanine green,ICG)是一种光热剂,具备良好的光热转化效能,但稳定性差,进入体循环后易被机体快速清除,且其靶向效率低,从而严重限制了其临床应用[2]。虽然纳米制剂能改善药物稳定性,并通过高渗透长滞留效应促进药物被动靶向至肿瘤部位,但这类人工合成的纳米材料易被巨噬细胞识别并吞噬,大量药物在未到达肿瘤前就被网状内皮系统清除[3]。
学者们从天然细胞中获得灵感,开发了细胞膜仿生纳米粒,其能模拟机体内各种细胞的生理功能,减低了纳米粒的免疫原性,从而避免被网状内皮系统清除,改善药代动力学特性[4]。最重要的是,通过细胞膜修饰纳米粒表面能赋予其主动靶向病灶的能力,这极大提高了药物在肿瘤组织中的蓄积,有利于提高疗效和减少不良反应[5]。目前,很多细胞都被应用于开发仿生载体,尤其是血小板。血小板在各类肿瘤的发生、发展和转移中扮演着重要角色,这源于血小板和肿瘤细胞的相互作用[6]。血小板膜(platelet membrane,PM)仿生修饰的纳米粒在肿瘤靶向治疗中具有广阔的应用前景,探讨PM仿生修饰纳米粒在肿瘤PTT中的优势具有重要意义。
本研究制备了载吲哚菁绿血小板膜仿生脂质体(indocyanine green-loaded platelet membrane biomimetic liposome,ICG-PLP),并初步探索了其对非小细胞肺癌、黑色素瘤、乳腺癌的PTT效果,现报告如下。
1 材料和方法 1.1 细胞、试剂与仪器细胞均购自中国科学院上海生命科学研究院。
胆固醇(美国Sigma公司),BCA蛋白定量试剂盒、维生素E聚乙二醇琥珀酸酯(D-α-tocopheryl polyethylene glycol 1000 succinate,TPGS)、磷脂(大连美仑生物技术有限公司),甲醇、二氯甲烷(成都市科隆化学品有限公司),SDS-PAGE快速制备试剂盒(上海雅酶生物医药科技有限公司),考马斯亮蓝R250(上海麦克林生化科技有限公司),亲脂性羰花青染料(1,1’-dioctadecyl-3,3,3’,3’-tetramethylindodicarbocyanine, 4-chlorobenzenesulfonatesalt;DiD)(北京兰博利德生物技术有限公司),DMEM、RPMI 1640培养基(美国Gibco公司),FBS(内蒙古奥普赛生物科技有限公司),MTT(北京索莱宝科技有限公司)。
精密分析电子天平(德国Sartorius公司),激光器(长春镭仕光电科技有限公司),TU-1810SPC型紫外分光光度计(北京析普通用公司),低温离心机、Varioskan LUX型多功能酶标仪(美国Thermo Scientific公司),Zetasizer Nano型激光粒度仪(英国Malvern仪器有限公司),RV10型旋转蒸发仪(德国IKA公司),电泳仪(美国Bio-Rad公司),TCS SP8型激光共聚焦扫描显微镜(德国Leica公司),HT7700型透射电子显微镜(日本Hitachi公司)。
1.2 细胞培养小鼠巨噬细胞RAW264.7、人非小细胞肺癌细胞A549、小鼠黑色素瘤细胞B16-F10、人脐静脉内皮细胞(human umbilical vein endothelialcell,HUVEC)用含有10% FBS和1%青霉素、链霉素的DMEM在5% CO2、37 ℃条件下培养。小鼠乳腺癌细胞4T1用含有10% FBS和1%青霉素、链霉素的RPMI 1640培养基在5% CO2、37 ℃条件下培养。
1.3 实验动物清洁级SD大鼠[体重(200±20)g,雌性]由西南医科大学实验动物中心提供并饲养,实验动物生产许可证号为SCXK(川)2023-0017,实验动物使用许可证号为SYXK(川)2023-0065。
1.4 ICG-PLP的制备称取1 mg ICG、8 mg胆固醇、40 mg磷脂和1 mg TPGS至圆底烧瓶中,加4 mL二氯甲烷溶解,随后于旋转蒸发仪上减压蒸发至形成均匀透明薄膜;然后加入2 mL PBS,搅拌至形成均匀混悬液,水浴超声5 min,即得载ICG脂质体(liposome,LP)ICG-LP[7]。采用梯度离心法[3]提取分离大鼠全血中的血小板,提取后的大鼠血小板经过反复冻融、100 W超声5 min得到PM。将PM和ICG-LP在黑暗中孵育30 min,再经100 W超声5 min即得ICG-PLP。用激光粒度仪检测ICG-PLP的粒径、多分散系数和zeta电位,用透射电子显微镜观察ICG-PLP形貌。
1.5 ICG-PLP包封率的测定采用文献[7-8]的方法。取ICG-PLP混悬液置于超滤管中,于14 000×g4 ℃离心30 min。滤出液经稀释处理后,采用紫外分光光度计于793 nm波长处测定其光密度,计算ICG-PLP中游离ICG的含量(W1)。另取同批次、同体积的ICG-PLP混悬液,稀释破乳后测定其光密度,计算ICG-PLP中含有的总ICG含量(W2)。包封率(%)=(W2-W1)/W2×100%。
1.6 SDS-PAGE考察ICG-PLP中PM全蛋白用BCA蛋白定量试剂盒检测ICG-PLP和PM中的蛋白质浓度后,加入蛋白上样缓冲液,于95 ℃加热5 min。处理后的样品经10% SDS-PAGE分离,凝胶采用考马斯亮蓝溶液染色以观察膜蛋白条带。
1.7 ICG-PLP光热能力初步考察(1)光热性能:分别配制ICG浓度为15、20、25 μg/mL的ICG-PLP混悬液各1 mL,置于比色皿中,采用808 nm近红外光照射300 s(2 W/cm2),照射期间每隔30 s记录1次温度。
(2)光热稳定性:分别配制25 μg/mL的ICG溶液和同等ICG浓度的ICG-PLP混悬液各1 mL,置于比色皿中,采用808 nm近红外光(2 W/cm2)照射5 min,等待温度下降至室温,在此期间每隔1 min记录1次温度,共进行3个开/关循环。
1.8 细胞摄取实验评估巨噬细胞RAW264.7及肿瘤细胞A549、B16-F10、4T1对仿生制剂的摄取情况。将ICG替换为DiD,按1.4节方法制备DiD标记的LP和DiD标记的血小板膜仿生脂质体(platelet membrane biomimetic liposome,PLP)。将RAW264.7细胞及肿瘤细胞以5×104个/皿的密度接种于激光共聚焦皿中,于37 ℃培养过夜。随后分别在激光共聚焦皿中加入DiD标记的LP和PLP。孵育4 h后,用PBS轻柔洗涤细胞,随后采用4%多聚甲醛固定液固定细胞,再用10 μg/mL Hoechst 33342溶液对细胞核染色。处理后的细胞经PBS洗涤后,采用激光共聚焦显微镜观察。
1.9 MTT法评估ICG-PLP体外抗肿瘤效果A549、B16-F10、4T1细胞以5 000个/孔的密度接种于96孔板中,于37 ℃培养过夜。随后加入不同浓度的ICG、ICG-LP、ICG-PLP溶液(ICG浓度分别为0、2.5、5、10、15 μg/mL)与细胞孵育4 h,经808 nm近红外光照射5 min(2 W/cm2),对照细胞不予任何处理,继续培养至24 h,用MTT法检测细胞活力。
1.10 溶血实验将2%红细胞混悬液(500 μL)分别与等体积200、400、600、800、1 000 μg/mL的ICG-PLP溶液混合,于37 ℃下避光孵育2 h。同时,分别用2% Triton溶液(阳性对照组)、0.9% NaCl溶液(阴性对照组)与2%红细胞混悬液孵育。孵育完毕后于400×g离心10 min,并在540 nm波长处测定上清液的光密度,按公式计算溶血率[9]:溶血率(%)=(As-An)/(Ap-An)×100%,其中As、An和Ap分别代表样品、阴性对照、阳性对照的光密度值。
1.11 细胞相容性考察HUVEC以5 000个/孔的密度接种于96孔板中,于37 ℃培养过夜。随后加入0、200、400、600、800、1 000 μg/mL的ICG-PLP溶液与细胞孵育24 h,采用MTT法检测细胞活力。
1.12 大鼠体内血液循环考察12只SD大鼠随机分为3组,每组4只,分别通过尾静脉注射游离ICG、ICG-LP、ICG-PLP(剂量为2.5 mg/kg,以ICG计)。在给药后0.16、1、2、3、4、5 h于大鼠眼眶后静脉丛取血至肝素化离心管中,并于900×g离心10 min,收集上层血浆样品,用多功能酶标仪检测血浆样品中ICG的荧光强度。
1.13 统计学处理使用GraphPad Prism 8进行数据分析,数据以x±s表示,多组间比较采用单因素方差分析,多重比较采用Tukey检验。检验水准(α)为0.05。
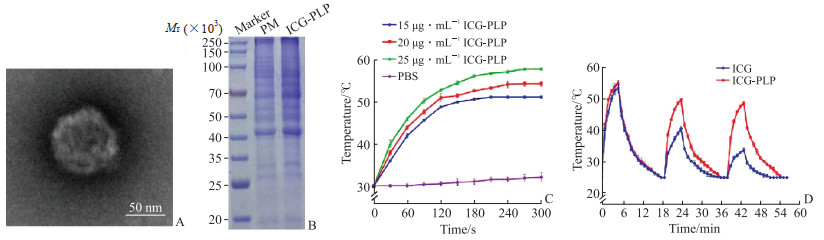
2 结果 2.1 ICG-PLP理化特性考察所制备的ICG-PLP平均粒径为(109.77±0.76)nm,平均zeta电位为(-21.23±0.84)mV,多分散系数为0.22±0.01,平均包封率为(97.68±0.01)%。通过透射电子显微镜观察到ICG-PLP为类球形结构(图 1A),与文献[3]报道的PLP类似。SDS-PAGE结果(图 1B)显示ICG-PLP具备与PM相似的蛋白质条带,提示仿生制剂ICG-PLP制备成功。如图 1C所示,经过近红外光照射后,ICG-PLP升温显著,且与ICG的浓度呈正相关。ICG浓度为15、20、25 μg/mL时,ICG-PLP温度可分别升至大约51.17、54.33、57.83 ℃。光热稳定性实验结果显示,经过3个近红外光照射周期后ICG-PLP仍有很强的产热能力,其光热稳定性比游离ICG高(图 1D)。
|
图 1 ICG-PLP理化性质初步考察 Fig 1 Preliminary investigation for physicochemical properties of ICG-PLP A: The morphology of ICG-PLP observed by transmission electron microscope; B: The sodium dodecylsulfate-polyacrylamide gel electrophoresis results of PM and ICG-PLP; C: Temperature curves of ICG-PLP irradiated by 2 W/cm2 near-infrared ray at different concentrations of ICG (n=3, x±s); D: Temperature curves of free ICG and ICG-PLP irradiated by 3 cycles of near-infrared ray (n=3, x±s). ICG-PLP: ICG-loaded platelet membrane biomimetic liposome; ICG: Indocyanine green; PM: Platelet membrane; PBS: Phosphate buffered saline. |
2.2 细胞摄取
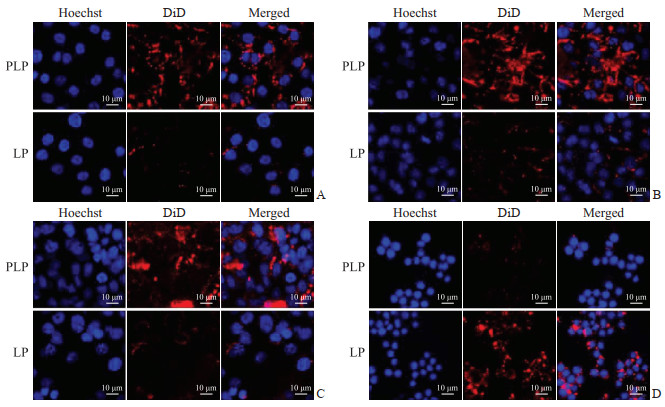
如图 2显示,PLP能被肿瘤细胞大量摄取。与普通纳米粒LP组比较,巨噬细胞对PLP摄取较少。结果表明PM仿生修饰能帮助纳米粒躲避巨噬细胞吞噬,促进药物靶向至肿瘤细胞。
|
图 2 肿瘤细胞和巨噬细胞对PLP的摄取 Fig 2 Uptake of PLP by tumor cells and macrophages A: Tumor cell A549; B: Tumor cell B16-F10; C: Tumor cell 4T1; D: Macrophage RAW264.7. PLP: Platelet membrane biomimetic liposome; LP: Liposome. |
2.3 肿瘤杀伤效果评价
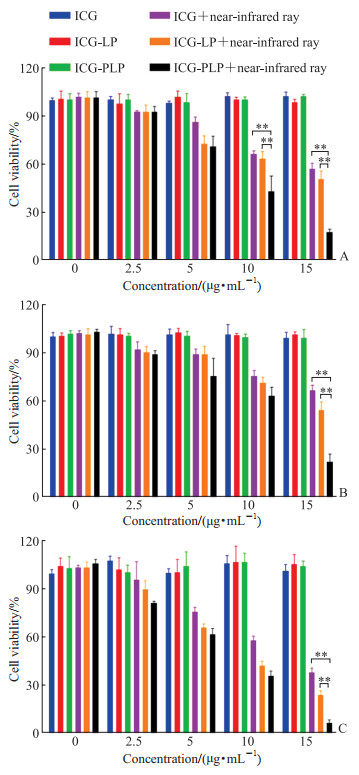
如图 3所示,在近红外光照射下ICG-LP和ICG-PLP展示出较强的细胞杀伤能力;随着ICG浓度升高,ICG制剂的细胞毒性逐渐增强。在近红外光照射下,ICG浓度为15 μg/mL时,ICG-PLP对肿瘤细胞A549、B16-F10、4T1的杀伤效果强于ICG-LP和游离ICG(均P<0.01),提示ICG-PLP具有很强的光毒性,能用于肿瘤治疗。
|
图 3 游离ICG、ICG-LP和ICG-PLP在无或有近红外光照射下对肿瘤细胞的细胞毒性 Fig 3 Cytotoxicity of free ICG, ICG-LP, and ICG-PLP on tumor cells in absence or presence of near-infrared ray irradiation A: A549; B: B16-F10; C: 4T1. **P<0.01. n=5, x±s. ICG: Indocyanine green; ICG-LP: ICG-loaded liposome; ICG-PLP: ICG-loaded platelet membrane biomimetic liposome. |
2.4 大鼠体内循环时间考察
ICG-PLP在大鼠体内的滞留时间比游离ICG、ICG-LP长(P<0.01)。给药3 h后,ICG组几乎检测不到荧光信号;给药4 h后,ICG-LP组也几乎检测不到荧光信号;给药5 h后,ICG-PLP组仍能检测到荧光信号。见图 4。

|
图 4 尾静脉注射ICG、ICG-LP、ICG-PLP的大鼠血浆样本的相对荧光强度 Fig 4 Relative fluorescence intensities of plasma samples from rats injected with ICG, ICG-LP, or ICG-PLP via tail vein **P < 0.01 vs ICG group or ICG-LP group at the same time point. n=4, x±s. ICG: Indocyanine green; ICG-LP: ICG-loaded liposome; ICG-PLP: ICG-loaded platelet membrane biomimetic liposome. |
2.5 安全性评价
在0~1 000 μg/mL的浓度范围内,ICG-PLP并未造成明显溶血,其溶血率均低于5%。采用MTT法考察仿生制剂与HUVEC的相容性,结果显示ICG-PLP对HUVEC活力无明显影响。结果表明ICG-PLP的安全性较好。
3 讨论ICG具有很好的光热转换率,但稳定性差,在水溶液中其结构会产生变化,影响其光学特性。本研究中ICG-PLP增强了ICG的光热稳定性,结果与文献报道[8]一致,这可能与纳米材料包裹ICG分子形成保护层从而将ICG与周围水环境隔离有关。ICG-PLP保留了大部分的PM蛋白,能够模仿血小板的功能。细胞摄取实验表明巨噬细胞对仿生纳米粒的吞噬较少,提示该纳米粒可通过PM伪装降低自身免疫原性,减少免疫系统的吞噬清除。其机制可能与PM上的CD47有关,CD47通过和巨噬细胞表面抑制性受体信号调节蛋白α结合,向巨噬细胞发送“不吃我”信号[10]。此外,CD47能延长仿生纳米粒的体内血液循环时间[11]。ICG半衰期短,在体内被迅速清除,本研究中ICG-PLP能延长ICG的体内循环时间,这一结果与巨噬细胞摄取实验结果相互印证。基于血小板的生理特性,PM修饰能促进仿生纳米粒被肿瘤细胞A549、B16-F10、4T1摄取。A549[12]、B16-F10[13]、4T1[14]均为表达CD44受体的肿瘤细胞,PM上的P-选择素能和肿瘤细胞上的CD44特异性结合[3],促进仿生纳米粒被肿瘤细胞内化。因此,本研究中的仿生纳米粒显示出对A549、B16-F10、4T1等肿瘤细胞良好的靶向性。
在近红外光照射下ICG-PLP发挥了明显的抗肿瘤效果,对A549、B16-F10、4T1细胞的杀伤能力比游离ICG和ICG-LP强,原因可能为:(1)将ICG制备成ICG-PLP增强了ICG的光热稳定性,有助于增强PTT效果;(2)PM修饰促进了肿瘤细胞对仿生纳米粒的摄取,大量ICG蓄积在肿瘤细胞内可发挥更好的光毒性。安全性考察实验显示ICG-PLP的溶血率低于5%,表明其对红细胞无毒性作用[9],同时对HUVEC几乎不造成损伤,安全性较好,该结果与文献报道[15]一致。这主要由于ICG-PLP采用的LP材料具有良好的生物相容性,且表面修饰的PM取自生物体内,因此几乎没有不良反应。
综上所述,仿生制剂ICG-PLP具有优良的光热性能和生物相容性,PM仿生修饰使其躲避巨噬细胞吞噬,延长药物在体内的作用时间,促进药物被肿瘤细胞(A549、B16-F10和4T1)识别摄取,通过PTT策略杀伤肿瘤细胞,具有高效靶向抗肿瘤的潜力。后期将开展体内靶向验证、体内光热效果考察、药效学评价及相关机制的研究。
| [1] |
CHEN J, ZHANG X, ZHANG J, et al. Multifunctional hydrogel for synergistic reoxygenation and chemo/photothermal therapy in metastatic breast cancer recurrence and wound infection[J]. J Control Release, 2024, 365: 74-88. DOI:10.1016/j.jconrel.2023.11.024 |
| [2] |
FAN Y, LI F, ZOU H, et al. Photothermal effect of indocyanine green modified scaffold inhibits oral squamous cell carcinoma and promotes wound healing[J]. Biomater Adv, 2022, 137: 212811. DOI:10.1016/j.bioadv.2022.212811 |
| [3] |
WAN S, FAN Q, WU Y, et al. Curcumin-loaded platelet membrane bioinspired chitosan-modified liposome for effective cancer therapy[J]. Pharmaceutics, 2023, 15(2): 631. DOI:10.3390/pharmaceutics15020631 |
| [4] |
XU H Z, LI T F, MA Y, et al. Targeted photodynamic therapy of glioblastoma mediated by platelets with photo-controlled release property[J]. Biomaterials, 2022, 290: 121833. DOI:10.1016/j.biomaterials.2022.121833 |
| [5] |
XIA Z, MU W, YUAN S, et al. Cell membrane biomimetic nano-delivery systems for cancer therapy[J]. Pharmaceutics, 2023, 15(12): 2770. DOI:10.3390/pharmaceutics15122770 |
| [6] |
KUNDE S S, WAIRKAR S. Platelet membrane camouflaged nanoparticles: biomimetic architecture for targeted therapy[J]. Int J Pharm, 2021, 598: 120395. DOI:10.1016/j.ijpharm.2021.120395 |
| [7] |
YI H, LU W, LIU F, et al. ROS-responsive liposomes with NIR light-triggered doxorubicin release for combinatorial therapy of breast cancer[J]. J Nanobiotechnology, 2021, 19(1): 134. DOI:10.1186/s12951-021-00877-6 |
| [8] |
LI M, BIAN X, CHEN X, et al. Multifunctional liposome for photoacoustic/ultrasound imaging-guided chemo/photothermal retinoblastoma therapy[J]. Drug Deliv, 2022, 29(1): 519-533. DOI:10.1080/10717544.2022.2032876 |
| [9] |
LI T, JING P, YANG L, et al. CAQK modification enhances the targeted accumulation of metformin-loaded nanoparticles in rats with spinal cord injury[J]. Nanomed-Nanotechnol Biol Med, 2022, 41: 102526. DOI:10.1016/j.nano.2022.102526 |
| [10] |
CHEN H, LUO X, CAI W, et al. Biomimetic copper-doped polypyrrole nanoparticles for enhanced cancer low-temperature photothermal therapy[J]. Int J Nanomedicine, 2023, 18: 7533-7541. DOI:10.2147/IJN.S428344 |
| [11] |
WAN G, CHEN X, GOU R, et al. Platelet membrane-based biochemotactic-targeting nanoplatform combining PDT with EGFR inhibition therapy for the treatment of breast cancer[J]. Biomater Sci, 2024, 12(3): 691-709. DOI:10.1039/d3bm01627g |
| [12] |
GUO B, WEI J, WANG J, et al. CD44-targeting hydrophobic phosphorylated gemcitabine prodrug nanotherapeutics augment lung cancer therapy[J]. Acta Biomater, 2022, 145: 200-209. DOI:10.1016/j.actbio.2022.04.016 |
| [13] |
YANG S, WONG K H, HUA P, et al. ROS-responsive fluorinated polyethyleneimine vector to co-deliver shMTHFD2 and shGPX4 plasmids induces ferroptosis and apoptosis for cancer therapy[J]. Acta Biomater, 2022, 140: 492-505. DOI:10.1016/j.actbio.2021.11.042 |
| [14] |
WANG T, YU Y, WANG B, et al. Photothermal hyaluronic acid composite hydrogel targeting cancer stem cells for inhibiting recurrence and metastasis of breast cancer[J]. Int J Biol Macromol, 2023, 252: 126358. DOI:10.1016/j.ijbiomac.2023.126358 |
| [15] |
LIU G, ZHAO X, ZHANG Y, et al. Engineering biomimetic platesomes for pH-responsive drug delivery and enhanced antitumor activity[J]. Adv Mater, 2019, 31(32): e1900795. DOI:10.1002/adma.201900795 |
 2024, Vol. 45
2024, Vol. 45


