随着肿瘤治疗技术发展,肿瘤患者生存期显著延长。但肿瘤进展导致的中晚期癌痛往往发展为难治性疼痛,严重影响患者生活质量[1]。鞘内药物输注系统(intrathecal drug delivery system,IDDS)是一种全新的给药方式,将镇痛药物从植入体内的输注泵精准输注到脊柱神经鞘内,药物直接作用于脊髓背角阿片受体,避免了胃肠道首过效应和血脑屏障,使缓解疼痛所需药物剂量只有常规口服剂量的1/300,显著减少了全身大剂量使用阿片类药物的不良反应[2]。对于口服吗啡当量超过200 mg/d、无法耐受或疼痛控制不佳的患者,WHO和2017年多模式镇痛共识会议(the Polyanalgesic Consensus Conference,PACC)推荐植入IDDS[3-4]。吗啡和氢吗啡酮是目前指南推荐的一线药物,但15%~20%的患者存在吗啡持续性药物不良反应或增加剂量无效,此时可考虑镇痛作用更强、副作用更小的氢吗啡酮替代[5]。目前国内使用IDDS治疗癌痛患者的临床数据匮乏[6],本研究对鞘内输注吗啡或氢吗啡酮治疗癌痛的有效性和安全性的随机对照试验(randomized controlled trial,RCT)进行meta分析,以期为临床提供循证参考。
1 资料和方法 1.1 纳入与排除标准 1.1.1 纳入标准(1)研究人群:诊断为癌痛且采用鞘内药物输注疗法的患者,不限年龄、性别、国籍、肿瘤类型,随访时间不定。(2)研究类型:RCT。(3)干预措施:采用IDDS输注氢吗啡酮或吗啡疗法。(4)结局指标:视觉模拟量表(visual analogue scale,VAS)评分、数字评分法(numerical rating scale,NRS)评分、每日给药剂量、暴发痛发生次数、不良反应发生率。(5)国内外公开发表的中英文文献。
1.1.2 排除标准(1)研究设计不合理,无法获取全文或数据无法提取的文献。(2)重复试验(取最新研究)、综述、经验介绍、病例报告、护理性研究、动物实验。(3)联合其他治疗方式、药物等。
1.2 检索策略 1.2.1 检索范围检索知网(CNKI)、万方数据、维普网、CBM、PubMed、Cochrane Library、Ovid等中英文文献数据库,检索时限从建库至2023年8月31日。
1.2.2 检索词中文以“注射,脊髓”“鞘内药物输注系统”“癌性疼痛”“氢吗啡酮”“吗啡”等为检索词,英文以“injections, spinal”“intrathecal drug delivery system”“cancer pain”“hydromorphone”“morphine”“randomized controlled trial”等为检索词,采用布尔逻辑运算符将主题词与自由词组合检索,同时查阅相关综述对文献进行补充。
1.3 文献数据提取及质量评价 1.3.1 数据提取由2位研究者独立进行数据筛选及提取,首先使用NoteExpress 3.0软件剔除重复题录,然后通过阅读题目及摘要进行人工初筛。若题目及摘要不能判断时下载全文阅读。若产生不同意见则寻求第3位研究者一起讨论并达成一致。提取的资料包括纳入研究的基本信息、研究对象及干预措施、偏移风险评估、结局指标和结果测量数据。
1.3.2 质量评价由2位研究者根据Cochrane偏倚风险评价工具对RCT进行独立评估,质量评价内容主要包括随机方法、分配方案隐藏、盲法、结果数据完整与否、选择性报告及其他偏倚来源等。每项风险评估包括“高”“低”“不清楚”。若2位研究者对结果产生分歧,则由第3位研究者进行判定。
1.4 结局指标结局指标主要包括疼痛评分、生活质量评分、免疫学指标及不良反应发生率等。
1.5 统计学处理采用RevMan 5.4.1软件进行分析,疼痛评分与暴发痛发生次数采用均数差(mean difference,MD)描述,必要时采用标准化均差(standardized mean difference,SMD)描述,不良反应发生率采用RR描述。以95% CI表示总体参数的估计区间。用Q检验和I2统计量计算异质性。在没有显著异质性(P>0.1、I2≤50%)的情况下,采用固定效应模型进行汇总分析;若研究异质性显著(P≤0.1、I2>50%),则采用随机效应模型并进行描述性分析。采用Z检验对合并统计量进行分析。用漏斗图判断发表偏倚。检验水准(α)为0.05。
2 结果 2.1 文献检索结果共检索到49篇文献,剔除重复发表文献、综述、动物实验等不符合要求的文献后,最终共纳入6篇RCT研究[7-12]。文献筛选流程图见图 1。

|
图 1 文献筛选流程图 Fig 1 Flow chart of literature screen |
2.2 纳入文献的基本特征
6篇RCT[7-12]中共纳入544例患者,其中氢吗啡酮组282例、吗啡组262例。纳入文献的基本特征见表 1。
|
|
表 1 纳入文献的基本特征 Tab 1 Basic characteristics of literatures included in this study |
2.3 纳入文献的质量评价结果
纳入的6篇文献[7-12]均为RCT,有2项研究[7, 9]中的5例患者中途因死亡或其他原因剔除,文献中均详细描述了剔除数目和理由,因此可认为没有不完整数据偏倚,纳入文献总体质量较高。见图 2。

|
图 2 纳入文献的Cochrane质量评价结果 Fig 2 Cochrane quality evaluation results of literatures included in this study |
2.4 meta分析结果 2.4.1 临床疗效
纳入的6项研究[7-12]中均采用疼痛评分作为临床疗效指标,其中3项研究[8-9, 11]采用VAS评估,3项研究[7, 10, 12]采用NRS评估。5项研究[7, 9-12]在试验前对基线疼痛评分进行了组间比较,纳入了治疗前数据,异质性分析结果为P=0.91、I2=0%,提示结果无异质性,固定效应模型meta分析结果显示氢吗啡酮和吗啡组的基线疼痛评分差异无统计学意义(SMD=0.05,95% CI -0.22~0.31,P=0.73)。5项研究[7, 9-12]统计了治疗1 d后疼痛评分(P=0.25,I2=27%),2项研究[9, 12]统计了治疗3 d后疼痛评分(P=0.16,I2=48%),结果均无异质性,采用固定效应模型分析;2项研究[11-12]统计了治疗7 d后疼痛评分(P=0.04,I2=76%),采用随机效应模型分析。meta分析结果显示,两组在治疗1 d后(SMD=-0.22,95% CI -0.48~0.05,P=0.10)、治疗3 d后(SMD=-0.25,95% CI -0.60~0.09,P=0.15)、治疗7 d后(SMD=-0.33,95% CI -1.02~0.36,P=0.35)的疼痛评分差异均无统计学意义。见图 3。1项研究[7]纳入了患者治疗后1、2及3个月的疼痛评分,结果显示两组均较治疗前有所改善(均P<0.01)。1项研究[8]对平均每日VAS评分按周进行比较,结果显示两组间差异无统计学意义(P>0.05)。

|
图 3 鞘内输注氢吗啡酮对比吗啡治疗癌痛临床疗效的meta分析结果 Fig 3 Meta-analysis of clinical efficacy of intrathecal hydromorphone versus morphine in treatment of cancer pain A: Pain score before treatment; B: Pain score 1 d after treatment; C: Pain score 3 d after treatment; D: Pain score 7 d after treatment. SD: Standard deviation; Std.: Standardized; IV: Inverse variance; 95% CI: 95% confidence interval. |
2.4.2 暴发痛发生次数
3项研究[7, 11-12]比较了氢吗啡酮和吗啡两组治疗前与治疗1 d后暴发痛发生次数。治疗前暴发痛发生次数异质性分析结果为P=0.33、I2=9%,提示结果无异质性,固定效应模型meta分析结果显示两组治疗前暴发痛发生次数差异无统计学意义(MD=-0.29,95% CI -0.77~0.19,P=0.24)。治疗1 d后暴发痛发生次数(P=0.03、I2=73%)采用随机效应模型分析,meta分析结果显示两组间差异无统计学意义(SMD=-0.05,95% CI -0.63~0.53,P=0.87)。2项研究[11-12]比较了两组治疗7 d后暴发痛发生次数(P=0.03、I2=80%),随机效应模型meta分析结果显示两组间差异无统计学意义(SMD=-0.56,95% CI -1.32~0.19,P=0.14)。见图 4。
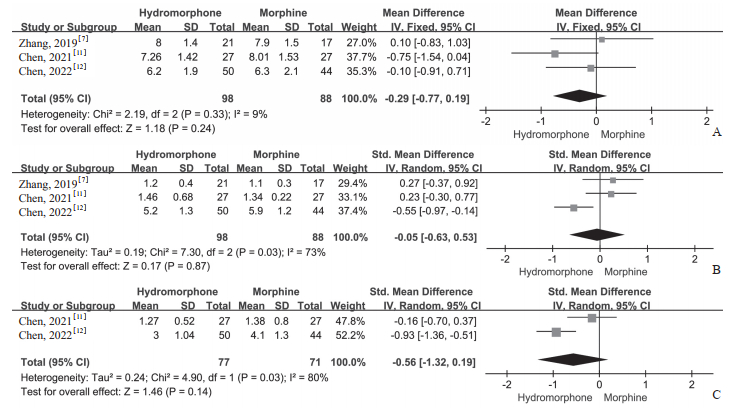
|
图 4 鞘内输注氢吗啡酮对比吗啡治疗癌痛暴发痛发生次数的meta分析结果 Fig 4 Meta-analysis of number of cancer breakthrough pain episodes of intrathecal hydromorphone versus morphine in treatment of cancer pain A: Number of breakthrough pain episodes before treatment; B: Number of breakthrough pain episodes 1 d after treatment; C: Number of breakthrough pain episodes 7 d after treatment. SD: Standard deviation; Std.: Standardized; IV: Inverse variance; 95% CI: 95% confidence interval. |
2.4.3 安全性评估
(1)恶心呕吐:共纳入5项研究[7, 9-12]。固定效应模型meta分析结果显示,氢吗啡酮组恶心呕吐发生率低于吗啡组(RR=0.44,95% CI 0.29~0.67,P=0.000 2)(图 5A)。1项研究[8]以百分数表示恶心呕吐的发生率,两组间差异无统计学意义(P>0.05)。
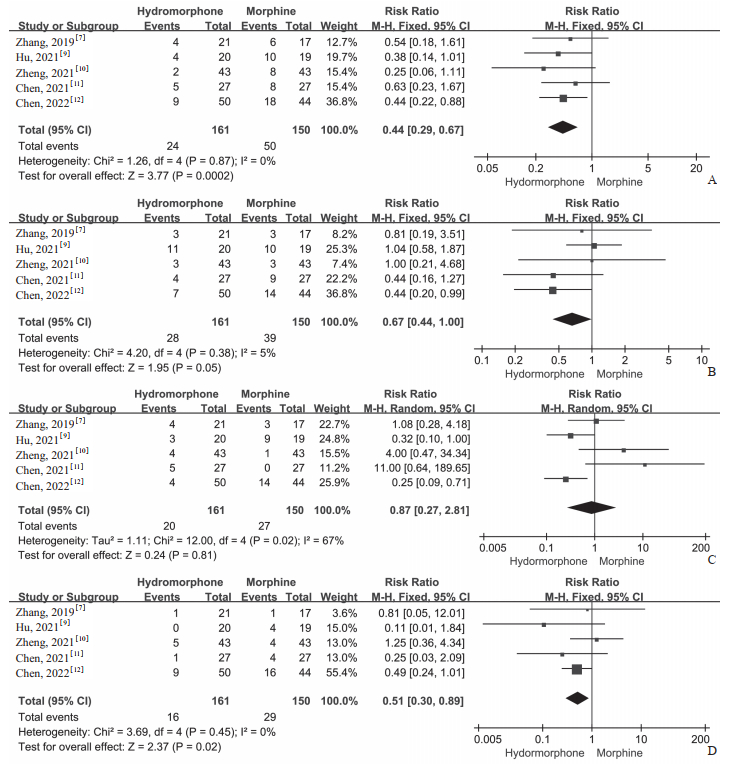
|
图 5 鞘内注射氢吗啡酮对比吗啡治疗癌痛不良反应发生率的meta分析结果 Fig 5 Meta-analysis results of adverse effects of intrathecal hydromorphone versus morphine in treatment of cancer pain A: Incidence of nausea and vomiting; B: Incidence of constipation; C: Incidence of itching; D: Incidence of somnolence. M-H: Mantel-Haenszel; 95% CI: 95% confidence interval. |
(2)便秘:共纳入5项研究[7, 9-12]。固定效应模型meta分析结果显示,氢吗啡酮组便秘发生率低于吗啡组(RR=0.67,95% CI 0.44~1.00,P=0.05,图 5B)。1项研究[8]以百分数表示便秘发生率,两组间差异无统计学意义(P=0.055)。
(3)瘙痒:共纳入5项研究[7, 9-12]。随机效应模型meta分析结果显示,氢吗啡酮组瘙痒发生率与吗啡组比较差异无统计学意义(RR=0.87,95% CI0.27~2.81,P=0.81,图 5C)。
(4)嗜睡:共纳入5项研究[7, 9-12]。固定效应模型meta分析结果显示,氢吗啡酮组嗜睡发生率低于吗啡组(RR=0.51,95% CI 0.30~0.89,P=0.02,图 5D)。
(5)其他:1项研究[9]报道了呼吸抑制,其中氢吗啡酮组0例、吗啡组2例(10.5%)。1项研究[7]吗啡组4例患者因增加吗啡剂量后仍镇痛效果不佳,施行氢吗啡酮药物轮换而剔除入组;且在研究随访期间,吗啡组3例患者和氢吗啡酮组4例患者因肿瘤相关并发症死亡,由于统计数据截止死亡前且与治疗方法无关,故仍纳入研究。1项研究[9]吗啡组有1例患者在研究过程中死亡,剔除入组。
2.4.4 生活质量1项研究[8]采用广泛焦虑障碍量表(generalized anxiety disorder-7,GAD-7)、患者健康问卷-9(patient health questionnaire-9,PHQ-9)评估患者治疗前后的生活质量,两组间差异无统计学意义(P>0.05)。2项研究[9-10]采用生活质量评分工具评估患者生活质量,与治疗前基线比较,两组治疗后生活质量评分均无明显变化(均P>0.05);其中1项研究[9]采用生活质量评分量表(qualify of life scale,QOL),两组治疗后15 d的QOL评分均高于治疗前(均P<0.01);1项研究[10]采用卡氏功能状态(Karnofsky performance status,KPS)评分,氢吗啡酮组和吗啡组治疗后KPS评分均高于治疗前[(65.2±15.8)分vs(45.1±8.3)分、(58.4±11.3)分vs(45.4±9.4)分,均P<0.01],且治疗后氢吗啡酮组生活质量优于吗啡组(P<0.05)。
2.4.5 其他临床疗效1项研究[8]采用镇痛药物剂量变化百分比及患者自控镇痛(patient-controlled analgesia,PCA)按压次数作为临床疗效指标。从治疗第3周开始氢吗啡酮剂量较基线的变化值低于吗啡组,且随着时间的推移差异更加显著,直至试验终点(P<0.01)。氢吗啡酮组PCA按压次数较吗啡组减少(7.79% vs -19.88%,P<0.01)。
1项研究[9]采用疼痛缓解程度评分作为临床疗效指标,两组治疗后患者疼痛均得到完全缓解,但氢吗啡酮组与吗啡组的疼痛缓解程度比较差异无统计学意义[(4.9±0.3)分vs(4.7±0.4)分,P>0.05]。
1项研究[10]根据美国国立综合癌症网络癌症指南评定镇痛效果,氢吗啡酮组镇痛总有效率为79.1%(34/43),高于吗啡组的58.1%(25/43),差异有统计学意义(P<0.05)。
1项研究[10]采用Ramsay镇静评分作为疗效指标,氢吗啡酮组镇静评分高于吗啡组,差异有统计学意义(P<0.05)。1项研究[9]以15 d为研究周期,按公式(吗啡总量=氢吗啡酮剂量/3)换算氢吗啡酮注射剂量,以纳入患者应用的吗啡总量及研究周期内每例解救次数及解救药物用量作为疗效指标,氢吗啡酮组上述疗效指标均低于吗啡组,差异均有统计学意义(均P<0.05)。
2.5 发表偏倚由于每个结局指标纳入的RCT较少,因此未对异质性大的指标进行敏感性分析。对5项研究[7-9, 11-12]进行治疗前基线疼痛评分评估并进行发表偏倚分析,结果如图 6所示,由于病例来自不同的医院,漏斗图不对称,提示存在轻微的发表偏倚。
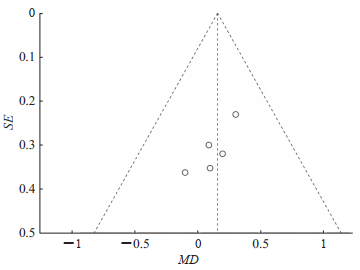
|
图 6 鞘内注射氢吗啡酮对比吗啡治疗癌痛的治疗前疼痛评分的发表偏倚漏斗图 Fig 6 Funnel plot of publication biases of pre-treatment pain score of intrathecal hydromorphone versus morphine for cancer pain SE: Standard error; MD: Mean difference. |
3 讨论
难治性癌痛指由肿瘤本身或肿瘤治疗相关因素导致的,经过规范化药物治疗后缓解程度不能使患者满意和/或患者不可耐受相关治疗而引起不良反应的疼痛[13]。对于癌痛暴发痛,目前国际普遍推荐英国和爱尔兰姑息治疗协会[14]在2009年发布的定义,是指在背景痛控制相对稳定、镇痛药物充分应用的前提下,自发或在某些可预知或不可预知因素的诱发下突然出现的短暂疼痛加重。有研究表明,暴发痛在癌症患者中的发生率可达33%~95%,暴发痛不仅影响患者的生活质量,也增加了医疗资源支出[15]。IDDS是一种微创的全身给药方式,将药物直接注入脑脊液是癌痛的新型治疗方式和常见阿片类药物用药方式的替代途径。
2017年PACC[3]及《难治性癌痛专家共识(2017年版)》[13]均建议,将吗啡、氢吗啡酮作为IDDS治疗的一线用药。吗啡作为阿片受体激动剂可阻断脊髓背角胶质细胞活性,减少背角传递的皮肤疼痛和上行通路传递的伤害性冲动,临床上已认可吗啡鞘内镇痛的有效性及高性价比。然而,《癌性暴发痛专家共识(2019年版)》[16]提到,常用于解救暴发痛的吗啡存在起效时间与暴发痛发作时间同步性不理想的问题,吗啡起效时间为30~60 min,而暴发痛在30 min内可得到缓解,吗啡无法有效缓解暴发痛。一项回顾性研究表明,使用鞘内吗啡镇痛的患者有15%~20%未得到有效的疼痛缓解[17]。氢吗啡酮主要作用于µ阿片受体,脂溶性高,易通过血脑屏障,起效快且作用强;氢吗啡酮不经由肾脏清除有活性的代谢产物,肝肾毒性低;此外,氢吗啡酮不会生成吗啡-6-葡糖苷酸(morphine-6-glucuronide,M-6-G),避免了M6G蓄积所引起的肾损伤及其他不良反应[18-19]。史学莲等[20]建议,若吗啡剂量超过40 mg/d或增量后镇痛效果仍欠佳时,可考虑更换为氢吗啡酮。临床指南建议当患者出现阿片类药物耐受时,应当首先考虑阿片类药物的轮换[2-3, 21]。Anderson等[22]的回顾性研究表明,当慢性非恶性疼痛患者使用鞘内输注吗啡镇痛效果不佳时,转换为氢吗啡酮后疼痛程度较前改善25%以上。以上研究结果提示,在难治性癌痛患者中,当出现吗啡耐受时,氢吗啡酮可能是良好的替代药物,为临床药物使用提供了更多选择。但是基于国内外文献检索,当前氢吗啡酮鞘内给药应用于难治性癌痛患者的RCT寥寥无几,与此同时,其治疗癌痛的有效性及安全性未达成共识,本研究针对现有RCT展开系统评价和meta分析。
本研究meta分析结果显示,氢吗啡酮与吗啡治疗后疼痛评分与暴发痛发生次数差异均无统计学意义。1项研究[8]统计了治疗后两组PCA按压次数及镇痛药物剂量变化百分比,氢吗啡酮组疗效优于吗啡组,提示随着时间的推移氢吗啡酮可实现与吗啡相同的暴发痛控制效果。美国一项志愿者研究显示,氢吗啡酮的临床应用优势可能比吗啡大,在研究剂量下氢吗啡酮起效快且镇痛效价更高[23]。考虑本研究meta分析中只有2项RCT进行第3天[9, 12]和第7天[11-12]疼痛评分,纳入样本量较小,可能存在偏倚。1项研究[7]统计了患者治疗后3个月的疼痛评分,结果显示两组差异无统计学意义。在安全性评价中,氢吗啡酮组中恶心呕吐、便秘和嗜睡发生率均低于吗啡组,提示氢吗啡酮的安全性可能优于吗啡。癌痛从生理、心理等多个方面影响患者的生活质量,导致整体生活质量下降[24]。调查显示有疼痛症状的癌症患者生活质量难以得到保障[25]。2项研究[9-10]报道了鞘内给药治疗后生活质量评分,结果显示氢吗啡酮组生活质量优于吗啡组,提示氢吗啡酮治疗可以改善患者的生活质量,但纳入文献较少,结果可能存在偏倚。1项研究[10]采用Ramsay镇静评分作为疗效指标,氢吗啡酮组Ramsay镇静评分高于吗啡组,提示氢吗啡酮的镇静效果可能优于吗啡。因不同研究对不良反应发生率和生活质量采用不同的评价指标,且有多个指标仅有1项RCT纳入,故某些结局指标只进行描述。此外,1项研究[9]报道鞘内用药15 d时,氢吗啡酮组氢吗啡酮用量换算成吗啡后消耗量低于吗啡组,提示鞘内应用氢吗啡酮治疗癌痛可以减少阿片类药物使用量,进而减少不良反应发生。鞘内应用氢吗啡酮有望使更多受癌痛困扰的患者受益。
本研究存在以下局限性:(1)纳入RCT较少,缺少客观指标,可能存在发表偏倚;(2)纳入研究中输注泵设置的参数不完全相同,使用阿片类药物的浓度也不完全相同,对结局指标可能存在一定干扰;(3)纳入研究患者的癌症类型不完全相同,且个体间对药物的敏感性存在差异,可能会不同程度影响结局指标;(4)结局指标比较分散,仅有个别研究纳入,较高的组间异质性导致敏感性分析实施较困难,影响结局指标分析及其准确性;(5)纳入研究未具体描述如何实施分配隐藏和盲法,可能存在实施、测量偏倚。
综上所述,本研究表明在3个月的随访期内鞘内输注氢吗啡酮治疗癌痛的疗效与吗啡相当;鞘内输注氢吗啡酮组患者的恶心呕吐、便秘和嗜睡发生率均低于吗啡组,患者的生活质量相对较高。但因受到纳入研究样本量和质量的限制,今后仍需更多高质量RCT进一步验证本研究结果。
| [1] |
胡夕春, 王杰军, 常建华, 等. 癌症疼痛诊疗上海专家共识(2017年版)[J]. 中国癌症杂志, 2017, 27(4): 312-320. DOI:10.19401/j.cnki.1007-3639.2017.04.012 |
| [2] |
CARACENI A, HANKS G, KAASA S, et al. Use of opioid analgesics in the treatment of cancer pain: evidence-based recommendations from the EAPC[J]. Lancet Oncol, 2012, 13(2): e58-e68. DOI:10.1016/S1470-2045(12)70040-2 |
| [3] |
DEER T R, POPE J E, HAYEK S M, et al. The Polyanalgesic Consensus Conference (PACC): recommendations on intrathecal drug infusion systems best practices and guidelines[J]. Neuromodulation, 2017, 20(2): 96-132. DOI:10.1111/ner.12538 |
| [4] |
MIGUEL R. Interventional treatment of cancer pain: the fourth step in the World Health Organization analgesic ladder?[J]. Cancer Control, 2000, 7(2): 149-156. DOI:10.1177/107327480000700205 |
| [5] |
梁平, 史学莲, 候娟, 等. 氢吗啡酮微创给药泵临床应用及稳定性研究进展[J]. 国际药学研究杂志, 2017, 44(3): 240-244. DOI:10.13220/j.cnki.jipr.2017.03.005 |
| [6] |
简文亭, 简道林, 马会改. 氢吗啡酮的临床应用[J]. 医药导报, 2014, 33(9): 1204-1207. DOI:10.3870/yydb.2014.09.025 |
| [7] |
张宇, 唐轶珣, 历欧, 等. 氢吗啡酮鞘内药物输注系统用于难治性癌痛病人的研究[J]. 中国疼痛医学杂志, 2019, 25(11): 823-830. DOI:10.3969/j.issn.1006-9852.2019.11.005 |
| [8] |
MA K, JIN Y, WANG L, et al. Intrathecal delivery of hydromorphone vs morphine for refractory cancer pain: a multicenter, randomized, single-blind, controlled noninferiority trial[J]. Pain, 2020, 161(11): 2502-2510. DOI:10.1097/j.pain.0000000000001957 |
| [9] |
胡阳, 王海宁, 林云凤, 等. 氢吗啡酮联合鞘内输注系统治疗难治性癌痛的临床观察[J]. 中国疼痛医学杂志, 2021, 27(10): 789-792. DOI:10.3969/j.issn.1006-9852.2021.10.014 |
| [10] |
郑留柱. 吗啡与氢吗啡酮(HM)治疗难治性癌痛患者的效果比较[J]. 华夏医学, 2021, 34(2): 127-130. DOI:10.19296/j.cnki.1008-2409.2021-02-035 |
| [11] |
陈晓倩, 范天仁. 氢吗啡酮和吗啡在重度癌痛患者鞘内自控镇痛中的应用分析[J]. 潍坊医学院学报, 2021, 43(3): 220-223. DOI:10.16846/j.issn.1004-3101.2021.03.018 |
| [12] |
陈彩霞, 杨昌卫, 邓敏. 鞘内持续泵注氢吗啡酮对老年顽固性癌痛患者的疼痛控制效果及安全性分析[J]. 中国实用医药, 2022, 17(12): 132-134. DOI:10.14163/j.cnki.11-5547/r.2022.12.044 |
| [13] |
王昆, 金毅. 难治性癌痛专家共识(2017年版)[J]. 中国肿瘤临床, 2017, 44(16): 787-793. DOI:10.3969/j.issn.1000-8179.20107.16.714 |
| [14] |
DAVIES A N, DICKMAN A, REID C, et al. The management of cancer-related breakthrough pain: recommendations of a task group of the Science Committee of the Association for Palliative Medicine of Great Britain and Ireland[J]. Eur J Pain, 2009, 13(4): 331-338. DOI:10.1016/j.ejpain.2008.06.014 |
| [15] |
DAVIES A, BUCHANAN A, ZEPPETELLA G, et al. Breakthrough cancer pain: an observational study of 1 000 European oncology patients[J]. J Pain Symptom Manag, 2013, 46(5): 619-628. DOI:10.1016/j.jpainsymman.2012.12.009 |
| [16] |
王昆. 癌性爆发痛专家共识(2019年版)[J]. 中国肿瘤临床, 2019, 46(6): 267-271. DOI:10.3870/j.issn.1004-0781.2021.01.002 |
| [17] |
PAICE J A, PENN R D, SHOTT S. Intraspinal morphine for chronic pain: a retrospective, multicenter study[J]. J Pain Symptom Manag, 1996, 11(2): 71-80. DOI:10.1016/0885-3924(95)00099-2 |
| [18] |
燕琳, 张传汉. 氢吗啡酮的药理作用及临床研究进展[J]. 中国疼痛医学杂志, 2015, 21(9): 701-703. DOI:10.3969/j.issn.1006-9852.2015.09.014 |
| [19] |
FELDEN L, WALTER C, HARDER S, et al. Comparative clinical effects of hydromorphone and morphine: a meta-analysis[J]. Br J Anaesth, 2011, 107(3): 319-328. DOI:10.1093/bja/aer232 |
| [20] |
史学莲, 高银粉, 宋姗姗, 等. 鞘内药物输注系统储药盒中氢吗啡酮浓度稳定性与临床意义[J]. 中国疼痛医学杂志, 2022, 28(10): 791-793. DOI:10.3969/j.issn.1006-9852.2022.10.013 |
| [21] |
SWARM R A, PAICE J A, ANGHELESCU D L, et al. Adult cancer pain, version 3. 2019, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2019, 17(8): 977-1007. DOI:10.6004/jnccn.2019.0038 |
| [22] |
ANDERSON V C, COOKE B, BURCHIEL K J. Intrathecal hydromorphone for chronic nonmalignant pain: a retrospective study[J]. Pain Med, 2001, 2(4): 287-297. DOI:10.1046/j.1526-4637.2001.01052.x |
| [23] |
MEISSNER K, DAHAN A, OLOFSEN E, et al. Morphine and hydromorphone effects, side effects, and variability: a crossover study in human volunteers[J]. Anesthesiology, 2023, 139(1): 16-34. DOI:10.1097/ALN.0000000000004567 |
| [24] |
SZE F K H, CHUNG T K, WONG E, et al. Pain in Chinese cancer patients under palliative care[J]. Palliat Med, 1998, 12(4): 271-277. DOI:10.1191/026921698666535718 |
| [25] |
彭鹏, 郑莹, 王杰军, 等. 癌痛患者的生活质量及其影响因素研究[J]. 中国肿瘤, 2009, 18(4): 273-277. |
 2024, Vol. 45
2024, Vol. 45


