2. 海军军医大学(第二军医大学)海军特色医学中心研究部,上海 200433
2. Department of Research, Naval Medical Center, Naval Medical University (Second Military Medical University), Shanghai 200433, China
随着潜水高气压暴露时间的延长,呼吸气体中的惰性气体会逐渐溶解于机体体液内,作业完成后的减压过程中,因压力降低导致溶解在体内的惰性气体逸出而产生气泡,这是导致潜水减压病的直接原因[1]。气泡产生的量与减压病发生的风险呈正相关,虽然随着减压方案的严格实施,潜水减压病的发生率显著下降,但是不管采用何种减压方案,减压后循环内仍会产生一定量的气泡,造成血管内皮细胞的损伤,从而影响血管功能[2]。因此,评价潜水对血管功能的影响及其变化规律越来越受到潜水医学研究者的关注。
血流介导的血管舒张(flow-mediated dilation,FMD)是一种内皮依赖性血管功能,常用于无创评估体内动脉(主要为肱动脉)的内皮功能[3]。本研究以5名潜水员为研究对象,检测其在40 m高压空气暴露前后肱动脉直径、FMD、收缩期峰值流速(systolic peak velocity,SPV)和阻力指数(resistance index,RI)等,以评估高压空气暴露对肱动脉功能的影响。
1 资料和方法 1.1 研究对象2023年6月选取5名潜水员作为受试者,均为男性,年龄为(24.8±3.1)岁,身高为(180.0±3.5)cm,体重为(74.4±7.2)kg,BMI为(22.9±1.9)kg/m2。
1.2 高气压暴露方案所有受试者均于本中心接受高气压暴露。采用空气加压至20 m,停留16 min;升压至40 m,停留16 min;减压至20 m,停留16 min;减压至18 m,停留9 min;随后每3 m一站,分别停留11、15、25、30和35 min。总计高气压暴露时间为190 min。
1.3 肱动脉功能检测于进舱前后,采用多普勒超声诊断仪(M8型,深圳迈瑞生物医疗电子股份有限公司)对肱动脉功能进行检测(图 1),主要检测指标为肱动脉直径、FMD、SPV和RI。受试者取仰卧位,手臂处于舒适的位置,将血压计袖带放置在肘窝上方,在肘窝上方检测基础水平的肱动脉内径。然后对袖带充气,压力超过收缩压至少50 mmHg(约180 mmHg,1 mmHg=0.133 kPa),充气后维持时间约5 min,随后对袖带放气。袖带放气前30 s到放气后2 min连续记录动脉的纵向图像,检测肱动脉最大直径。选取直径最大界面,检测同一部位肱动脉直径3次并取平均值,同时记录SPV和RI(图 1)。FMD的计算公式:FMD(%)=(反应性充血后肱动脉直径-反应性充血前肱动脉直径)/反应性充血前肱动脉直径×100%。
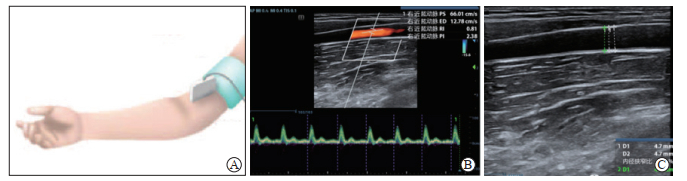
|
图 1 多普勒超声诊断仪检测肱动脉相关参数 A:肱动脉功能检测示意图;B:检测肱动脉收缩期峰值流速(SPV)和阻力指数(RI);C:检测肱动脉直径. |
1.4 统计学处理
应用SPSS 20.0软件进行统计学分析。对高气压暴露前后的数据进行正态性检验,数据符合正态分布,以x±s表示,组间比较采用配对t检验。检验水准(α)为0.05。
2 结果 2.1 肱动脉SPV的变化高气压暴露前和暴露后,2个阶段袖带放气后的潜水员肱动脉SPV与袖带充气前相比均呈现下降趋势,但差异无统计学意义(暴露前P=0.24,暴露后P=0.95)。高气压暴露后潜水员肱动脉SPV在袖带充气前和放气后较高气压暴露前均下降,差异有统计学意义(充气前P=0.04,充气后P=0.03)。见表 1。
|
|
表 1 高气压暴露前后潜水员肱动脉参数的变化 |
2.2 肱动脉RI的变化
高气压暴露前和暴露后,2个阶段袖带放气后的潜水员肱动脉RI较袖带充气前均有升高趋势,但差异无统计学意义(暴露前P=0.74,暴露后P=0.24)。高气压暴露后潜水员肱动脉RI在袖带充气前和放气后较高气压暴露前均呈升高趋势,但差异无统计学意义(充气前P=0.18,充气后P=0.10)。见表 1。
2.3 肱动脉直径的变化高气压暴露前和暴露后,2个阶段袖带放气后的潜水员肱动脉直径较袖带充气前均增加,差异有统计学意义(暴露前P=0.005,暴露后P=0.001)。高气压暴露后潜水员肱动脉直径在袖带充气前和放气后较高气压暴露前均有下降趋势,但差异无统计学意义(充气前P=0.09,充气后P=0.10)。见表 1。
2.4 肱动脉FMD的变化高气压暴露前和暴露后,潜水员的FMD为9%~20%。与高气压暴露前相比,高气压暴露后潜水员肱动脉FMD有升高趋势,但差异无统计学意义(P=0.79)。见表 1。
3 讨论潜水减压病是限制潜水作业效率的重要因素之一,而潜水减压过程中产生的气泡是导致潜水减压病的直接原因。随着潜水减压方案的不断完善和减压方案在潜水过程中的正确使用及严格执行,潜水减压病的发生率已明显下降[4]。然而,即使潜水作业后进行正常的减压,体内(主要是静脉系统)仍难以避免气泡的产生[5]。循环内的气泡与血管内皮细胞直接接触会导致内皮细胞的损伤,从而引起内皮细胞功能异常和血管功能障碍。研究发现,潜水作业后循环内内皮细胞相关的微粒含量显著增加,进一步说明减压对内皮细胞的损伤作用[6-7]。因此,潜水医学领域越来越多的研究关注潜水后减压对心血管功能的影响。
肱动脉和颈动脉是常用于评价血管功能的部位,而肱动脉检测更加常见。FMD是一种内皮依赖性功能,作为一种无创手段,越来越多的研究将其用于评估潜水减压对血管内皮功能的影响。本研究中潜水员的FMD为9%~20%。研究显示,FMD主要与内皮来源的一氧化氮有关[8]。内皮剥脱或采用一氧化氮合酶抑制剂可以影响动脉血管的FMD。一些研究通过给予外源性一氧化氮供体(如硝化甘油)确定最大血管舒张反应,评价血管平滑肌功能(内皮非依赖性血管舒张)[9-10]。
有研究将FMD计算为反应性充血后肱动脉直径与反应性充血前肱动脉直径比值的百分数[9]。国外一些研究观察了不同潜水方式(包括屏气潜水、自携式潜水和饱和潜水等)对FMD的影响[2, 11-12],但国内尚未有相关报道。有研究显示,潜水或高气压暴露后FMD平均下降4%~5%[5, 13],本研究中潜水员在高气压暴露后FMD稍有升高,原因尚不清楚。本研究显示,高气压暴露后基础状态下的肱动脉直径较正常值稍有下降,与前期研究[11]类似。高气压暴露后肱动脉直径的变化是否与暴露压力和时间有关尚不清楚,还有待更多大样本的研究证实。
SPV在脉冲多普勒图形上处于波峰部位,受血流推动力、阻力、管壁弹性、局部口径等因素的影响,推动力越大SPV越高,阻力越大SPV越低;局部口径变小(如狭窄)则局部SPV增高,而其他部位SPV相对较低。RI是反映血管阻力的参数,其数值越大代表阻力越大,这一参数反映阻力的大小比SPV更为灵敏[14]。本研究显示,不管是基线值还是高气压暴露后,袖带放气之后SPV稍有下降,而RI稍有升高。与高气压暴露前相比,高气压暴露后,袖带充气前和放气后的潜水员肱动脉SPV均下降(P<0.05),而RI呈升高趋势,这可能与肱动脉血管直径减小有关。这也从另一方面证实高气压暴露对血管功能具有一定的影响。
本研究显示,40 m高压空气暴露较短时间可导致肱动脉收缩,引起血流阻力增加、流速下降,但对肱动脉的功能影响较小,这可能与所采用的方案较为保守、减压时间较长有关。本研究中,潜水员在水下20 m停留16 min,最高压力下(40 m)停留16 min,随后的减压总时间为141 min(不包括各站间的移行时间)。按照我国空气潜水减压表的要求,减压总时间38 min;按照美国海军潜水手册空气潜水减压表要求,减压总时间为53 min 20 s。本研究的减压时间远远长于规定的安全减压时间。
本研究样本量较小,还需更多的研究证实本研究结果。近年来,越来越多的潜水作业采用水面吸氧减压方案,这不仅能缩短减压时间,同时也提高了减压的安全性,因此吸氧减压对血管功能的影响也有待进一步明确。
| [1] |
VANN R D, BUTLER F K, MITCHELL S J, et al. Decompression illness[J]. Lancet, 2011, 377(9760): 153-164. DOI:10.1016/S0140-6736(10)61085-9 |
| [2] |
IMBERT J P, EGI S M, BALESTRA C. Vascular function recovery following saturation diving[J]. Medicina, 2022, 58(10): 1476. DOI:10.3390/medicina58101476 |
| [3] |
THIJSSEN D H J, BRUNO R M, VAN MIL A C C M, et al. Expert consensus and evidence-based recommendations for the assessment of flow-mediated dilation in humans[J]. Eur Heart J, 2019, 40(30): 2534-2547. DOI:10.1093/eurheartj/ehz350 |
| [4] |
TUOMINEN L J, SOKOLOWSKI S, LUNDELL R V, et al. Decompression illness in Finnish technical divers: a follow-up study on incidence and self-treatment[J]. Diving Hyperb Med, 2022, 52(2): 78-84. DOI:10.28920/dhm52.2.74-84 |
| [5] |
LJUBKOVIC M, MARINOVIC J, OBAD A, et al. High incidence of venous and arterial gas emboli at rest after trimix diving without protocol violations[J]. J Appl Physiol, 2010, 109(6): 1670-1674. DOI:10.1152/japplphysiol.01369.2009 |
| [6] |
YU X, XU J, HUANG G, et al. Bubble-induced endothelial microparticles promote endothelial dysfunction[J]. PLoS One, 2017, 12(1): e0168881. DOI:10.1371/journal.pone.0168881 |
| [7] |
VINCE R V, MCNAUGHTON L R, TAYLOR L, et al. Release of VCAM-1 associated endothelial microparticles following simulated SCUBA Dives[J]. Eur J Appl Physiol, 2009, 105(4): 507-513. DOI:10.1007/s00421-008-0927-z |
| [8] |
MA T, LIU X, REN Q, et al. Flow-mediated dilation analysis coupled with nitric oxide transport to enhance the assessment of endothelial function[J]. J Appl Physiol (1985), 2021, 131(1): 1-14. DOI:10.1152/japplphysiol.00039.2021 |
| [9] |
CORRETTI M C, ANDERSON T J, BENJAMIN E J, et al. Guidelines for the ultrasound assessment of endothelial-dependent flow-mediated vasodilation of the brachial artery: a report of the International Brachial Artery Reactivity Task Force[J]. J Am Coll Cardiol, 2002, 39(2): 257-265. DOI:10.1016/s0735-1097(01)01746-6 |
| [10] |
LAMBRECHTS K, PONTIER J M, BALESTRA C, et al. Effect of a single, open-sea, air scuba dive on human micro- and macrovascular function[J]. Eur J Appl Physiol, 2013, 113(10): 2637-2645. DOI:10.1007/s00421-013-2676-x |
| [11] |
BARAK O F, JANJIC N, DRVIS I, et al. Vascular dysfunction following breath-hold diving[J]. Can J Physiol Pharmacol, 2020, 98(2): 124-130. DOI:10.1139/cjpp-2019-0341 |
| [12] |
DELEU L, CATHERINE J, POSTELMANS L, et al. Effect of SCUBA diving on ophthalmic parameters[J]. Medicina (Kaunas), 2022, 58(3): 408. DOI:10.3390/medicina58030408 |
| [13] |
THEUNISSEN S, GUERRERO F, SPONSIELLO N, et al. Nitric oxide-related endothelial changes in breath-hold and scuba divers[J]. Undersea Hyperb Med, 2013, 40(2): 135-144. |
| [14] |
BODDI M. Renal ultrasound (and Doppler sonography) in hypertension: an update[J]. Adv Exp Med Biol, 2017, 956: 191-208. DOI:10.1007/5584_2016_170 |
 2024, Vol. 45
2024, Vol. 45


