2. 上海交通大学医学院附属仁济医院耳鼻喉科,上海 200001;
3. 上海市浦东医院骨科,上海 201399;
4. 海军军医大学(第二军医大学)中医系经典著作教研室,上海 200433;
5. 海军军医大学(第二军医大学)中医系中医内科教研室,上海 200433;
6. 海军军医大学(第二军医大学)中医系军事中医学教研室,上海 200433;
7. 海军军医大学(第二军医大学)第三附属医院中西医结合科,上海 201805
2. Department of Otolaryngology, Renji Hospital Affiliated to Shanghai Jiao Tong University School of Medicine, Shanghai 200001, China;
3. Department of Orthopaedics, Pudong Hospital, Shanghai 201399, China;
4. Department of Classical Work Office, School of Traditional Chinese Medicine, Naval Medical University (Second Military Medical University), Shanghai 200433, China;
5. Department of Internal Traditional Chinese Medicine, School of Traditional Chinese Medicine, Naval Medical University (Second Military Medical University), Shanghai 200433, China;
6. Department of Military Traditional Chinese Medicine, School of Traditional Chinese Medicine, Naval Medical University (Second Military Medical University), Shanghai 200433, China;
7. Department of Integrative Medicine, The Third Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 201805, China
近年来,电磁辐射对人体健康的危害愈加受到重视[1]。电磁辐射污染是除水污染、空气污染和固体垃圾污染之外的第四大污染[2],其对暴露在电磁辐射环境下的作业人员健康有较为严重的威胁[3]。电磁辐射对包括中枢神经系统、生殖系统等在内的多个靶器官产生影响[4-5]。针对439名青少年手机使用情况的前瞻性队列研究显示,1年内青少年记忆力的变化与累积手机使用时间呈负相关,与手机电磁辐射剂量的关系更为密切[6]。老年人如长期使用手机会增加神经性头痛的风险[7]。
四生汤由全国名中医、军队中医药“国医名师”凌昌全教授创建,是海军军医大学(第二军医大学)第一附属医院临床长期使用的院内制剂,该方剂主要由生黄芪、生白术、生地黄、生薏苡仁组成,有益气养阴之功,尤适用于治疗放疗导致的气阴两伤之证候[8-9]。放疗属于电离辐射,与电磁辐射有所不同[10],但一些防治电离辐射的药物对防护电磁辐射也有一定功效[11-12]。目前,研究较多的抗电磁辐射中药制剂有当归注射液、复方鱼腥草注射液和苦豆子总碱注射液等[12]。研究表明,绿茶多酚、银杏叶、莲藕原花青素、大蒜提取物、桑寄生、莪术和迷迭香等天然成分对电磁辐射所致神经损伤具有一定的防护作用[11-12]。
本研究通过大鼠动物模型评价四生汤对电磁辐射所致海马神经元损伤的抑制作用,为其用于电磁辐射所致神经损伤的防护提供实验基础。
1 材料和方法 1.1 主要仪器及试剂电磁辐射源由海军研究院提供,Morris水迷宫由海军军医大学(第二军医大学)基础医学部神经生物学教研室提供。TUNEL细胞凋亡检测试剂盒、活性氧(reactive oxygen species,ROS)检测试剂盒、FBS、胰酶及D-Hanks平衡盐溶液购自山西易励科技有限公司。安多霖胶囊购自福建众安药业有限公司(国药准字Z10970016);四生汤来源于海军军医大学(第二军医大学)第一附属医院,院内制剂生产批号为南制字(2011)F50005。
1.2 实验动物分组与干预SPF级雄性SD大鼠45只,体重70~90 g,购自上海市计划生育科学研究所实验动物经营部,动物合格证号:20180006036824,集中饲养。大鼠随机分为三大组,每大组15只:(1)空白对照组,用生理盐水灌胃,剂量为10 mL/kg;(2)四生汤组,用四生汤灌胃,给药剂量为10 mL/kg;(3)安多霖组(阳性对照组),用安多霖胶囊的水溶液进行灌胃,给药剂量为6 g/kg。以上三大组均根据辐射剂量的不同进一步分为高、中、低剂量亚组,每个亚组5只大鼠。实验开始后每天对大鼠进行灌胃,自由摄食和饮水,连续饲养6周(即辐射4周及辐射后2周)后停止给药,并继续饲养至第8周。
1.3 各组大鼠电磁辐照将大鼠置于暗室内进行辐照,温度(20±2)℃,相对湿度(60±10)%。电磁辐射条件:频率2.856 GHz,低、中、高剂量亚组平均功率密度分别为10、20及40 mW/cm2,辐射时间10 min,3次/周,持续4周。
1.4 大鼠学习记忆能力检测参考李海娟[13]的方法,在电磁辐射结束后的2、4周各进行1次Morris水迷宫实验,记录大鼠逃避潜伏期,计算平均逃避潜伏期(average escape latency,AEL)。具体方法如下:在电磁辐射结束后,首先训练大鼠找到站立平台,将大鼠分别从4个入水点面向迷宫池壁放入水中,系统记录大鼠的活动轨迹,4次/d,共4 d。在进入下一次训练前,大鼠被置于站立平台上10 s。记录大鼠第1、2、3、7、14、28天的AEL,未能在60 s内找到平台的大鼠其AEL计为60 s。
1.5 TUNEL法检测细胞凋亡电磁辐射结束后4周第2次Morris水迷宫实验结束后,颈椎脱臼处死大鼠,断头取脑,分离海马组织,PBS清洗2次,用不含EDTA的胰酶消化组织后,PBS清洗细胞外的其余组织2次。将清洗后所得细胞分为2份。其中一份加入适量4%多聚甲醛溶液,水平摇床上放置30 min;PBS清洗2次后,用含0.3% Triton X-100的PBS重悬,孵箱中放置5 min;PBS清洗2次后,再加入50 μL TUNEL检测液,室温避光放置90 min后,再用PBS洗涤2次,用500 μL PBS悬浮;冰浴避光放置,用流式细胞仪检测细胞凋亡情况。
1.6 细胞ROS含量检测将另一份细胞用无血清培养基重悬,用DMSO溶解2', 7'-二氯二氢荧光素二乙酸酯(DCFH-DA)ROS荧光探针粉末,终浓度为10 mmol/L;用无血清培养基稀释DCFH-DA ROS荧光探针溶液,稀释比例为1∶1 000,得到染色工作液(终浓度为10 μmol/L)。细胞悬液离心(5 min,715.4×g)后弃上清,用染色工作液重悬细胞,室温避光放置40 min;颠倒混匀后,冰浴避光放置,用流式细胞仪检测,计算细胞ROS含量。
1.7 统计学处理应用SPSS 24.0软件进行统计学分析。计量资料以x±s表示。Morris水迷宫实验为两因素多水平重复测量设计,数据分析采用重复测量的方差分析方法;其余数据各时间点多组间的比较采用方差分析,各时间点两组间的比较采用独立样本t检验。检验水准(α)为0.05。
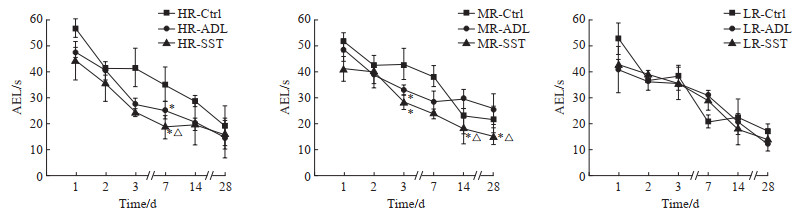
2 结果 2.1 四生汤对大鼠电磁辐射所致学习记忆能力下降的抑制作用如表 1所示,辐射结束后,各组大鼠的游泳速度差异无统计学意义(均P>0.05)。如图 1所示,各组大鼠的AEL在训练期间呈逐渐缩短趋势,训练至第3天达到较稳定水平,表明大鼠已基本获得找到平台的能力。高剂量(40 mW/cm2)辐射结束后第7天,空白对照组大鼠的AEL比四生汤组、安多霖组延长,且安多霖组大鼠的AEL比四生汤组延长(均P<0.05)。中剂量(20 mW/cm2)辐射结束后第3天空白对照组大鼠的AEL比四生汤组、安多霖组延长(均P<0.05);第14、28天时,空白对照组和安多霖组大鼠的AEL比四生汤组延长(均P<0.05)。低剂量(10 mW/cm2)辐射结束后,3组间AEL差异无统计学意义(P>0.05)。
|
|
表 1 电磁辐射结束后各时间点3组大鼠游泳速度比较 Tab 1 Comparison of swimming speed among 3 groups of rats at different time points after electromagnetic radiation |
|
图 1 电磁辐射结束后各时间点3组大鼠的学习记忆能力检测 Fig 1 Detection of learning and memory ability of rats at different time points after electromagnetic radiation Morris water maze test. *P < 0.05 vs Ctrl group; △P < 0.05 vs ADL group. n=5, x±s. HR: High-dose electromagnetic radiation (40 mW/cm2); MR: Medium-dose electromagnetic radiation (20 mW/cm2); LR: Low-dose electromagnetic radiation (10 mW/cm2); Ctrl: Control; ADL: Anduolin; SST: Sisheng decoction; AEL: Average escape latency. |
2.2 四生汤对大鼠电磁辐射所致海马神经元凋亡的抑制作用
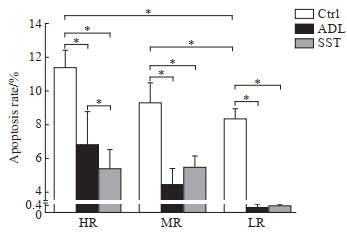
如图 2所示,与低剂量辐射相比,高、中剂量辐射后大鼠海马神经元凋亡率增大(均P<0.05);高、中、低剂量辐射后,安多霖组和四生汤组大鼠海马神经元凋亡率均低于空白对照组(均P<0.05);高剂量辐射后四生汤组大鼠海马神经元凋亡率低于安多霖组(P<0.05)。
|
图 2 流式细胞术检测各组大鼠海马神经元凋亡率 Fig 2 Apoptosis rate of hippocampal neurons in each group of rats detected by flow cytometry *P < 0.05. n=5, x±s. Ctrl: Control; ADL: Anduolin; SST: Sisheng decoction; HR: High-dose electromagnetic radiation (40 mW/cm2); MR: Medium-dose electromagnetic radiation (20 mW/cm2); LR: Low-dose electromagnetic radiation (10 mW/cm2). |
2.3 四生汤对大鼠电磁辐射所致海马神经元ROS含量的影响
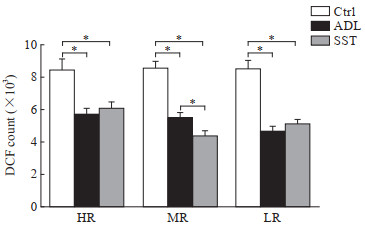
如图 3所示,虽然高、中、低剂量辐射后大鼠海马神经元ROS含量差异无统计学意义,但安多霖组、四生汤组比空白对照组均降低(均P<0.05),表明安多霖胶囊和四生汤对大鼠电磁辐射所致的海马神经元ROS均具有一定的抑制作用;中剂量辐射后四生汤对ROS的抑制作用比安多霖胶囊增强(P<0.05)。
|
图 3 流式细胞术检测各组大鼠海马神经元ROS含量 Fig 3 ROS contents of hippocampal neurons in each group of rats detected by flow cytometry *P < 0.05. n=5, x±s. ROS: Reactive oxygen species; DCF: 2', 7'-dichlorofluorescein; Ctrl: Control; ADL: Anduolin; SST: Sisheng decoction; HR: High-dose electromagnetic radiation (40 mW/cm2); MR: Medium-dose electromagnetic radiation (20 mW/cm2); LR: Low-dose electromagnetic radiation (10 mW/cm2). |
3 讨论
电磁辐射的防护分为物理防护和医学防护两大类,前者主要通过电磁屏蔽材料制成的装备进行防护,后者主要通过抗辐射药物对电磁辐射所致机体损伤进行保护和修复[12]。适度有氧运动可提高海马区对电磁辐射引起的氧化应激的抵抗能力[14]。目前已被用于治疗电磁辐射损伤的化学药物主要有谷氨酰胺、氨磷汀等[15],但它们对机体正常细胞的不良作用较大。生物药物诸如超氧化物歧化酶、促红细胞生成素、集落刺激因子、IL-6等,大多成本较高,价格昂贵[11]。中医药来源丰富、不良反应较小、疗效确切,是当前电磁辐射防护药物研究的热点。
电磁辐射对认知功能及中枢神经系统的影响尚有一定的争议。一方面,研究证实一定剂量(2.45 GHz,1 mW/cm2,3 h/d,30 d;2.856 GHz,10 mW/cm2,6 min/次,30 d)的长期电磁辐射可引起大鼠学习记忆能力降低[16-17],长期暴露于手机电磁辐射可导致小鼠海马Bax/Bcl2 mRNA表达平衡发生变化[18];另一方面,Ishihara等[19]进行的文献回顾分析表明在14%的提取关系中手机电磁辐射与认知表现之间存在负相关,更早期的研究结果亦表明2 450 MHz(0.6 W/kg,45 min/d,10 d)未能引起大鼠空间学习记忆能力的下降[20]。为何会出现两类不同的研究结果?究其原因,电磁辐射带来的损伤与辐射源的频率、调频、功率密度及辐射方式和时间等参数密切相关[21],以上研究结果之间的差异可能与这些参数的不同有一定关系。
李海娟[13]通过研究微波辐射(辐射频率2.856 GHz,辐射时间10 min,3次/周)后2、4、8周大鼠认知行为和相关生理指标的改变,证实高剂量(30 mW/cm2)电磁辐射可有效降低大鼠空间学习记忆能力、损伤海马神经元。这与Singh等[22]开展的大鼠海马整体蛋白质组分析结果一致。海马作为学习和记忆相关的主要边缘系统脑区,与动物的空间信息编码紧密相连。特别是,海马锥体细胞在空间记忆的形成与维持中扮演着重要角色,海马神经元损伤可能是电磁辐射损伤空间学习记忆能力的重要原因。本研究细胞凋亡检测结果显示,安多霖胶囊和四生汤对大鼠电磁辐射所致海马神经元凋亡均具有一定的抑制作用,且在高剂量辐射后四生汤的抑制作用强于安多霖胶囊(P<0.05)。
氧化应激是电磁辐射生物学效应的重要机制,其可通过线粒体依赖机制诱导内质网超微结构损伤和细胞凋亡[13]。本研究发现,中剂量(20 mW/cm2)辐射后,四生汤对大鼠海马神经元ROS的抑制作用较安多霖胶囊增强(P<0.05)。将此结果与细胞凋亡检测结果联合分析,间接表明四生汤对神经元凋亡的抑制作用可能与其减轻氧化应激损伤作用有一定关系。这与龚茜芬等[23]的研究结果一致。
本研究有一定的局限性。第一,本研究仅对四生汤抑制大鼠海马神经元的凋亡、降低其ROS含量等电磁辐射所致损伤和减轻大鼠学习记忆力损伤的作用进行了评价,尽管海马神经元损伤可能是电磁辐射导致空间学习记忆能力降低的重要原因,但抑制大鼠海马神经元的凋亡、降低其ROS含量与减轻大鼠学习记忆力损伤的因果关系尚未明确。第二,四生汤本身为长期用于临床的院内制剂,尽管安全可控,但其组分众多,究竟哪些组分发挥了关键作用仍需进一步研究。
| [1] |
RAGHU S V, KUDVA A, RAJANIKANT G, et al. Medicinal plants in mitigating electromagnetic radiation-induced neuronal damage: a concise review[J]. Electromagn Biol Med, 2021, 41: 1-14. DOI:10.1080/15368378.2021.1963762 |
| [2] |
BALMORI A. Electromagnetic radiation as an emerging driver factor for the decline of insects[J]. Sci Total Environ, 2021, 767: 144913. DOI:10.1016/j.scitotenv.2020.144913 |
| [3] |
BUSHBERG J T, CHOU C K, FOSTER K R, et al. IEEE committee on man and radiation-COMAR technical information statement: health and safety issues concerning exposure of the general public to electromagnetic energy from 5G wireless communications networks[J]. Health Phys, 2020, 119(2): 236-246. DOI:10.1097/HP.0000000000001301 |
| [4] |
SINGH K V, ARYA R, NIRALA J P, et al. Effects of mobile phone electromagnetic radiation on rat hippocampus proteome[J]. Environ Toxicol, 2022, 37(4): 836-847. DOI:10.1002/tox.23447 |
| [5] |
GAUTAM R, PRIYADARSHINI E, NIRALA J, et al. Impact of nonionizing electromagnetic radiation on male infertility: an assessment of the mechanism and consequences[J]. Int J Radiat Biol, 2022, 98(6): 1063-1073. DOI:10.1080/09553002.2020.1859154 |
| [6] |
SCHOENI A, ROSER K, RÖÖSLI M. Memory performance, wireless communication and exposure to radiofrequency electromagnetic fields: a prospective cohort study in adolescents[J]. Environ Int, 2015, 85: 343-351. DOI:10.1016/j.envint.2015.09.025 |
| [7] |
FARASHI S, BASHIRIAN S, KHAZAEI S, et al. Mobile phone electromagnetic radiation and the risk of headache: a systematic review and meta-analysis[J]. Int Arch Occup Environ Health, 2022, 95(7): 1587-1601. DOI:10.1007/s00420-022-01835-x |
| [8] |
凌昌全, 高虹, 陈喆, 等. 四生汤对小鼠脾淋巴细胞DNA损伤修复功能的影响[J]. 中国中西医结合杂志, 1998, 18(1): 38-40. DOI:10.3321/j.issn:1003-5370.1998.01.01 |
| [9] |
温新宇, 王玲, 田亚平. 四生汤对辐射损伤小鼠的保护作用[J]. 军医进修学院学报, 2010, 31(9): 921-923. |
| [10] |
GHOLIPOUR HAMEDANI B, GOLIAEI B, SHARIATPANAHI S P, et al. An overview of the biological effects of extremely low frequency electromagnetic fields combined with ionizing radiation[J]. Prog Biophys Mol Biol, 2022, 172: 50-59. DOI:10.1016/j.pbiomolbio.2022.04.008 |
| [11] |
杜欣, 向阳, 成玉斌, 等. 电磁辐射效应及中药防辐射研究进展[J]. 临床军医杂志, 2016, 44(12): 1319-1320. DOI:10.16680/j.1671-3826.2016.12.35 |
| [12] |
朱小闪, 刘宁宁, 翟艳霞, 等. 电磁辐射损伤个体防护的研究进展[J]. 实用医药杂志, 2020, 37(12): 1130-1132, 1137. DOI:10.14172/j.issn1671-4008.2020.12.024 |
| [13] |
李海娟. 5-HT受体基因多态性与电磁辐射致认知功能改变易感性的相关性研究[D]. 北京: 中国人民解放军军事医学科学院, 2015. DOI: 10.7666/d.Y2993907.
|
| [14] |
RASOULI MOJEZ M, ALI GAEINI A, CHOOBINEH S, et al. Hippocampal oxidative stress induced by radiofrequency electromagnetic radiation and the neuroprotective effects of aerobic exercise in rats: a randomized control trial[J]. J Phys Act Health, 2021, 18(12): 1532-1538. DOI:10.1123/jpah.2021-0213 |
| [15] |
ÖZSOBACI N P, ERGÜN D D, TUNÇDEMIR M, et al. Protective effects of zinc on 2.45 GHz electromagnetic radiation-induced oxidative stress and apoptosis in HEK293 cells[J]. Biol Trace Elem Res, 2020, 194(2): 368-378. DOI:10.1007/s12011-019-01811-6 |
| [16] |
LU Y, XU S, HE M, et al. Glucose administration attenuates spatial memory deficits induced by chronic low-power-density microwave exposure[J]. Physiol Behav, 2012, 106(5): 631-637. DOI:10.1016/j.physbeh.2012.04.019 |
| [17] |
ZHAO L, PENG R Y, WANG S M, et al. Relationship between cognition function and hippocampus structure after long-term microwave exposure[J]. Biomed Environ Sci, 2012, 25(2): 182-188. DOI:10.3967/0895-3988.2012.02.009 |
| [18] |
TOHIDI F Z, SADR-NABAVI A, HAGHIR H, et al. Long-term exposure to electromagnetic radiation from mobile phones can cause considerable changes in the balance of Bax/Bcl2 mRNA expression in the hippocampus of mice[J]. Electromagn Biol Med, 2021, 40(1): 131-137. DOI:10.1080/15368378.2020.1830793 |
| [19] |
ISHIHARA T, YAMAZAKI K, ARAKI A, et al. Exposure to radiofrequency electromagnetic field in the high-frequency band and cognitive function in children and adolescents: a literature review[J]. Int J Environ Res Public Health, 2020, 17(24): 9179. DOI:10.3390/ijerph17249179 |
| [20] |
COBB B L, JAUCHEM J R, ADAIR E R. Radial arm maze performance of rats following repeated low level microwave radiation exposure[J]. Bioelectromagnetics, 2004, 25(1): 49-57. DOI:10.1002/bem.10148 |
| [21] |
MANIAK K, MYDLIKOWSKI R. Autonomous instrumentation for measuring electromagnetic radiation from rocks in mine conditions-a functional analysis[J]. Sensors, 2022, 22(2): 600. DOI:10.3390/s22020600 |
| [22] |
SINGH K V, GAUTAM R, MEENA R, et al. Effect of mobile phone radiation on oxidative stress, inflammatory response, and contextual fear memory in Wistar rat[J]. Environ Sci Pollut Res Int, 2020, 27(16): 19340-19351. DOI:10.1007/s11356-020-07916-z |
| [23] |
龚茜芬, 杨学森, 涂灵, 等. 复方中药制剂对电磁辐射致大鼠海马神经损伤的防治作用[J]. 中国应用生理学杂志, 2013, 29(4): 346-350, 388. DOI:10.13459/j.cnki.cjap.2013.04.006 |
 2024, Vol. 45
2024, Vol. 45


