2. 新疆师范大学教育科学学院, 乌鲁木齐 830054;
3. 西京学院心理咨询中心, 西安 710123;
4. 北京中医药大学东方学院心理咨询中心, 廊坊 061199;
5. 中国人民解放军联勤保障部队第九二三医院精神心理科, 南宁 530021
2. College of Education Science, Xinjiang Normal University, Urumqi 830054, Xinjiang Uygur Autonomous Region, China;
3. Psychological Counselling Center, Xijing University, Xi'an 710123, Shaanxi, China;
4. Psychological Counseling Center, Oriental College, Beijing University of Chinese Medicine, Langfang 061199, Hebei, China;
5. Department of Psychiatry, No. 923 Hospital of Joint Logistics Support Force of PLA, Nanning 530021, Guangxi Zhuang Autonomous Region, China
焦虑障碍常伴有恐慌、担忧、坐立不安和睡眠障碍等躯体症状[1],其核心特征是病理性焦虑[2]。在我国,焦虑障碍的年患病率为24.47‰,终身患病率为41.12‰[3]。WHO对包括我国在内的28个国家和地区进行的流行病学调查显示,焦虑障碍的终身患病率为13.6%~28.8%,年患病率为5.6%~19.3%[4]。焦虑障碍具有明显的性别差异,女性焦虑障碍的发病率是男性的2倍[5-6]。一项研究指出,人群中5%的个体会在一生中的某个时候罹患焦虑障碍,主要好发于成年早期和青春期晚期,首次出现的平均年龄为25~30岁[7]。关于焦虑障碍患病率、核心特征、临床表现、并发症等研究较多,而对其高危人群、性别差异、生理唤醒等的研究相对较少。焦虑障碍在人群中非常普遍,并且与高比例的损伤和残疾有关[8-9]。即使接受系统性的药物治疗,焦虑障碍患者仍具有较高的复发率,这给社会及个人带来沉重负担。
焦虑障碍高危人群概念是由墨尔本大学Nelson团队提出的精神分裂症超高危状态发展而来,焦虑障碍高危人群较正常人群具有更高的焦虑障碍转归风险[10]。焦虑障碍高危人群研究是指在精神疾病症状上对焦虑障碍高发病风险进行研究,学术界中常使用的相关概念包括焦虑高危和亚临床焦虑障碍。持续焦虑和担忧6个月以上、经常担心1个话题以上、难以控制焦虑情绪、焦虑伴随躯体症状,这4个条件中满足3个即可被归类为焦虑高危[11]。亚临床焦虑障碍与焦虑障碍概念上具有一定的相似性,若不进行有效干预未来转归为焦虑障碍的风险较高。因此,需要更精确把握焦虑障碍症状的评估以及联合稳定性更强的指标进行人群界定。
焦虑障碍诊断一直以主观标准为主[12],其诊断结果的准确性受主观因素的影响,易导致误诊。因此,探究焦虑障碍诊断的客观标准是近年来的重要议题。
本研究参考了近年来在脑电与机器学习领域对焦虑障碍的相关研究,探讨机器学习提取焦虑障碍患者的脑电特征并建立模型预测个体焦虑水平与焦虑程度,目的在于通过脑电指标对具有罹患焦虑障碍高危因素、尚不足以进行诊断的焦虑障碍高危人群进行早期识别,既可以据此进行早期干预和心理宣教,又可以服务于心理选拔,保证兵源的优质从而提高部队战斗力,对未来的征兵心理选拔具有前瞻性意义。
1 对象和方法 1.1 研究对象招募解放军总医院医学心理科、中国人民解放军联勤保障部队第九二三医院焦虑障碍患者(焦虑障碍组,n=39)及焦虑障碍高危者(焦虑高危组,n=44)参与研究,同时招募健康人(正常组,n=39)作为正常对照。共采集到122份脑电数据,其中焦虑高危组5人有近期服药史,因无法评估药物带来的影响于复检后剔除;正常组1人不符合纳入标准,复检后剔除;焦虑障碍组1人进行脑电图采集时焦虑障碍症状明显,不愿继续试验,中途退出。最终入组人数为115人,其中焦虑高危组39人、焦虑障碍组38人、正常组38人。本研究通过空军军医大学第一附属医院临床试验伦理委员会审批(KY20182047-F-1),所有参与者均签署了书面知情同意书。
1.2 纳入及排除标准焦虑高危组入组标准:(1)年龄16~55岁;(2)状态-特质焦虑问卷(state-trait anxiety inventory,S-TAI)的特质焦虑维度得分男性>53分、女性>55分;(3)具有焦虑障碍部分典型症状,但程度较轻,尚不足以诊断为焦虑障碍;(4)面对应激事件具有习惯性地产生过度紧张担心的特点;(5)未治疗;(6)精神病16项前驱期问卷(prodromal questionnaire-16,PQ-16)条目分<7分,痛苦分<8分;(7)右利手。焦虑高危组排除标准:(1)有严重躯体疾病或酒精等物质滥用史;(2)有精神或神经系统疾病史;(3)试验前3个月内接受过电休克治疗;(4)有头部创伤史;(5)色盲及色弱者;(6)智力障碍者。
正常组的入组标准:(1)年龄16~55岁;(2)焦虑自评量表得分<50分;(3)抑郁自评量表得分<50分;(4)90项症状自评量表总分<160分;(5)PQ-16条目分<7分,痛苦分<8分;(6)右利手;(7)S-TAI特质焦虑维度得分男性<53分、女性<55分。排除标准同焦虑高危组的排除标准。
焦虑障碍组的入组标准:(1)年龄16~55岁;(2)焦虑自评量表得分>50分;(3)经2名高年资主治以上级别医师诊断,符合美国《精神障碍诊断与统计手册(第5版)》广泛性焦虑障碍的诊断标准;(4)PQ-16条目分<7分,痛苦分<8分;(5)初中以上文化程度;(6)右利手。排除标准同焦虑高危组的排除标准。
1.3 实验程序实验人员向被试告知实验内容及要求后,被试自愿签署知情同意书。被试清洁头皮并吹干后,使用Neuroscan Scan 4.5系统采集脑电图,同步使用Eprime 3.0软件进行军事应激反应性焦虑预测量表的作答,量表评分等级由低到高用数字1~4表示,按键“z”代表等级1,“x”代表等级2,小键盘“1”代表等级3,小键盘“2”代表等级4,显示器为17英寸(0.431 8 m)液晶显示屏,被试与屏幕距离约为70 cm,屏幕刷新率为60 Hz。
1.4 试验设备脑电设备采用NeuroScan SynAmps 2放大器及采集系统,并应用NeuroScan 32导联的Ag/AgCl电极帽进行脑电图记录。本研究使用国际标准10-20系统进行电极定位,根据国际心理生理学会和国际临床神经生理学联合会的指导意见,记录时的参考电极为鼻尖处的Ref电极,前额中央电极接地。重参考后的参考电极为A1、A2,位于双侧乳突;采集电极分别为FP1、FP2、F3、F4、F7、F8、Fz、FC3、FC4、FT7、FT8、FCz、T3、T4、C3、C4、Cz、CP3、CP4、TP7、TP8、CPz、P3、P4、T5、T6、Pz、O1、O2、Oz、垂直眼电(vertical electro oculogram,VEOG)和水平眼电(horizontal electro oculogram,HEOG)。试验中各电极处的头皮阻抗均在5 kΩ以下,采样率为1 000 Hz。
1.5 数据分析离线处理脑电数据,使用Matlab/eeglab 12.0.2.6b软件进行分析。预处理步骤如下:导入数据,电极定位,剔除无用电极,再重参考,双侧乳突平均做参考,后滤波(40 Hz低通滤波,1 Hz高通滤波),消除50 Hz工频干扰,再做分段(-200 ms,500 ms)后进行基线校正,剔除坏段和插值坏导,再进行独立成分分析:去眼电(HEOG、VEOG)、心电和肌电,最后叠加平均。以2 s为1个时间单位,将问卷作答状态下的脑电数据分段;预处理后的脑电原始信号采用傅里叶变换进行功率谱密度(power spectral density,PSD)分析,得到脑电各频率范围的功率谱(单位:μV2/Hz)。预处理后,将变换后各频率上的脑电功率分为6个频段:δ(1~3 Hz)、θ(4~7 Hz)、α(8~12 Hz)、β1(13~20 Hz)、β2(21~30 Hz)、γ(31~40 Hz)。
1.6 统计学处理采用SPSS 22.0软件进行统计分析,R 4.3.1软件ggplot2包作图。所有数据均进行正态性检验及方差齐性检验。差异分析采用3组间重复测量方差分析,若通过方差齐性检验,经Sidak校正后进行两两比较;若未通过方差齐性检验,经Dunnett’s T3校正后再进行两两比较。检验水准(α)为0.05。
PSD分析:脑电图不同的频段具有不同的生理意义,对于表征大脑活动具有十分重要的意义。为了深入了解脑电图在频段节律上的特点,本实验对每个频段16个感兴趣电极(FP1、FP2、F3、F4、C3、C4、P3、P4、O1、O2、F7、F8、T3、T4、T5、T6)的频率信号PSD取平均值,采用重复测量方差分析对3组被试的PSD进行统计学分析。
时频分析:使用带有固定200 ms汉宁窗口的短时傅里叶变换对预处理脑电原始信号进行时频分析。对于每个时期,傅里叶变换算法产生了复杂的时间频率,在每个时频处估计时间点与频率点,时间点从-200 ms扩展到500 ms时域(步长为1 ms)为横坐标,频率点从1 Hz到40 Hz(步长为1 Hz)为纵坐标。基线校正:频谱图以参考间隔进行基线校正,在-200 ms到0 ms的范围内每个频率使用减法。
功能连接:采用Matlab脚本计算功能连接指标加权相位延迟指数(weighted phase-lag index,wPLI)。基于功能连接算法分析脑电图时间序列之间的频率相干性,得到相干矩阵,用错误发现率(false discovery rate,FDR)校正,用BrainnetView软件绘制脑网络连接图。分别对3组被试全频段wPLI指标进行统计分析。
机器学习:采用Python 2.0 Scikit-Learn包的支持向量机(support vector machine,SVM)与K近邻分类器,分别对3组被试进行二分类,提取115(被试)×16(电极)×4(行为学问卷得分、PSD、时频幅值、功能连接wPLI)个指标。交叉验证时采用两两分类的方法,3组之间两两比较。在分析PSD图时,每组得到的特征指标个数为被试数(38或39)×电极数(30)×频段数(6)。
2 结果 2.1 人口学资料115名被试中男68人、女47人,焦虑障碍组、焦虑高危组、正常组的年龄分别为(33.72±9.44)、(34.57±12.28)、(28.7±8.50)岁,3组间年龄差异无统计学意义(P>0.05)。
2.2 PSD分析3组被试δ频段PSD组间主效应差异有统计学意义(F=97.55,P<0.001),焦虑障碍组(6.16±0.61)>焦虑高危组(5.22±0.73)>正常组(3.36±0.06)。θ频段PSD组间主效应差异有统计学意义(F=65.87,P<0.001),焦虑障碍组(2.25±0.07)>焦虑高危组(2.23±0.08)>正常组(1.34±0.39)。α频段PSD组间主效应差异有统计学意义(F=178.73,P<0.001),焦虑障碍组(2.02±0.45)>焦虑高危组(1.94±0.57)>正常组(0.98±0.02)。
β1频段PSD组间主效应差异有统计学意义(F=105.38,P<0.001),焦虑高危组(1.16±0.02)>焦虑障碍组(1.14±0.01)>正常组(0.50±0.01)。β2频段PSD组间主效应差异有统计学意义(F=51.42,P<0.001),焦虑高危组(0.85±0.03)>焦虑障碍组(0.81±0.01)>正常组(0.42±0.01)。γ频段PSD组间主效应差异有统计学意义(F=34.54,P<0.001),焦虑高危组(0.47±0.02)>焦虑障碍组(0.43±0.01)>正常组(0.23±0.01)。
3组被试在6个频段上电极分布的PSD均随着频率的增加而减小,在δ、θ和α低频频段,焦虑障碍组PSD均高于焦虑高危组和正常组;在β1、β2和γ高频频段,焦虑高危组前额叶(FP1、FP2)、颞叶(T3、T4)区PSD有上升波动,均高于焦虑障碍组及正常组。见图 1。
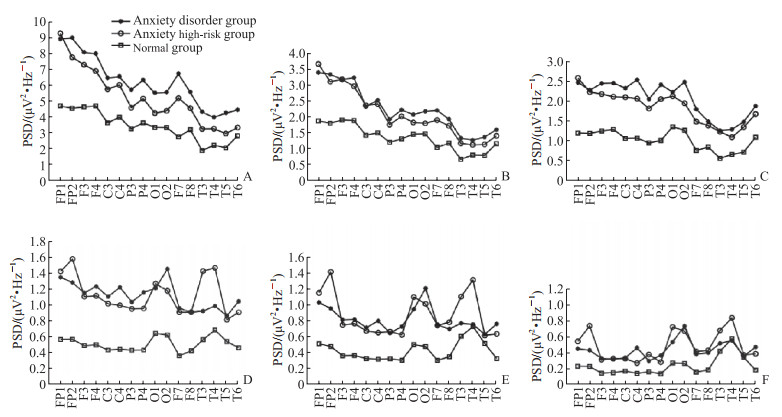
|
图 1 3组被试问卷作答状态下诱发的PSD在不同频段、不同电极的分布图 Fig 1 Distribution of PSD in different frequency bands and different electrodes during responsing to the questionnaire in 3 groups of subjects A: δ frequency band (1-3 Hz); B: θ frequency band (4-7 Hz); C: α frequency band (8-12 Hz); D: β1 frequency band (13-20 Hz); E: β2 frequency band (21-30 Hz); F: γ frequency band (31-40 Hz). PSD: Power spectral density. |
2.3 时频分析
感兴趣区是脑电时频数据由时间序列下具体频率点的坐标所构成的,通过划分感兴趣区提取事件相关同步化(event related synchronization,ERS)和事件相关去同步化(event-related desynchronization,ERD)2个指标。本研究提取不同频段分布在顶区(即Pz区)的不同感兴趣区进行时频分析。
由图 2可见,与正常组相比,焦虑障碍组在100~300 ms时间窗δ频段感兴趣区1能量增强(t=2.595,P<0.01),在350~450 ms时间窗β1频段感兴趣区2能量增强(t=2.167,P<0.05),在400~500 ms时间窗β2频段感兴趣区3能量降低(t=-2.422,P<0.01)。以上结果表明焦虑障碍组与正常组主要在枕叶区的脑电特征有显著差异。与正常组相比,焦虑高危组在50~150 ms时间窗β1频段感兴趣区4能量降低(t=-3.009,P<0.01),在其他频段两组间差异均无统计学意义(均P>0.05)。焦虑障碍组与焦虑高危组在各频段的差异均无统计学意义(均P>0.05)。
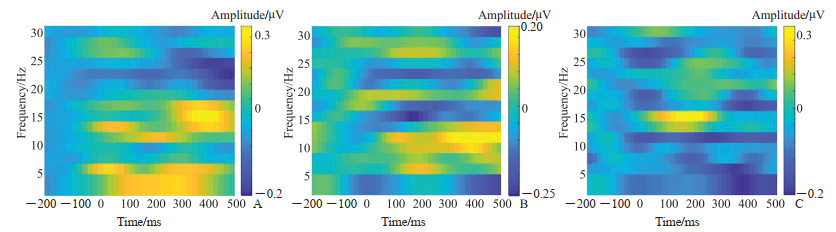
|
图 2 焦虑障碍组(A)、焦虑高危组(B)及正常组(C)被试在不同频段的总平均时频图 Fig 2 Total average time-frequency maps of anxiety disorder group (A), anxiety high-risk group (B), and normal group (C) in different frequency bands |
2.4 功能连接分析
β1频段脑电功能连接分析结果显示,在β1频段焦虑障碍组与正常组的wPLI分别在TP7-FC3电极对(t=2.45,P<0.05)、T5-FC3电极对(t=-3.01,P<0.05)的差异有统计学意义。如图 3所示。脑网络响应差异主要分布在左半球颞叶与额中央区方向的功能连接激活。
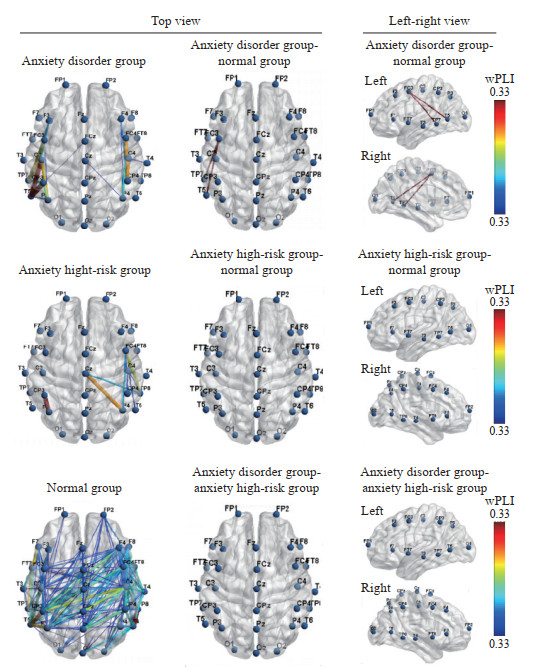
|
图 3 焦虑障碍组、焦虑高危组及正常组β1频段wPLI功能连接 Fig 3 Functional connection diagram of wPLI in β1 frequency band of anxiety disorder group, anxiety high-risk group, and normal group wPLI: Weighted phase-lag index. |
2.5 机器学习结果
在两两分类中,置换检验(置换次数为5 000次)结果显示P=0.009。各频段权重分别为:δ=0.23、θ=0.19、α=0.11、β1=0.47、β2=0.15、γ=0.15。从权重比例可以得出,δ与β1频段所占权重较大。
采用Python 2.0 Scikit-Learn包的SVM与K近邻分类器分别进行二分类,先提取量表行为学指标单独进行机器学习二分类,再通过脑电多质融合指标(PSD值、时频幅值、功能连接)进行二分类。结果显示,单纯提取行为学特征指标,SVM分类器对区分焦虑障碍者与正常人、焦虑高危者与正常人、焦虑障碍者与焦虑高危者的准确率分别为75%、71%、48%,K近邻分类器对区分焦虑障碍者与正常人、焦虑高危者与正常人、焦虑障碍者与焦虑高危者的准确率分别为77%、75%、59%。而通过提取多质融合指标,SVM分类器对区分焦虑障碍者与正常人、焦虑高危者与正常人、焦虑障碍者与焦虑高危者的准确率分别为83%、79%、51%,K近邻分类器对区分焦虑障碍者与正常人、焦虑高危者与正常人、焦虑障碍者与焦虑高危者的准确率分别为78%、75%、58%。说明多质融合指标能够有效地提高不同人群识别率,但2种分类器对焦虑障碍者与焦虑高危者的识别率均较低,表明焦虑障碍组与焦虑高危组被试之间区分度并不显著。
3 讨论本研究结果显示,在问卷作答状态下焦虑障碍患者、焦虑高危者及正常人之间在全频段及所研究导联的脑电功率差异均有统计学意义(P<0.05),这与既往研究[13]结果类似。本研究结果表明,只有β1频段PSD具有跨状态、跨样本量的稳定性。Jang等[14]的研究指出,β频段的增强与焦虑障碍有一定相关性,本研究的结果与其一致。也有研究指出,当被试发生思维漫游时β频段功率降低[15]。由此可见,β频段与安静且注意资源集中的任务相关,此结果同样符合高频频段与高级认知任务相关的总体规律。本研究中的问卷作答过程属于高级认知任务,需要被试稳定的利用注意力资源完成自陈式量表,与β1频段所反映的认知活动相符。Sangal等[16]的研究指出,在完成oddball范式时,Broca区的β1频段可以作为诊断注意力缺陷/多动症的诊断指标,灵敏度为86%,特异度为57%。Saad等[17]报告,美国食品药品管理局将Cz电极作为采集β频段脑电诊断注意力缺陷/多动症的标准电极。已有较多的研究对焦虑障碍患者和正常人群的脑成像及脑电数据进行机器学习和人群分类,都得到了较好的识别率[18-19]。Cai等[20]利用卡尔曼导数公式、离散小波变换和自适应预测滤波器分析92例焦虑障碍患者和121名正常对照者的脑电图,对焦虑障碍的区分准确率达79.27%。此外,多项研究基于机器学习识别各种精神障碍,预测准确度较好[21-24]。也有学者认为低频慢速振荡与高频快速振荡的耦合可能反映皮质下的相互作用[25]。
本研究结合了行为学、PSD、功能连接wPLI指标,应用SVM进行分类,结果显示可以通过组合特征识别3组人群,机器学习多质融合维度的精度高于单一指标的精度。PSD与功能连接网络可以作为区分焦虑障碍者、焦虑高危者与正常人的潜在综合特征,这可能有助于我们对该类疾病的理解。
本研究验证了焦虑障碍高危人群、正常人群、焦虑障碍患者之间的差异,发现在症状学及行为学上3组具有梯度性差异,而在电生理指标上焦虑障碍高危人群与焦虑障碍患者差异无统计学意义。军事应激反应性焦虑预测量表作答状态下,β1频段脑电功率有潜力成为筛查焦虑障碍患者及焦虑障碍高危人群的特征性电生理指标。军事应激反应性焦虑预测量表同时具有作为脑电刺激材料的实验属性和作为测量工具的预测属性,通过一次基于脑电的实测可以同时得到主观行为学指标及电生理指标,并利用机器学习技术进行指标整合,可最大限度提高对焦虑障碍患者及焦虑高危人群的识别能力。
| [1] |
KLONSKY E D, JANE J S, TURKHEIMER E, et al. Gender role and personality disorders[J]. J Pers Disord, 2002, 16(5): 464-476. DOI:10.1521/pedi.16.5.464.22121 |
| [2] |
MARON E, NUTT D. Biological markers of generalized anxiety disorder[J]. Dialogues Clin Neurosci, 2017, 19(2): 147-158. DOI:10.31887/DCNS.2017.19.2/dnutt |
| [3] |
KROENKE K, SPITZER R L, WILLIAMS J B, et al. Anxiety disorders in primary care: prevalence, impairment, comorbidity, and detection[J]. Ann Intern Med, 2007, 146(5): 317-325. DOI:10.7326/0003-4819-146-5-200703060-00004 |
| [4] |
CUMMINGS C M, CAPORINO N E, KENDALL P C. Comorbidity of anxiety and depression in children and adolescents: 20 years after[J]. Psychol Bull, 2014, 140(3): 816-845. DOI:10.1037/a0034733 |
| [5] |
SEIVEWRIGHT N, TYRER P, FERGUSON B, et al. Longitudinal study of the influence of life events and personality status on diagnostic change in three neurotic disorders[J]. Depress Anxiety, 2000, 11(3): 105-113. DOI:10.1002/(SICI)1520-6394(2000)11:3<105::AID-DA4>3.0.CO;2-H |
| [6] |
PIGOTT T A. Gender differences in the epidemiology and treatment of anxiety disorders[J]. J Clin Psychiatry, 1999, 60(Suppl 18): 4-15. |
| [7] |
KASTER T S, VIGOD S N, GOMES T, et al. Risk of serious medical events in patients with depression treated with electroconvulsive therapy: a propensity score-matched, retrospective cohort study[J]. Lancet Psychiatry, 2021, 8(8): 686-695. DOI:10.1016/S2215-0366(21)00168-1 |
| [8] |
LEENSTRA A S, ORMEL J, GIEL R. Positive life change and recovery from depression and anxiety. A three-stage longitudinal study of primary care attenders[J]. Br J Psychiatry, 1995, 166(3): 333-343. DOI:10.1192/bjp.166.3.333 |
| [9] |
ZIMMERMANN M, CHONG A K, VECHIU C, et al. Modifiable risk and protective factors for anxiety disorders among adults: a systematic review[J]. Psychiatry Res, 2020, 285: 112705. DOI:10.1016/j.psychres.2019.112705 |
| [10] |
LEE T Y, LEE J, KIM M, et al. Can we predict psychosis outside the clinical high-risk state?A systematic review of non-psychotic risk syndromes for mental disorders[J]. Schizophr Bull, 2018, 44: 276-285. DOI:10.1093/schbul/sbx173 |
| [11] |
ANGST J. Modern epidemiology of anxiety: results of the Zurich cohort study[J]. Hum Psychopharmacol Clin Exp, 1999, 14(S1): S29-S37. DOI:10.1002/(SICI)1099-1077(199908)14:1+ |
| [12] |
CARTER R M, WITTCHEN H U, PFISTER H, et al. One-year prevalence of subthreshold and threshold DSM-Ⅳ generalized anxiety disorder in a nationally representative sample[J]. Depress Anxiety, 2001, 13(2): 78-88. DOI:10.1002/da.1020 |
| [13] |
冯博, 吕静, 成思哲, 等. 焦虑障碍高危人群脑电信号频域分析[J]. 中华行为医学与脑科学杂志, 2020, 29(12): 1100-1105. DOI:10.3760/cma.j.cn371468-20200619-01490 |
| [14] |
JANG K I, SHIM M, LEE S M, et al. Increased beta power in the bereaved families of the sewol ferry disaster: a paradoxical compensatory phenomenon?A two-channel electroencephalography study[J]. Psychiatry Clini Neurosci, 2017, 71: 759-68. DOI:10.1111/pcn.12546 |
| [15] |
VAN SON D, DE BLASIO F M, FOGARTY J S, et al. Frontal EEG theta/beta ratio during mind wandering episodes[J]. Biol Psychol, 2019, 140: 19-27. DOI:10.1016/j.biopsycho.2018.11.003 |
| [16] |
SANGAL R B, SANGAL J M. Use of EEG beta-1 power and theta/beta ratio over Broca's area to confirm diagnosis of attention deficit/hyperactivity disorder in children[J]. Clin EEG Neurosci, 2015, 46(3): 177-182. DOI:10.1177/1550059414527284 |
| [17] |
SAAD J F, KOHN M R, CLARKE S, et al. Is the theta/beta EEG marker for ADHD inherently flawed?[J]. J Atten Disord, 2018, 22(9): 815-826. DOI:10.1177/1087054715578270 |
| [18] |
RICHTER T, FISHBAIN B, FRUCHTER E, et al. Machine learning-based diagnosis support system for differentiating between clinical anxiety and depression disorders[J]. J Psychiatr Res, 2021, 141: 199-205. DOI:10.1016/j.jpsychires.2021.06.044 |
| [19] |
MARSHALL M. The hidden links between mental disorders[J]. Nature, 2020, 581(7806): 19-21. DOI:10.1111/pcn.12546.Epub2017Jul31 |
| [20] |
CAI H, HAN J, CHEN Y, et al. A pervasive approach to EEG-based depression detection[J]. Complexity, 2018, 2018: 1-13. DOI:10.1155/2018/5238028 |
| [21] |
LI X, LA R, WANG Y, et al. EEG-based mild depression recognition using convolutional neural network[J]. Med Biol Eng Comput, 2019, 57(6): 1341-1352. DOI:10.1007/s11517-019-01959-2 |
| [22] |
IN J K, SUNGKEAN K, YOUNG K S, et al. Machine learning-based electroencephalographic phenotypes of schizophrenia and major depressive disorder[J]. Front Psychiatry, 2021, 12: 745458. DOI:10.3389/fpsyt.2021.745458.eCollection2021 |
| [23] |
DEMETRIOU E A, PARK S H, HO N, et al. Machine learning for differential diagnosis between clinical conditions with social difficulty: autism spectrum disorder, early psychosis, and social anxiety disorder[J]. Front Psychiatry, 2020, 11: 545. DOI:10.3389/fpsyt.2020.00545 |
| [24] |
RICHTER T, FISHBAIN B, MARKUS A, et al. Using machine learning-based analysis for behavioral differentiation between anxiety and depression[J]. Sci Rep, 2020, 10: 16381. DOI:10.1038/s41598-020-72289-9 |
| [25] |
DE PASCALIS V, SOMMER K, SCACCHIA P. Resting frontal asymmetry and reward sensitivity theory motivational traits[J]. Sci Rep, 2018, 8: 13154. DOI:10.1038/s41598-018-31404-7 |
 2024, Vol. 45
2024, Vol. 45


