2. 复旦大学附属中山医院心内科, 上海 200030
2. Department of Cardiology, Zhongshan Hospital, Fudan University, Shanghai 200030, China
ST段抬高型心肌梗死(ST segment elevation myocardial infarction,STEMI)是常见的心血管疾病,也是全球高发病率和高死亡率疾病之一,经皮冠状动脉介入(percutaneous coronary intervention,PCI)是治疗STEMI的有效手段[1-2]。然而,患者在冠状动脉血流恢复后仍可能发生心肌再灌注损伤、心肌内微血管结构破坏,导致微循环障碍,甚至引起心肌内出血(intramyocardial hemorrhage,IMH)。IMH被认为在一定程度上可反映心肌再灌注损伤的程度,且IMH被认为会增加心力衰竭、主要心脏不良事件及心源性猝死等的发生率[3-4]。
心脏磁共振(cardiac magnetic resonance,CMR)可综合评价STEMI后心脏结构和功能变化,包括心室壁运动情况、左心室射血分数(left ventricular ejection fraction,LVEF)、心肌应变力、梗死面积、心肌水肿、IMH、微循环障碍等[5-7]。目前,CMR被认为是无创诊断IMH的“金标准”[8],其中T2* mapping序列对评估IMH较灵敏且更具有优势[9]。
目前尚无成熟手段有效控制心肌再灌注损伤发生,因此早期发现心肌再灌注损伤及判断预后至关重要。本研究利用CMR评价STEMI患者PCI术后发生IMH情况,并动态监测心肌损伤标志物水平,探讨IMH对心功能的影响及心肌损伤标志物与IMH的相关性,评估心肌损伤标志物诊断IMH的价值。
1 资料和方法 1.1 研究对象连续纳入复旦大学附属中山医院2022年9月至2023年12月收治的STEMI患者53例。纳入标准:临床确诊为STEMI且起病后24 h内成功行PCI治疗的患者。排除标准:(1)既往有心肌梗死病史的患者;(2)既往有钆对比剂过敏、严重心律失常、肾功能不全或幽闭恐惧症等无法耐受CMR增强检查,或获得的CMR图像质量差的患者。本研究经复旦大学附属中山医院伦理委员会审批(B2018-286),所有研究对象均已签署知情同意书。
1.2 CMR扫描方法所有CMR扫描均在1.5 T磁共振扫描仪(MAGNETOM Area,德国Siemens公司)和8通道相控阵心脏线圈上进行。扫描序列包括定位像、电影(cine)序列、T2序列、T2* mapping序列、心肌延迟强化(late gadolinium enhancement,LGE)序列。扫描得到各标准层面的电影图像、短轴T2序列图像、短轴T2*mapping序列图像及LGE图像。T2* mapping序列扫描参数:回波时间为2.05、3.83、5.61、7.39、9.17、10.95、12.73、14.51 ms,重复时间为650 ms,视野315 mm×420 mm,矩阵86×192,层厚8 mm。
通过高压注射器以3.0 mL/s的速度注射对比剂钆双胺注射液(0.15 mmol/kg,商品名Omniscan;美国GE Healthcare公司),在注射对比剂10 min后,利用相位敏感反转恢复序列扫描LGE图像。扫描参数:反转时间由反转时间定位像确定,回波时间为3.23 ms,重复时间为857.6 ms,视野340 mm×340 mm,矩阵192×256,层厚8 mm。
1.3 图像分析及数据测量 1.3.1 心功能参数利用心功能分析软件CVI 42(加拿大Circle Cardiovascular Imaging公司)浏览及分析左心室电影图像,得到下列心功能参数:LVEF、左心室舒张末期容积指数(left ventricular end-diastolic volume index,LVEDVi)、左心室收缩末期容积指数(left ventricular end-systolic volume index,LVESVi)、左心室每搏输出量指数(left ventricular stroke volume index,LVSVi)、心指数、左心室心肌质量指数(left ventricular mass index,LVmassi)。
1.3.2 心肌应变参数利用CVI 42软件勾画每层舒张末期的心内膜和心外膜,得到心肌应变参数:左心室整体纵向应变(left ventricular global longitudinal strain,LVGLS)、左心室整体周向应变(left ventricular global circumference strain,LVGCS)、左心室整体径向应变(left ventricular global radial strain,LVGRS)。
1.3.3 心肌梗死面积及IMH评估将T2* mapping序列和LGE序列的dicom数据导入CVI 42软件进行分析。定义平均信号强度低于正常心肌平均信号强度2个标准差的区域为IMH区域,利用T2* mapping图像描记IMH区域并计算IMH容积及IMH容积百分比(IMH在心肌总容积的占比)。定义LGE图像上信号强度高于正常心肌平均信号强度5个标准差的区域为梗死区(手动描记纳入微血管阻塞区),获得梗死容积及梗死容积百分比(梗死区域在心肌总容积的占比)。
1.4 临床指标及心肌损伤标志物指标采集从住院病历中摘录收集患者的基线临床资料,包括年龄、性别、BMI、心血管危险因素、冠状动脉造影结果(包括责任血管)等。采集患者发病时及PCI术后即刻、术后1 d、术后3 d共4个时间点的血清样本,测定各时间点肌钙蛋白T(cardiac troponin T,cTnT)、肌酸激酶同工酶MB(creatine kinase isoenzyme MB,CKMB)及氨基末端脑利尿钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)水平,计算术后即刻与术前相比的变化量并记录峰值。
1.5 统计学处理采用SPSS 27.0软件进行统计学分析。计量资料若满足正态分布,以x ± s表示,采用独立样本t检验进行组间分析,利用Pearson相关分析检验各变量间的相关性;计量资料若不符合正态分布,以中位数(下四分位数,上四分位数)表示,采用Mann-Whitney U检验进行组间分析,利用Spearman秩相关分析检验各变量间的相关性。计数资料以例数和百分数表示,采用χ2检验进行组间比较。绘制心肌损伤标志物诊断IMH的ROC曲线,并计算AUC值。检验水准(α)为0.05。
2 结果 2.1 基线资料分析1例患者因T2* mapping图像质量差无法评估IMH容积被排除,最终入组52例患者,根据CMR结果(图 1)分为非IMH组(19例)和IMH组(33例)。两组患者的基线资料差异均无统计学意义(表 1)。
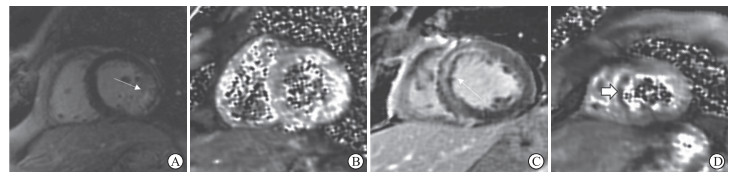
|
图 1 STEMI患者CMR图像 Fig 1 CMR images of STEMI patients A, B: CMR images of STEMI patients without IMH. LGE imaging showed infarct (A, arrow) and T2* mapping (B) indicated no IMH. C, D: CMR images of STEMI patients with IMH. LGE imaging showed infarct (C, arrow) and T2* mapping (D, arrow) showed IMH. STEMI: ST segment elevation myocardial infarction; CMR: Cardiac magnetic resonance; IMH: Intramyocardial hemorrhage; LGE: Late gadolinium enhancement. |
|
|
表 1 两组STEMI患者临床基线资料 Tab 1 Clinical baseline data of STEMI patients in 2 groups |
2.2 非IMH组和IMH组患者CMR参数比较及相关性分析
IMH组的LVEF、LVGRS较非IMH组低(均P<0.01),且LVGCS、LVGLS、心指数及梗死容积百分比均高于非IMH组(均P<0.01)。见表 2。IMH组IMH容积百分比为3.01%(2.00%,5.90%)。
|
|
表 2 两组STEMI患者心脏磁共振特征比较 Tab 2 Comparison of cardiac magnetic resonance characteristics of STEMI patients between 2 groups |
就IMH组而言,IMH容积百分比与梗死容积百分比呈正相关(rs=0.647,P<0.001);IMH容积百分比、梗死容积百分比与LVEF均呈负相关(rs=-0.640、r=-0.423,均P<0.001),与各左心室整体心肌应变参数也有一定的相关性(IMH容积百分比与LVGRS、LVGCS及LVGLS的相关系数分别为-0.403、0.459、0.515,梗死容积百分比与LVGRS、LVGCS及LVGLS的相关系数分别为-0.383、0.475、0.489,均P<0.05)。就非IMH组而言,梗死容积百分比与LVEF及左心室整体心肌应变参数均无关(均P>0.05)。
2.3 非IMH组和IMH组患者各时间点心肌损伤标志物水平及演变术前两组患者心肌损伤标志物水平差异均无统计学意义(均P>0.05)。两组术后即刻cTnT、CKMB水平均上升,IMH组术后即刻cTnT及CKMB水平均高于非IMH组(P<0.001),但术后CKMB水平较cTnT水平降低快,在术后第3天IMH组cTnT水平仍高于非IMH组(P<0.001)且明显高于正常参考值(<0.015 ng/mL),而CKMB水平在术后第3天时接近正常水平(0~23 U/L)。非IMH组的cTnT、CKMB水平演变趋势与IMH组相似,但变化程度及峰值均低于IMH组(均P<0.01)。两组患者术前、术后即刻的NT-proBNP水平差异均无统计学意义(均P>0.05),但在术后第1天和第3天IMH组患者的NT-proBNP水平高于非IMH组(均P<0.05)。见表 3。
|
|
表 3 两组STEMI患者各时间点心肌损伤标志物水平 Tab 3 Levels of cardiomyocyte injury markers of STEMI patients at each time point between 2 groups |
2.4 心肌损伤标志物水平对IMH的诊断价值
ROC曲线(图 2)显示,PCI术后即刻cTnT、PCI术后即刻与术前相比cTnT变化量及峰值cTnT诊断IMH的AUC值分别为0.890(P<0.001)、0.839(P<0.001)及0.810(P<0.001),PCI术后即刻CKMB、PCI术后即刻与术前相比CKMB变化量及峰值CKMB对诊断IMH的AUC值分别为0.830(P<0.001)、0.792(P=0.001)及0.724(P=0.011)。对于STEMI患者,PCI术后即刻cTnT诊断IMH的AUC值最大,其最佳临界值为2.31 ng/mL;PCI术后即刻CKMB诊断IMH的AUC值也较大,其最佳临界值为189.5 U/L。

|
图 2 心肌损伤标志物诊断心肌内出血的ROC曲线 Fig 2 ROC curves of cardiomyocyte injury markers for diagnosing intramyocardial hemorrhage A: ROC curves of cTnT for diagnosing intramyocardial hemorrhage; B: ROC curves of CKMB for diagnosing intramyocardial hemorrhage. ROC: Receiver operating characteristic; cTnT: Cardiac troponin T; CKMB: Creatine kinase isoenzyme MB. |
2.5 心肌损伤标志物水平与CMR参数的相关性分析
取IMH组及非IMH组之间差异有统计学意义的部分心肌损伤标志物与CMR参数行相关性分析,结果见表 4。PCI术后即刻cTnT、CKMB与LVEF及LVGRS呈负相关,与LVGCS、LVGLS、心肌梗死容积百分比及IMH容积百分比均呈正相关(均P<0.01)。
|
|
表 4 STEMI患者心肌损伤标志物与CMR参数的相关性分析 Tab 4 Correlation analyses of cardiomyocyte injury markers and CMR parameters in STEMI patients |
根据PCI术后即刻cTnT的中位数5.55 ng/mL,将所有患者分为低cTnT组(PCI术后即刻cTnT<5.55 ng/mL)和高cTnT组(PCI术后即刻cTnT≥5.55 ng/mL)。低cTnT组患者的心肌梗死容积百分比和IMH容积百分比均低于高cTnT组[(22.6±11.16)% vs(38.55±14.05)%,P<0.001;0(0,1.38%)vs 4.79%(2.37%,7.21%),P<0.001],而LVEF高于高cTnT组[(54.22±7.92)% vs(46.00±9.09)%,P=0.001]。
3 讨论本研究结果提示:(1)存在IMH的患者较无IMH的患者心肌梗死容积百分比高且左心室收缩功能更差;(2)cTnT及CKMB水平升高对IMH的发生有提示作用,其中术后即刻cTnT的诊断效能最佳,最佳预测临界值为2.31 ng/mL,且更高的术后即刻cTnT水平意味着患者心功能差、梗死面积大、再灌注损伤较严重。
IMH是再灌注损伤的重要机制,在PCI术后IMH的发生率为25%~50%[10-11]。IMH已被证实与左心室重构及心脏不良事件发生有关[12]。CMR是临床评价IMH的主要方式,本研究通过CMR T2* mapping序列评估IMH,发现发生IMH患者的LVEF较非IMH组患者降低,另外,IMH组的心肌梗死容积百分比高于非IMH组。Amier等[13]研究也证明在STEMI患者中,IMH与更严重的心肌梗死和更差的短期左心室功能相关。心肌应力是反映心肌形变程度的指标,既往研究发现STEMI患者的LVGLS、LVGCS和LVGRS均较正常心肌降低[14-15]。在本研究中,IMH组各心肌应变参数的绝对值均较非IMH组降低,提示IMH对左心室三层心肌的形变程度均有不良影响。由此可见,IMH不仅导致更严重的心肌梗死,且对左心室收缩功能有短期不良影响。另外,与下壁心肌梗死相比,前壁心肌梗死通常会导致更差的临床结果,即LVEF更低、心力衰竭发生率及死亡率更高。一般认为左主干或左冠状动脉前降支闭塞往往导致更大的梗死容积,以前研究认为这与微血管损伤如IMH有关[16-17]。在本研究中,虽然IMH组与非IMH组的责任血管位置差异无统计学意义(P=0.068),但IMH组有更高的梗死容积百分比,且梗死容积百分比与IMH容积百分比呈正相关,与既往研究结果不冲突。
评估梗死容积和IMH容积对PCI术后STEMI患者至关重要。但是无论是心肌梗死容积还是IMH容积的评估,都只能在STEMI患者病情平稳后通过CMR评估,而且CMR存在检查费用昂贵、检查时间长(部分患者无法配合)等不足。因此,寻找一种简单、可靠的生物标志物用于早期判断IMH至关重要。
cTnT被认为可用于评估心肌梗死患者的风险程度[18],目前临床上也将cTnT用于间接评估梗死容积。研究表明cTnT作为临床常用的心肌损伤标志物,是预测IMH的重要独立预测因子[19]。还有研究证明,接受PCI治疗的STEMI患者cTnT升高提示患者可能存在与梗死区域无关的灌注缺陷[20]。在本研究中,cTnT及CKMB水平升高均对IMH的发生有提示作用,且术后即刻cTnT的诊断效能最高;同时,cTnT及CKMB水平与LVEF呈负相关、与心肌梗死容积百分比及IMH容积百分比呈正相关,其中术后即刻cTnT的相关系数较其余心肌损伤标志物参数大,且在这些患者中均未发现与梗死区域无关的灌注缺损。因此,PCI术后监测心肌损伤标志物至关重要,其不仅能反映心肌损伤情况,也有助于尽早判断IMH的发生。NT-proBNP作为临床评估心力衰竭的指标,在术后第3天IMH组高于非IMH组(P=0.002),这也证实IMH对左心室收缩功能有不良影响。
本研究尚存在一些不足之处。首先,本研究为单中心研究,且所纳入的研究对象偏少,结果可能存在偏倚;其次,PCI术后STEMI患者的IMH是动态变化的,CMR成像时机可能影响IMH的检测结果,不能排除部分患者IMH容积被低估的可能性。因此,本研究结果仍需要多中心前瞻性研究及多时间点的CMR评估以进一步证实。
综上所述,IMH可导致更严重心肌梗死,且对左心室收缩功能有短期不良影响;心肌损伤标志物可能为判断STMEI患者PCI术后IMH提供了一个方便的方法,有助于及早发现IMH、及时完善CMR检查和采取临床治疗。
| [1] |
SYMONS R, MASCI P G, GOETSCHALCKX K, et al. Effect of infarct severity on regional and global left ventricular remodeling in patients with successfully reperfused ST segment elevation myocardial infarction[J]. Radiology, 2015, 274(1): 93-102. DOI:10.1148/radiol.14132746 |
| [2] |
LECHNER I, REINDL M, TILLER C, et al. Culprit lesion vessel size and risk of reperfusion injury in ST-segment elevation myocardial infarction: a cardiac magnetic resonance imaging study[J]. J Am Heart Assoc, 2024, 13(3): e033102. DOI:10.1161/JAHA.123.033102 |
| [3] |
WU Z, JIN X, TUDAHUN I, et al. Intramyocardial hemorrhage leads to higher MACE rate by increasing myocardial infarction volume in patients with STEMI[J]. Int J Gen Med, 2024, 17: 275-285. DOI:10.2147/IJGM.S444360 |
| [4] |
REINSTADLER S J, STIERMAIER T, REINDL M, et al. Intramyocardial haemorrhage and prognosis after ST-elevation myocardial infarction[J]. Eur Heart J Cardiovasc Imaging, 2019, 20(2): 138-146. DOI:10.1093/ehjci/jey101 |
| [5] |
IBANEZ B, JAMES S, AGEWALL S, et al. 2017 ESC guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: the Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC)[J]. Eur Heart J, 2018, 39(2): 119-177. DOI:10.1093/eurheartj/ehx393 |
| [6] |
HOLZKNECHT M, REINDL M, TILLER C, et al. Global longitudinal strain improves risk assessment after ST-segment elevation myocardial infarction: a comparative prognostic evaluation of left ventricular functional parameters[J]. Clin Res Cardiol, 2021, 110(10): 1599-1611. DOI:10.1007/s00392-021-01855-6 |
| [7] |
陈思, 刁海霞, 赵依晴, 等. 微循环阻塞对急性ST段抬高型心肌梗死患者直接经皮冠脉介入术后左心室恶化重构预测价值分析[J]. 中华内科杂志, 2023, 62(12): 1458-1464. DOI:10.3760/cma.j.cn112138-20221220-00944 |
| [8] |
徐紫谦, 陈伟, 陈榆舒, 等. 心肌缺血/再灌注损伤后心肌内出血的心血管MR研究现状及进展[J]. 中国医学影像技术, 2015, 31(10): 1605-1609. DOI:10.13929/j.1003-3289.2015.10.039 |
| [9] |
FERRÉ-VALLVERDÚ M, SÁNCHEZ-LACUESTA E, PLAZA-LÓPEZ D, et al. Prognostic value and clinical predictors of intramyocardial hemorrhage measured by CMR T2*sequences in STEMI[J]. Int J Cardiovasc Imaging, 2021, 37(5): 1735-1744. DOI:10.1007/s10554-020-02142-7 |
| [10] |
BEKKERS S C, SMULDERS M W, PASSOS V L, et al. Clinical implications of microvascular obstruction and intramyocardial haemorrhage in acute myocardial infarction using cardiovascular magnetic resonance imaging[J]. Eur Radiol, 2010, 20(11): 2572-2578. DOI:10.1007/s00330-010-1849-9 |
| [11] |
GANAME J, MESSALLI G, DYMARKOWSKI S, et al. Impact of myocardial haemorrhage on left ventricular function and remodelling in patients with reperfused acute myocardial infarction[J]. Eur Heart J, 2009, 30(12): 1440-1449. DOI:10.1093/eurheartj/ehp093 |
| [12] |
BEIJNINK C W H, VAN DER HOEVEN N W, KONIJNENBERG L S F, et al. Cardiac MRI to visualize myocardial damage after ST-segment elevation myocardial infarction: a review of its histologic validation[J]. Radiology, 2021, 301(1): 4-18. DOI:10.1148/radiol.2021204265 |
| [13] |
AMIER R P, TIJSSEN R Y G, TEUNISSEN P F A, et al. Predictors of intramyocardial hemorrhage after reperfused ST-segment elevation myocardial infarction[J]. J Am Heart Assoc, 2017, 6(8): e005651. DOI:10.1161/JAHA.117.005651 |
| [14] |
MANGION K, MCCOMB C, AUGER D A, et al. Magnetic resonance imaging of myocardial strain after acute ST-segment-elevation myocardial infarction: a systematic review[J]. Circ Cardiovasc Imaging, 2017, 10(8): e006498. DOI:10.1161/CIRCIMAGING.117.006498 |
| [15] |
SHARMA S, LASSEN M C H, NIELSEN A B, et al. The clinical application of longitudinal layer specific strain as a diagnostic and prognostic instrument in ischemic heart diseases: a systematic review and meta-analysis[J]. Front Cardiovasc Med, 2023, 10: 980626. DOI:10.3389/fcvm.2023.980626 |
| [16] |
EITEL I, KUBUSCH K, STROHM O, et al. Prognostic value and determinants of a hypointense infarct core in T2-weighted cardiac magnetic resonance in acute reperfused ST-elevation-myocardial infarction[J]. Circ Cardiovasc Imaging, 2011, 4(4): 354-362. DOI:10.1161/CIRCIMAGING.110.960500 |
| [17] |
NIJVELDT R, BEEK A M, HIRSCH A, et al. Functional recovery after acute myocardial infarction: comparison between angiography, electrocardiography, and cardiovascular magnetic resonance measures of microvascular injury[J]. J Am Coll Cardiol, 2008, 52(3): 181-189. DOI:10.1016/j.jacc.2008.04.006 |
| [18] |
SHARAIN K, VASILE V C, SANDOVAL Y, et al. The elevated high-sensitivity cardiac troponin T pilot: diagnoses and outcomes[J]. Mayo Clin Proc, 2021, 96(9): 2366-2375. DOI:10.1016/j.mayocp.2021.01.027 |
| [19] |
任道元, 陈铟铟, 金航, 等. 急诊经皮冠状动脉介入治疗术后围术期心肌肌钙蛋白T水平对心肌内出血的预测价值[J]. 中国介入心脏病学杂志, 2023, 31(4): 266-272. DOI:10.3969/j.issn.1004-8812.2023.04.003 |
| [20] |
BRAVO BAPTISTA S, FAUSTINO M, BRIZIDA L, et al. Early peripheral endothelial dysfunction predicts myocardial infarct extension and microvascular obstruction in patients with ST-elevation myocardial infarction[J]. Portuguese J Cardiol Off J Portuguese Soc Cardiol, 2017, 36(10): 731-742. DOI:10.1016/j.repc.2017.01.006 |
 2024, Vol. 45
2024, Vol. 45


