2. 四川省达州市万源市中心医院外二科, 达州 636350;
3. 重庆医科大学生命科学研究院骨发育与再生实验室, 重庆 400016
2. Department of Surgery (Ⅱ), The Central Hospital of Wanyuan, Dazhou 636350, Sichuan, China;
3. Laboratory of Bone Development and Regeneration, Institute of Life Sciences, Chongqing Medical University, Chongqing 400016, China
乳腺癌是女性最常被诊断出的恶性肿瘤,也是癌症相关死亡的主要原因之一[1]。乳腺癌易受激素紊乱、遗传、环境和表观遗传突变等因素影响,其发病和进展机制尚不明确,防治仍未取得根本性突破[2-3],迫切需要进一步探究乳腺癌发生、发展的分子机制。
环状RNA是一类通过反向剪接形成的共价闭合环状转录本,结构稳定,在生物体内表达丰富,并通过多种机制广泛地调控疾病的发生和发展[4-5]。近年来随着测序技术的发展,一些环状RNA被发现在疾病中具有生物学意义[6-8]。本研究通过环状RNA测序分析乳腺癌组织及癌旁正常组织中差异表达的环状RNA,并选择乳腺癌组织和癌旁正常组织中差异表达最显著的环状RNA hsa_circ_0001460[chr4:178274462-178281831,其亲本基因为Nei核酸内切酶Ⅷ样蛋白3(Nei endonuclease Ⅷ like protein 3,NEIL3),故命名为circNEIL3]为研究对象,探究其在乳腺癌中的表达、生物学功能和分子调控机制。
1 材料和方法 1.1 临床样本收集2019年3月至2021年4月在四川省达州市万源市中心医院行手术治疗的50例乳腺癌患者的乳腺癌组织及癌旁正常组织,所有组织在切除后立即放入RNA保存液中,然后放置于-80 ℃冰箱备用。所有患者术前均未行化疗或放疗,且术后病理证实为乳腺癌。收集患者临床信息,包括年龄、绝经情况、病理分级、肿瘤大小、肿瘤淋巴结转移分期。所有患者均签署知情同意书。本研究经四川省达州市万源市中心医院伦理委员会审批。
1.2 主要试剂与仪器DMEM和RPMI 1640培养基购自美国Gibco公司;MEGM培养基购自瑞士Lonza公司;FBS购自美国PAN公司;TRIzol和Lipofectamine 2000购自美国Invitrogen公司;核质分离PARISTM试剂盒购自美国Life Technologies公司;RNA酶R(RNase R)购自美国Epicentre Biotechnologies公司;反转录试剂盒与qPCR试剂盒购自宝生物工程(大连)有限公司;CCK-8试剂盒购自汉恒生物科技(上海)有限公司;circNEIL3过表达质粒(circN3OE)、对照质粒(vector)、siRNA(si-circNEIL3)和阴性对照siRNA(si-nc)购自金开瑞生物工程(武汉)有限公司;总蛋白提取试剂盒、BCA蛋白定量试剂盒、SDS-PAGE试剂盒和PVDF膜购自碧云天生物技术(上海)有限公司;细胞周期蛋白D1(cyclin D1,CCND1)抗体、细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)4抗体、细胞周期蛋白E1(cyclin E1,CCNE1)抗体、CDK2抗体、β-肌动蛋白抗体和HRP标记二抗购自美国Santa Cruz公司;SW-9800型超净工作台购自苏州泰安空气技术有限公司;PCR反转录仪、CFX96TM实时荧光qPCR仪、蛋白垂直电泳电转系统、FACSCanto Ⅱ流式细胞仪购自美国Bio-Rad公司;酶标仪购自美国ThermoFisher公司。
1.3 环状RNA测序提取3对乳腺癌组织及癌旁正常组织的总RNA并检测其完整度、浓度和纯度。所得总RNA经质检合格后进行后续实验,由上海康成生物技术有限公司对总RNA进行环状RNA测序分析。
1.4 细胞培养及转染人正常乳腺细胞及人乳腺癌细胞由重庆医科大学分子医学与肿瘤研究中心提供。以上细胞使用适合的MEGM、DMEM或RPMI 1640培养基进行培养,细胞放置于37 ℃、CO2体积分数为5% 的细胞培养箱内培养。将处于对数生长期的细胞按照Lipofectamine 2000转染试剂说明书进行转染。转染48 h后收集细胞检测转染效率,用于后续实验。转染vector、circN3OE、si-nc和si-circNEIL3的细胞被分别命名为vector组、circN3OE组、si-nc组和si-circNEIL3组。
1.5 RNA提取、反转录及qPCR使用TRIzol试剂提取组织和细胞中的RNA,按照反转录试剂盒说明书将其反转录为cDNA,以cDNA为模板,使用CFX96TM实时荧光qPCR仪进行PCR扩增,采用2-ΔΔCt法计算RNA的相对表达量。引物序列如下:circNEIL3正义引物5'-GCAGTTT-TATGCCTGTCCTCTACCT-3',反义引物5'-CTTC-ACTCTTGAGCACTGAATTTCA-3';NEIL3正义引物5'-CAAGCGTCCTAATTGTGGTCA,反义引物5'-CCCTGCTAGATGTCCAACTGATT-3';β-肌动蛋白正义引物5'-GATTCCTATGTGGGCGACGA-3',反义引物5'-TGTAGAAGGTGTGGTGCCAG-3';U6正义引物5'-CTCGCTTCGGCAGCACA-3',反义引物5'-AACGCTTCACGAATTTGCGT-3'[9]。
1.6 核质分离实验按照核质分离PARISTM试剂盒说明书提取MCF-7细胞的细胞核和细胞质RNA,使用反转录试剂盒将相应的RNA反转录为cDNA,利用qPCR检测细胞核和细胞质中RNA表达量。
1.7 RNA酶消化实验使用TRIzol试剂提取细胞中的RNA,取2 μg RNA和RNase R(4 U/μg)轻柔混匀后,于37 ℃条件下处理20 min。使用反转录试剂盒反转录相应的RNA为cDNA,利用qPCR检测样本中RNA的表达情况。
1.8 CCK-8实验取转染48 h后的BT-549和MCF-7细胞,将每组细胞制成密度为2×104/mL的细胞悬液,按每孔100 μL接种于96孔板中,每组设置3个复孔。于0、24、48和72 h时每孔分别加入10 μL CCK-8溶液,在细胞培养箱中孵育1.5 h后,于450 nm处测量光密度值。
1.9 集落形成实验取转染48 h后的BT-549和MCF-7细胞(1×103/孔),接种于6孔板中,置于细胞培养箱中培养2周后,利用4%多聚甲醛固定20 min,弃多聚甲醛,加入0.1%结晶紫染色液染色15 min,轻轻漂洗掉染色液,室温晾干后拍照,进行集落计数。
1.10 流式细胞术取转染48 h后的MCF-7细胞,室温避光条件下以膜联蛋白Ⅴ/PI对细胞进行10 min染色,使用流式细胞仪测量凋亡细胞。另取转染48 h后的MCF-7细胞,使用70%的乙醇于4 ℃条件下固定细胞12 h,短暂离心后弃乙醇,经PBS洗涤后,在室温避光条件下使用聚酰亚胺溶液处理30 min,使用流式细胞仪测量细胞周期分布情况。
1.11 蛋白质印迹法收集转染48 h后的BT-549和MCF-7细胞,使用RIPA裂解液充分裂解细胞并提取细胞总蛋白,每孔上样15 μg蛋白质样品,电泳待目的条带分开后切胶,210 mA恒流转膜。取膜在室温下用8%脱脂牛奶封闭2 h,然后4 ℃条件下加入一抗(稀释比例为CCND1抗体1∶2 000、CDK4抗体1∶2 000、CCNE1抗体1∶3 000、CDK2抗体1∶3 000和β-肌动蛋白抗体1∶2 000)孵育过夜;然后室温孵育二抗(稀释比例为1∶8 000)2 h。使用ECL试剂盒进行化学发光显影,用Quantity One对图像进行半定量分析。
1.12 统计学处理应用SPSS 20.0软件进行统计学分析。计量资料以x ± s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。计数资料以频数表示,采用χ2检验分析circNEIL3表达量与患者临床病理指标的关系。检验水准(α)为0.05。
2 结果 2.1 差异表达的环状RNA对3对乳腺癌组织和癌旁正常组织进行环状RNA测序,相对于癌旁正常组织,在乳腺癌组织中31个环状RNA表达上调、51个环状RNA表达下调。其中circNEIL3(hsa_circ_0001460)在乳腺癌组织中上调倍数最高(图 1)。
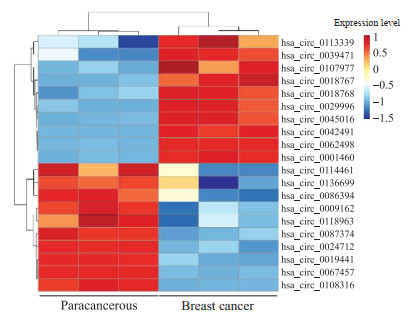
|
图 1 乳腺癌组织和癌旁正常组织中部分差异表达的环状RNA热图 Fig 1 Heat map of differentially expressed circular RNAs in breast cancer tissue and paracancerous tissue |
2.2 circNEIL3环状结构及稳定性
circNEIL3由NEIL3基因的第8、9号外显子环化而成(图 2A),因此命名为circNEIL3。RNA酶消化实验结果(图 2B)显示,与未处理的RNA相比,RNase R处理的RNA样品中NEIL3与β-肌动蛋白mRNA的表达丰度降低(均P<0.01),而circNEIL3在两组间的表达差异没有统计学意义(P>0.05)。circNEIL3在MCF-7细胞中的分布情况如图 2C所示,circNEIL3主要位于细胞质中。
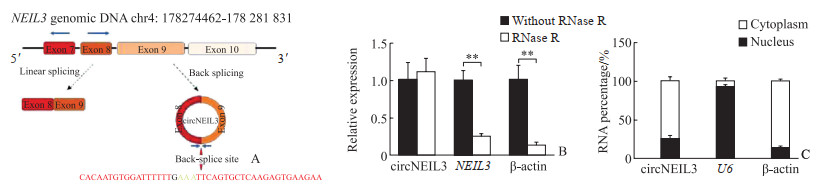
|
图 2 circNEIL3的结构及其在MCF-7细胞中的特征 Fig 2 Structure of circNEIL3 and its characteristics in MCF-7 cells A: Schematic illustration of human circNEIL3. B: RNA expression in breast cancer cells was detected after RNase R treatment. **P < 0.01. n=3, x ± s. C: The cellular localization of circNEIL3 was analyzed by real-time quantitative polymerase chain reaction. NEIL3: Nei endonuclease Ⅷ like protein 3; RNase R: Ribonuclease R. |
2.3 circNEIL3的表达及其与临床病理指标的关系
乳腺癌组织中circNEIL3的表达水平高于癌旁正常组织(1.85±1.21 vs 1.00±0.27,P<0.01)。与MCF-10A细胞(1.02±0.24)相比,BT-549(2.73±0.57)、MDA-MB-231(3.01±0.70)、MDA-MB-468(2.91±0.40)、BT-483(4.22±0.75)和MCF-7(6.28±1.30)细胞中circNEIL3表达水平均上调(均P<0.05)。如表 1所示,肿瘤最大径>2 cm和高TNM分期(Ⅲ期)的乳腺癌患者多表现为circNEIL3高表达(均P<0.05),表明circNEIL3与乳腺癌关系密切。
|
|
表 1 50例乳腺癌患者临床病理特征与circNEIL3表达的关系 Tab 1 Correlation between circNEIL3 expression and clinicopathological features in 50 breast cancer patients |
2.4 过表达及敲低circNEIL3的乳腺癌细胞模型构建
在BT-549细胞中转染vector和circN3OE,circNEIL3的相对表达量在vector组和circN3OE组中分别为1.04±0.38和8.43±2.02,提示circNEIL3表达上调(P<0.01);在MCF-7细胞中转染si-nc和si-circNEIL3,si-nc组和si-circNEIL3组中circNEIL3的相对表达量分别为1.01±0.19和0.37±0.06,提示circNEIL3表达下调(均P<0.01)。同时,vector、circN3OE、si-nc和si-circNEIL3组中circNEIL3的亲本线性基因NEIL3相对表达量分别为1.04±0.39、1.07±0.58、1.03±0.27和1.03±0.67,4组间差异无统计学意义(P均>0.05)。
2.5 circNEIL3促进乳腺癌细胞增殖CCK-8实验结果显示,转染circN3OE的BT-549细胞转染72 h时增殖活性较vector组细胞升高(P<0.01,图 3A),而转染si-circNEIL3的MCF-7细胞转染72 h时增殖活性较si-nc组细胞降低(P<0.01,图 3B)。集落形成实验结果支持CCK-8实验结果,转染circN3OE的BT-549细胞集落数较vector组增加(161.67±6.11 vs 118.67±14.22,P<0.01;图 3C),而转染si-circNEIL3的MCF-7细胞集落数较si-nc组减少(56.00±6.56 vs 132.33±7.51,P<0.01;图 3D)。
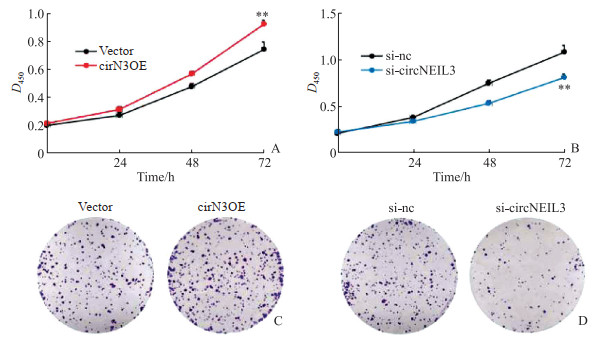
|
图 3 CCK-8实验和集落形成实验检测circNEIL3对乳腺癌细胞增殖的影响 Fig 3 Effect of circNEIL3 on proliferation of breast cancer cells determined by CCK-8 and colony-formation assays A, B: The growth curves of breast cancer cells BT-549 (A) and MCF-7 (B) were measured using CCK-8 assay. **P < 0.01 vs vector/si-nc group. n=3, x ± s. C, D: The proliferation of breast cancer cells BT-549 (C) and MCF-7 (D) was detected by colony-formation assay. CCK-8: Cell counting kit 8; circN3OE: circNEIL3 overexpression plasmid; si-nc: Negative control small interfering RNA; si-circNEIL3: Specific small interfering RNA targeting circNEIL3. |
2.6 敲低circNEIL3可促进细胞凋亡和细胞周期阻滞
流式细胞术结果显示,与对照组相比,在乳腺癌细胞MCF-7中敲低circNEIL3的表达可提高细胞早期凋亡率[(19.53±0.91)% vs(5.20±0.30)%,P<0.01;图 4A],表明敲低circNEIL3可促进细胞凋亡。细胞周期检测结果显示,敲低circNEIL3的表达可增高G1期细胞百分比、降低S期细胞百分比(均P<0.01,图 4B),表明敲低circNEIL3导致细胞周期阻滞于G1期。
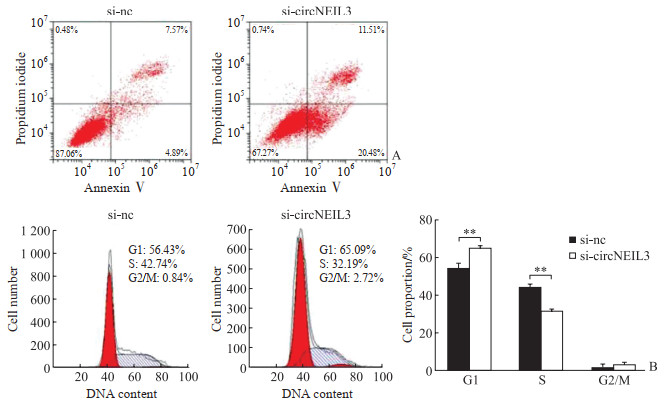
|
图 4 流式细胞术分析circNEIL3对乳腺癌细胞凋亡和细胞周期阻滞的影响 Fig 4 Effects of circNEIL3 on apoptosis and cell cycle arrest of breast cancer cells analyzed by flow cytometry A: The apoptosis of MCF-7 cells transfected with si-nc or si-circNEIL3; B: The cell cycle of MCF-7 cells transfected with si-nc or si-circNEIL3. **P < 0.01. n=3, x ± s. si-nc: Negative control small interfering RNA; si-circNEIL3: Specific small interfering RNA targeting circNEIL3. |
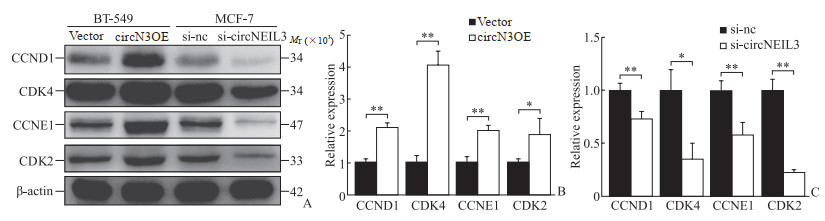
2.7 circNEIL3影响周期相关蛋白的表达
蛋白质印迹法检测结果显示,在BT-549细胞中转染circN3OE后,细胞中CCND1、CDK4、CCNE1和CDK2蛋白表达水平均升高(均P<0.05);而在MCF-7细胞中转染si-circNEIL3后,细胞中CCND1、CDK4、CCNE1和CDK2蛋白表达水平均降低(均P<0.05)。见图 5。
|
图 5 蛋白质印迹法检测circNEIL3对乳腺癌细胞中细胞周期相关蛋白表达的影响 Fig 5 Effect of circNEIL3 on expression of cell cycle-related proteins in breast cancer cells detected by Western blotting A: Results of Western blotting; B: The levels of cell cycle-related proteins in breast cancer cells BT-549 transfected with vector plasmids or circN3OE; C: The levels of cell cycle-related proteins in breast cancer cells MCF7 transfected with si-nc or si-circNEIL3. *P < 0.05, **P < 0.01. n=3, x ± s. circN3OE: circNEIL3 overexpression plasmid; si-nc: Negative control small interfering RNA; si-circNEIL3: Specific small interfering RNA targeting circNEIL3; CCND1: Cyclin D1; CDK: Cyclin-dependent kinase; CCNE1: Cyclin E1. |
3 讨论
越来越多的证据表明环状RNA对基因表达具有重要的调控能力[5, 7]。目前环状RNA在生物体内的表达及生物学功能得到广泛研究,尤其是在肿瘤的进展、转移、凋亡、自噬等领域[5-6]。研究显示环状RNA主要作为miRNA海绵调节下游靶基因表达,进而发挥相应的生物学功能,circ-MET(hsa_circ_0082002)在肝细胞癌中高表达,并通过miRNA-30-5p/snail/二肽基肽酶4轴促进肝细胞癌发展,产生对抗程序性死亡受体1治疗的耐药性[6]。同时环状RNA可以同蛋白质结合并影响其稳定性或功能,环状RNA-SORE(一种在耐索拉非尼肝细胞癌细胞中上调的环状RNA)与致癌蛋白Y-框结合蛋白1(Y-box binding protein 1,YBX1)结合,阻止YBX1与E3泛素连接酶pre-mRNA加工因子19(pre-mRNA processing factor 19,PRP19)相互作用,从而阻止PRP19对YBX1的泛素化降解,最终导致肝细胞癌对索拉非尼产生耐药性[5]。值得注意的是,环状RNA还可以充当蛋白质翻译模板而调节生理相关过程,circ-ZNF609(一种在鼠和人类成肌细胞中表达的环状RNA)能以依赖剪接和不依赖帽的方式翻译成蛋白质,特异性控制成肌细胞增殖[8]。
StarBase数据库(http://www.circbase.org/)提示circNEIL3(chr4:178274462–178281831)源于NEIL3基因座中的外显子区域,由外显子8和外显子9环化形成,该区域位于染色体4q34.3。研究表明,circNEIL3在多种恶性肿瘤中表达上调,并促进多种癌细胞的恶性表型。其在宫颈癌中高表达,通过作为竞争性内源RNA与miRNA-137竞争性结合间接上调Krüppel样因子12的表达,促进宫颈癌细胞增殖[10]。在肝细胞癌中表达上调的circNEIL3通过miRNA-3150b-3p/层粘连蛋白γ 1亚基促进肝细胞癌细胞增殖、迁移和侵袭[11]。此外,circNEIL3能通过miRNA-432-5p/RNA特异性腺苷脱氨酶1/胶质瘤相关癌基因同源物1和上皮-间质转换轴调控胰腺导管腺癌增殖和转移[9]。而circNEIL3在乳腺癌中的表达及生物学功能、分子机制未见报道。本研究发现circNEIL3在乳腺癌组织和细胞中稳定高表达,且circNEIL3的异常高表达与肿瘤大小、TNM分期相关。体外细胞功能实验结果提示,过表达circNEIL3可促进乳腺癌细胞的增殖活性和集落形成,而敲低circNEIL3可降低乳腺癌细胞的增殖活性和集落形成,促进细胞凋亡并使细胞周期阻滞在G1期。
细胞周期进程调节因子CCND1与CDK4或CDK6形成复合体,与CCNE1/CDK2复合体一起磷酸化视网膜母细胞瘤蛋白,使E2F转录因子被激活并通过调节特定基因的转录促进细胞增殖[12]。Shen等[9]报道circNEIL3可以调控胰腺导管腺癌细胞中CCND1和CDK4等细胞周期蛋白的表达,而且CDK4/6抑制剂已被批准用于CDK4/6阳性乳腺癌亚型的治疗[13]。本实验检测了circNEIL3对乳腺癌细胞中部分细胞周期蛋白表达的影响,结果显示过表达circNEIL3可上调CCND1、CDK2、CCNE1和CDK4的表达,而敲低circNEIL3则产生相反的作用,说明circNEIL3可通过影响细胞周期相关蛋白表达促进乳腺癌细胞增殖。
| [1] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7-30. DOI:10.3322/caac.21387 |
| [2] |
GALLUZZI L, VITALE I, AARONSON S A, et al. Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018[J]. Cell Death Differ, 2018, 25(3): 486-541. DOI:10.1038/s41418-017-0012-4 |
| [3] |
GINSBURG O, BRAY F, COLEMAN M P, et al. The global burden of women's cancers: a grand challenge in global health[J]. Lancet, 2017, 389(10071): 847-860. DOI:10.1016/S0140-6736(16)31392-7 |
| [4] |
KRISTENSEN L S, ANDERSEN M S, STAGSTED L V W, et al. The biogenesis, biology and characterization of circular RNAs[J]. Nat Rev Genet, 2019, 20(11): 675-691. DOI:10.1038/s41576-019-0158-7 |
| [5] |
XU J, JI L, LIANG Y, et al. CircRNA-SORE mediates sorafenib resistance in hepatocellular carcinoma by stabilizing YBX1[J]. Signal Transduct Target Ther, 2020, 5(1): 298. DOI:10.1038/s41392-020-00375-5 |
| [6] |
HUANG X Y, ZHANG P F, WEI C Y, et al. Circular RNA circMET drives immunosuppression and anti-PD1 therapy resistance in hepatocellular carcinoma via the miR-30-5p/snail/DPP4 axis[J]. Mol Cancer, 2020, 19(1): 92. DOI:10.1186/s12943-020-01213-6 |
| [7] |
LIANG G, LING Y, MEHRPOUR M, et al. Autophagy-associated circRNA circCDYL augments autophagy and promotes breast cancer progression[J]. Mol Cancer, 2020, 19(1): 65. DOI:10.1186/s12943-020-01152-2 |
| [8] |
LEGNINI I, TIMOTEO G D, ROSSI F, et al. Circ-ZNF609 is a circular RNA that can be translated and functions in myogenesis[J]. Mol Cell, 2017, 66(1): 22-37. DOI:10.1016/j.molcel.2017.02.017 |
| [9] |
SHEN P, YANG T, CHEN Q, et al. CircNEIL3 regulatory loop promotes pancreatic ductal adenocarcinoma progression via miRNA sponging and A-to-I RNA-editing[J]. Mol Cancer, 2021, 20(1): 51. DOI:10.1186/s12943-021-01333-7 |
| [10] |
CHEN Y, GENG Y, HUANG J, et al. CircNEIL3 promotes cervical cancer cell proliferation by adsorbing miR-137 and upregulating KLF12[J]. Cancer Cell Int, 2021, 21(1): 34. DOI:10.1186/s12935-020-01736-4 |
| [11] |
LI Z, ZHANG J, JIANG Y, et al. Circular ribonucleic acid Nei-like deoxyribonucleic acid glycosylase 3 governs the microribonucleic acid-3150b-3p/laminin subunit gamma 1 network to partially promote the development of hepatocellular carcinoma[J]. Hepatol Res, 2021, 51(6): 702-714. DOI:10.1111/hepr.13636 |
| [12] |
MONTALTO F I, AMICIS F D. Cyclin D1 in cancer: a molecular connection for cell cycle control, adhesion and invasion in tumor and stroma[J]. Cells, 2020, 9(12): 2648. DOI:10.3390/cells9122648 |
| [13] |
XUE Y, MEEHAN B, MACDONALD E, et al. CDK4/6 inhibitors target SMARCA4-determined cyclin D1 deficiency in hypercalcemic small cell carcinoma of the ovary[J]. Nat Commun, 2019, 10(1): 558. DOI:10.1038/s41467-018-06958-9 |
 2024, Vol. 45
2024, Vol. 45


