缺乏活性结合位点的“难成药”靶点、难以提升的选择性、层出不穷的耐药问题等均是传统小分子靶向药物难以突破的瓶颈,同时细胞疗法、免疫疗法和基因编辑技术的迅速发展使传统小分子药物的研发面临前所未有的挑战。近年来,以蛋白水解靶向嵌合体(proteolysis targeting chimaera,PROTAC)为核心的靶向蛋白降解(targeted protein degradation,TPD)技术给分子靶向治疗领域带来了新的机遇。TPD技术利用一类化学分子对蛋白质的稳态系统重新编程,并通过细胞内固有的降解机制破坏靶蛋白[1],突破了传统小分子药物“占位驱动”的作用机制限制,为新药研发提供了新的思路。
真核细胞内的蛋白降解途径主要包括泛素- 蛋白酶体系统(ubiquitin-proteasome system,UPS)和溶酶体途径,这2条途径独立且又相互联系。UPS主要清除短寿命蛋白质或错误折叠的单体蛋白,溶酶体则通过内吞、吞噬或自噬途径来降解受损蛋白和不溶性蛋白质聚集体甚至受损细胞器和入侵的病原微生物等。当前,基于UPS开发的TPD技术主要包括分子胶降解剂[2]、PROTAC和疏水标签[3-4],基于溶酶体途径开发的TPD技术主要包括溶酶体靶向嵌合体(lysosometargeting chimaera,LYTAC)[5-9]、基于共价纳米抗体Gluebody的靶向嵌合体(Gluebody targeting chimaera,GlueTAC)[10]、自噬体绑定化合物(autophagosome-tethering compound,ATTEC)[11-13]、自噬靶向嵌合体(autophagy-targeting chimera,AUTAC[14] /AUTOTAC[15])等。
近年来,笔者团队围绕TPD领域开展创新药物研究,致力探讨多维度的致病靶蛋白降解手段,积累了较为丰富的实践经验[2, 13, 16-21]。本文结合笔者团队的相关工作,简述TPD技术的发展历程与研究进展,分析其应用前景与挑战。
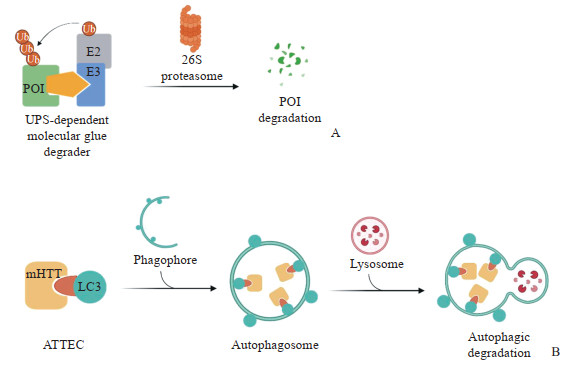
1 TPD药物的经典模式——单价分子胶降解剂和二价小分子降解剂单价和二价的小分子降解剂是当前TPD药物的主要模式[1]。分子胶降解剂是一类典型的单价小分子降解剂,具有较低的分子量(通常在500以下),其理化性质与传统小分子药物相似,大多符合类药“五规则”。分子胶降解剂通过结合于2种蛋白质相互作用界面,诱导2种蛋白质在空间上相互邻近,从而稳定蛋白质- 蛋白质相互作用(protein-protein interaction,PPI)或诱导形成新PPI,驱动靶蛋白基于UPS或溶酶体途径降解(图 1)。笔者团队对分子胶降解剂的发现策略和案例研究进行了详细的分析[2]。
|
图 1 分子胶降解剂的作用机制 Fig 1 Mechanism of action of molecular glue degraders The figures were created with BioRender.com. A: Protein degradation mediated by molecular glue degraders via UPS; B: Protein degradation mediated by molecular glue degraders via autophagy-lysosomal pathway. UPS: Ubiquitin-proteasome system; POI: Protein of interest; Ub: Ubiquitin; E2: Ubiquitin-conjugating enzyme E2; E3: E3 ubiquitin ligase; mHTT: Mutant huntingtin; LC3: Microtubule associated protein 1 light chain 3; ATTEC: Autophagosome-tethering compound. |
1.1 基于UPS的分子胶降解剂
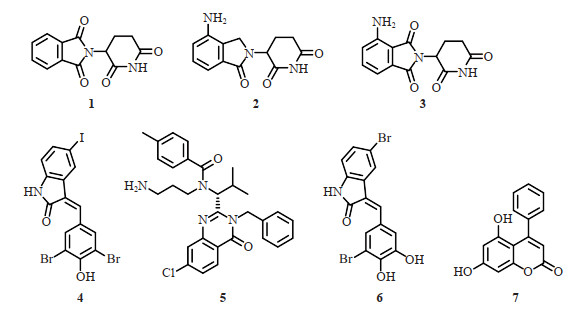
此类分子胶降解剂都是早期在机制研究中偶然发现获得,典型的例子是沙利度胺类免疫调节药物(thalidomide-like immunomodulatory drug,IMiD)(化合物1~3,图 2)。IMiD与cereblon(CRBN)蛋白直接结合,CRBN则与损伤特异性DNA结合蛋白1、滞蛋白4(cullin 4)和环框蛋白1形成E3泛素连接酶复合物CRL4(cullin-Ring泛素连接酶4)。IMiD进入CRBN结合口袋后产生了一个新的界面,促进与某些新底物蛋白如Ikaros家族锌指蛋白1、Ikaros家族锌指蛋白3和酪蛋白激酶1α等的结合,最终通过形成E3泛素连接酶- 分子胶降解剂- 新底物蛋白三元复合物促使新底物蛋白的泛素化和蛋白质降解(图 1A)[22-25]。
|
图 2 代表性的分子胶降解剂的化学结构 Fig 2 Chemical structures of representative molecular glue degraders |
1.2 ATTEC分子胶降解剂
ATTEC分子胶降解剂是近年来颇受关注的基于自噬- 溶酶体途径的TPD策略。自噬降解蛋白的大致过程为:(1)在细胞自噬诱导信号的调控下,微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3,LC3)由胞质型(LC3- Ⅰ)脂化成自噬体膜型(LC3- Ⅱ),吸附在由高尔基体、内质网等细胞器的游离膜形成的杯状双层膜结构的吞噬泡(phagophore)上,并进一步延伸;(2)吞噬泡进一步包裹住胞质中的靶蛋白等底物形成双层膜结构的封闭隔室,即自噬体(autophagosome);(3)自噬体与溶酶体融合形成自噬溶酶体(autolysosome),完成后续降解。复旦大学鲁伯埙等基于高通量药物筛选策略,发现了以分子胶方式同时结合LC3和突变亨廷顿蛋白(mutant huntingtin,mHTT)的4个ATTEC分子(化合物4~7,图 2),这些ATTEC分子将mHTT拉进LC3介导的自噬过程,使得mHTT在溶酶体酶的作用下降解(图 1B)[12]。这些化合物在细胞和动物模型中都能降解mHTT,并能改善亨廷顿病相关表型,且不影响野生型亨廷顿蛋白水平。
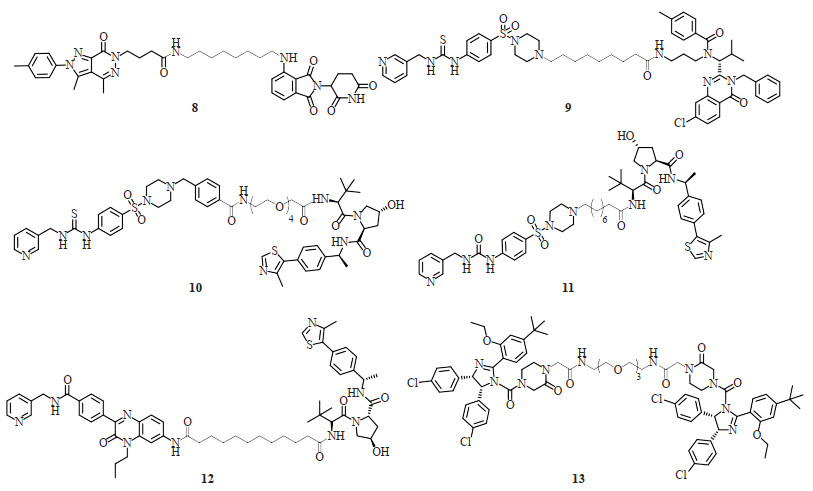
1.3 二价小分子降解剂PROTAC和ATTEC尽管分子胶降解剂在新药研发中备受瞩目,但合理设计策略的缺乏限制了分子胶发现的效率和适用性。将分子胶降解剂转换为蛋白降解标签来进行PROTAC和二价ATTEC分子的设计是当前非常热门的蛋白降解剂设计策略,例如,将沙利度胺等IMiD作为E3泛素连接酶CRBN的配体广泛用于PROTAC设计,以及将单价ATTEC分子作为LC3配体用于广义的异双功能ATTEC自噬降解剂设计[13, 26]。笔者团队也基于上述2种策略进行了蛋白靶向降解剂的开发。例如,基于CRBN配体泊马度胺(化合物3,图 2)设计合成了一系列靶向磷酸二酯酶6δ亚基(phosphodiesterase 6δ subunit,PDEδ)的PROTAC分子,获得了具有良好体内体外降解活性和抗肿瘤活性的代表性化合物(化合物8,图 3),并通过机制研究证明PDEδ降解是有效的靶向Kirsten大鼠肉瘤病毒癌基因同源物的策略[16];此外,以ATTEC小分子ispinesib(纺锤体驱动蛋白小分子抑制剂;化合物5,图 2)为LC3配体,通过化学连接子与前期开发的烟酰胺磷酸核糖转移酶(nicotinamide phosphoribosyltransferase,NAMPT)小分子抑制剂连接,合成了靶向NAMPT的自噬降解剂[13]。其中降解活性最优的化合物9(图 3)在100 nmol/L浓度下可降解人卵巢癌A2780细胞中90% 的NAMPT,首次证明了ispinesib是一种有效的自噬降解标签。
|
图 3 笔者团队报道的二价小分子PROTAC和ATTEC降解剂[13, 16-20] Fig 3 Bivalent small molecule PROTAC and ATTEC degraders reported by our group[13, 16-20] PROTAC: Proteolysis targeting chimaera; ATTEC: Autophagosome-tethering compound. |
从单价分子胶降解剂的偶然发现到二价异双功能分子的理性设计,是小分子药物设计理念的一次革命性创新,证明了基于“诱导- 邻近(inducedproximity)”的机制设计双功能嵌合体是一项有效的TPD策略,构成了TPD药物设计的理论基础之一。
除CRBN配体之外,还有不到10个E3泛素连接酶可被用于PROTAC的设计,其中应用较为广泛的是希佩尔- 林道肿瘤抑制蛋白(von HippelLindau tumor suppressor,VHL)、鼠双微粒体基因2(murine double minute 2,MDM2)蛋白和凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)。笔者团队基于VHL E3泛素连接酶开发了高活性的经典NAMPT PROTAC(化合物10和11,图 3)及诊断治疗型NAMPT PROTAC(化合物12,图 3)[17-19],促进了以NAMPT为靶点的抗癌新药的开发,并实现了可视化跟踪蛋白降解的过程。此外,还设计了一类靶向MDM2-p53蛋白相互作用的同型二价PROTAC,其由两分子MDM2抑制剂nutlin-3和一个聚乙二醇链组成(化合物13,图 3),可有效诱导MDM2经蛋白酶体途径自身降解,进而稳定肿瘤抑制因子p53,发挥抗肿瘤作用[20]。
2 TPD技术的飞跃——超越经典小分子PROTAC自2001年Sakamoto等[27]首次提出PROTAC的概念以来,PROTAC技术经历了20余年的飞速发展。目前国内外已有超过20款PROTAC分子处于临床研究阶段,其中最早进入临床研究的ARV-110与ARV-471分别在前列腺癌和乳腺癌的治疗中得到了临床验证[28-30],是PROTAC技术转化应用的里程碑。与传统小分子抑制剂相比,PROTAC策略具有以下优势:(1)全新的作用机制,理论上能够循环使用,持续降解靶蛋白。PROTAC发挥作用取决于靶蛋白和E3泛素连接酶的空间邻近,属于“事件驱动”(event driven)的作用模式。PROTAC只需提供与靶蛋白的结合活性,无须直接占据靶蛋白的活性口袋便可实现高亲和力、高浓度和长时间的结合,在靶向缺乏活性位点的“难成药”靶点方面有较大优势,且蛋白降解后PROTAC可从复合物中解离,通过反复迭代的作用模式持续降解靶蛋白[31]。(2)提高选择性,降低毒性和不良反应用。PROTAC本质上是一类“距离诱导剂”,其引起靶蛋白降解的关键是稳定的三元复合物的形成。通过针对两端配体及连接子(linker)的合理设计与优化,理论上可以提升小分子抑制剂的选择性,并降低相关毒性和不良反应。(3)克服耐药问题。小分子抑制剂是临床广泛应用的靶向治疗策略,然而长时间、大剂量的给药将引起靶蛋白表达上调、突变或旁路信号代偿扩增,进而导致耐药问题。利用PROTAC的独有机制和催化特性,可在低剂量和低频率的给药方式下实现致病靶蛋白的快速降解和清除,避免了长期高频和高剂量给药导致的获得性耐药。
尽管经典PROTAC策略开辟了靶向药物的新赛道,但是不能解决所有的药靶问题,并面临着一些挑战:(1)分子量过大、水溶性差、透膜性差导致的成药性问题;(2)全身给药后易发生非肿瘤部位非特异性蓄积,存在脱靶效应等风险;(3)受限于E3泛素连接酶工具的研发水平;(4)仍需要基于经验主义反复尝试,依赖大量的构效关系探索;(5)受限于UPS的细胞内定位及蛋白酶体狭窄的内径,PROTAC技术可降解的靶蛋白局限在具有胞质结构域、短寿命或错误折叠的单体蛋白,而胞外蛋白、大部分膜蛋白及错误折叠蛋白形成的蛋白质聚集体则不能通过PROTAC技术降解。因此,近几年TPD领域涌现出了多种新型蛋白降解技术,主要表现在以下几个方面。
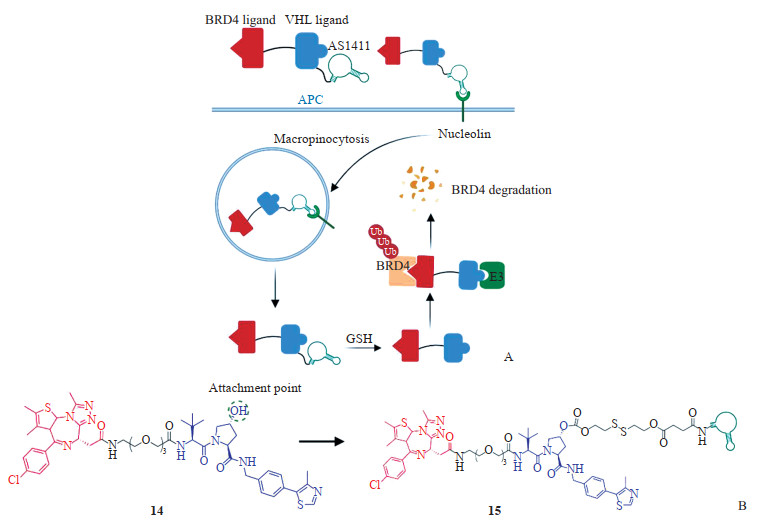
2.1 融合其他药物设计策略将PROTAC技术与其他药物设计策略巧妙结合,赋予传统PROTAC更多的功能,通过不同的响应方式调控PROTAC分子的靶向性、时空选择性和降解效率,降低对正常细胞的毒性,减少脱靶效应带来的安全性风险。例如:(1)光控型PROTAC通过引入光脱笼保护基团或采用偶氮苯“光开关”技术,实现了对泛素化反应的精准调控[32-33];(2)智能响应型PROTAC利用疾病微环境与正常细胞的差异,内源性调节PROTAC的靶向性和活性[21, 34-35]。笔者团队针对肿瘤细胞膜上特异性高表达的靶受体(核仁素,nucleolin),开发了基于核酸适配体-PROTAC偶联物(aptamer-PROTAC conjugate,APC)[21]。其设计原理是通过1个谷胱甘肽(glutathione,GSH)敏感的二硫键连接子将靶向含溴结构域蛋白4(bromodomain-containing protein 4,BRD4)的PROTAC分子(化合物14,图 4)与靶向核仁素的适配体AS1411进行偶联(化合物15,图 4)。化合物15能特异性识别MCF-7乳腺癌细胞膜上高表达的核仁素并高效地富集在细胞膜上,然后通过内吞方式进入肿瘤细胞,肿瘤细胞过表达的GSH切断连接原型PROTAC分子和核仁素适配体的二硫键,使原型PROTAC释放从而发挥特异性降解BRD4的功能(图 4)。此策略也是核酸和小分子偶联药物的一个成功案例,利用核酸适配体良好的理化性质、特异性和安全性,显著提高了传统PROTAC的水溶性和肿瘤靶向性。
|
图 4 基于APC的设计策略 Fig 4 Design strategies of APC The figures were created with BioRender.com. A: Schematic diagram of design strategy of the APC; B: Chemical structures and design rationale of the APC. APC: Aptamer-PROTAC conjugate; BRD4: Bromodomain-containing protein 4; VHL: Von HippelLindau tumor suppressor; Ub: Ubiquitin; E3: E3 ubiquitin ligase; GSH: Glutathione; PROTAC: Proteolysis targeting chimaera. |
2.2 发展除UPS以外的TPD途径
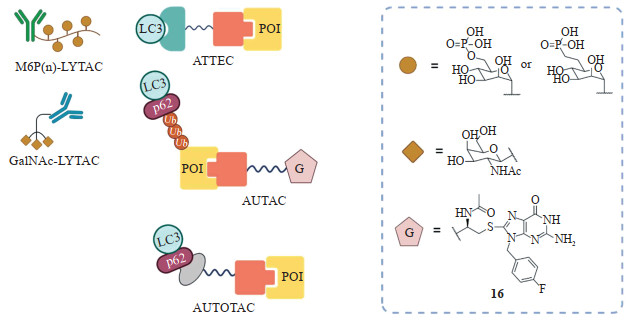
近年来兴起的是基于溶酶体途径的靶向降解技术,具有代表性的包括:(1)LYTAC技术。其设计策略是将靶蛋白结合配体与糖肽配体偶联得到一类双功能分子(图 5)[5-9]。其中,靶蛋白配体是与胞外蛋白或膜蛋白胞外域具有亲和力的抗体、多肽或小分子,而糖肽配体可结合细胞表面的溶酶体靶向受体(lysosome-targeting receptor,LTR)。目前已经应用到LYTAC设计的LTR包括阳离子- 非依赖型甘露糖-6- 磷酸受体和肝脏特异型去唾液酸糖蛋白受体。LYTAC结合靶蛋白和LTR形成三元复合物后通过内吞作用进入细胞内,将靶蛋白转运到溶酶体中降解。LYTAC技术为靶向降解胞外蛋白和膜蛋白提供了全新的技术手段,与PROTAC技术互为补充。缺点是合成难度较高,抗体寡糖的免疫原性和药代动力学性质有待考察。(2)ATTEC技术。本文第1节已经详细介绍。(3)AUTAC技术。在多种引发自噬信号的通路中,由内源核苷酸8- 硝基环鸟苷单磷酸核苷酸(8-nitro-cGMP)介导的蛋白S- 鸟苷化修饰(S-guanylation)已被证明是招募自噬体的重要信号,可以介导底物蛋白的K63泛素化和选择性自噬清除。Arimoto教授团队基于这一特性开发了AUTAC技术[14]。AUTAC也是一类异双功能分子,包含靶蛋白配体、降解标签(即cGMP类似物;化合物16,图 5)和化学连接子3个部分。在细胞内,AUTAC首先与靶蛋白结合,通过降解标签模拟S- 鸟苷化修饰,诱导靶蛋白被K63多聚泛素链标记,泛素化的靶蛋白随后被自噬受体p62选择性识别并结合,p62进一步与LC3相互作用,介导靶蛋白被募集到自噬体中,最后与溶酶体融合完成降解。AUTAC的特点在于其适用于线粒体等细胞器碎片。(4)AUTOTAC技术。AUTOTAC的自噬靶向配体可以直接结合p62的ZZ结构域形成p62-AUTOTAC- 靶蛋白三元复合物(图 5),导致p62激活并暴露出N端的Phox和Bem1结构域及LC3结构域,这2个结构域可分别介导p62的自身寡聚合及与LC3的相互作用,进而介导靶蛋白的自噬降解。该技术的特色是不仅可降解细胞内的可溶性单体蛋白,还可以降解UPS- 抗性的异常折叠蛋白或其聚集体。
|
图 5 代表性的基于溶酶体途径的靶向蛋白降解策略 Fig 5 Representative lysosome-dependent protein degradation strategies The figure was created with BioRender.com. M6P: Mannose-6-phosphate; LYTAC: Lysosome-targeting chimaera; LC3: Microtubule associated protein 1 light chain 3; ATTEC: Autophagosome-tethering compound; POI: Protein of interest; GalNAc: N-acetylgalactosamine; Ub: Ubiquitin; AUTAC: Autophagy-targeting chimera; AUTOTAC: Autophagy-targeting chimera. |
2.3 进一步丰富靶向蛋白降解剂的分子形式
突破小分子药物设计的思维定势,采用不同药物分子形式(如核酸、抗体、多肽)或其组合,攻克更多“难成药”靶点。当前,PROTAC的靶蛋白结合配体通常通过高通量筛选或合理设计得到[36-38]。然而,有相当一部分蛋白靶标缺乏明确的配体结合位点,寻找小分子配体需耗费大量的时间与成本[39-40],在这些配体难以结合的靶点中,有一部分能够与特定的核酸序列相互作用,基于核酸的TPD技术应运而生。目前,已经有多种基于核酸的TPD技术被成功开发,这些技术根据靶蛋白与特定核酸序列的相互作用,合理设计核酸类似物作为配体,用于降解缺乏传统小分子配体结合口袋的靶蛋白,如RNA结合蛋白、转录因子和G- 四链体结合蛋白等[38-39, 41-45]。笔者团队的综述对基于核酸的靶向降解药物发现策略和案例研究进行了详细的分析[46]。此外,多个针对胞外和细胞膜蛋白的降解技术(如LYTAC[5-9]、双特异性核酸适配体嵌合体[47]、基于抗体的PROTAC[48]、GlueTAC[10]和APC[21])都是应用了抗体、多肽、核酸和小分子等多种药物形式或其组合,极大拓展了可降解靶蛋白的范围。
3 挑战和机遇尽管TPD技术获得了蓬勃发展,但在分子设计、成药性优化、生物活性评价和机制研究等方面仍面临着巨大挑战:(1)除了PROTAC和分子胶降解剂以外,其他类型的蛋白降解技术尚未有进入临床研究阶段的药物,很多技术尚处于刚完成概念验证的初步探索阶段,它们是否具有广谱适用性还需要经过更多的案例验证和更深入的机制研究。(2)异双功能降解剂由于分子量较大,普遍面临成药性的问题,在研究的初始阶段常常难以兼顾活性、理化性质、选择性和药代动力学性质等因素,并依赖大量的构效关系探索来获得有进一步研究价值的候选分子。(3)这些技术通常需要通过招募效应子(如泛素连接酶和LC3蛋白),并诱导底物接近来发挥功能,而开发高亲和力的效应子招募配体是当前异双功能靶向药物发现中的瓶颈。例如,PROTAC技术的发展一直受限于E3泛素连接酶配体探索不足的问题,ATTEC自噬降解剂的设计也仅有少数几个LC3招募配体可供选择。
因此,本领域未来研究的方向主要包括以下2个方面。(1)着眼于解决临床实际需求,建立完整的PROTAC和分子胶研发技术平台。①在研发初期,合理选择靶蛋白配体和E3泛素连接酶招募配体,综合考虑PROTAC的连接子类型、长度及连接位点,并对合成的可行性进行评估;②进一步完善药物体外药物代谢动力学和药效动力学的分析环节,指导化合物的合理优化,开发口服高效的TPD药物。(2)通过技术创新丰富TPD技术的应用场景,拓展可降解的致病靶蛋白范围,为基础研究提供新的工具。①进一步开发E3泛素连接酶和LTR工具箱、构建化学结构多样化的LC3配体库,并阐明相关作用机制;②结合抗体、多肽或核酸偶联技术,以及纳米载药等递送策略提高药物靶向性和安全性,突破更多“难成药”靶点。随着对TPD技术的深入研究和不断优化,相信未来会有更多的TPD药物进入临床,给广大患者带来福音。
| [1] |
TENG M, GRAY N S. The rise of degrader drugs[J]. Cell Chem Biol, 2023, 30(8): 864-878. DOI:10.1016/j.chembiol.2023.06.020 |
| [2] |
DONG G, DING Y, HE S, et al. Molecular glues for targeted protein degradation: from serendipity to rational discovery[J]. J Med Chem, 2021, 64(15): 10606-10620. DOI:10.1021/acs.jmedchem.1c00895 |
| [3] |
NEKLESA T K, TAE H S, SCHNEEKLOTH A R, et al. Small-molecule hydrophobic tagging-induced degradation of HaloTag fusion proteins[J]. Nat Chem Biol, 2011, 7(8): 538-543. DOI:10.1038/nchembio.597 |
| [4] |
MA A, STRATIKOPOULOS E, PARK K S, et al. Discovery of a first-in-class EZH2 selective degrader[J]. Nat Chem Biol, 2020, 16(2): 214-222. DOI:10.1038/s41589-019-0421-4 |
| [5] |
BANIK S M, PEDRAM K, WISNOVSKY S, et al. Lysosome-targeting chimaeras for degradation of extracellular proteins[J]. Nature, 2020, 584(7820): 291-297. DOI:10.1038/s41586-020-2545-9 |
| [6] |
CAIANIELLO D F, ZHANG M, RAY J D, et al. Bifunctional small molecules that mediate the degradation of extracellular proteins[J]. Nat Chem Biol, 2021, 17(9): 947-953. DOI:10.1038/s41589-021-00851-1 |
| [7] |
ZHANG X, LIU H, HE J, et al. Site-specific chemoenzymatic conjugation of high-affinity M6P glycan ligands to antibodies for targeted protein degradation[J]. ACS Chem Biol, 2022, 17(11): 3013-3023. DOI:10.1021/acschembio.1c00751 |
| [8] |
ZHOU Y, TENG P, MONTGOMERY N T, et al. Development of triantennary N-acetylgalactosamine conjugates as degraders for extracellular proteins[J]. ACS Cent Sci, 2021, 7(3): 499-506. DOI:10.1021/acscentsci.1c00146 |
| [9] |
AHN G, BANIK S M, MILLER C L, et al. LYTACs that engage the asialoglycoprotein receptor for targeted protein degradation[J]. Nat Chem Biol, 2021, 17(9): 937-946. DOI:10.1038/s41589-021-00770-1 |
| [10] |
ZHANG H, HAN Y, YANG Y, et al. Covalently engineered nanobody chimeras for targeted membrane protein degradation[J]. J Am Chem Soc, 2021, 143(40): 16377-16382. DOI:10.1021/jacs.1c08521 |
| [11] |
FU Y, CHEN N, WANG Z, et al. Degradation of lipid droplets by chimeric autophagy-tethering compounds[J]. Cell Res, 2021, 31(9): 965-979. DOI:10.1038/s41422-021-00532-7 |
| [12] |
LI Z, WANG C, WANG Z, et al. Allele-selective lowering of mutant HTT protein by HTT-LC3 linker compounds[J]. Nature, 2019, 575(7781): 203-209. DOI:10.1038/s41586-019-1722-1 |
| [13] |
DONG G, WU Y, CHENG J, et al. Ispinesib as an effective warhead for the design of autophagosome-tethering chimeras: discovery of potent degraders of nicotinamide phosphoribosyltransferase (NAMPT)[J]. J Med Chem, 2022, 65(11): 7619-7628. DOI:10.1021/acs.jmedchem.1c02001 |
| [14] |
TAKAHASHI D, MORIYAMA J, NAKAMURA T, et al. AUTACs: cargo-specific degraders using selective autophagy[J]. Mol Cell, 2019, 76(5): 797-810.e10. DOI:10.1016/j.molcel.2019.09.009 |
| [15] |
JI C H, KIM H Y, LEE M J, et al. The AUTOTAC chemical biology platform for targeted protein degradation via the autophagy-lysosome system[J]. Nat Commun, 2022, 13(1): 904. DOI:10.1038/s41467-022-28520-4 |
| [16] |
CHENG J, LI Y, WANG X, et al. Discovery of novel PDEδ degraders for the treatment of KRAS mutant colorectal cancer[J]. J Med Chem, 2020, 63(14): 7892-7905. DOI:10.1021/acs.jmedchem.0c00929 |
| [17] |
WU Y, PU C, FU Y, et al. NAMPT-targeting PROTAC promotes antitumor immunity via suppressing myeloid-derived suppressor cell expansion[J]. Acta Pharm Sin B, 2022, 12(6): 2859-2868. DOI:10.1016/j.apsb.2021.12.017 |
| [18] |
BI K, CHENG J, HE S, et al. Discovery of highly potent nicotinamide phosphoribosyltransferase degraders for efficient treatment of ovarian cancer[J]. J Med Chem, 2023, 66(1): 1048-1062. DOI:10.1021/acs.jmedchem.2c01990 |
| [19] |
CHENG J, HE S, XU J, et al. Making protein degradation visible: discovery of theranostic PROTACs for detecting and degrading NAMPT[J]. J Med Chem, 2022, 65(23): 15725-15737. DOI:10.1021/acs.jmedchem.2c01243 |
| [20] |
HE S, MA J, FANG Y, et al. Homo-PROTAC mediated suicide of MDM2 to treat non-small cell lung cancer[J]. Acta Pharm Sin B, 2021, 11(6): 1617-1628. DOI:10.1016/j.apsb.2020.11.022 |
| [21] |
HE S, GAO F, MA J, et al. Aptamer-PROTAC conjugates (APCs) for tumor-specific targeting in breast cancer[J]. Angew Chem Int Ed Engl, 2021, 60(43): 23299-23305. DOI:10.1002/anie.202107347 |
| [22] |
KRÖNKE J, FINK E C, HOLLENBACH P W, et al. Lenalidomide induces ubiquitination and degradation of CK1α in del (5q) MDS[J]. Nature, 2015, 523(7559): 183-188. DOI:10.1038/nature14610 |
| [23] |
LU G, MIDDLETON R E, SUN H, et al. The myeloma drug lenalidomide promotes the cereblon-dependent destruction of Ikaros proteins[J]. Science, 2014, 343(6168): 305-309. DOI:10.1126/science.1244917 |
| [24] |
KRÖNKE J, UDESHI N D, NARLA A, et al. Lenalidomide causes selective degradation of IKZF1 and IKZF3 in multiple myeloma cells[J]. Science, 2014, 343(6168): 301-305. DOI:10.1126/science.1244851 |
| [25] |
GANDHI A K, KANG J, HAVENS C G, et al. Immunomodulatory agents lenalidomide and pomalidomide co-stimulate T cells by inducing degradation of T cell repressors Ikaros and Aiolos via modulation of the E3 ubiquitin ligase complex CRL4(CRBN.)[J]. Br J Haematol, 2014, 164(6): 811-821. DOI:10.1111/bjh.12708 |
| [26] |
PEI J, PAN X, WANG A, et al. Developing potent LC3-targeting AUTAC tools for protein degradation with selective autophagy[J]. Chem Commun, 2021, 57(97): 13194-13197. DOI:10.1039/d1cc04661f |
| [27] |
SAKAMOTO K M, KIM K B, KUMAGAI A, et al. Protacs: chimeric molecules that target proteins to the Skp1-Cullin-F box complex for ubiquitination and degradation[J]. Proc Natl Acad Sci USA, 2001, 98(15): 8554-8559. DOI:10.1073/pnas.141230798 |
| [28] |
SUN X, GAO H, YANG Y, et al. PROTACs: great opportunities for academia and industry[J]. Signal Transduct Target Ther, 2019, 4: 64. DOI:10.1038/s41392-019-0101-6 |
| [29] |
PETRYLAK D P, GAO X, VOGELZANG N J, et al. First-in-human phase Ⅰ study of ARV-110, an androgen receptor (AR) PROTAC degrader in patients (pts) with metastatic castrate-resistant prostate cancer (mCRPC) following enzalutamide (ENZ) and/or abiraterone (ABI)[J]. J Clin Oncol, 2020, 38(15 Suppl): 3500. DOI:10.1200/jco.2020.38.15_suppl.3500 |
| [30] |
FLANAGAN J J, QIAN Y, GOUGH S M, et al. Abstract P5-04-18:ARV-471, an oral estrogen receptor PROTAC degrader for breast cancer[J]. Cancer Res, 2019, 79(4 Suppl): p5-04-18. DOI:10.1158/1538-7445.sabcs18-p5-04-18 |
| [31] |
PAIVA S L, CREWS C M. Targeted protein degradation: elements of PROTAC design[J]. Curr Opin Chem Biol, 2019, 50: 111-119. DOI:10.1016/j.cbpa.2019.02.022 |
| [32] |
LIU J, CHEN H, MA L, et al. Light-induced control of protein destruction by opto-PROTAC[J]. Sci Adv, 2020, 6(8): eaay5154. DOI:10.1126/sciadv.aay5154 |
| [33] |
REYNDERS M, TRAUNER D. PHOTACs enable optical control of protein degradation[J]. Methods Mol Biol, 2021, 2365: 315-329. DOI:10.1007/978-1-0716-1665-9_17 |
| [34] |
CHENG W, LI S, WEN X, et al. Development of hypoxia-activated PROTAC exerting a more potent effect in tumor hypoxia than in normoxia[J]. Chem Commun, 2021, 57(95): 12852-12855. DOI:10.1039/d1cc05715d |
| [35] |
SHI S, DU Y, ZOU Y, et al. Rational design for nitroreductase (NTR)-responsive proteolysis targeting chimeras (PROTACs) selectively targeting tumor tissues[J]. J Med Chem, 2022, 65(6): 5057-5071. DOI:10.1021/acs.jmedchem.1c02221 |
| [36] |
SCHEEPSTRA M, HEKKING K F W, VAN HIJFTE L, et al. Bivalent ligands for protein degradation in drug discovery[J]. Comput Struct Biotechnol J, 2019, 17: 160-176. DOI:10.1016/j.csbj.2019.01.006 |
| [37] |
BURSLEM G M, CREWS C M. Proteolysis-targeting chimeras as therapeutics and tools for biological discovery[J]. Cell, 2020, 181(1): 102-114. DOI:10.1016/j.cell.2019.11.031 |
| [38] |
GHIDINI A, CLÉRY A, HALLOY F, et al. RNA-PROTACs: degraders of RNA-binding proteins[J]. Angew Chem Int Ed Engl, 2021, 60(6): 3163-3169. DOI:10.1002/anie.202012330 |
| [39] |
SAMARASINGHE K T G, JAIME-FIGUEROA S, BURGESS M, et al. Targeted degradation of transcription factors by TRAFTACs: transcription factor targeting chimeras[J]. Cell Chem Biol, 2021, 28(5): 648-661.e5. DOI:10.1016/j.chembiol.2021.03.011 |
| [40] |
LAZO J S, SHARLOW E R. Drugging undruggable molecular cancer targets[J]. Annu Rev Pharmacol Toxicol, 2016, 56: 23-40. DOI:10.1146/annurev-pharmtox-010715-103440 |
| [41] |
LIU J, CHEN H, ÜMIT KANISKAN H, et al. TF-PROTACs enable targeted degradation of transcription factors[J]. J Am Chem Soc, 2021, 143(23): 8902-8910. DOI:10.1021/jacs.1c03852 |
| [42] |
PATIL K M, CHIN D, SEAH H L, et al. G4-PROTAC: targeted degradation of a G-quadruplex binding protein[J]. Chem Commun (Camb), 2021, 57(95): 12816-12819. DOI:10.1039/d1cc05025g |
| [43] |
SHAO J, YAN Y, DING D, et al. Destruction of DNA-binding proteins by programmable oligonucleotide PROTAC (O'PROTAC): effective targeting of LEF1 and ERG[J]. Adv Sci (Weinh), 2021, 8(20): e2102555. DOI:10.1002/advs.202102555 |
| [44] |
YAN Y, SHAO J, DING D, et al. 3-Aminophthalic acid, a new cereblon ligand for targeted protein degradation by O'PROTAC[J]. Chem Commun, 2022, 58(14): 2383-2386. DOI:10.1039/d1cc06525d |
| [45] |
SAMARASINGHE K T G, AN E, GENUTH M A, et al. OligoTRAFTACs: a generalizable method for transcription factor degradation[J]. RSC Chem Biol, 2022, 3(9): 1144-1153. DOI:10.1039/d2cb00138a |
| [46] |
WANG W, HE S, DONG G, et al. Nucleic-acid-based targeted degradation in drug discovery[J]. J Med Chem, 2022, 65(15): 10217-10232. DOI:10.1021/acs.jmedchem.2c00875 |
| [47] |
MIAO Y, GAO Q, MAO M, et al. Bispecific aptamer chimeras enable targeted protein degradation on cell membranes[J]. Angew Chem Int Ed Engl, 2021, 60(20): 11267-11271. DOI:10.1002/anie.202102170 |
| [48] |
COTTON A D, NGUYEN D P, GRAMESPACHER J A, et al. Development of antibody-based PROTACs for the degradation of the cell-surface immune checkpoint protein PD-L1[J]. J Am Chem Soc, 2021, 143(2): 593-598. DOI:10.1021/jacs.0c10008 |
 2024, Vol. 45
2024, Vol. 45


