急性术后疼痛是患者受到手术刺激后出现的一系列生理、心理及行为反应,接受外科手术的患者中约有30%会出现中重度急性术后疼痛[1]。剧烈的术后疼痛会增加患者的心理和身体负担,严重影响患者术后康复和生活质量,并可能进一步发展为慢性疼痛[2]。目前临床上主要按照体重给予镇痛药物,但是不同患者在经历同样手术并使用相同剂量的镇痛药物后,术后疼痛的程度却有明显的差别[3],表明疼痛存在显著的个体差异。因此,科学预测急性术后疼痛的发生及精确制定个体化镇痛方案显得十分重要。疼痛敏感性是指不同个体对疼痛的敏感程度,本研究通过疼痛敏感性问卷(pain sensitivity questionnaire,PSQ)评估患者术前疼痛敏感性,探讨其与腹腔镜胃肠肿瘤手术患者急性术后疼痛的相关性,为急性术后疼痛的预测和管理提供依据。
1 资料和方法 1.1 临床资料选取2022年9月至2023年3月择期在全身麻醉下行腹腔镜胃肠肿瘤根治术的患者62例。纳入标准:美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级Ⅰ~Ⅱ级,年龄≥18岁,性别不限。排除标准:(1)合并严重心血管疾病或严重肝肾功能不全;(2)有慢性疼痛病史;(3)有长期使用镇痛药物史或长期酒精摄入史;(4)有阿片类药物过敏史;(5)有中枢神经系统和/或精神病史;(6)有长期高血压、糖尿病等影响痛觉感受病史;(7)理解能力差,不能配合研究或不愿意参加本研究。剔除标准:(1)中途退出试验;(2)临时更改手术或麻醉方法;(3)术后进入ICU;(4)非计划二次手术。62例患者中,术后入ICU 2例,临时更改手术方式7例,数据随访失败3例,最终入组50例。本研究经我院伦理委员会审批(KY-2022-139-02),患者均签署知情同意书。
1.2 麻醉方法所有患者术前常规禁饮、禁食,不使用术前用药。入室后开放静脉通路,监测血压、心率、血氧饱和度(oxygen saturation,SpO2)、心电图等。麻醉诱导方案为咪达唑仑0.03 mg/kg、依托咪酯0.2 mg/kg、舒芬太尼0.5 μg/kg、罗库溴铵0.6 mg/kg,气管插管后行机械通气,潮气量6~8 mL/kg、通气频率12 min-1、吸呼比1∶2、维持呼气末二氧化碳分压(partial pressure of end-tidal carbon dioxide,PetCO2)35~45 mmHg(1 mmHg=0.133 kPa)。麻醉维持采用丙泊酚、顺式阿曲库铵、七氟烷静吸复合麻醉。术中于切皮、开腹、关腹共追加舒芬太尼0.3 μg/kg,缝皮时停用丙泊酚、七氟烷及顺式阿曲库铵。手术结束即刻接静脉自控镇痛泵(舒芬太尼2.0 μg/kg),术毕转入麻醉后监测治疗室。待患者意识、自主呼吸及咳嗽吞咽反射恢复,呼吸循环稳定,呼之能应,呼吸空气5 min情况下SpO2≥95%时,拔出气管导管。患者完全清醒、生命体征平稳后返回病房。
1.3 观察指标及评估方法(1)一般临床资料收集及疼痛敏感性评估:记录患者年龄、性别、ASA分级、BMI、术前PSQ评分[4]、手术时间、全身麻醉苏醒时间、气管导管拔管时间。根据既往研究结果,术前PSQ评分≥5.0分判断为高敏感性,<5.0分为低敏感性[5]。(2)疼痛程度评估:采用视觉模拟量表(visual analogue scale,VAS)评估疼痛程度,记录外周静脉置管及术后清醒即刻、1 h、2 h、3 h、4 h、5 h、6 h、8 h、10 h、12 h、24 h的VAS评分,VAS评分>3分者判定有急性术后疼痛的发生。(3)术后并发症及补救镇痛:记录患者术后24 h内恶心、呕吐、嗜睡、腹胀等的发生情况。当VAS评分>3分时,单次静脉注射舒芬太尼5 μg进行补救镇痛,并记录补救镇痛次数。同时记录镇疼泵按压次数。
1.4 统计学处理采用PASS 15.0软件计算样本量,根据预试验结果,术后2 h时低敏感性组VAS评分为(1.84±1.12)分、高敏感性组为(3.45±1.23)分,设定双侧检验,检验水准(α)为0.05,检验效能(1-β)为0.9,计算出每组需13例,依据20%的失访率及拒访率,每组至少需要纳入17例患者。采用SPSS 27.0软件进行统计学分析,呈正态分布的计量资料以x±s表示,组间比较采用独立样本t检验;呈偏态分布的计量资料以中位数(下四分位数,上四分位数)表示,组间比较采用非参数检验;计数资料采用例数和百分数表示,组间比较采用χ2检验。采用Pearson相关分析评估术前PSQ评分与术后各时间点VAS评分的相关性。以术前PSQ评分为检验变量、是否发生急性术后疼痛为状态变量绘制ROC曲线,评估术前PSQ评分对急性术后疼痛的预测价值。检验水准(α)为0.05。
2 结果 2.1 一般资料根据术前PSQ评分结果,高敏感性组(PSQ评分≥5.0分)19例,低敏感性组(PSQ评分<5.0分)31例。高敏感性组和低敏感性组患者年龄、性别、ASA分级、BMI、手术时间、全身麻醉苏醒时间及气管导管拔管时间差异均无统计学意义(均P>0.05,表 1)。
|
|
表 1 两组患者的一般资料比较 |
2.2 两组患者外周静脉置管及术后VAS评分的比较
与低敏感性组比较,高敏感性组外周静脉置管及术后清醒即刻、1 h、2 h的VAS评分均较高,差异有统计学意义(均P<0.05,表 2)。
|
|
表 2 两组患者外周静脉置管及术后各时间点VAS评分比较 |
2.3 术前PSQ评分与外周静脉置管及术后VAS评分的相关性
Pearson相关分析结果显示,术前PSQ评分与外周静脉置管VAS评分呈正相关(r=0.693,P<0.05),与术后清醒即刻、1 h、2 h的VAS评分亦呈正相关(r=0.917、0.901、0.841,均P<0.05),见图 1。术前PSQ评分与术后3、4、5、6、8、10、12、24 h的VAS评分无明显相关性(r=0.107、-0.163、-0.058、0.067、0.142、0.017、0.133、-0.193,均P>0.05)。
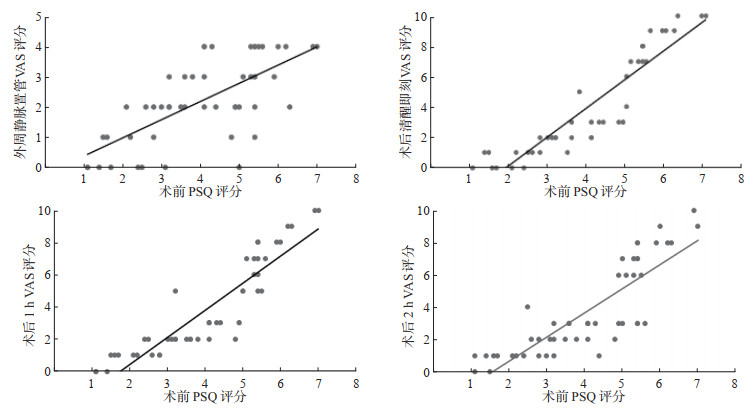
|
图 1 术前PSQ评分与外周静脉置管及术后VAS评分的Pearson相关分析 PSQ:疼痛敏感性问卷;VAS:视觉模拟量表. |
2.4 两组患者术后24 h内补救镇痛和镇痛泵按压次数的比较
低敏感性组和高敏感性组患者术后24 h内补救镇痛次数分别为0(0,0)次和3(3,3)次,差异有统计学意义(Z=-6.521,P<0.001);术后24 h镇痛泵按压次数分别为(10.81±2.55)次和(11.79±3.36)次,差异无统计学意义(t=-1.172,P=0.247)。
2.5 术前PSQ评分预测腹腔镜胃肠肿瘤手术患者急性术后疼痛的价值50例患者中,共发生急性术后疼痛24例(48.0%)。以术前PSQ评分为检验变量、是否发生急性术后疼痛为状态变量绘制ROC曲线,其AUC为0.909,通过约登指数计算出术前PSQ评分最佳临界值为4.85分,提示采用术前PSQ评分可预测腹腔镜胃肠肿瘤手术患者急性术后疼痛的发生。见图 2。
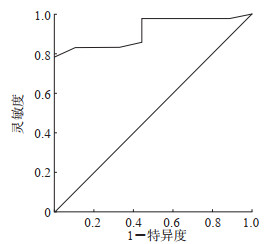
|
图 2 术前PSQ评分预测腹腔镜胃肠肿瘤手术患者急性术后疼痛的接受者操作特征曲线 因部分患者术前PSQ评分相同,故接受者操作特征曲线中存在倾斜线段. PSQ:疼痛敏感性问卷. |
2.6 两组患者术后24 h内并发症的比较
术后24 h内,低敏感性组发生恶心4例(12.9%)、呕吐3例(9.7%)、嗜睡1例(3.2%)、腹胀2例(6.5%),高敏感性组发生恶心3例(15.8%)、呕吐1例(5.3%)、嗜睡1例(5.3%)、腹胀6例(31.6%),两组术后24 h内并发症发生率差异无统计学意义(P>0.05)。
3 讨论腹腔镜下胃肠肿瘤根治术具有微创、应激反应小、恢复快的优势,但由于手术范围广及气腹残余气体刺激等原因,常导致急性术后疼痛的发生。目前临床上围手术期镇痛多使用阿片类药物,其相关的不良反应已引起临床医师的广泛关注。由于患者对疼痛的敏感性具有明显的个体差异,传统的镇痛方案常导致镇痛不足或过度,因此个体化疼痛诊疗很有必要。目前疼痛敏感性的评估主要采用定量感觉测试(quantitative sensory testing,QST)和PSQ。因QST受到设备、成本和患者合作的限制,临床上普遍认为PSQ用于评估疼痛敏感性更简单、实用。PSQ是一种基于想象日常生活中疼痛情境的疼痛感知自我评估方法,该问卷最初是由Ruscheweyh等[4]于2009年开发。PSQ由17个项目组成,其中3项描述日常生活中不产生疼痛场景的项目作为无痛参考,其余14项描述日常生活会产生疼痛的情况。受试者在数字评分表上对预期疼痛进行评分,范围从0分(完全不痛)到10分(可以想象的最严重的疼痛),评分越高表明受试者的疼痛敏感性越高,以14项疼痛评分的平均值作为最终得分。研究证实PSQ评分与健康人和慢性疼痛患者的各种实验性疼痛敏感性评估结果基本一致[6]。
在一项行腹腔镜胆囊切除手术患者的研究中,Persson等[7]发现外周静脉置管VAS评分与术后90 min内静息时最大疼痛强度呈正相关,且外周静脉置管VAS评分≥2分者发生中重度急性术后疼痛的风险相较于<2分者高出3.4倍。随后该研究小组又在多项手术类型中进行了验证,结果表明外周静脉置管VAS评分预测急性术后疼痛的发生是可靠的,外周静脉置管VAS评分≥2分者发生中重度急性术后疼痛的风险比评分<2分者高出1.5倍[8]。王艳萍等[9]在一项针对腹腔镜下肾切除术患者的研究中也验证了这一点。Carvalho等[10]在一项分娩镇痛的研究中发现,外周静脉置管VAS评分与从分娩镇痛到患者要求实施硬膜外镇痛的时间呈负相关(r=-0.33,P<0.05),表明外周静脉置管VAS评分越高则患者的痛阈越低,发生急性术后疼痛的风险也越高。本研究结果显示,术前PSQ评分与外周静脉置管VAS评分呈正相关,故采用PSQ问卷测得的疼痛敏感性是可靠的。
已有文献报道,个体疼痛敏感性与行甲状腺、心脏、肺、膝关节手术患者的术后疼痛呈正相关[5, 11-14],但其与胃肠肿瘤手术患者急性术后疼痛的相关性目前尚未明确。研究表明,在行关节镜下半月板部分切除术的患者中,PSQ评分≥5.0分者术后疼痛的发生率更高[5]。我们参考此研究并结合预试验结果,以术前PSQ评分5.0分为界限将胃肠肿瘤手术患者划分为疼痛高敏感性组与低敏感性组。与低敏感性组比较,高敏感性组术后清醒即刻、1 h、2 h的VAS评分较高,术前PSQ评分与术后清醒即刻、1 h、2 h的VAS评分呈正相关,提示疼痛敏感性与腹腔镜胃肠肿瘤手术患者急性术后疼痛程度呈正相关,术前PSQ评分≥5.0分者术后疼痛发生率更高,与既往研究结果[5]相符。但术前PSQ评分与术后2 h后的VAS评分无明显相关性。可能的原因是本研究中对于术后VAS评分>3分者进行了补救镇痛,高敏感性组的患者在术后2 h内VAS评分较高,补救镇痛用药剂量较多,因此两组患者VAS评分在2 h后差异无统计学意义,术前PSQ评分与术后2 h后VAS评分亦无明显相关性。
本研究以术前PSQ评分为检验变量、是否发生急性术后疼痛为状态变量绘制ROC曲线,其AUC为0.909,提示术前PSQ评分可有效预测腹腔镜胃肠肿瘤手术患者急性术后疼痛的发生。通过约登指数计算出术前PSQ评分≥4.85分者术后疼痛的发生率更高,即术前PSQ评分≥4.85分者提示有较高的急性术后疼痛发生风险,这有助于临床工作者识别疼痛高风险人群,实现个体化疼痛诊疗,提前进行镇痛干预,从而减少术后急性疼痛的发生。本研究得到的PSQ评分临界值为4.85分,与先前参考的PSQ评分临界值5.0分略有不同,这可能是因为腹腔镜下胃肠肿瘤根治术相较于关节镜下半月板部分切除术的疼痛刺激更大,更容易发生急性术后疼痛。
本研究存在一定局限性:(1)个体的疼痛敏感性还受到遗传、心理、环境等多方面因素的影响[15],但受设计类型所限,未能将其他因素纳入观察范围。(2)术后疼痛程度与手术类型有明显的相关性[16],本研究只纳入了腹腔镜胃肠肿瘤手术患者,未纳入开腹手术患者,因此本研究结果是否适用于开腹手术患者需要进一步研究。(3)本研究为小样本、单中心试验,有待多中心、大样本试验进一步验证。
综上所述,疼痛敏感性与腹腔镜胃肠肿瘤手术患者急性术后疼痛程度呈正相关,有可能成为急性术后疼痛发生风险的预测指标。在腹腔镜胃肠肿瘤手术患者中,PSQ≥4.85分者发生急性术后疼痛的风险更高,这一结果有助于临床个体化围手术期镇痛策略的实施。
| [1] |
SANGESLAND A, STØREN C, VAEGTER H B. Are preoperative experimental pain assessments correlated with clinical pain outcomes after surgery? A systematic review[J]. Scand J Pain, 2017, 15: 44-52. DOI:10.1016/j.sjpain.2016.12.002 |
| [2] |
黑子清, 靳三庆, 李雅兰, 等. 成人术后急性疼痛PCIA治疗规范化管理建议[J]. 临床麻醉学杂志, 2018, 34(2): 187-190. DOI:10.12089/jca.2018.02.023 |
| [3] |
罗梅, 唐霓, 王晓斌. 术前疼痛阈值对胸腔镜术后急性疼痛的影响[J]. 川北医学院学报, 2022, 37(3): 299-302. DOI:10.3969/j.issn.1005-3697.2022.03.006 |
| [4] |
RUSCHEWEYH R, MARZINIAK M, STUMPENHORST F, et al. Pain sensitivity can be assessed by self-rating: development and validation of the pain sensitivity questionnaire[J]. Pain, 2009, 146(1): 65-74. DOI:10.1016/j.pain.2009.06.020 |
| [5] |
YAARI L, DOLEV A, KITTANI M, et al. Preoperative pain sensitivity questionnaire helps customize pain management after arthroscopic partial meniscectomy[J]. Knee Surg Sports Traumatol Arthrosc, 2021, 29(12): 4198-4204. DOI:10.1007/s00167-021-06438-6 |
| [6] |
INAL F Y, GUL K, YILMAZ CAMGOZ Y, et al. Validation of the Turkish version of the pain sensitivity questionnaire in patients with chronic pain[J]. J Int Med Res, 2021, 49(12): 3000605211060158. DOI:10.1177/03000605211060158 |
| [7] |
PERSSON A K M, PETTERSSON F D, DYREHAG L E, et al. Prediction of postoperative pain from assessment of pain induced by venous cannulation and propofol infusion[J]. Acta Anaesthesiol Scand, 2016, 60(2): 166-176. DOI:10.1111/aas.12634 |
| [8] |
PERSSON A K M, ÅKESON J. Prediction of acute postoperative pain from assessment of pain associated with venous cannulation[J]. Pain Pract, 2019, 19(2): 158-167. DOI:10.1111/papr.12729 |
| [9] |
王艳萍, 彭菲, 李燕爽, 等. 外周静脉置管疼痛评分与腹腔镜肾切除术患者术后疼痛程度的相关性[J]. 临床麻醉学杂志, 2020, 36(11): 1078-1081. DOI:10.12089/jca.2020.11.008 |
| [10] |
CARVALHO B, ZHENG M, AIONO-LE TAGALOA L. Evaluation of experimental pain tests to predict labour pain and epidural analgesic consumption[J]. Br J Anaesth, 2013, 110(4): 600-606. DOI:10.1093/bja/aes423 |
| [11] |
郭旗, 张传林, 黄久勤. 疼痛敏感性调查问卷在全膝关节置换术中的应用[J]. 中国骨与关节损伤杂志, 2021, 36(2): 177-179. DOI:10.7531/j.issn.1672-9935.2021.02.022 |
| [12] |
DUCHOW J, SCHLÖRICKE E, HÜPPE M. Self-rated pain sensitivity and postoperative pain[J]. Schmerz, 2013, 27(4): 371-379. DOI:10.1007/s00482-013-1338-6 |
| [13] |
BJØRNNES A K, LIE I, PARRY M, et al. Association between self-perceived pain sensitivity and pain intensity after cardiac surgery[J]. J Pain Res, 2018, 11: 1425-1432. DOI:10.2147/jpr.s167524 |
| [14] |
VALEBERG B T, HØVIK L H, GJEILO K H. Relationship between self-reported pain sensitivity and pain after total knee arthroplasty: a prospective study of 71 patients 8 weeks after a standardized fast-track program[J]. J Pain Res, 2016, 9: 625-629. DOI:10.2147/JPR.S113258 |
| [15] |
谢琪林, 康芳. 疼痛敏感性的评估及相关影响因素研究进展[J]. 国际麻醉学与复苏杂志, 2021, 42(6): 659-663. DOI:10.3760/cma.j.cn321761-20200514-00315 |
| [16] |
GLARE P, AUBREY K R, MYLES P S. Transition from acute to chronic pain after surgery[J]. Lancet, 2019, 393(10180): 1537-1546. DOI:10.1016/S0140-6736(19)30352-6 |
 2024, Vol. 45
2024, Vol. 45


