2. 海军军医大学(第二军医大学)第二附属医院临床遗传科, 上海 200003
2. Department of Clinical Genetics, The Second Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200003, China
脓毒症是机体对感染的免疫反应失衡而引起的一种危及生命的多器官功能障碍,是导致ICU病死率、医疗费用增高的重要原因之一[1]。肺损伤是脓毒症患者的常见并发症,超过50%的脓毒症患者可发展为急性肺损伤(acute lung injury,ALI)或急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[2]。巨噬细胞是先天免疫中最重要的细胞类型,在机体免疫反应的调节中处于中心地位。根据功能的不同,巨噬细胞大致可分为促进炎症的M1型和介导免疫抑制的M2型2种类型[3],其极化主导了机体免疫状态。在脓毒症的早期阶段,巨噬细胞以M1型为主,释放大量炎症因子、诱发强烈的炎症反应,有利于病原体的清除,但同时过强的免疫反应也会导致组织器官损伤,因此免疫抑制也会同时启动,通过巨噬细胞向M2型极化来限制过度炎症反应带来的机体损伤;但在脓毒症后期,免疫抑制常常导致机会感染或二重感染[4]。
Janus激酶(Janus kinase,JAK)/信号转导及转录激活蛋白(signal transducer and activator of transcription,STAT)通路调控了免疫反应、细胞增殖等重要的生理过程,近年来研究发现其在巨噬细胞极化调节中也发挥着重要作用。不同的JAK与STAT亚型可导致不同的极化,例如JAK1和STAT6与M2极化相关[5-6],而JAK2和STAT3则与M1极化相关[7],调控这些分子亦可改变巨噬细胞的极化状态。临床上使用JAK/STAT靶向药物治疗脓毒症相关肺损伤已取得了初步成果,但由于脓毒症免疫状态与JAK/STAT通路之间联系复杂,其临床应用仍有待进一步探索。本文对JAK/STAT通路调控巨噬细胞极化在脓毒症相关肺损伤中发挥的作用进行综述,并总结目前基于JAK/STAT通路的治疗进展,以期为后续的基础、临床研究提供理论支持。
1 JAK/STAT与巨噬细胞极化 1.1 巨噬细胞极化巨噬细胞在所有人体组织中广泛存在,在先天性免疫中发挥着至关重要的作用,是抵御微生物入侵的第一道防线[8]。当感染发生时,巨噬细胞膜受体[如Toll样受体(Toll-like receptor,TLR)等]会识别入侵微生物产生的脂多糖(lipopolisaccharide,LPS)等模式识别分子(pattern recognition molecule,PRM),并吞噬和消化病原体、呈递抗原,进而激活免疫应答[9]。此外,巨噬细胞还可通过分泌细胞因子发挥免疫调节功能[10]。值得注意的是,除了免疫激活,巨噬细胞还能介导免疫抑制。在长时间的LPS或IL-4刺激后,巨噬细胞可表现出抑制炎症[10]、组织修复[11]和血管生成[12]等功能。这种功能上的差异性源于巨噬细胞不同的激活类型。
巨噬细胞的2种亚型通常在免疫反应中发挥不同的作用。M1极化通常由辅助性T细胞(helper T cell,Th)1和自然杀伤(nature killer,NK)细胞分泌的TNF-α、干扰素γ(interferon γ,IFN-γ)等诱导,该类型的巨噬细胞常释放大量促炎细胞因子(如TNF-α、IL-1β、IL-12)并触发炎症反应[13-14];相反,M2极化通常由Th2细胞和肥大细胞分泌的IL-4、IL-13等细胞因子诱导,这类巨噬细胞可释放IL-10和TGF-β等抗炎因子,促进组织修复和纤维化[15-16]。巨噬细胞的极化类型常随病程的发展而动态变化。在脓毒症的发展过程中,M1型巨噬细胞在早期阶段驱动过度的免疫激活,导致多个器官的免疫损伤;而在脓毒症后期,M2型巨噬细胞的主要存在会导致免疫抑制,增加继发感染的风险[4]。
1.2 JAK/STAT信号通路JAK/STAT是多种细胞因子和生长因子信号转导的主要途径,主要由4种JAK亚型[JAK1、JAK2、JAK3、酪氨酸激酶2(tyrosine kinase 2,TYK2)][17-18]和7种STAT亚型(STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b、STAT6)组成[19-21]。通常情况下,细胞因子等信号分子与细胞膜上的受体结合后诱导JAK发生磷酸化,进而磷酸化激活STAT并形成二聚体,STAT二聚体入核作为转录因子调节相关基因的表达。
1.3 脓毒症ALI中JAK/STAT通路对巨噬细胞极化的调节在脓毒症的病程进展过程中,机体的炎症反应从早期的免疫亢进到后期的免疫抑制发生着剧烈的变化。与此同时,巨噬细胞的极化状态也发生相应的改变,而JAK/STAT通路始终介导着这一过程的发生(图 1)。在脓毒症发生的早期阶段,免疫反应迅速达到高峰并表现为全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),此过程中常伴随着多种器官的炎症性损伤,由于肺对炎症反应最为敏感,常常会导致ALI和ARDS。当LPS与巨噬细胞表面的TLR4结合后,细胞内的JAK、TYK2被激活,进而磷酸化STAT1介导激活炎症反应,发生吞噬作用、诱导细胞凋亡,造成包括肺损伤在内的各种器官损伤[22-23],此过程可能受到巨噬细胞内代谢的影响。有动物实验证明,通过药物抑制或敲除STAT1、STAT4可降低炎症反应引发的肺损伤,提高脓毒症小鼠的存活率;同样,敲除其上游的JAK2、TYK2也具有相同的效果,并同时观察到炎症介质如TNF-α、IL-6、高迁移率族蛋白B1(high mobility group box-1 protein,HMGB1)等的表达减少[24]。
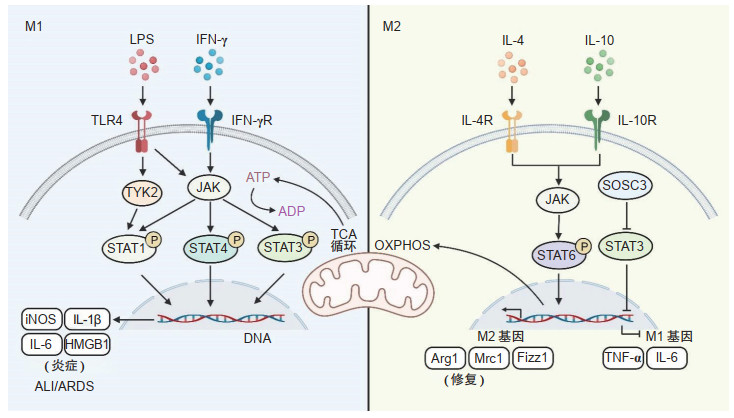
|
图 1 JAK/STAT信号通路对巨噬细胞极化的调节机制 JAK:Janus激酶;STAT:信号转导及转录激活蛋白;LPS:脂多糖;IFN-γ:干扰素γ;TLR4:Toll样受体4;IFN-γR:干扰素γ受体;TYK2:酪氨酸激酶2;ATP:腺苷三磷酸;ADP:腺苷二磷酸;TCA循环:三羧酸循环;iNOS:诱导型一氧化氮合酶;IL:白细胞介素;HMGB1:高迁移率族蛋白B1;ALI:急性肺损伤;ARDS:急性呼吸窘迫综合征;IL-4R:白细胞介素4受体;IL-10R:白细胞介素10受体;OXPHOS:氧化磷酸化;SOSC3:细胞因子信号转导抑制因子3;Arg1:精氨酸酶1;Mrc1:甘露糖受体C1;Fizz1:炎症区域分子1;TNF-α:肿瘤坏死因子α. |
STAT3也同样参与了脓毒症诱发的ALI。炎症因子通过巨噬细胞膜受体招募细胞内的JAK,继而磷酸化激活STAT3,磷酸化的STAT3通过SH2结构域相互结合形成二聚体,进入细胞核启动NF-κB、IL-1β、TNF-α、IL-6、C-C趋化因子配体2(C-C chemokine ligand 2,CCL-2)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)等表达。在脓毒症肺损伤动物模型中,STAT3与这些炎症因子的表达量及肺损伤程度呈正相关[25];而使用JAK抑制剂托法替尼(tofacitinib)或通过秋水仙碱抑制STAT3磷酸化从而抑制JAK-STAT3激活[26-27],或者使用miRNA-181a-5p、miRNA-23a-3p等抑制STAT1、STAT3表达[28]后,上述炎症因子水平与肺损伤程度均可明显缓解。
临床上也观察到STAT1、STAT3激活对脓毒症肺损伤的促进作用。Wang等[29]对26例合并ARDS的脓毒症患者外周血进行基因表达谱分析,发现STAT1在该类患者中表达显著升高,导致M1型巨噬细胞的组织浸润增加,并激活巨噬细胞中iNOS、IL-1β、IL-6、CCL-2表达,促进ARDS的发展;进一步在小鼠模型中通过敲低干扰素调节因子1(interferon regulatory factor 1,IRF1;STAT1的转录启动因子)降低STAT1的表达,可观察到M1型巨噬细胞的比例降低,炎症因子表达减少,肺组织损伤减轻。
同时,JAK/STAT通路也与巨噬细胞的代谢重编程密切相关。在小鼠及人来源的巨噬细胞中,IFN-γ刺激会显著激活JAK/STAT1与糖酵解途径,并引发M1型巨噬细胞标志基因iNOS的表达,表现出促炎效应。由于JAK是一种ATP依赖的激酶,糖酵解所提供的ATP成为JAK/STAT1激活下游基因表达的关键因素。当使用2-脱氧-D-葡萄糖抑制糖酵解后,JAK/STAT1的激活和iNOS的表达随之减少,提示糖酵解可能是JAK/STAT1激活巨噬细胞M1极化的先决条件[30]。在M2极化过程中,JAK1/STAT6对代谢重编程的作用则更加显著。研究显示,M2极化的能量供应主要依赖氧化磷酸化(oxidative phosphorylation,OXPHOS)。当JAK1或STAT6的磷酸化被抑制时,不仅M2标志基因[如精氨酸酶1(arginase 1,Arg1)、甘露糖受体C1(mannose receptor C-type 1,Mrc1)、炎症区域分子1(found in inflammatory zone 1,Fizz1)]的表达受到显著抑制,OXPHOS的活性也降低,表明JAK1/STAT6不仅影响M2效应基因的表达,更在巨噬细胞代谢体系的适配中扮演重要角色[5]。
JAK/STAT通路主要受到3类因子的负向调控:细胞因子信号抑制物(suppressor of cytokine signalling,SOCS)、激活STAT蛋白抑制因子(protein inhibitor of activated STAT,PIAS)和蛋白酪氨酸磷酸酶(protein tyrosine phosphatase,PTPase)。STAT信号通路激活可诱导SOCS基因转录,而SOCS可通过直接结合JAK抑制其酪氨酸激酶活性,或发挥E3泛素连接酶活性促进JAK蛋白降解,进而与JAK/STAT形成负反馈环路参与其活性的调节[31]。Qin等[32]的研究表明SOCS3缺失的巨噬细胞中STAT3表达增加并呈现M1极化。而过表达SOCS3不仅可抑制JAK1/STAT3,还可同时抑制NF-κB通路从而减少IL-6、TNF-α等促炎因子表达,促进M2极化,减轻炎症引起的ALI[33];也有研究表明,SOCS3低表达可以诱导巨噬细胞M2极化[34]。值得注意的是,某些情况下,JAK/STAT通路可逆向调节SOCS从而减轻炎症。一项研究发现,TNF-α可通过JAK/STAT通路依赖性方式上调SOCS1和SOCS3,从而干扰生长激素诱导的胰岛素样生长因子Ⅰ/Ⅱ的表达,有助于改善内毒素诱导的生长激素抵抗[35]。动物实验已经证实,通过构建SOCS3质粒并转染进入脓毒症小鼠体内,可提高小鼠的存活率[36]。以上实验证据均提示SOCS对M1型巨噬细胞的激活及脓毒症病情发展至关重要。
2 基于JAK/STAT通路脓毒症相关肺损伤治疗进展脓毒症相关肺损伤的治疗一直以来是危重症领域的难题。近年来,随着脓毒症相关肺损伤分子机制研究的不断进展,其治疗方式也逐渐更新,更多更有针对性的药物不断应用于临床。一些非JAK/STAT通路的药物可通过调控JAK/STAT通路中关键分子的磷酸化过程调节该通路的活性,进而影响炎症因子的释放和脓毒症相关肺损伤。甲氨蝶呤是一种叶酸拮抗剂,同时也能抑制JAK1/STAT3通路,被广泛用作调控免疫系统的抗炎药物。研究发现,在合并肺损伤的脓毒症大鼠模型中,甲氨蝶呤治疗可以减少TNF-α、IL-1β、IL-6等促炎因子及iNOS、环氧化酶2等酶的表达,从而抑制脓毒症免疫亢进阶段肺组织剧烈的炎症损伤[37]。这提示甲氨蝶呤可能成为治疗脓毒症肺损伤的潜在药物,但目前尚无进一步的临床试验验证。Xu等[38]通过体内和体外实验及网络药理学分析发现,在脓毒症背景下,一种生物活性化合物C498-0670可通过与JAK2相互作用来影响促炎因子的释放,减少脓毒症小鼠肺组织的炎症细胞浸润,故认为该化合物是脓毒症肺损伤的潜在治疗方式。此外,有研究证实,通过抑制Zeste同源物2的组蛋白甲基转移酶增强子(histone methyltransferase enhancer of Zeste homolog 2,EZH2),能够抑制STAT1/SOCS3通路并激活SOCS1/STAT6通路,从而调节肺泡巨噬细胞极化,使其偏向M2型,缓解脓毒症相关肺损伤[39]。
托法替尼是第1个获批的JAK抑制剂,用于治疗自身免疫病。随后针对JAK/STAT通路上其他靶点的靶向抑制剂,如巴瑞替尼(baricitinib)、芦可替尼(ruxolitinib)、吡西替尼(peficitinib)、乌帕替尼(upadacitinib)、迪高替尼(delgocitinib),也相继出现。Li等[40]研究报道,JAK1/JAK2抑制剂芦可替尼能够改善脓毒症小鼠的预后。Tsirigotis等[41]研究显示,若在小鼠感染念珠菌前1 d开始使用芦可替尼,会因抑制免疫反应降低小鼠生存率;而在感染后1 d开始使用芦可替尼则会提高生存率,并且具有剂量依赖性,6.25 mg/(kg·d)的剂量可在不增加病原体负荷的情况下抑制过高的炎症反应,从而达到最佳的生存获益。该研究表明,尽管芦可替尼能够提高患念珠菌脓毒症小鼠的生存率,但给药剂量和给药时间极大地影响了小鼠的免疫状态、对病原体的清除和生存。Sedivy-Haley等[42]研究显示,在使用芦可替尼对M1型巨噬细胞进行预处理后,其对沙门氏菌的杀灭作用明显减弱,使沙门氏菌更容易在细胞内存活,而同样的处理却并不能增加M2型巨噬细胞中沙门氏菌的存活率。这提示芦可替尼在脓毒症中主要通过抑制M1型巨噬细胞减轻炎症反应而发挥作用。此外,芦可替尼停药时,个别患者可能会发生停药综合征,其潜在机制可能是由于全身免疫细胞中JAK/STAT通路紊乱而造成的细胞因子风暴,可能对脓毒症患者造成严重打击[43]。因此,在脓毒症中使用JAK抑制剂减轻免疫损伤需要严格把握给药剂量和时机,过早或过量给药均可能减弱病原体清除能力,导致感染风险增加。有meta分析指出JAK抑制剂导致二重感染的发生率为0.23%[44]。以上风险提示在脓毒症相关肺损伤中使用JAK抑制剂的给药方式和时间还需要不断创新改进,并通过临床试验进行验证。组织特异性或细胞特异性的给药方式有望避免上述风险,增加JAK抑制剂类药物的安全性。纳米颗粒可与药物偶联,再通过装配不同的配体靶向特定的组织或细胞,从而达到靶向给药的目的。例如在脓毒症相关肺损伤患者中,通过靶向肺上皮细胞或巨噬细胞等存在JAK/STAT通路异常激活的部位,减少给药剂量以降低不良反应发生。目前,芦可替尼-金纳米颗粒已经获批用于局部给药,减少全身给药的不良反应[45]。另一种JAK抑制剂巴瑞替尼也已经通过纳米技术实现改良[46]。通过纳米技术使JAK/STAT抑制剂更具靶向性可能是突破其在脓毒症治疗领域目前局限性的潜在方法。
其他JAK/STAT通路的靶向抑制剂已经被证实可调节巨噬细胞活化状态并影响其他与巨噬细胞活化密切相关的疾病的预后[47]。例如,托法替尼通过抑制大鼠角膜移植物中STAT1活化,降低淋巴结中M1型巨噬细胞比例,从而抑制炎症反应,改善角膜移植排斥反应[48]。然而,关于JAK/STAT通路的靶向抑制剂如何调节巨噬细胞极化从而影响脓毒症相关肺损伤预后的机制研究及临床研究仍然非常缺乏。
3 小结巨噬细胞极化作为脓毒症炎症调控中重要的主导因素,其对病程的影响已被广泛认可。JAK/STAT信号通路的组成多样,调控网络复杂,因此在调控巨噬细胞极化方面其功能表现出很强的异质性。在脓毒症相关肺损伤背景下,JAK/STAT通路在调节巨噬细胞极化方面发挥了不可取代的作用,大量动物实验证实通过调节该通路状态可以影响疾病的进展。因此,靶向JAK/STAT信号通路关键点可能成为降低脓毒症患者死亡率的重要方法。基于JAK/STAT通路的新疗法可能在治疗脓毒症相关肺损伤方面具有很大的潜力。值得注意的是,各种JAK/STAT家族成员所产生的效应具有高度异质性(如STAT家族不同成员对巨噬细胞极化的影响不同),这取决于它们作用的细胞类型和触发它们激活的信号。JAK/STAT抑制剂作为一类已经获批的药品,临床上已经证明其具有良好的有效性及安全性。虽然已有大量研究证实JAK/STAT通路主导了巨噬细胞极化并由此参与了脓毒症相关肺损伤的发生、发展,且靶向JAK/STAT通路进而调节巨噬细胞极化状态在动物模型中取得了令人瞩目的疗效,但其在临床上的应用实践仍然不多,需要进一步开展临床试验进行验证。未来仍需要更多关于JAK/STAT通路抑制剂对巨噬细胞影响的基础及临床研究来探究其用于治疗脓毒症相关肺损伤的可行性。
| [1] |
WANG W, LIU C F. Sepsis heterogeneity[J]. World J Pediatr, 2023, 19(10): 919-927. DOI:10.1007/s12519-023-00689-8 |
| [2] |
AZIZ M, ODE Y, ZHOU M, et al. B-1a cells protect mice from sepsis-induced acute lung injury[J]. Mol Med, 2018, 24(1): 26. DOI:10.1186/s10020-018-0029-2 |
| [3] |
NOBS S P, KOPF M. Tissue-resident macrophages: guardians of organ homeostasis[J]. Trends Immunol, 2021, 42(6): 495-507. DOI:10.1016/j.it.2021.04.007 |
| [4] |
CHEN X, LIU Y, GAO Y, et al. The roles of macrophage polarization in the host immune response to sepsis[J]. Int Immunopharmacol, 2021, 96: 107791. DOI:10.1016/j.intimp.2021.107791 |
| [5] |
RUNTSCH M C, ANGIARI S, HOOFTMAN A, et al. Itaconate and itaconate derivatives target JAK1 to suppress alternative activation of macrophages[J]. Cell Metab, 2022, 34(3): 487-501. DOI:10.1016/j.cmet.2022.02.002 |
| [6] |
JIMÉNEZ-GARCÍA L, HIGUERAS M Á, HERRANZ S, et al. A hispanolone-derived diterpenoid inhibits M2-macrophage polarization in vitro via JAK/STAT and attenuates chitin induced inflammation in vivo[J]. Biochem Pharmacol, 2018, 154: 373-383. DOI:10.1016/j.bcp.2018.06.002 |
| [7] |
XU M, LI X, SONG L. Baicalin regulates macrophages polarization and alleviates myocardial ischaemia/reperfusion injury via inhibiting JAK/STAT pathway[J]. Pharm Biol, 2020, 58(1): 655-663. DOI:10.1080/13880209.2020.1779318 |
| [8] |
GORDON S, TAYLOR P R. Monocyte and macrophage heterogeneity[J]. Nat Rev Immunol, 2005, 5(12): 953-964. DOI:10.1038/nri1733 |
| [9] |
MOLGORA M, SUPINO D, MANTOVANI A, et al. Tuning inflammation and immunity by the negative regulators IL-1R2 and IL-1R8[J]. Immunol Rev, 2018, 281(1): 233-247. DOI:10.1111/imr.12609 |
| [10] |
BOUTILIER A J, ELSAWA S F. Macrophage polarization states in the tumor microenvironment[J]. Int J Mol Sci, 2021, 22(13): 6995. DOI:10.3390/ijms22136995 |
| [11] |
STEFANOWSKI J, LANG A, RAUCH A, et al. Spatial distribution of macrophages during callus formation and maturation reveals close crosstalk between macrophages and newly forming vessels[J]. Front Immunol, 2019, 10: 2588. DOI:10.3389/fimmu.2019.02588 |
| [12] |
HE H, MACK J J, GÜÇ E, et al. Perivascular macrophages limit permeability[J]. Arterioscler Thromb Vasc Biol, 2016, 36(11): 2203-2212. DOI:10.1161/ATVBAHA.116.307592 |
| [13] |
SHAPOURI-MOGHADDAM A, MOHAMMADIAN S, VAZINI H, et al. Macrophage plasticity, polarization, and function in health and disease[J]. J Cell Physiol, 2018, 233(9): 6425-6440. DOI:10.1002/jcp.26429 |
| [14] |
SICA A, MANTOVANI A. Macrophage plasticity and polarization: in vivo veritas[J]. J Clin Invest, 2012, 122(3): 787-795. DOI:10.1172/JCI59643 |
| [15] |
WU Y, ZHAN S, CHEN L, et al. TNFSF14/LIGHT promotes cardiac fibrosis and atrial fibrillation vulnerability via PI3Kγ/SGK1 pathway-dependent M2 macrophage polarisation[J]. J Transl Med, 2023, 21(1): 544. DOI:10.1186/s12967-023-04381-3 |
| [16] |
CHOW S K H, WONG C H W, CUI C, et al. Modulating macrophage polarization for the enhancement of fracture healing, a systematic review[J]. J Orthop Translat, 2022, 36: 83-90. DOI:10.1016/j.jot.2022.05.004 |
| [17] |
WILKS A F, HARPUR A G, KURBAN R R, et al. Two novel protein-tyrosine kinases, each with a second phosphotransferase-related catalytic domain, define a new class of protein kinase[J]. Mol Cell Biol, 1991, 11(4): 2057-2065. DOI:10.1128/mcb.11.4.2057-2065.1991 |
| [18] |
KROLEWSKI J J, LEE R, EDDY R, et al. Identification and chromosomal mapping of new human tyrosine kinase genes[J]. Oncogene, 1990, 5(3): 277-282. |
| [19] |
ZHONG Z, WEN Z, DARNELL J E Jr. Stat3 and Stat4: members of the family of signal transducers and activators of transcription[J]. Proc Natl Acad Sci USA, 1994, 91(11): 4806-4810. DOI:10.1073/pnas.91.11.4806 |
| [20] |
LIU X, ROBINSON G W, GOUILLEUX F, et al. Cloning and expression of Stat5 and an additional homologue (Stat5b) involved in prolactin signal transduction in mouse mammary tissue[J]. Proc Natl Acad Sci USA, 1995, 92(19): 8831-8835. DOI:10.1073/pnas.92.19.8831 |
| [21] |
HOU J, SCHINDLER U, HENZEL W J, et al. An interleukin-4-induced transcription factor: IL-4 Stat[J]. Science, 1994, 265(5179): 1701-1706. DOI:10.1126/science.8085155 |
| [22] |
HERZIG D, FANG G, TOLIVER-KINSKY T E, et al. STAT1-deficient mice are resistant to cecal ligation and puncture-induced septic shock[J]. Shock, 2012, 38(4): 395-402. DOI:10.1097/SHK.0b013e318265a2ab |
| [23] |
WANG J, CHEN G, LI L, et al. Sustained induction of IP-10 by MRP8/14 via the IFNβ-IRF7 axis in macrophages exaggerates lung injury in endotoxemic mice[J]. Burns Trauma, 2023, 11(tkad006). DOI:10.1093/burnst/tkad006 |
| [24] |
YUAN J, ZHANG Y. Sevoflurane reduces inflammatory factor expression, increases viability and inhibits apoptosis of lung cells in acute lung injury by microRNA-34a-3p upregulation and STAT1 downregulation[J]. Chem Biol Interact, 2020, 322: 109027. DOI:10.1016/j.cbi.2020.109027 |
| [25] |
XU F, WANG S, WANG Y, et al. Inhibition of gp130 alleviates LPS-induced lung injury by attenuating apoptosis and inflammation through JAK1/STAT3 signaling pathway[J]. Inflamm Res, 2023, 72(3): 493-507. DOI:10.1007/s00011-022-01686-9 |
| [26] |
ZHANG X, WANG X, SUN L, et al. Tofacitinib reduces acute lung injury and improves survival in a rat model of sepsis by inhibiting the JAK-STAT/NF-κB pathway[J]. J Inflamm (Lond), 2023, 20(1): 5. DOI:10.1186/s12950-023-00332-3 |
| [27] |
LIU Y, YANG H, ZHU F, et al. Inhibition of STAT3 phosphorylation by colchicine regulates NLRP3 activation to alleviate sepsis-induced acute lung injury[J]. Inflammopharmacology, 2023, 31(4): 2007-2021. DOI:10.1007/s10787-023-01199-9 |
| [28] |
HU R J, CHEN X C, XU L, et al. MiR-181a-5p Delivered by adipose-derived mesenchymal stem cell exosomes alleviates Klebsiella pneumonia infection-induced lung injury by targeting STAT3 signaling[J]. Mediators Inflamm, 2022, 2022: 5188895. DOI:10.1155/2022/5188895 |
| [29] |
WANG A, KANG X, WANG J, et al. IFIH1/IRF1/STAT1 promotes sepsis associated inflammatory lung injury via activating macrophage M1 polarization[J]. Int Immunopharmacol, 2023, 114: 109478. DOI:10.1016/j.intimp.2022.109478 |
| [30] |
WANG F, ZHANG S, JEON R, et al. Interferon gamma induces reversible metabolic reprogramming of M1 macrophages to sustain cell viability and pro-inflammatory activity[J]. eBioMedicine, 2018, 30: 303-316. DOI:10.1016/j.ebiom.2018.02.009 |
| [31] |
KANNO H, MATSUMOTO S, YOSHIZUMI T, et al. Role of SOCS and VHL proteins in neuronal differentiation and development[J]. Int J Mol Sci, 2023, 24(4): 3880. DOI:10.3390/ijms24043880 |
| [32] |
QIN H, YEH W I, DE SARNO P, et al. Signal transducer and activator of transcription-3/suppressor of cytokine signaling-3 (STAT3/SOCS3) axis in myeloid cells regulates neuroinflammation[J]. Proc Natl Acad Sci USA, 2012, 109(13): 5004-5009. DOI:10.1073/pnas.1117218109 |
| [33] |
TANG L, ZHANG H, WANG C, et al. M2A and M2C macrophage subsets ameliorate inflammation and fibroproliferation in acute lung injury through interleukin 10 pathway[J]. Shock, 2017, 48(1): 119-129. DOI:10.1097/shk.0000000000000820 |
| [34] |
JI X C, SHI Y J, ZHANG Y, et al. Reducing suppressors of cytokine signaling-3 (SOCS3) expression promotes M2 macrophage polarization and functional recovery after intracerebral hemorrhage[J]. Front Neurol, 2020, 11: 586905. DOI:10.3389/fneur.2020.586905 |
| [35] |
JIANG X, HE M, BAI J, et al. Signal transduction for TNFα-induced type Ⅱ SOCS expression and its functional implication in growth hormone resistance in carp hepatocytes[J]. Front Endocrinol (Lausanne), 2020, 11: 20. DOI:10.3389/fendo.2020.00020 |
| [36] |
FANG M, DAI H, YU G, et al. Gene delivery of SOCS3 protects mice from lethal endotoxic shock[J]. Cell Mol Immunol, 2005, 2(5): 373-377. |
| [37] |
BRINGUÉ J, GUILLAMAT-PRATS R, MARTINEZ M L, et al. Methotrexate ameliorates systemic inflammation and septic associated-lung damage in a cecal ligation and puncture septic rat model[J]. Int J Mol Sci, 2021, 22(17): 9612. DOI:10.3390/ijms22179612 |
| [38] |
XU J, ZHANG X, ZHOU M, et al. Bioactive compound C498-0670 alleviates LPS-induced sepsis via JAK/STAT and NFκB signaling pathways[J]. Front Immunol, 2023, 14: 1132265. DOI:10.3389/fimmu.2023.1132265 |
| [39] |
BAO X, LIU X, LIU N, et al. Inhibition of EZH2 prevents acute respiratory distress syndrome (ARDS)-associated pulmonary fibrosis by regulating the macrophage polarization phenotype[J]. Respir Res, 2021, 22(1): 194. DOI:10.1186/s12931-021-01785-x |
| [40] |
LI L, HE X, WANG X, et al. Ruxolitinib protects lipopolysaccharide (LPS)-induced sepsis through inhibition of nitric oxide production in mice[J]. Ann Transl Med, 2020, 8(8): 546. DOI:10.21037/atm-20-2972 |
| [41] |
TSIRIGOTIS P, PAPANIKOLAOU N, ELEFANTI A, et al. Treatment of experimental Candida sepsis with a Janus kinase inhibitor controls inflammation and prolongs survival[J]. Antimicrob Agents Chemother, 2015, 59(12): 7367-7373. DOI:10.1128/AAC.01533-15 |
| [42] |
SEDIVY-HALEY K, BLIMKIE T, FALSAFI R, et al. A transcriptomic analysis of the effects of macrophage polarization and endotoxin tolerance on the response to Salmonella[J]. PLoS One, 2022, 17(10): e0276010. DOI:10.1371/journal.pone.0276010 |
| [43] |
CHUKWUKA N H, HASHMI A T, KAMHOLZ S L. Ruxolitinib discontinuation syndrome[J]. Am J Ther, 2020, 29(1): e132-e134. DOI:10.1097/mjt.0000000000001150 |
| [44] |
BECHMAN K, SUBESINGHE S, NORTON S, et al. A systematic review and meta-analysis of infection risk with small molecule JAK inhibitors in rheumatoid arthritis[J]. Rheumatology, 2019, 58(10): 1755-1766. DOI:10.1093/rheumatology/kez087 |
| [45] |
BOCA S, BERCE C, JURJ A, et al. Ruxolitinib-conjugated gold nanoparticles for topical administration: an alternative for treating alopecia?[J]. Med Hypotheses, 2017, 109: 42-45. DOI:10.1016/j.mehy.2017.09.023 |
| [46] |
ANSARI M J, ALSHAHRANI S M. Nano-encapsulation and characterization of baricitinib using poly-lactic-glycolic acid co-polymer[J]. Saudi Pharm J, 2019, 27(4): 491-501. DOI:10.1016/j.jsps.2019.01.012 |
| [47] |
WANG A, SINGH K, IBRAHIM W, et al. The promise of JAK inhibitors for treatment of sarcoidosis and other inflammatory disorders with macrophage activation: a review of the literature[J]. Yale J Biol Med, 2020, 93(1): 187-195. |
| [48] |
YU J, LI P, LI Z, et al. Topical administration of 0.3% tofacitinib suppresses M1 macrophage polarization and allograft corneal rejection by blocking STAT1 activation in the rat cornea[J]. Transl Vis Sci Technol, 2022, 11(3): 34. DOI:10.1167/tvst.11.3.34 |
 2024, Vol. 45
2024, Vol. 45


