随着全球平均气温升高,极端高温气候事件发生频繁且持续时间和强度增加[1-2]。高温暴露是军事领域不可避免的特殊作业环境[3],其常导致机体产生热应激反应,轻则影响作业效能,重则引发从热痉挛到热射病的热致疾病[4],甚至危及生命。热习服(heat acclimatization)训练是目前公认的能有效提升机体耐热能力、降低热损伤风险、预防热致疾病的方法[5-6]。热习服是指机体在反复热刺激下形成的一系列有利于适应热环境和提高热耐受能力的保护性生理反应状态[6-7]。热习服形成后机体将具备一系列全身性热适应性调节能力,包括出汗率升高、核心体温下降、心血管稳定改善、知觉劳损降低、全身和骨骼肌代谢改善等,可使机体热耐受能力提高,热损伤风险降低[8]。目前对热习服状态的确定需要经过热耐力评估才能实现,除了某些生理、心理、综合指标用于指示热习服状态[6]外,缺乏在小分子代谢、基因、蛋白质等分子层面的有效预测标志物。
热习服状态的形成伴随着机体血液中小分子代谢物的改变。本课题组在实验动物模型中发现,热习服大鼠血浆中三甲胺氧化物、谷氨酸、脂质等小分子代谢物显著降低,且其改变与热耐力提升相关[9]。也有研究发现热习服过程中血乳酸、电解质等代谢物发生显著变化[10-11],证明血清代谢物检测是研究热习服状态相关生物标志物的有效方法。随着代谢组学检测技术的不断发展,通过监测生命体内小分子物质的动态变化规律研究生理病理变化过程、描绘细胞产物的代谢通路变化已被广泛运用。在目前的热习服领域研究中,对人体的研究仅局限于有限的生理指标,关于生化小分子的研究较少,缺乏对人群热习服血清代谢轮廓特征的系统性研究。本研究在流行病学设计的基础上,以血清代谢组学检测分析为主要技术手段,分析热习服和未习服人群血液中小分子代谢产物的差异,明确热习服相关代谢通路变化,为热习服代谢机制研究和标志物探索提供思路。
1 对象和方法 1.1 研究对象以2023年5月底由我国北方地区进入南方湿热地区某市的某部跨域作业人员为研究对象,选择其中年龄在18~30岁、BMI在18~25 kg/m2、6个月内未系统服用任何药物的70例健康男性纳入研究。收集研究对象2个月内的个人热暴露情况,并在2个月后采集血样进行代谢组学检测分析。根据热习服定义及专家建议,将每天处于自然高热环境中生活和作业的40名跨域人员归入热习服组,每天处于空调舒适人工环境中生活和作业的30名跨域人员归入未习服组。研究对象在参与研究前均被充分告知实验内容,并自愿签署知情同意书。本研究通过海军军医大学(第二军医大学)医学研究伦理委员会审查批准。
1.2 血清样本采集与处理在上午7:00-8:00采集受试者空腹血液样本。要求采血前至少禁食8 h,常规消毒后,使用真空采血管通过受试者左肘静脉采集5 mL静脉血。血液样本在20~25 ℃环境中静置1 h后,1 200×g离心15 min取上清液,将上清液转移至1.5 mL EP管中,储存于-80 ℃冰箱中备用。
1.3 血液样本中代谢物的检测与分析 1.3.1 样本处理和质控样本制备吸取100 μL血清样本置于1.5 mL离心管中,加入300 μL提取液[乙腈∶甲醇(体积比)=1∶1,含0.02 mg/mL内标L-2-氯苯丙氨酸],涡旋混匀30 s后,低温超声提取30 min(5 ℃,40 kHz);将样品于-20 ℃静置30 min后,4 ℃、13 000×g离心15 min,移取上清液,氮气吹干;加入100 µL复溶液[乙腈∶水(体积比)=1∶1]复溶,涡旋混匀30 s,低温超声萃取5 min(5 ℃,40 kHz);然后4 ℃ 13 000×g离心10 min,移取上清液至带内插管的进样小瓶中,上机分析。同时,取20 μL等体积的所有样本上清液混合制备质控(quality control,QC)样本,在仪器分析过程中每5~15个样本中插入1个QC样本,用于检测时评估数据质量。
1.3.2 色谱-质谱分析采用超高效液相色谱串联傅里叶变换质谱UHPLC-Q Exactive HF-X系统对样本进行分析。
色谱条件:3 μL样本经ACQUITY UPLC HSS T3色谱柱(100 mm×2.1 mm,1.8 µm)分离后进入质谱检测。流动相A为95%水+5%乙腈(含0.1%甲酸),流动相B为47.5%乙腈+47.5%异丙醇+5%水(含0.1%甲酸)。梯度洗脱方法:0~3.5 min,流动相B从0升至24.5%,流速为0.4 mL/min;3.5~5 min,流动相B从24.5%升至65%,流速为0.4 mL/min;5~5.5 min,流动相B从65%升至100%,流速为0.4 mL/min;5.5~7.4 min,流动相B维持100%,流速从0.4 mL/min升至0.6 mL/min;7.4~7.6 min,流动相B从100%降至51.5%,流速为0.6 mL/min;7.6~7.8 min,流动相B从51.5%降至0,流速从0.6 mL/min降至0.5 mL/min;7.8~9 min,流动相B维持在0,流速从0.5 mL/min降至0.4 mL/min;9~10 min,流动相B维持在0,流速为0.4 mL/min。
质谱条件:样品质谱信号采集采用正负离子扫描模式,质量扫描范围为70~1 050 m/z。鞘气流速为50 psi(1 psi=6.895 kPa),辅助气流速为13 psi,辅助气加热温度为425 ℃,正模式离子喷雾电压设置为3 500 V,负模式离子喷雾电压设置为-3 500 V,离子传输管温度为325 ℃,归一化碰撞能为20-40-60 V循环碰撞能。一级质谱分辨率60 000,二级质谱分辨率7 500,用数据依赖采集(data dependent acquisition,DDA)模式采集数据。
1.3.3 数据分析和统计学处理将色谱-质谱原始下机数据使用Progenesis QI软件(美国Waters Corporation公司)进行检测和原始数据峰值的校准。通过搜索人类代谢组数据库(The Human Metabolome Database,HMDB;http://www.hmdb.ca/)和Metlin数据库(https://metlin.scripps.edu/)鉴定代谢物。将含代谢物信息的数据矩阵上传至美吉云平台(cloud.majorbio.com)进行分析[12]。如果每组样本的缺失值超过20%,则删除代谢特征组。每个代谢物使用总和归一化,同时删除RSD>30%的代谢物,并进行常用对数变换,以减少分析误差。采用R 1.6.2软件ropls包对预处理后的数据矩阵进行主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA),并使用7次循环交互验证来评估模型的稳定性,模型置换次数为200次。采用变量重要性投影(variable importance in projection,VIP)分析评价代谢产物的重要性,VIP>1且P<0.05的代谢物被认为具有统计学意义[13]。差异代谢物通过京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库(https://www.kegg.jp/kegg/pathway.html)进行代谢通路的注释,获得差异代谢物参与的通路。采用Python软件包scipy.stats进行通路富集分析,并通过Fisher确切概率法获得与实验处理最相关的生物学途径。人口学数据采用SPSS 26.0软件进行分析,计量资料以x±s表示,采用独立样本t检验进行组间比较,检验水准(α)为0.05。
2 结果 2.1 两组研究对象一般资料比较两组研究对象年龄、身高、体重和BMI差异无统计学意义(均P>0.05)。热习服组所处环境日间平均温度、夜间平均温度均高于未习服组(P<0.001,P=0.003)。需要强调的是,热习服组白天的作业环境平均温度>37 ℃,而未习服组平均温度仅为26.45 ℃,再加上作业产热,前者提供了很强的热刺激或热习服适应条件。虽然未习服组白天的环境湿度高于热习服组(P<0.001),但是温度不高的条件下湿度对热习服的促进并无明显效果。因作业内容不同,热习服组工作强度高于未习服组(P<0.001),但两组都未达到高强度运动的标准。见表 1。
|
|
表 1 热习服组与未习服组基本资料和热暴露情况 Tab 1 Basic data and heat exposure of heat acclimatization (HA) group and heat non-acclimatization (HN) group |
2.2 代谢组学轮廓分析
送检的70例血清样本中,正、负离子模式共检测到6 542个可定量的峰,去掉假阳性和噪声后得到可鉴定的小分子代谢物1 320个。PCA显示QC样本分布集中,表明仪器数据稳定且可重复。OPLS-DA模型分析可见2组样本分布在第一主成分的左侧和右侧,组内样本聚集良好,且模型的R2Y值和Q2值均>0.9,表明模型无过拟合问题,具有良好的可靠性和有效性;此外,两组之间具有显著的分离界限,模型置换检验Q2的线性拟合的截距均在0以下(图 1),表明多变量数据具有良好的适应性,可用于差异代谢物的进一步分析。

|
图 1 OPLS-DA分析及其阳、阴离子模型置换检验 Fig 1 OPLS-DA analysis and permutation test of anion and cation models A: Cationic model score chart; B: Anionic model score chart; C: Cationic model permutation test; D: Anionic model permutation test. R2Y (cum) and Q2 (cum) are model validation parameters, which represent model interpretability and model predictability, respectively. The cationic model coefficients Q2 (cum) was 0.992 and R2Y (cum) was 0.993; the anionic model coefficients Q2 (cum) was 0.998 and R2Y (cum) was 0.998; and the above coefficients were greater than 0.9 and close to 1, indicating that the model had high prediction ability and good fitting degree. OPLS-DA: Orthogonal partial least squares-discriminant analysis; HA: Heat acclimatization group; HN: Heat non-acclimatization group. |
2.3 差异代谢物分析
基于上述OPLS-DA模型,以P<0.05且VIP>1为筛选条件,得到热习服组和未习服组之间差异小分子代谢物306种,其中热习服组升高的有212种、下降的有94种,有机酸及其衍生物、脂质和类脂分子类代谢物占总差异代谢物的50%以上。当以更严格的标准[P<0.05、VIP>1且差异倍数(fold change,FC)>1.5或<0.66]为筛选条件时,获得89个代谢物,其中热习服组有57个代谢物升高、32个代谢物下降。值得关注的是,相对于未习服组,热习服组的L-β-天冬氨酸-L-苯丙氨酸和Tetranor-PGFM两种代谢物的浓度升高了10倍以上,苯丙氨酸、甘氨酸等的浓度升高了2倍以上;前30种差异小分子代谢物中,15种为氨基酸、肽类似物,7种为有机化合物,8种为脂质和类脂分子(表 2)。血清代谢物火山图见图 2。
|
|
表 2 血清前30种差异代谢物 Tab 2 The top 30 serum differential metabolites |
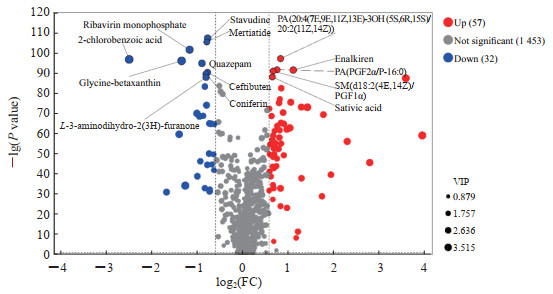
|
图 2 血清代谢物火山图 Fig 2 Volcano plot of serum metabolites Up: Significantly increased metabolites in the heat acclimatization group; Down: Significantly decreased metabolites in the heat acclimatization group. FC: Fold change; PA: Phosphatidic acid; PGF: Prostaglandin F; SM: Sphingomyelin; VIP: Variable importance in projection. |
2.4 差异代谢通路分析
对89个差异代谢物进行KEGG通路分析,发现主要富集在13条代谢通路,涉及类固醇激素生物合成,色氨酸代谢,甘氨酸、丝氨酸和苏氨酸代谢,以及甘油磷脂代谢等通路,见图 3。以代谢通路影响值为标准筛选出热习服组和未习服组间最显著的差异代谢通路,见图 4。其中影响值>0.1的有D-氨基酸代谢通路、核苷酸代谢通路、赖氨酸降解通路和生物素代谢通路,提示在热习服过程中氨基酸代谢发挥了重要作用,可能是促进热习服的重要因素。
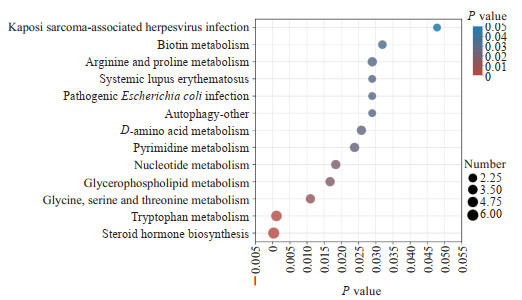
|
图 3 血清差异代谢物KEGG通路富集分析 Fig 3 Differential metabolite KEGG pathway analysis KEGG: Kyoto Encyclopedia of Genes and Genomes. |
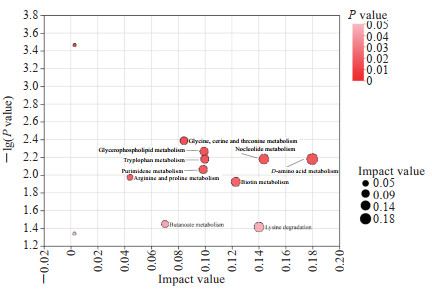
|
图 4 血清差异代谢物KEGG通路拓扑分析 Fig 4 KEGG pathway topological analysis of differential metabolites The impact values of top 10 KEGG pathways are labeled with the path names. KEGG: Kyoto Encyclopedia of Genes and Genomes. |
3 讨论
本研究以我国由温区到热区跨域作业人员为研究对象,根据自然热环境暴露和空调人工环境暴露的区别,将跨域作业2个月后的人员身体状态分为热习服状态和未习服状态,并采集血液样本进行血清代谢组学分析。结果提示两组人群血清中存在明显的小分子代谢物浓度差异和代谢途径扰动,涉及多种氨基酸和脂类物质的显著变化,提示氨基酸代谢(D-氨基酸代谢,色氨酸代谢,甘氨酸、丝氨酸和苏氨酸代谢,赖氨酸降解,精氨酸和脯氨酸代谢)、碳水化合物代谢(丁酸代谢)和脂质代谢(甘油磷脂代谢、类固醇激素生物合成)通路参与了热习服过程。
热习服组和未习服组之间的差异代谢物主要包括色氨酸、苯丙氨酸、甘氨酸等有机酸类,脑磷脂、心磷脂等脂类,以及4-羟基-4-(3-吡啶基)丁酸等杂环化合物类,其中有机酸类和脂类占总差异代谢物的50%以上。相比而言,L-β-天冬氨酸-L-苯丙氨酸和Tetranor-PGFM两种代谢物在热习服组的浓度升高了10倍以上,苯丙氨酸、甘氨酸等的浓度升高了2倍以上,提示这些小分子代谢物在热习服状态维护中有重要价值。有研究发现热习服的形成过程中有多种氨基酸参与[14]。色氨酸在热刺激下发挥适应性调节作用[15],补充色氨酸可以促进机体散热来代偿热负荷所致的体温升高[16],经过热习服训练的个体能够通过氨基酸代谢表现出更强的热适应调节能力[17]。针对高温暴露的人群研究也证实,机体谷氨酸代谢、赖氨酸代谢和甘油磷脂代谢与热刺激密切相关[18]。
热应激会损伤肠道黏膜屏障,导致脂多糖(lipopolysaccharide,LPS)入血引发炎症反应[19-20],而热习服后多种氨基酸能够减少热应激所致肠道损伤,在维持肠道屏障功能中发挥重要作用。色氨酸能调节紧密连接蛋白表达,改善LPS引起的肠道屏障功能障碍[21]。亮氨酸通过为物质转运提供能量而促进肠道发育,并可能通过调节空肠上皮细胞增殖、凋亡、代谢和吞噬作用影响肠道屏障功能[22]。精氨酸保护细胞免受LPS诱导的氧化损伤引起的凋亡[23]。补充精氨酸可阻断LPS与Toll样受体4(Toll-like receptor 4,TLR4)结合,抑制下游NF-κB和MAPK信号通路激活进而缓解肠道炎症[24]。芳香族氨基酸色氨酸、苯丙氨酸、酪氨酸通过与细胞膜上钙离子敏感受体(calcium-sensing receptor,CaSR)结合,阻断MAPK、NF-κB炎症信号转导,调控炎症细胞因子的表达,从而发挥抗炎作用[25-26]。苯丙氨酸能通过激活核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)信号通路,调节肠道内抗氧化酶活性,进而减轻肠道氧化损伤[27]。甘氨酸在肠道内快速代谢并参与谷胱甘肽合成,通过与自由基反应和与活性氧(reactive oxygen species,ROS)相互作用调节肠道氧化还原状态,缓解LPS诱导的肠道氧化损伤[28]。Tetranor-PGFM是前列腺素F2α(prostaglandin F2α,PGF2α)的标志性代谢物,而PGF2α作为前列腺素的一种,通过作用于PGF2α受体促进钙信号转导和三磷酸肌醇形成,同样能够调节炎症水平[29]。
KEGG通路富集分析显示,热习服组和未习服组之间存在13条差异代谢通路,其中精氨酸和脯氨酸代谢,色氨酸代谢,甘氨酸、丝氨酸和苏氨酸代谢,D-氨基酸代谢,以及甘油磷脂代谢通路均与氨基酸和磷脂代谢相关。由此可见,热习服与大量氨基酸含量的升高和氨基酸代谢通路的激活有关,机体通过调节氨基酸代谢维持代谢稳态适应高温和剧烈活动的影响,减少热应激引起的肠道屏障功能破坏,进而提高机体的热耐受能力和运动表现。热习服过程中伴随着能量消耗的增加和代谢活动的增强[30],机体为应对能量供应的不足激活多种途径满足能量消耗。赖氨酸降解代谢的中间产物能进入三羧酸循环为机体代谢提供能量[31]。β-丙氨酸是咪唑二肽合成的唯一限制性氨基酸[32],具有提升抗氧化能力、增强运动能力、对抗疲劳等功能[33]。此外,丁酸代谢通路的激活、3-羟基丁酸和丙酮酸的下降可能是因为高热对能量代谢途径造成了抑制[34],而耐热性高的细胞可能通过激活线粒体来补偿产能途径抑制导致的ATP损失,并减少内源性产热[35]或上调糖酵解途径来增强机体耐热性[10]。甘油磷脂代谢作为机体重要的生理过程,对维持细胞膜和线粒体结构、蛋白质识别与信号转导、能量代谢平衡具有重要作用,该通路的激活可能和热应激条件下机体组织细胞耗氧量增加、大量有害ROS和高温导致的线粒体结构酶变性破坏有关[36-37],但该通路能否作为热损伤的标志性通路还有待进一步研究。
本研究存在一些局限性。首先,由于跨域人群和作业内容的特殊性,往往不易按照最优设计获得各种信息和生物样本,本研究仅收集了热习服完成后的人体血清样本,缺少热习服之前的自身对照样本,未能更加科学地获得热习服代谢相关小分子谱。其次,有研究证实饮食、睡眠等都能影响机体小分子代谢物谱[38-39]。本研究中所有研究对象虽统一住宿和就餐,但未严格定制个体饮食摄入,这可能对实验结果有一定影响。此外,本研究筛选出的差异代谢物和通路还需在更大样本量或其他人群研究中验证,以期得到明确的热耐力提升标志物。
总之,本研究通过代谢组学筛选出了89个与热习服相关的差异代谢物,确定了13条差异代谢通路,它们可能是热耐力提升的特征标志物,为今后基于人群的热习服研究提供了线索。热习服期间补充充足的氨基酸,特别是色氨酸[21]、甘氨酸[28]、精氨酸[23]和苯丙氨酸[27],对于维持热习服期间的能量和营养、促进热习服后恢复具有重要意义。
| [1] |
EBI K L, CAPON A, BERRY P, et al. Hot weather and heat extremes: health risks[J]. Lancet, 2021, 398(10301): 698-708. DOI:10.1016/S0140-6736(21)01208-3 |
| [2] |
CAMPBELL-LENDRUM D, CORVALÁN C, NEIRA M. Global climate change: implications for international public health policy[J]. Bull World Health Organ, 2007, 85(3): 235-237. DOI:10.2471/blt.06.039503 |
| [3] |
罗雪, 何根林, 杨学森. 高温环境军事作业热损伤卫生防护体系建设与探讨[J]. 人民军医, 2018, 61(2): 106-110. |
| [4] |
SORENSEN C, HESS J. Treatment and prevention of heat-related illness[J]. N Engl J Med, 2022, 387(15): 1404-1413. DOI:10.1056/NEJMcp2210623 |
| [5] |
PÉRIARD J D, EIJSVOGELS T M H, DAANEN H A M. Exercise under heat stress: thermoregulation, hydration, performance implications, and mitigation strategies[J]. Physiol Rev, 2021, 101(4): 1873-1979. DOI:10.1152/physrev.00038.2020 |
| [6] |
陈家俊, 王静. 热习服训练方案及评价指标的研究进展[J]. 军事医学, 2020, 44(6): 465-469, 480. DOI:10.7644/j.issn.1674-9960.2020.06.013 |
| [7] |
沈丹丹, 朱能. 热习服训练对高温工作场所员工环境适应性的影响[J]. 中国安全科学学报, 2015, 25(8): 17-21. DOI:10.16265/j.cnki.issn1003-3033.2015.08.003 |
| [8] |
鞠晓北, 王长海, 屠志浩, 等. 军事作业中热习服训练及相关耐热策略的研究进展[J]. 职业与健康, 2023, 39(18): 2588-2592. DOI:10.13329/j.cnki.zyyjk.2023.0454 |
| [9] |
梁涵, 康争春, 李玉祥, 等. 热习服对大鼠血液代谢产物影响的研究[J]. 第二军医大学学报, 2016, 37(9): 1057-1062. LIANG H, KANG Z C, LI Y X, et al. Effect of heat acclimation on metabolites in rat blood[J]. Acad J Sec Mil Med Univ, 2016, 37(9): 1057-1062. DOI:10.16781/j.0258-879x.2016.09.1057 |
| [10] |
GEORGOULIS I, BOCK C, LANNIG G, et al. Metabolic remodeling caused by heat hardening in the Mediterranean mussel Mytilus galloprovincialis[J]. J Exp Biol, 2022, 225(24): jeb244795. DOI:10.1242/jeb.244795 |
| [11] |
HEANEY L M, DEIGHTON K, SUZUKI T. Non-targeted metabolomics in sport and exercise science[J]. J Sports Sci, 2019, 37(9): 959-967. DOI:10.1080/02640414.2017.1305122 |
| [12] |
XIE M, CHEN W, LAI X, et al. Metabolic responses and their correlations with phytochelatins in Amaranthus hypochondriacus under cadmium stress[J]. Environ Pollut, 2019, 252(Pt B): 1791-1800. DOI:10.1016/j.envpol.2019.06.103 |
| [13] |
LI C, AL-DALALI S, ZHOU H, et al. Influence of mixture of spices on phospholipid molecules during water-boiled salted duck processing based on shotgun lipidomics[J]. Food Res Int, 2021, 149: 110651. DOI:10.1016/j.foodres.2021.110651 |
| [14] |
CAO Y, LIU Y, DONG Q, et al. Alterations in the gut microbiome and metabolic profile in rats acclimated to high environmental temperature[J]. Microb Biotechnol, 2022, 15(1): 276-288. DOI:10.1111/1751-7915.13772 |
| [15] |
PARTHASARATHY A, CROSS P J, DOBSON R C J, et al. A three-ring circus: metabolism of the three proteogenic aromatic amino acids and their role in the health of plants and animals[J]. Front Mol Biosci, 2018, 5: 29. DOI:10.3389/fmolb.2018.00029 |
| [16] |
SUTOH M, KASUYA E, YAYOU K I. Effects of intravenous tryptophan infusion on thermoregulation in steers exposed to acute heat stress[J]. Anim Sci J, 2018, 89(5): 777-783. DOI:10.1111/asj.12988 |
| [17] |
XU F, GAO T, LIU X. Metabolomics adaptation of juvenile Pacific abalone Haliotis discus hannai to heat stress[J]. Sci Rep, 2020, 10(1): 6353. DOI:10.1038/s41598-020-63122-4 |
| [18] |
CHICAS R C, WANG Y, JENNIFER WEIL E, et al. The impact of heat exposures on biomarkers of AKI and plasma metabolome among agricultural and non-agricultural workers[J]. Environ Int, 2023, 180: 108206. DOI:10.1016/j.envint.2023.108206 |
| [19] |
WANG Z, SHAO D, WU S, et al. Heat stress-induced intestinal barrier damage and dimethylglycine alleviates via improving the metabolism function of microbiota gut brain axis[J]. Ecotoxicol Environ Saf, 2022, 244: 114053. DOI:10.1016/j.ecoenv.2022.114053 |
| [20] |
DOKLADNY K, ZUHL M N, MOSELEY P L. Intestinal epithelial barrier function and tight junction proteins with heat and exercise[J]. J Appl Physiol (1985), 2016, 120(6): 692-701. DOI:10.1152/japplphysiol.00536.2015 |
| [21] |
CHEN M, LIU Y, XIONG S, et al. Dietary L-tryptophan alleviated LPS-induced intestinal barrier injury by regulating tight junctions in a Caco-2 cell monolayer model[J]. Food Funct, 2019, 10(5): 2390-2398. DOI:10.1039/c9fo00123a |
| [22] |
MAO X, REN M, CHEN D, et al. Leucine modulates the IPEC-J2 cell proteome associated with cell proliferation, metabolism and phagocytosis[J]. Anim Nutr, 2018, 4(3): 316-321. DOI:10.1016/j.aninu.2018.03.006 |
| [23] |
ZHANG H, PENG A, YU Y, et al. L-arginine protects ovine intestinal epithelial cells from lipopolysaccharide-induced apoptosis through alleviating oxidative stress[J]. J Agric Food Chem, 2019, 67(6): 1683-1690. DOI:10.1021/acs.jafc.8b06739 |
| [24] |
LAN J, DOU X, LI J, et al. L-arginine ameliorates lipopolysaccharide-induced intestinal inflammation through inhibiting the TLR4/NF-κB and MAPK pathways and stimulating β-defensin expression in vivo and in vitro[J]. J Agric Food Chem, 2020, 68(9): 2648-2663. DOI:10.1021/acs.jafc.9b07611 |
| [25] |
MINE Y, ZHANG H. Calcium-sensing receptor (CaSR)-mediated anti-inflammatory effects of L-amino acids in intestinal epithelial cells[J]. J Agric Food Chem, 2015, 63(45): 9987-9995. DOI:10.1021/acs.jafc.5b03749 |
| [26] |
RENZ H, BRANDTZAEG P, HORNEF M. The impact of perinatal immune development on mucosal homeostasis and chronic inflammation[J]. Nat Rev Immunol, 2011, 12(1): 9-23. DOI:10.1038/nri3112 |
| [27] |
FENG L, LI W, LIU Y, et al. Dietary phenylalanine-improved intestinal barrier health in young grass carp (Ctenopharyngodon idella) is associated with increased immune status and regulated gene expression of cytokines, tight junction proteins, antioxidant enzymes and related signalling molecules[J]. Fish Shellfish Immunol, 2015, 45(2): 495-509. DOI:10.1016/j.fsi.2015.05.001 |
| [28] |
WANG W, WU Z, LIN G, et al. Glycine stimulates protein synthesis and inhibits oxidative stress in pig small intestinal epithelial cells[J]. J Nutr, 2014, 144(10): 1540-1548. DOI:10.3945/jn.114.194001 |
| [29] |
WU C, XU Y, HE Q, et al. Ligand-induced activation and G protein coupling of prostaglandin F2α receptor[J]. Nat Commun, 2023, 14(1): 2668. DOI:10.1038/s41467-023-38411-x |
| [30] |
石瑞婷. 热湿环境对官兵机体的影响及习服研究[J]. 公安海警学院学报, 2017, 16(5): 38-43. |
| [31] |
田颖, 时明慧. 赖氨酸生理功能的研究进展[J]. 美食研究, 2014, 31(3): 60-64. DOI:10.3969/j.issn.1009-4717.2014.03.014 |
| [32] |
HARRIS R C, TALLON M J, DUNNETT M, et al. The absorption of orally supplied beta-alanine and its effect on muscle carnosine synthesis in human vastus lateralis[J]. Amino Acids, 2006, 30(3): 279-289. DOI:10.1007/s00726-006-0299-9 |
| [33] |
齐博, 武书庚, 王晶, 等. β-丙氨酸的生理功能及其在动物生产中的应用[J]. 动物营养学报, 2016, 28(4): 1027-1034. DOI:10.3969/j.issn.1006-267x.2016.04.009 |
| [34] |
ARAÚJO A M, ENEA M, CARVALHO F, et al. Hepatic metabolic derangements triggered by hyperthermia: an in vitro metabolomic study[J]. Metabolites, 2019, 9(10): 228. DOI:10.3390/metabo9100228 |
| [35] |
KANAMORI T, MIYAZAKI N, AOKI S, et al. Investigation of energy metabolic dynamism in hyperthermia-resistant ovarian and uterine cancer cells under heat stress[J]. Sci Rep, 2021, 11(1): 14726. DOI:10.1038/s41598-021-94031-9 |
| [36] |
YI G, LI L, LUO M, et al. Heat stress induces intestinal injury through lysosome- and mitochondria-dependent pathway in vivo and in vitro[J]. Oncotarget, 2017, 8(25): 40741-40755. DOI:10.18632/oncotarget.16580 |
| [37] |
夏亮, 刘江伟, 沈才福, 等. 姜黄素预处理通过保护线粒体和抗氧化应激减轻干热环境热射病大鼠肝损伤[J]. 现代生物医学进展, 2017, 17(18): 3434-3437, 3466. DOI:10.13241/j.cnki.pmb.2017.18.007 |
| [38] |
DI RENZO L, GUALTIERI P, ROMANO L, et al. Role of personalized nutrition in chronic-degenerative diseases[J]. Nutrients, 2019, 11(8): 1707. DOI:10.3390/nu11081707 |
| [39] |
DAVIES S K, ANG J E, REVELL V L, et al. Effect of sleep deprivation on the human metabolome[J]. Proc Natl Acad Sci USA, 2014, 111(29): 10761-10766. DOI:10.1073/pnas.1402663111 |
 2024, Vol. 45
2024, Vol. 45


